巨噬細胞表達ID1支持結腸癌細胞的干細胞性并限制CD8+ T細胞的浸潤
消除腫瘤干細胞(CSCs)和恢復抗腫瘤免疫仍然是癌癥治療中未遇到的挑戰。腫瘤相關巨噬細胞(tumor -associated macrophages, TAM)是腫瘤組織中重要的免疫細胞群,有助于形成CSC壁龕和抑制性免疫微環境。在這里,作者報告了TAMs中分化抑制因子1 (ID1)的高表達與結直腸癌(CRC)患者的不良預后相關。表達ID1的巨噬細胞維持腫瘤的干細胞性,抑制CD8+ T細胞的浸潤。在機制上,ID1與STAT1相互作用誘導其細胞質分布,并抑制STAT1介導的SerpinB2和CCL4轉錄,這兩種分泌因子負責腫瘤干細胞抑制和CD8+ T細胞募集。減少ID1表達可改善結直腸癌的進展,增強腫瘤對免疫治療和化療的敏感性。總之,作者的研究強調了ID1在控制TAM的腫瘤表型中的關鍵作用,并為ID1在CRC中的治療靶向鋪平了道路。本文于2023年11月發布于《Nature Communications》,IF=16.6。
技術路線:

主要研究結果:
1、TAMs中ID1的表達增強與結直腸癌患者的不良臨床結果相關
一項基于轉錄組的研究表明,來自腫瘤組織的TAM在轉錄上與單核細胞及其各自的組織巨噬細胞不同。為了探索CRC TAMs中差異表達的致癌轉錄因子,作者深入挖掘了CRC細胞衍生條件培養基(CM)刺激下的腹膜巨噬細胞(PM)基因微陣列數據集(GSE80065)。在TAMs (CRC CM刺激的PM)中,與未刺激的PM (Ctrl)相比,2830個基因(log2FC > 1.5, P≤0.05)上調,其中80個基因編碼轉錄因子,其中10個基因在CRC中表現出致癌特性(圖1a)。在CT26或mc38來源的CM處理的RAW 264.7細胞中,驗證了前5個基因的蛋白豐度。與對照組(Ctrl)相比,c- myc、Snai1和ID1,而不是Tcf4和ID2,在結腸癌細胞來源的cm處理組中被發現高表達(圖1b, c)。由于c- myc和Snai1已被證明是替代巨噬細胞激活的關鍵參與者,作者隨后關注ID1及其在TAM中的作用。與正常結腸組織中浸潤的巨噬細胞相比,AOM/ dss誘導的結直腸癌模型或ApcMin自發結直腸癌模型中浸潤的TAM均具有更高的ID1(圖1d-f)。此外,從mc38衍生的同源原位腫瘤中分離的TAMs比從C57BL/6J小鼠中分離的pmms具有更高的ID1 mRNA和蛋白質表達(圖1g, h)。作者還通過包含101例CRC患者標本的組織微陣列分析了人CRC TAMs中ID1的表達。在鄰近正常組織中,CD68+ TAM中ID1的表達高于巨噬細胞(圖1i, j)。作者還評估了在結直腸癌發展過程中TAM中ID1表達的潛在動力學改變。ID1在結直腸癌淋巴結轉移患者的TAM中高表達,且與結直腸癌組織學分級和TNM分期呈正相關。此外,CD68+ TAM中ID1的高表達與結直腸癌患者預后不良相關(圖1k)。總的來說,作者的研究結果表明,ID1在結直腸癌TAMs中異常高表達,尤其是晚期結直腸癌,預示著不良的臨床預后。
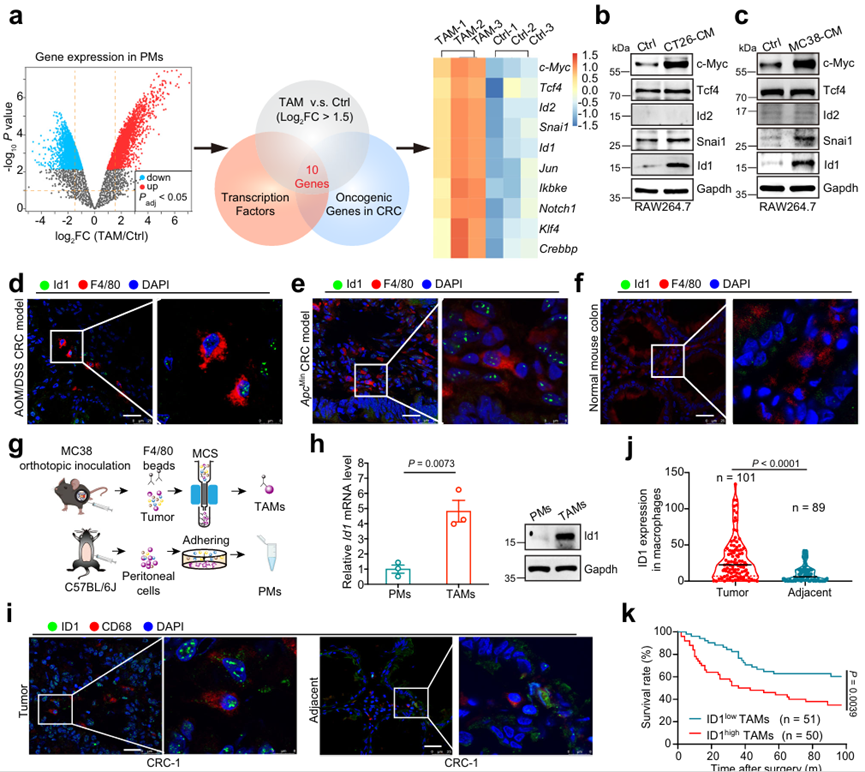
圖1、TAMs中ID1的表達增強與結直腸癌患者的不良臨床預后相關
2、表達TAMs的ID1促進結直腸癌的生長和轉移
為了確定ID1是否直接調節巨噬細胞表型,作者在骨髓特異性基因啟動子(Lyz2tm1(Cre)Ifo/J)的控制下,通過將含有ID1外顯子的小鼠(ID1f/ f)與表達Cre重組酶的小鼠雜交,建立了骨髓特異性ID1缺陷小鼠(ID1Lyz-KO)。小鼠MC38結腸癌細胞皮下接種于ID1f/f和ID1Lyz-KO小鼠。與ID1f/f小鼠相比,MC38荷瘤ID1Lyz-KO小鼠的腫瘤生長降低,這與全體性ID1KO小鼠的數據一致。數據表明,表達ID1的骨髓細胞促進結直腸癌的進展。作者使用兩種TAM過繼轉移模型進一步研究巨噬細胞ID1消融是否抑制腫瘤進展。首先,在體外用具有抗炎條件的基礎培養基(白細胞介素-4)和巨噬細胞集落刺激因子(m-CSF))刺激骨髓源性巨噬細胞,誘導TAM表型。將上述TAM與MC38細胞混合,并過繼轉移至C57BL/6J受體小鼠。ID1f/f衍生的TAM加速了MC38細胞的腫瘤生長,而ID1的缺失減弱了TAM的促腫瘤作用。其次,分選從ID1f/f和ID1Lyz-KO小鼠的MC38源性腫瘤中分離出TAM,與MC38細胞混合,并過繼轉移到C57BL/ 6J受體小鼠體內(圖2a)。含有ID1Lyz-KO TAM的腫瘤比含有ID1f/f TAM的腫瘤生長慢得多(圖2b, c)。ID1Lyz-KO TAM組腫瘤結節中Ki67+細胞比例較低(圖2d)。這些數據表明,TAMs中ID1的缺失會抑制結直腸癌的生長。TAM常通過影響分泌因子的產生,與腫瘤細胞或TME中的其他免疫細胞發生串擾。MC38荷瘤小鼠瘤內注射ID1f/f或ID1Lyz-KO TAMs衍生的CM。注射來自ID1Lyz-KO TAM的CM的腫瘤生長速度比注射來自ID1f/f TAM的CM的腫瘤生長速度慢。為了研究巨噬細胞中的ID1是否參與腫瘤轉移的控制,作者建立了3種CRC轉移模型。在脾-肝轉移模型中,將熒光素酶標記的CT26細胞與TAM來源的CM腹腔注射一起注入脾內(圖2e)。注射ID1f/f TAMs衍生cm的小鼠顯示出增強的生物發光信號、肝/體重比、腫瘤直徑和轉移性腫瘤結節的肝葉數量,當在TAMs中消融ID1時,這些都是相反的(圖2f-k)。在CT26原位肝轉移模型中,將高度轉移的CT26細胞注射到盲腸壁的漿膜下層,并通過腹腔注射TAM來源的CM(圖2l)。用ID1Lyz-KO TAM衍生的cm治療組,轉移部位更少,轉移瘤直徑更小(圖2m - o)。在結直腸癌肺轉移模型中,通過尾靜脈注射熒光素酶標記的CT26細胞,并通過腹腔注射TAM來源的CM。ID1Lyz-KO TAM衍生cm治療組肺轉移面積更小,肺/體重比更低。這些數據表明,表達ID1的TAM通過影響其分泌成分促進結直腸癌腫瘤的生長和轉移。據報道,促炎刺激誘導巨噬細胞具有抗腫瘤(m1樣)表型。IFN-γ和LPS刺激RAW 264.7細胞(如圖RAW- ctrl所示)和ID1過表達的RAW 264.7細胞(如圖RAW- ID1oe所示),誘導腫瘤抑制表型(圖2p)。作者發現來自RAW-Ctrl細胞的CM減輕了腫瘤細胞的生長,降低了Ki67+細胞的比例,而ID1異位表達逆轉了這些抑制作用(圖2q, r)。這些數據表明,高ID1表達損害了經典活化巨噬細胞的抗腫瘤表型。
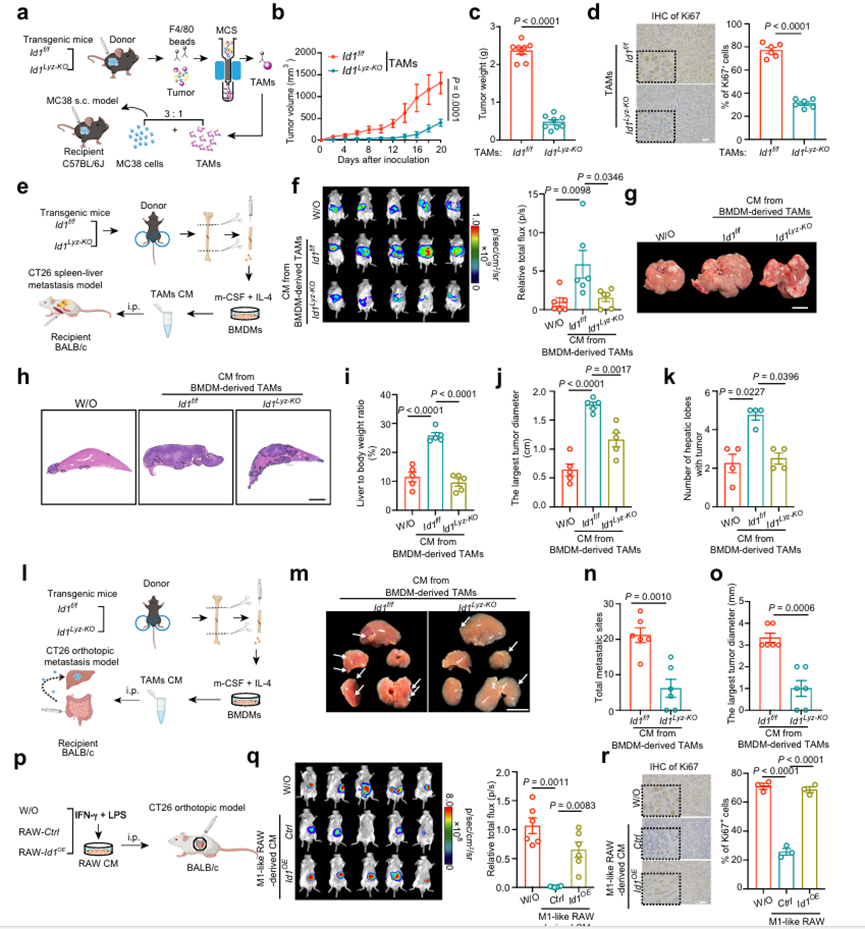
圖2、表達TAM促進結直腸癌的生長和轉移
3、表達TAMs的ID1部分通過排除CD8+ T細胞募集來促進結直腸癌的發展
TAM通常通過防止腫瘤細胞受到T細胞的攻擊而具有直接的免疫抑制功能。為了評估表達ID1的TAM是否具有免疫抑制功能,如圖2a所示,將MC38細胞和TAM混合接種于免疫缺陷的BALB/c裸鼠,而不是免疫正常的C57BL/6J小鼠。BALB/c裸小鼠的腫瘤抑制率約為50%,而C57BL/6J小鼠(如圖2a所示)的腫瘤抑制率超過80%(圖3a),表明表達ID1的TAM可能破壞T細胞介導的抗腫瘤免疫應答。TAMs中ID1的缺失增加了免疫活性C57BL/6J小鼠mc38衍生腫瘤中CD8+ T細胞的浸潤(圖3b, c)。此外,TAMs中ID1的缺失增加了腫瘤浸潤性CD8+ T細胞中干擾素-γ (IFN-γ)和顆粒酶B的表達(圖3d)。作者還利用BALB/c裸鼠脾-肝轉移模型評估了ID1在抗腫瘤免疫應答中的作用。與ID1f/f TAM中的CM相比,ID1Lyz-KO TAM中的CM可減輕BALB/c裸小鼠的生物發光信號、肝/體重比和腫瘤直徑。然而,在免疫正常小鼠中,ID1缺失導致的TAM腫瘤抑制率從70%下降到40%,在免疫缺陷小鼠中(圖3e),證實了ID1表達的TAM調節T細胞介導的抗腫瘤免疫。用來自ID1f/f TAM的CM治療可減少肝或肺轉移瘤內區域的CD8+ T細胞浸潤(如圖2e、l),通過敲除TAM中的ID1可逆轉這一情況(圖3f-h)。此外,在原位結直腸癌模型中,用來自m1樣RAW 264.7細胞的CM處理(如圖2p所示)增加了腫瘤中CD8+ T細胞的浸潤,這被ID1過表達所消除(圖3i)。為了驗證CD8+ T細胞參與表達ID1的TAM的腫瘤促進作用,作者在CT26 s.c.模型中使用全身給藥抗CD8β抗體來耗盡CD8+ T細胞(圖3j)。與ID1Lyz-KO TAMs的CM治療相比,ID1Lyz-KO TAMs治療降低了腫瘤生長,這被CD8+ T細胞消耗部分逆轉(圖3k-m),腫瘤抑制率從~85% (IgG治療組)到35% (CD8消耗抗體組)(圖3n)。這些數據表明,表達ID1的TAM的促腫瘤作用依賴于CD8+ T細胞。缺乏腫瘤內T細胞浸潤與T細胞增殖或遷移減少有關。m1樣RAW 264.7細胞中的ID1OE抑制CD8+ T細胞遷移,而TAM中的ID1Lyz-KO則增強CD8+ T細胞遷移(圖3o,p)。作者還評估了ID1操縱巨噬細胞對T細胞增殖和殺傷活性的影響。用羧基熒光素琥珀酰酰酯(CFSE)熒光染料標記CD8+ T細胞,作者發現在m1樣RAW 264.7細胞中過表達ID1或在TAM中耗盡ID1對CD8+ T細胞的增殖沒有影響。此外,ID1f/f組和ID1Lyz-KO組在影響ova特異性CD8+細胞毒性OT-1 T細胞殺傷活性方面沒有差異。作者也證實了作者在人類原代細胞共培養系統中的觀察結果。當與CRC患者外周血單個核細胞(PBMCs)分離的CD8+ T細胞共培養時,與對照組相比,CRC患者腫瘤組織分離的TAM中ID1的缺失顯示CD8+ T細胞遷移率增強(圖3q)。ID1表達的MDSCs有促進腫瘤生長的報道,作者進一步探討它們是否也通過影響CD8+ T細胞浸潤發揮促瘤作用。從ID1f/f和ID1Lyz-KO小鼠mc38來源腫瘤中分離的Cd11b+ Gr1+ MDSCs與CD8+ T細胞共培養。作者發現MDSCs中ID1的缺失對CD8+ T細胞的遷移速率沒有影響。這些數據表明,表達TAMs而非MDSCs的ID1阻礙CD8+ T細胞募集并促進腫瘤細胞逃避免疫消除。
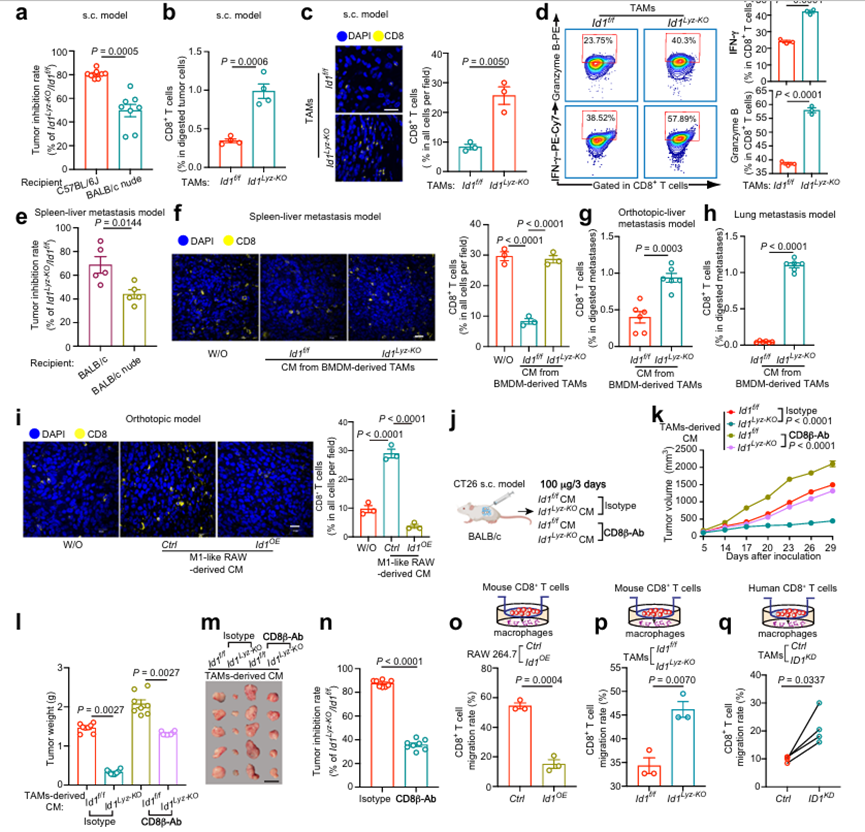
圖3、表達ID1的TAM部分通過抑制CD8+ T細胞募集促進結直腸癌進展
4、表達ID1的TAM是通過激活FAK-YAP信號通路來維持CRC干性性狀的必要條件
敲除TAMs中的ID1對免疫缺陷小鼠的腫瘤生長和轉移有抑制作用,表明表達ID1的TAMs可能影響腫瘤的內在特性。CSC被認為是腫瘤發生、轉移、耐藥和復發的起源。如上所述,ID1Lyz-KO組分離的腫瘤細胞表達CD44和Lgr5 (CSC標志物)低于ID1f/f組(圖4a, b)。TAM中ID1的缺失使腫瘤啟動細胞頻率降低到近1/3(從1/979降至1/ 2378)(圖4c)。這些數據表明,表達TAMs的ID1支持結直腸癌細胞的干性特征。TAM可以通過可溶性介質促進CSC表型。與CRC患者腫瘤組織來源的ID1KD TAM共培養的HCT116細胞表達的CD44和LGR5水平低于與Ctrl TAM共培養的細胞(圖4d)。與ID1Lyz-KO TAM共培養的MC38細胞表達的CD44和Aldh水平低于與ID1f/f TAM共培養的MC38細胞(圖4e)。CT26細胞與過表達ID1的m1樣RAW 264.7細胞共培養,HCT116細胞與過表達ID1的m1樣THP-1細胞共培養,CD44和ALDH的表達高于與Ctrl細胞共培養的細胞。此外,來自ID1KDor ID1Lyz-KO TAMs的CM被抑制,而來自ID1OE RAW 264.7細胞或ID1OE THP-1細胞的CM促進了腫瘤球的形成能力(圖4f;)和CRC細胞的侵襲性。這些數據表明,TAMs中的ID1通過改變TAMs的分泌成分來增加CRC細胞的干性特征。通過混合MC38細胞和ID1f/f/ID1Lyz-KO TAMs植入sc腫瘤結節,利用轉錄組測序技術評估從腫瘤結節分離的癌細胞中的差異表達基因(DEGs)(圖4)。基因集富集分析(GSEA)表明,TAMs中atID1的缺失導致局灶黏附激酶(FAK)和ye相關蛋白(YAP)信號通路的抑制,但不影響其他腫瘤干性相關信號通路,如Notch、Wnt/βcatenin和Sonic hedgehog (SHH)通路(圖4h, 1)。與該數據一致的是,從ID1f/f小鼠的腫瘤結節中分離出的腫瘤細胞與BMDM衍生的TAM混合后,與未混合的細胞相比,p-Fak和Yap的豐度更高,這是通過TAM中ID1的消耗而逆轉的(圖4j)。作者還在MC38 s.c.模型(如圖2a所示)、脾-肝轉移模型(如圖2e所示)、原位模型(如圖2p所示)以及體外細胞非接觸共培養系統中檢測到了FAK-YAP信號的變化。ID1缺失的TAMs減少,而ID1過表達的m1樣RAW 264.7細胞增加了p-Fak和Yap的豐度。FAK特異性抑制劑Y15可以逆轉m1樣THP1細胞中ID1過表達對YAP蛋白表達的上調作用,表明ID1通過FAK依賴的方式誘導YAP活化(圖4k)。FAK通過磷酸化YAP的Y357位點來維持腫瘤干性性狀,從而增強其蛋白穩定性、核易位和轉錄活性。YAP在核易位后與TEAD形成轉錄復合物,是維持腫瘤干性性狀的關鍵步驟。ID1缺失下調,而其過表達增強了YAP蛋白的穩定性、YAP (Y357)磷酸化、核易位、TEAD的熒光素酶活性以及下游靶基因的轉錄(圖41 - O)。維替波芬是YAP-TEAD復合物的一種抑制因子,在很大程度上逆轉了ID1過表達m1樣THP-1細胞的CM對CRC腫瘤干細胞的促進作用(圖4p)。這些數據表明,來自表達TAMs的ID1分泌成分對于維持腫瘤細胞中FAK-YAP的激活至關重要。Y15進一步驗證表達ID1的TAM是否通過激活FAK信號維持癌干性性狀。在CT26 s.c. BALB/c裸鼠模型中,與對照組相比,Y15如預期的那樣緩解了腫瘤生長,逆轉了ID1OE RAW 264.7細胞中CM的腫瘤加速作用(圖4q, r)。值得注意的是,在Y15處理下,ID1OE m1樣巨噬細胞中的CM不再增強腫瘤細胞的侵襲性、腫瘤球體形成能力或CD44蛋白的豐富度(圖4s)。這些數據表明,表達ID1的TAM通過激活癌細胞中的FAK-YAP信號來支持CRC的干細胞性。
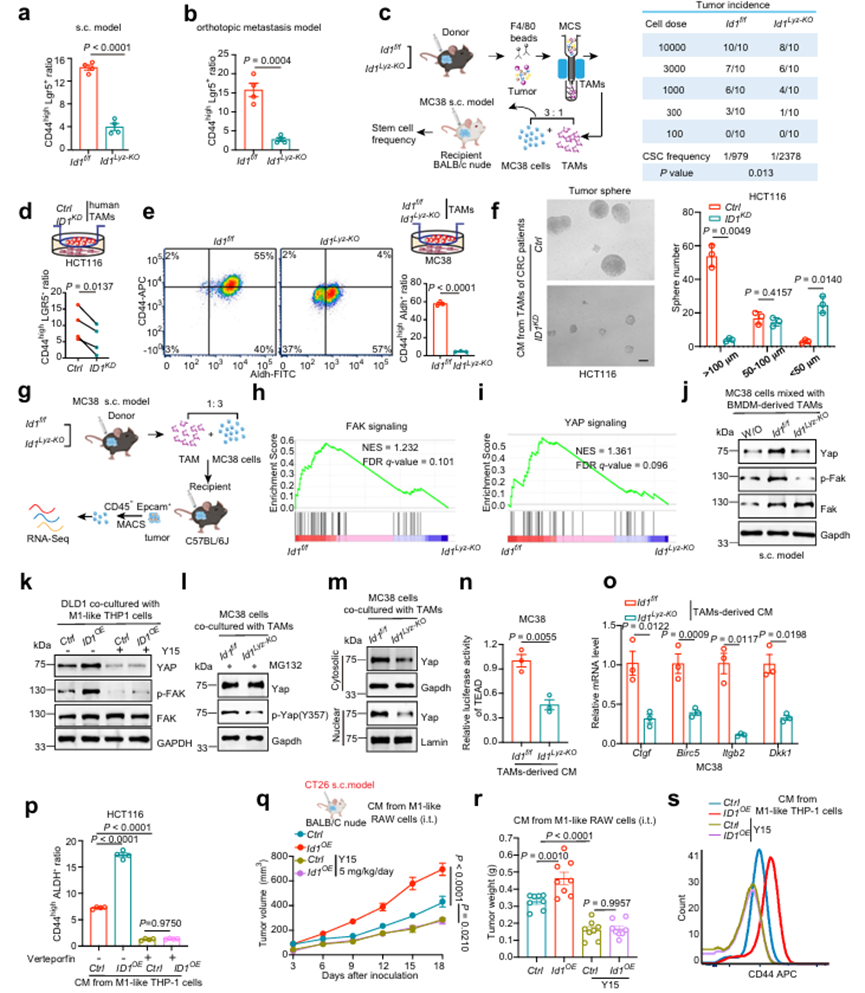
圖4、表達ID1的TAM對于通過激活FAK-YAP信號通路維持CRC干性性狀至關重要
5、TAMs中的ID1通過抑制CCL4和SerpinB2轉錄介導腫瘤免疫逃避和CRC干性維持
對ID1f/ ID1Lyz-KO小鼠中mc38來源的腫瘤組織分離的TAM進行轉錄組測序,以探索ID1如何塑造TAM的促腫瘤表型(圖5a)。ID1抑制與其相互作用的bHLH蛋白的DNA結合和轉錄激活能力。作者的上述數據表明,ID1調節的分泌成分對TAM維持癌癥的干細胞性和促進癌癥免疫侵襲至關重要。因此,作者將重點放在ID1Lyz-KO TAM中編碼分泌蛋白的基因與ID1f/f TAM相比的上調上。在ID1Lyz-KO TAMs中,與ID1f/f TAMs相比,發現超過2000個基因增加(圖5b)。從免疫應答調節方面,作者選擇了20個log2FC > 1.5的上調基因編碼趨化因子,其中Ccl3、Ccl4、Cxcl9和Cxcl16具有共同的抑瘤作用和促進T細胞浸潤的作用(圖5c)。在這四種趨化因子中,只有Ccl4在ID1OE RAW 264.7細胞中的轉錄水平低于Ctrl細胞(圖5d)。酶聯免疫吸附試驗(ELISA)證實,從結直腸癌患者腫瘤組織、mc38衍生腫瘤組織或BMDMs誘導的ID1缺失的TAM顯示CCL4蛋白豐度增加(圖5e)。m1樣巨噬細胞中ID1的過表達降低了CCL4蛋白水平(圖5f)。然后,作者建立了Ccl4缺失的TAM來驗證Ccl4在介導ID1調節的CD8+ T細胞募集中的作用。TAM中ID1的缺失導致CD8+ T細胞遷移增加,這可以通過敲低Ccl4來逆轉(圖5)。這些數據表明,表達ID1的TAM失去了CCL4的分泌,阻礙了CD8+ T細胞向腫瘤部位的運輸。從腫瘤內在特性調控方面,作者選擇了12個log2FC > 1.5的編碼分泌性腫瘤抑制因子(不含趨化因子)的上調基因,其中只有Serpin家族B成員2 (SerpinB2)被報道抑制FAK信號傳導(圖5h)。分析CRC GEO數據集,作者發現SerpinB2與CRC患者的滿意結局呈正相關。TAMs中ID1的缺失增加了SerpinB2蛋白的豐度,而ID1過表達降低了SerpinB2蛋白的豐度(圖5i, j)。TAMs中ID1敲除對CSC標志物表達、腫瘤球形成能力和腫瘤侵襲性的抑制作用可以通過去除Serpinb2 (Serpinb2KD)來逆轉(圖5 k、m)。此外,在TAM中沉默Serpinb2可以增強腫瘤侵襲性和腫瘤成球能力,這可以通過Y15治療逆轉。這些數據表明,ID1可以抑制Serpinb2的表達,激活FAK信號,增強癌細胞的干細胞性。為了證實ID1是否通過損害SerpinB2和CCL4的表達而發揮促瘤作用,作者在ID1f/f和ID1Lyz-KO TAM中同時缺失了這兩個基因。當Ccl4和Serpinb2同時缺失時,TAM中ID1缺失對腫瘤生長和肝轉移的抑制作用被完全消除(圖5n-p)。無論是在s.c.模型中還是在轉移模型中,當Ccl4和Serpinb2同時被敲低時,TAMs中ID1缺失引起的CD8+ T細胞浸潤增強和對FAK-YAP信號的抑制都減弱了。證據表明,ID1抑制巨噬細胞SerpinB2和CCL4的轉錄,促進腫瘤免疫逃逸,增強CRC細胞的致瘤能力,最終導致腫瘤生長和轉移加劇。
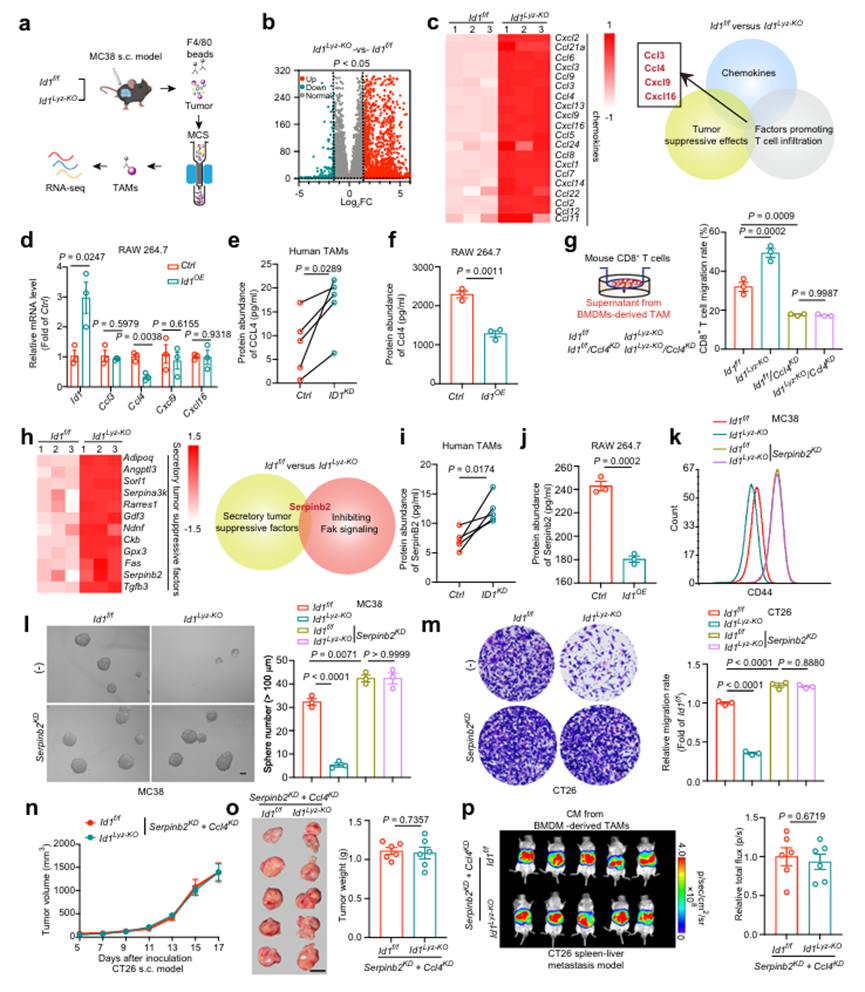
圖5、TAMs中的ID1通過抑制CCL4和SerpinB2轉錄介導腫瘤免疫逃避和CRC干性維持
6、ID1與STAT1相互作用抑制CCL4和SerpinB2的轉錄
由于ID1不具有DNA結合能力,通常與TF相互作用并抑制其活性,因此采用共免疫沉淀聯用質譜法(Co-IP/MS)鑒定RAW 264.7細胞中可能與ID1相互作用的TF。此外,使用hTFtarget工具預測了16個可能負責CCL4和SerpinB2轉錄的TF。根據Co-IP/MS分析,STAT1是16個TF中唯一一個與ID1相互作用的TF(圖6a)。作者通過Co-IP、近距離結扎實驗(PLA)和共聚焦成像進一步證實了CRC患者腫瘤組織中HEK 293T細胞、RAW 264.7細胞和CD68+ TAM中STAT1和ID1的直接相互作用(圖6b-e)。這些數據表明ID1可能與STAT1相互作用,抑制STAT1介導的CCL4和SerpinB2轉錄。采用染色質免疫沉淀法(ChIP)驗證了Serpinb2和Ccl4是否為RAW 264.7細胞中Stat1的靶基因。Stat1在?3000 ~?2701 bp、?2760 ~?2461 bp和?1080 ~?781 bp的位置與Ccl4啟動子結合;以及在- 2517至- 2221 bp和- 1320至- 1021 bp的Serpinb2啟動子。為了進一步驗證,作者選擇了結合信號最高的啟動子區域pCcl4-2和pSerpinb2-8。雙熒光素酶報告基因實驗表明,ID1通過結合pCcl4-2和pSerpinb2-8啟動子區域抑制Ccl4和Serpinb2的轉錄(圖6f)。為了進一步探索ID1調控STAT1轉錄活性的分子機制,作者深入剖析了這兩種蛋白的結合結構域。Co-IP分析表明,ID1的n端和HLH結構域介導了其與STAT1的相互作用。此外,STAT1的n端、DNA結合域和SH2域介導了其與ID1的關聯。據報道,n端和SH2結構域介導STAT1二聚化。然而,ID1過表達對STAT1二聚化沒有影響。STAT1的細胞質和細胞核定位是一個維持適度信號激活的動態過程。因此,作者質疑ID1是否參與了STAT1核出口的調控。在IFN-γ處理下,ID1的過表達降低了細胞核中基礎Stat1和p-Stat1的豐度,但增加了細胞質中的Stat1和p-Stat1的豐度(圖6g)。CRM1識別STAT1 DNA結合域的一個區域,將其重新分配回細胞質。作者發現ID1增強了CRM1與STAT1的相互作用(圖6h, i)。Co-IP分析進一步證實了這三種蛋白相互作用,這意味著在ID1、STAT1和CRM1之間形成了異三聚體蛋白復合物。Leptomycin B是一種CRM1抑制劑,可保持Stat1的核分布。在IFN-γ處理下,ID1將STAT1二聚體從細胞核重新分配到細胞質中,這可以通過leptomycin B處理消除(圖6j)。此外,作者發現在leptomycin b處理下,ID1缺失并不影響Stat1與Serpinb2和Ccl4啟動子的結合能力。這些數據表明,ID1促進CRM1向STAT1募集,從而促進STAT1的細胞質分布,抑制STAT1誘導的CCL4和SerpinB2轉錄
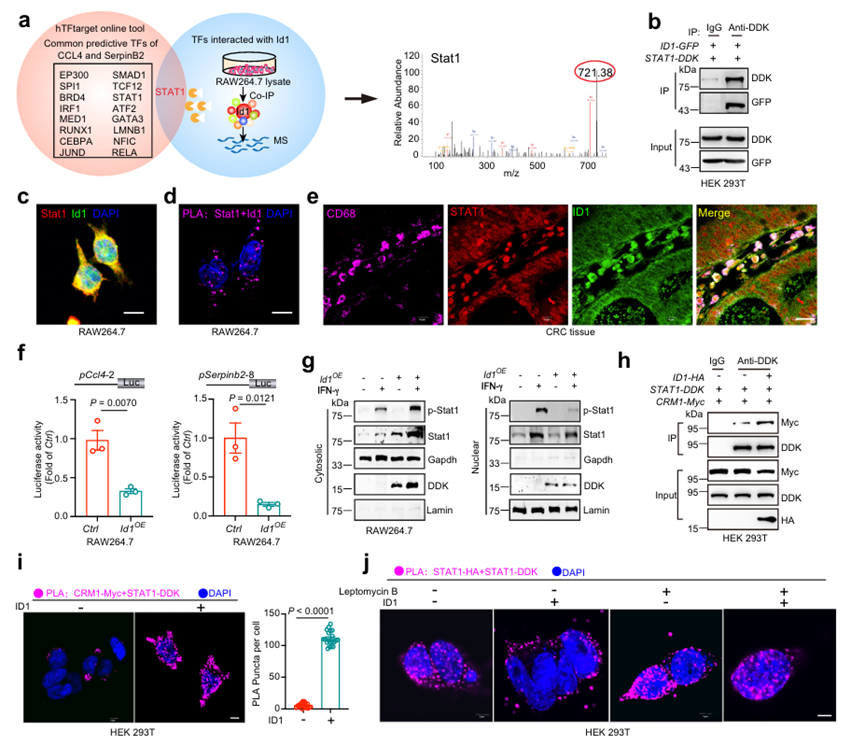
圖6、ID1與STAT1相互作用抑制CCL4和SerpinB2的轉錄
7、靶向ID1抑制結直腸癌進展并使腫瘤細胞對化療和免疫治療敏感
ID1是一種短壽命蛋白,主要受到泛素化介導的蛋白酶體或自噬降解的影響。作者探討了藥物減少ID1是否可以消除TAM的促腫瘤作用。泛素化特異性蛋白酶1 (USP1)是一種去泛素化酶,據報道可以保持蛋白的穩定。作者評估了ML323 (USP1的選擇性抑制劑)在同基因sc型結直腸癌小鼠模型和同基因原位轉移型結直腸癌小鼠模型中的潛在抗腫瘤作用。在s.c.模型中,ML323給藥降低了TAMs中ID1的表達,并表現出明顯的腫瘤抑制作用,從腫瘤體積和腫瘤重量與載藥組比較可見(圖7a, b)。此外,作者檢測到ml323處理組腫瘤浸潤性CD8+ T細胞中顆粒酶B和IFN-γ表達增加,CD8+ T細胞效應功能增強(圖7c)。此外,ml323處理組腫瘤組織中分離的腫瘤細胞中CSC標志物的表達降低(圖7d)。在原位肝轉移模型中,ML323治療明顯減輕了肝轉移,CD8+ T細胞浸潤和有效性增強,腫瘤細胞干性性狀受到抑制(圖7e-i)。作者進一步證實,ML323部分通過調節TAMs中ID1的表達來抑制腫瘤進展。使用ID1f/f和ID1LyzKO小鼠,作者證明在MC38 s.c.模型中,骨髓細胞中ID1的缺失在很大程度上但不是完全逆轉了ML323的腫瘤抑制作用(圖7j, k),表明ML323在髓細胞中部分通過ID1起作用。然后將TAM從腫瘤組織中分離出來,置于載具或ML323處理的小鼠中,以研究ML323的影響(圖71)。通過非接觸式共培養系統,作者證明了ML323處理的TAM促進了CD8+ T細胞的遷移,抑制了CT26細胞中CD44和Aldh的表達(圖7m, n)。此外,體外實驗進一步證實了ML323對TAM的直接影響。作者證實,BMDM衍生TAM的CM與ML323治療也促進了CD8+ T細胞的遷移能力,降低了CSC標志物的表達,腫瘤成球能力和侵襲性。此外,TAMs中的ID1Lyz-KO消除了ML323治療對腫瘤干細胞和CD8+ T細胞遷移的影響(圖7o,p),表明ML323對TAM的影響是由ID1介導的。在機制上,在ML323處理的TAM中,Serpinb2和Ccl4的蛋白豐度均上調(如圖7l所示)。作者使用RAW 264.7細胞進行體外實驗,進一步驗證ML323通過調節ID1對Serpinb2和Ccl4的影響。作者的研究結果表明,ML323處理導致ID1過表達陰性的RAW 264.7細胞中Serpinb2和Ccl4的表達增加(圖7q, r)。這些數據共同表明,ML323通過降低TAMs中ID1的表達來發揮抗腫瘤作用。這些結果促使作者在臨床前小鼠模型中評估ML323(較低劑量為3mg /kg)聯合化療或免疫治療的潛在效果。首先,作者用ML323聯合5-氟尿嘧啶(5-FU)治療CT26荷瘤小鼠(圖7s)。與5-FU或ML323單藥治療組相比,ML323聯合5-FU表現出協同抗腫瘤作用,從腫瘤體積(圖7t)和腫瘤重量(圖7u, v)可見。其次,作者在CT26荷瘤小鼠中測定了ML323與抗ctla4的協同作用(圖7w)。聯合治療的抗腫瘤效果強于單獨使用ML323或抗ctla4(圖7x-z)。此外,在聯合治療組中觀察到CD8+ T細胞浸潤增加,CD8+ T細胞效應功能增強。這些數據表明,通過抑制USP1活性靶向ID1可能是提高化療和免疫治療CRC療效的潛在策略。由于所有的實驗都是在雄性小鼠身上進行的,作者進一步研究ID1在TAM中的作用是否存在性別差異。在雄性小鼠中觀察到,注射來自ID1Lyz-KO TAM的CM的腫瘤生長速度比注射來自ID1f/f TAM的CM的腫瘤生長速度慢。此外,ID1Lyz-KO組腫瘤組織中CD45- Epcam+腫瘤細胞CD8+ T細胞浸潤增多,CD8+ T細胞活性提高,CD44high Lgr5+表達降低。這些數據表明,ID1在TAM中的促腫瘤作用在性別之間沒有差異。為了探索作者的發現的普遍性,作者建立了另外兩個使用H22(小鼠肝細胞癌細胞系)和Pan02(小鼠胰腺導管腺癌細胞系)的sc腫瘤小鼠模型。BMDM衍生TAM中ID1的缺失也能抑制肝癌和胰腺癌的腫瘤生長,降低腫瘤干細胞比例,促進CD8+ T細胞的浸潤和活性。這些數據表明,作者關于表達TAM的ID1促進腫瘤進展的發現可能與其他類型的癌癥具有廣泛的相關性。
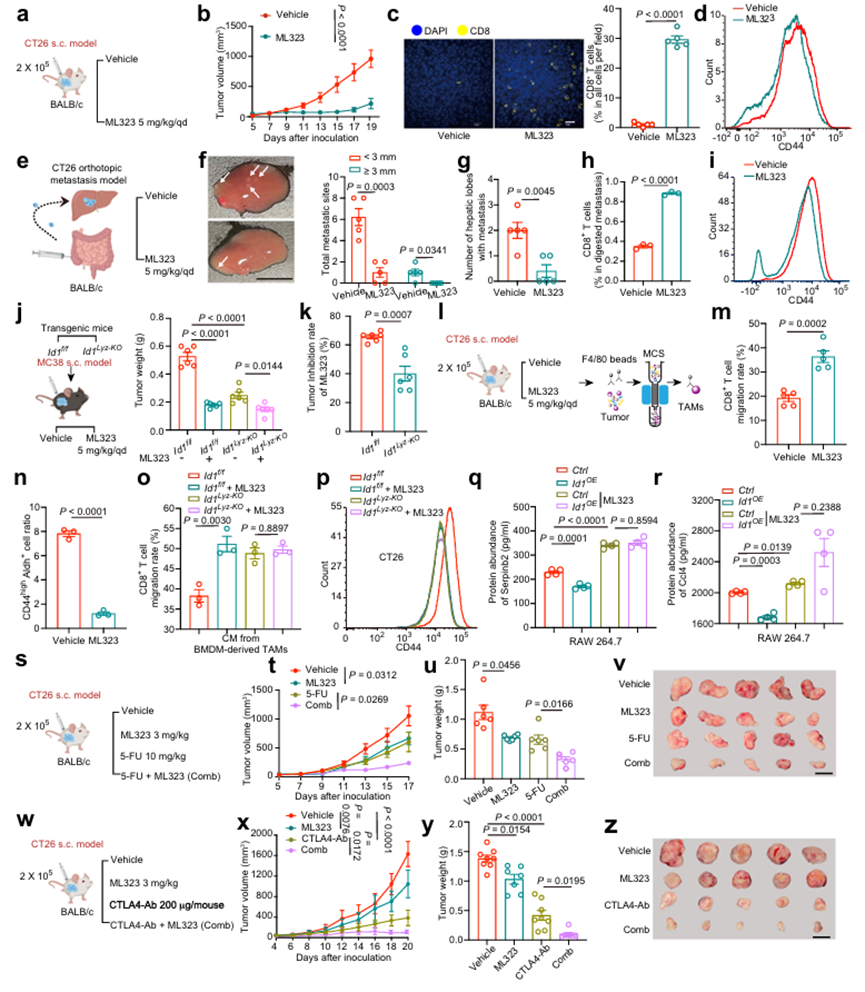
圖7、靶向ID1抑制結直腸癌進展并使腫瘤細胞對化療和免疫治療敏感
結論
總的來說,作者的工作確定了TAM表達的ID1作為中心分子節點,雙重控制癌癥啟動能力和誘導腫瘤免疫逃逸。在結直腸癌中,TAMs中ID1的高表達代表了一種免疫逃避和腫瘤干細胞維持機制。此外,作者提供的證據表明,靶向ID1穩定性可以提高CRC患者的免疫治療和化療敏感性。
實驗方法
流式細胞術、質粒構建、免疫沉淀,免疫印跡,免疫染色和免疫組織化學、質譜分析、腫瘤球形成試驗、羧基熒光素丁二酰酯(CFSE)測定
參考文獻
Shang S, Yang C, Chen F, Xiang RS, Zhang H, Dai SY, Liu J, Lv XX, Zhang C, Liu XT, Zhang Q, Lu SB, Song JW, Yu JJ, Zhou JC, Zhang XW, Cui B, Li PP, Zhu ST, Zhang HZ, Hua F. ID1 expressing macrophages support cancer cell stemness and limit CD8+ T cell infiltration in colorectal cancer. Nat Commun. 2023 Nov 23;14(1):7661. doi: 10.1038/s41467-023-43548-w. PMID: 37996458; PMCID: PMC10667515.






