SIRT6調(diào)節(jié)的巨噬細胞胞葬作用表觀遺傳控制糖尿病牙周炎的炎癥消退
糖尿病加劇了牙周炎的患病率和嚴(yán)重程度,導(dǎo)致嚴(yán)重的牙周破壞并最終導(dǎo)致牙齒脫落。炎癥的延遲消退是糖尿病牙周炎(DP)發(fā)病機制的主要因素,但這種不平衡的免疫穩(wěn)態(tài)的潛在機制尚不清楚。下圖為23年巨噬細胞胞葬中標(biāo)題目:
巨噬細胞中SIRT6作為組蛋白去乙酰化酶的不足導(dǎo)致人類和小鼠DP中未解決的炎癥和加重的牙周炎,并伴有凋亡性中性粒細胞(AN)的積累和中性粒細胞胞外陷阱的增加。在機制上,驗證了巨噬細胞接受高糖刺激導(dǎo)致SIRT6-miR-216/217軸紊亂,通過直接靶向DEL-1/CD36軸觸發(fā)AN的胞葬受阻。此外,我們證明了SIRT6對MIR217HG轉(zhuǎn)錄的抑制作用,并鑒定了微處理器的作用,即SIRT6通過hnRNPA2B1、DGCR8和Drosha復(fù)合體在表觀遺傳學(xué)上阻礙了初級miR-216/217的剪接。該研究于23年1月發(fā)表于《Theranostics》,IF:12.4。
技術(shù)路線:

1.嗜中性粒細胞和巨噬細胞在人DP中的特征性分布
為了探索糖尿病相關(guān)炎癥性疾病中細胞群組成和調(diào)節(jié)細胞通路的差異,使用單細胞測序分析了來自健康非糖尿病和糖尿病足潰瘍非治愈者(DFU-Non-healer)的足部皮膚樣本GSE165816 .GO富集分析結(jié)果顯示,炎癥和細胞凋亡相關(guān)通路被激活(圖1A和B)。在鑒定的炎癥細胞中,研究專注于增加巨噬細胞浸潤,并通過GO分析和UMAP分析進一步鑒定巨噬細胞簇的細胞群。UMAP分析顯示巨噬細胞異常極化(圖1C)。GO富集分析顯示,與非DM對照巨噬細胞相比,糖尿病巨噬細胞在免疫反應(yīng)、吞噬作用、遷移能力和葡萄糖代謝等相關(guān)途徑中出現(xiàn)異常(圖1D和E)。這些結(jié)果表明,糖尿病創(chuàng)面愈合過程中的異常炎癥反應(yīng)可能是由細胞凋亡相關(guān)通路的大量激活和巨噬細胞的異常吞噬能力引起的。為了進一步探討DP炎癥持續(xù)升高是否與巨噬細胞吞噬能力異常有關(guān),我們收集了患有或不患有糖尿病的牙周炎患者的牙齦樣本(圖1F)。因此,我們首先在牙齦中檢測到中性粒細胞,結(jié)果顯示DP中性粒細胞浸潤(CD15)細胞數(shù)量高于CP組(1G和L)。采用連續(xù)切片牙齦組織進行TUNEL染色,結(jié)果顯示DP的牙齦組織中有大量的凋亡細胞,而CP中幾乎沒有可見的凋亡細胞(圖1H和M)。此外,通過切片進行比較觀察,發(fā)現(xiàn)大多數(shù)凋亡細胞是CD15中性粒細胞(圖1G和H)。隨后使用MPO和H3cit標(biāo)記NETs,發(fā)現(xiàn)DP中中性粒細胞的過度積累和延遲去除導(dǎo)致了大量NETs的形成(圖1I和N),從而加重了糖尿病患者的炎癥并延遲了炎癥的消退。為進一步探究未及時清除的凋亡中性粒細胞是否為巨噬細胞浸潤異常所導(dǎo)致的,接下來對巨噬細胞極化進行免疫熒光染色。巨噬細胞(CD68)在DP牙齦中的浸潤率遠高于CP(圖1O)。DP組CD68、CD86陽性M1巨噬細胞浸潤率高于CP組(圖1J和P),CD68 CD206陽性M2極化巨噬細胞中DP組和CP組無差異(圖1K和Q)。然而,DP組的M2/M1比值明顯低于CP組(圖1R)綜上所述,凋亡中性粒細胞和NETs的過度積累和延遲清除,伴有巨噬細胞浸潤增加和巨噬細胞極化破壞,無疑加重了DP炎癥。
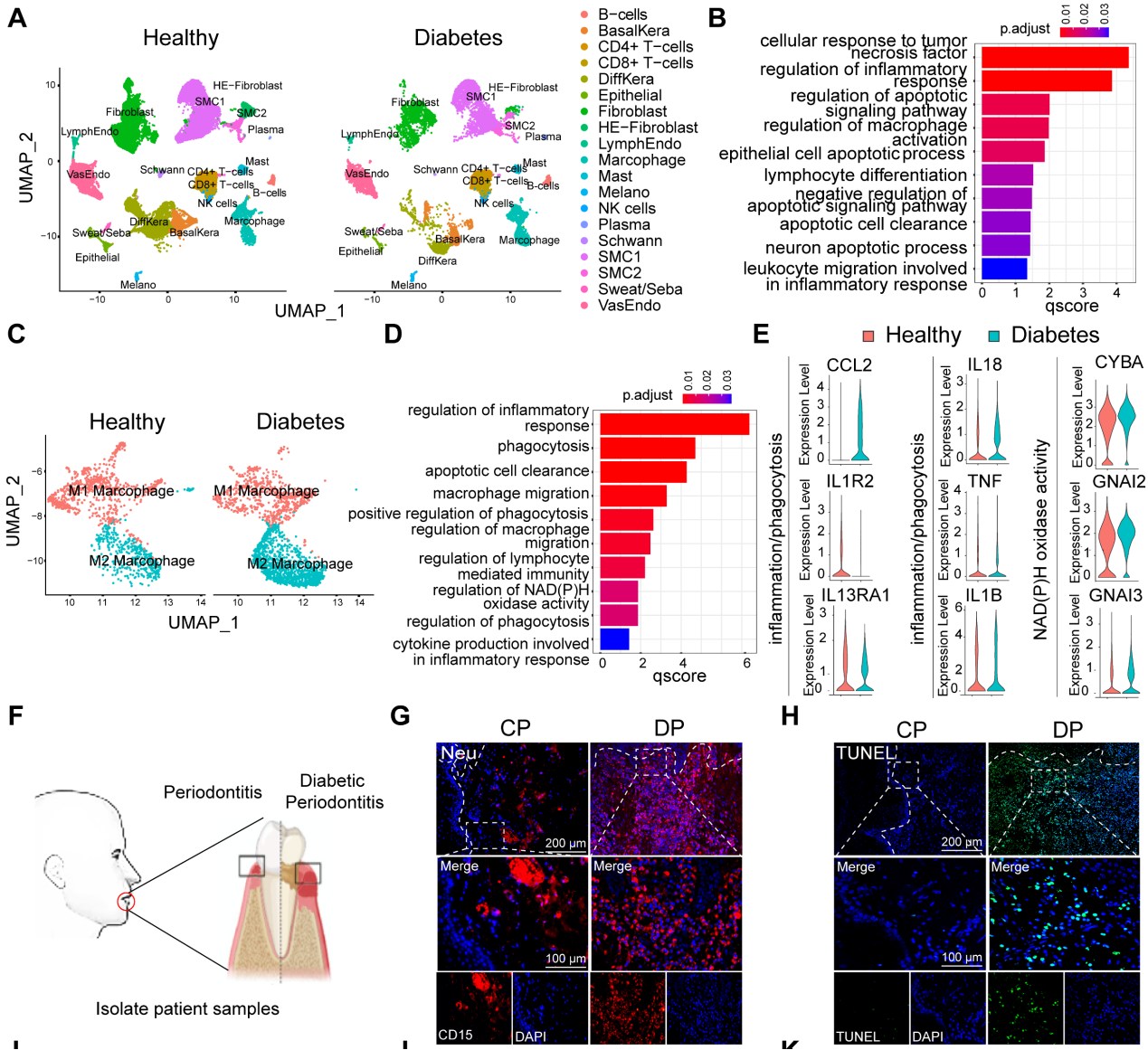
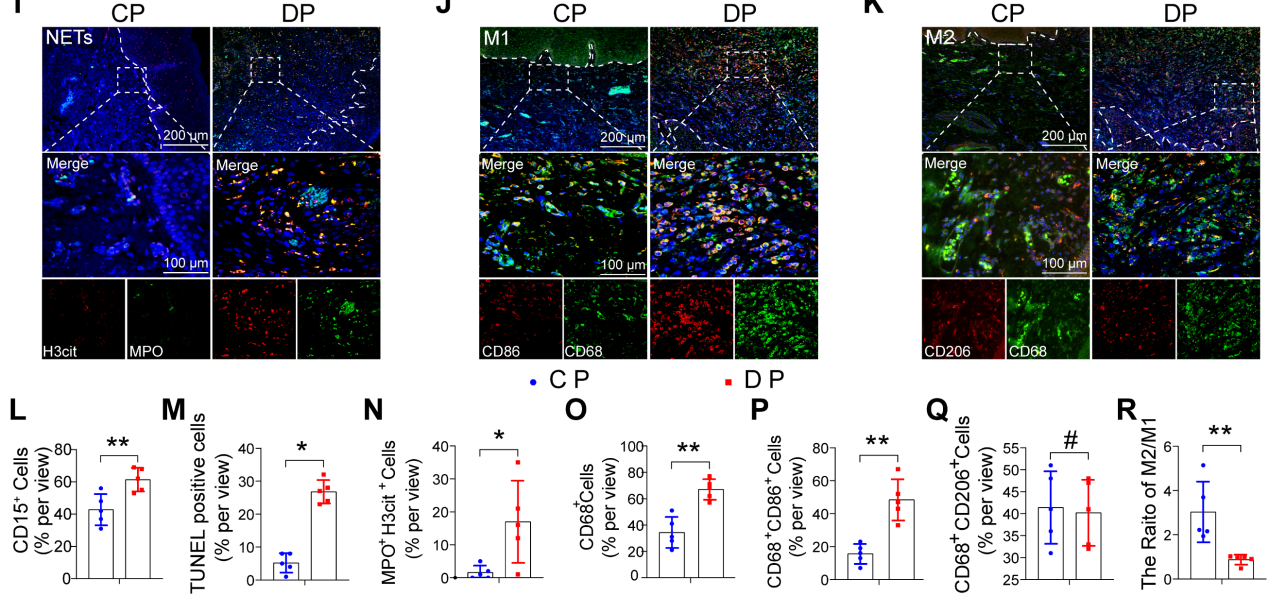 圖1嗜中性粒細胞和巨噬細胞在人DP中的特征性分布
圖1嗜中性粒細胞和巨噬細胞在人DP中的特征性分布
2.功能失調(diào)的中性粒細胞和巨噬細胞會加重小鼠 DP 的炎癥損傷并損害炎癥消退
為了探究糖尿病對牙周炎進展和炎癥消退的影響,我們使用了兩種經(jīng)典的結(jié)扎誘導(dǎo)牙周炎(LIP)小鼠模型,即牙周炎模型和牙周炎消退模型。在牙周炎模型中進行結(jié)扎過程長達14天,而牙周炎消退模型中的小鼠結(jié)扎7天,然后去除結(jié)扎以模擬炎癥消退的過程再進行7天(圖2A)進行顯微CT和組織形態(tài)學(xué)分析以觀察牙槽骨丟失和炎癥。在牙周炎和牙周炎消退模型中,糖尿病小鼠從CEJ到ABC的距離均顯著增加(圖2B和I)。在牙周炎和牙周炎消退模型中,與CP組相比,糖尿病小鼠表現(xiàn)出更多的破骨細胞活性,TRAP陽性破骨細胞表面發(fā)生率更高(圖2C和J)。此外,在DP的牙周中觀察到大量的中性粒細胞浸潤以及MPO和H3cit NET(圖2D、K、E、L)。TUNEL染色還顯示DP牙周內(nèi)有大量凋亡細胞,而CP組未觀察到可見的凋亡細胞(圖2F和M)。DP組F4/80巨噬細胞浸潤數(shù)大于CP組(圖2N)具體來說,F(xiàn)4/80+ CD86+ M1巨噬細胞的數(shù)量(圖2G和O)和F4 / 80 CD206 M2巨噬細胞(圖2H和P)顯著高于CP組。然而,在LIP模型的分辨率中,與CP組相比,DP中M2 / M1巨噬細胞的比率也顯著降低(圖2Q)總的來說,牙周組織中凋亡性粒細胞和NETosis的積累加速了牙周炎的進展,而凋亡性中性粒細胞和NET的延遲清除阻礙了小鼠DP炎癥的消退。
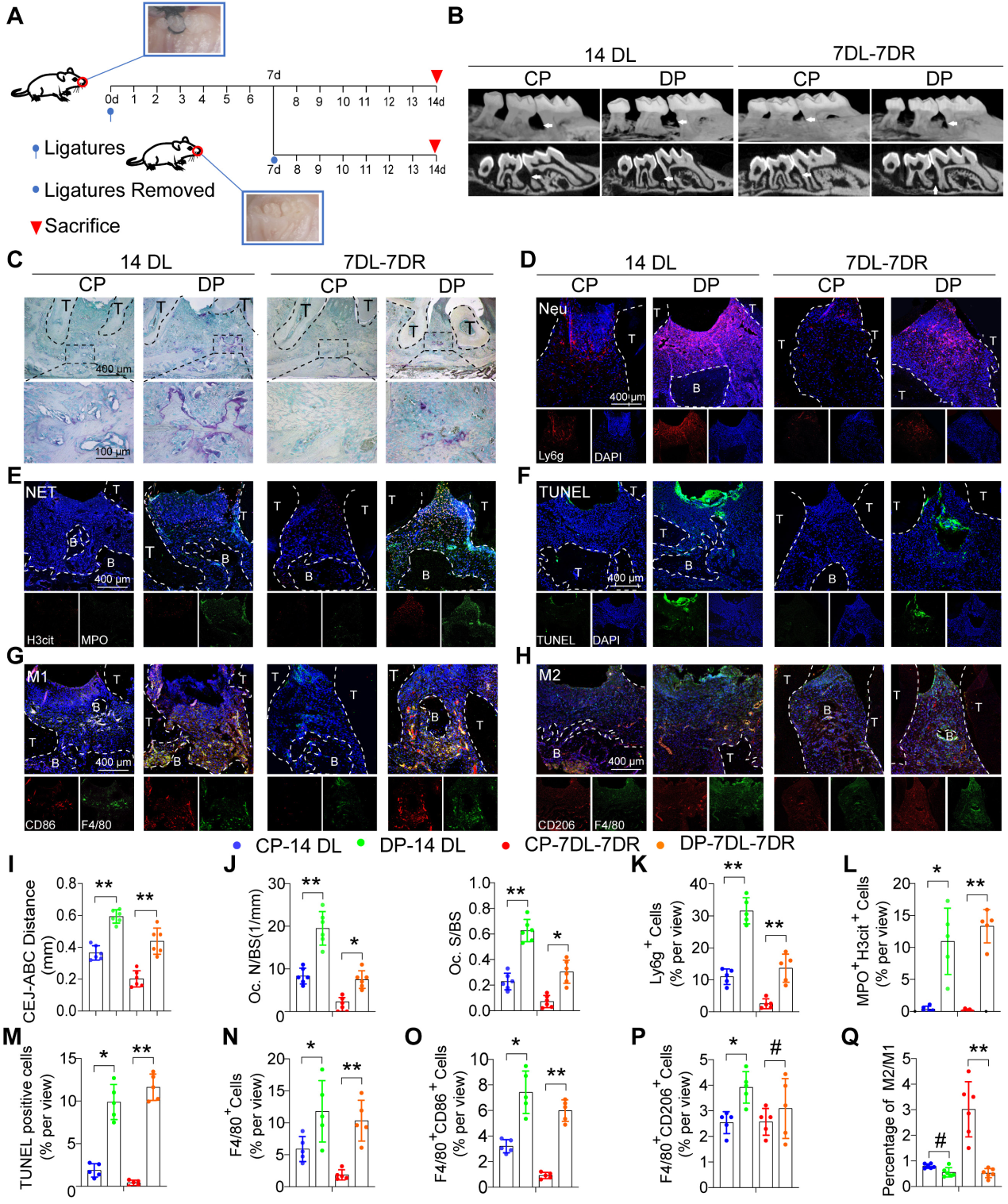
圖2功能失調(diào)的中性粒細胞和巨噬細胞會加重小鼠 DP 的炎癥損傷并損害炎癥消退
3.SIRT6 在高糖條件下顯著調(diào)節(jié)巨噬細胞胞吐作用
高糖(HG)刺激后巨噬細胞吞噬凋亡中性粒細胞的能力下降(圖3A)。鑒于DM巨噬細胞團團的GO富集分析顯示NAD+代謝異常(圖1D, E),我們進一步檢查發(fā)現(xiàn)HG刺激可導(dǎo)致NAD+/NADH代謝異常(圖3B)。Sirtuins (SIRTs)是一個依賴NAD+的組蛋白去乙酰化酶家族,在葡萄糖穩(wěn)態(tài)、炎癥、基因組穩(wěn)定性和DNA修復(fù)中發(fā)揮作用。因此,我們確定并重點關(guān)注SIRT6,因為它在HG條件下明顯下調(diào),在48 h和72 h時最為明顯(圖3C)。為了進一步研究SIRT6在DP巨噬細胞中的可能功能,CD68(巨噬細胞標(biāo)志物)和SIRT6共染色顯示,與CP相比,DP巨噬細胞中SIRT6的表達顯著降低(圖3D)。SIRT6抑制劑顯著降低了巨噬細胞進行胞葬的能力,而SIRT6過表達則提高了其吞噬凋亡中性粒細胞的能力(圖3E, F)。與胞葬相比,凋亡細胞增加了巨噬細胞的遷移能力。綜上所述,高糖刺激導(dǎo)致巨噬細胞SIRT6的低表達,從而損害了胞葬,胞葬通過減少死細胞的DAMP釋放和維持生物穩(wěn)態(tài)來抑制炎癥。然而,當(dāng)糖尿病患者巨噬細胞的胞漿功能受損時,通過損傷相關(guān)的分子識別模型,促炎溶解細胞死亡,包括NETosis和胞葬,導(dǎo)致巨噬細胞浸潤增加,打破了M1和M2分化的平衡。
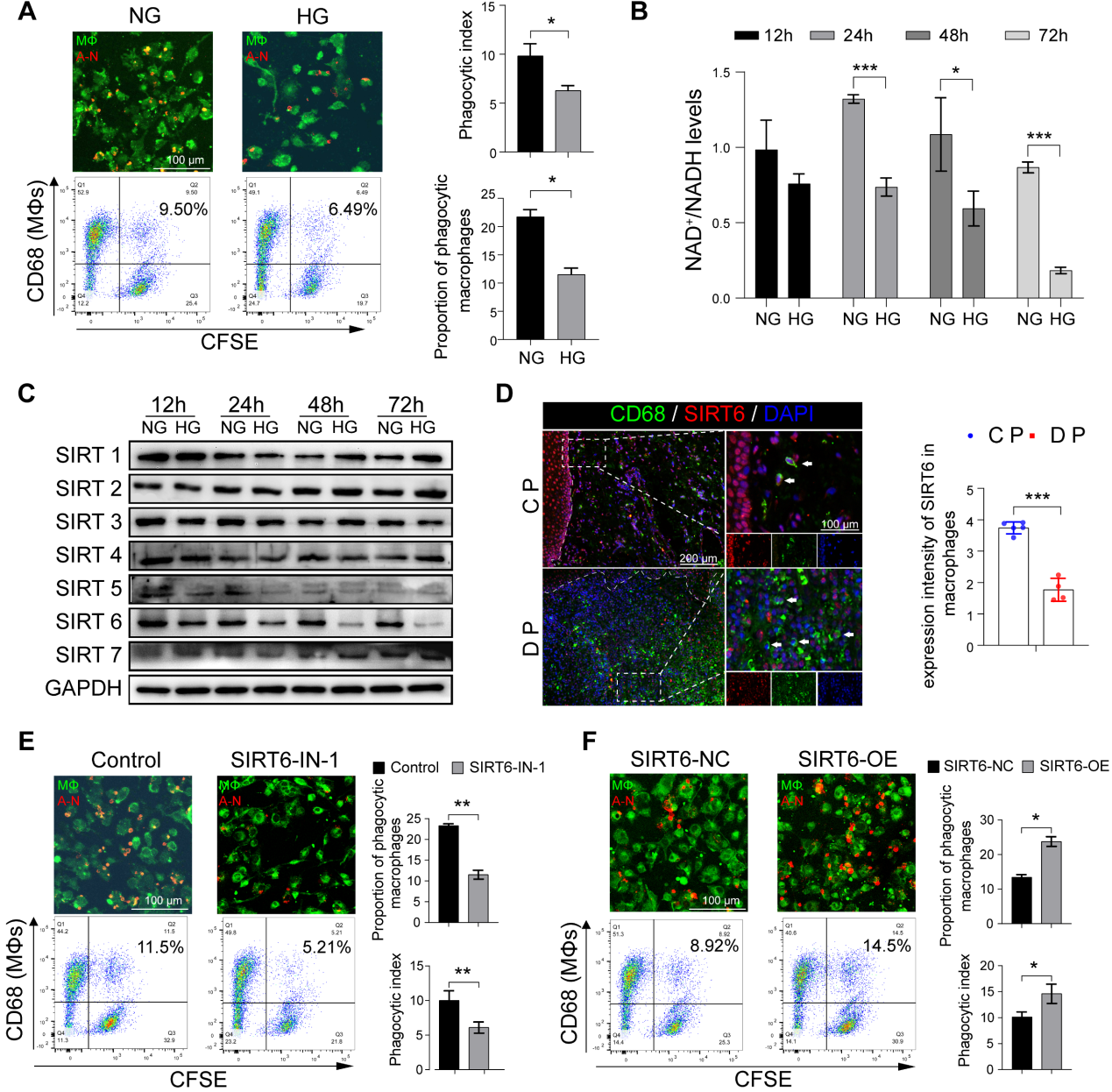
圖3 SIRT6 在高糖條件下顯著調(diào)節(jié)巨噬細胞胞吐作用
4.髓細胞特異性SIRT6基因敲除會加重牙周炎并損害炎癥消退
為了探索SIRT6介導(dǎo)的巨噬細胞胞葬在牙周炎中的作用,我們將LysM-Cre小鼠與SIRT6flox/flox小鼠雜交產(chǎn)生mS6KO小鼠。與野生型小鼠骨髓巨噬細胞(BMMs)相比,mS6KO骨髓巨噬細胞吞噬凋亡中性粒細胞的能力下降(圖4A)。采用2月齡mS6KO小鼠及其WT窩代建立LIP模型和LIP分辨率模型。與WT小鼠相比,CEJ到ABC的距離(圖4B, I)和捕獲陽性的破骨細胞明顯增加(圖4C, J)。為了研究巨噬細胞胞葬功能受損是否與mS6KO小鼠的持續(xù)性骨質(zhì)流失有關(guān),通過TUNEL染色評估m(xù)S6KO小鼠和WT小鼠牙周組織中凋亡細胞的數(shù)量(圖4D,結(jié)果顯示,與同窩野生型小鼠相比,mS6KO小鼠牙周組織中Ly6g+細胞和凋亡細胞的數(shù)量顯著增加(圖4E, L), SIRT6敲除促進了mS6KO小鼠牙周組織中NETosis(圖4F, M), F4/80+ CD86+ M1巨噬細胞(圖4G, O)和F4/80+ CD206+ M2巨噬細胞(圖4H, P)。與WT小鼠相比,mS6KO小鼠牙周組織中抗炎的F4/80+ CD206+ M2巨噬細胞的百分比較低(圖4Q)。綜上所述,這些發(fā)現(xiàn)表明SIRT6介導(dǎo)的巨噬細胞胞葬與牙周破壞和炎癥的消退有關(guān)。
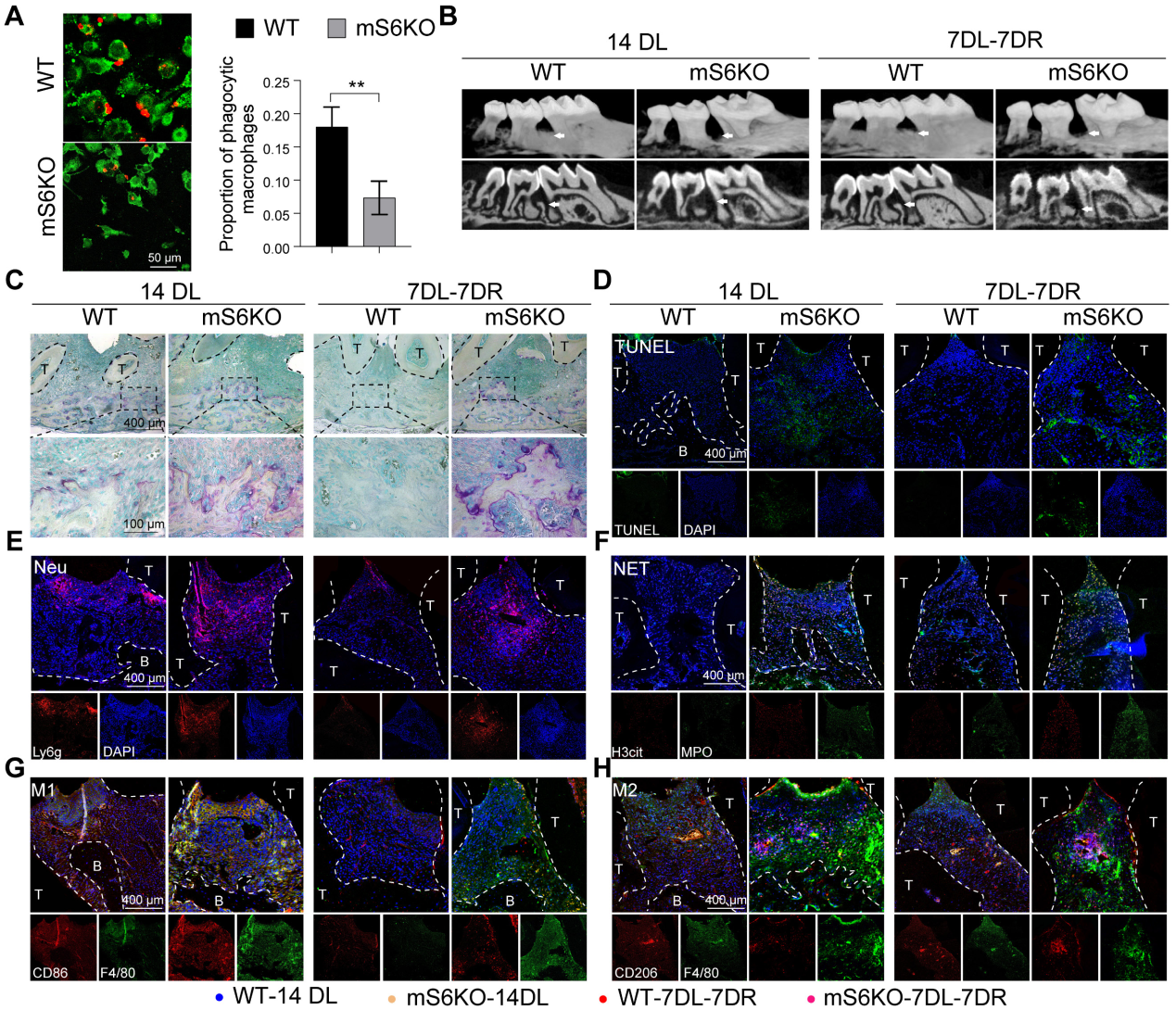
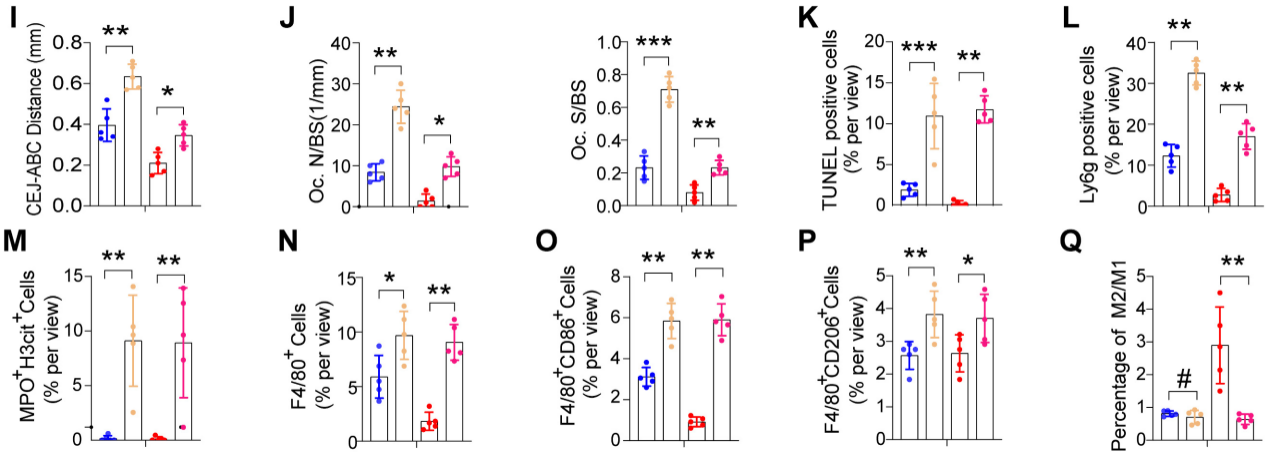
圖4髓細胞特異性SIRT6基因敲除會加重牙周炎并損害炎癥消退
5.SIRT6通過H3K56ac抑制miR-216a-5p-216b-5p-217簇的轉(zhuǎn)錄
為了深入了解SIRT6調(diào)控巨噬細胞胞葬的詳細機制,我們進一步評估了SIRT6對巨噬細胞中microRNA表達的影響。從SIRT6抑制后的巨噬細胞中分離RNA進行miRNA PCR微陣列分析,結(jié)果顯示miR-216a-5p-216b-5p-217簇明顯增加,SIRT6表達下調(diào)(圖5A-C)。數(shù)據(jù)進一步顯示SIRT6抑制和HG條件下miR-216a-5p-216b-5p-217簇表達增加(圖5D和F),SIRT6過表達導(dǎo)致miR-216a-5p-216b-5p-217簇表達降低(圖5E)。為了進一步闡明SIRT6如何抑制miR-216a-5p-216b-5p-217簇表達,通過ChIP-qPCR檢測了巨噬細胞中SIRT6宿主基因MIR217HG啟動子的組蛋白修飾。SIRT6作為一種轉(zhuǎn)錄共抑制因子,通過催化位點9和56乙酰化的組蛋白H3賴氨酸殘基(H3K9ac和H3K56ac)的去乙酰化。HG處理僅顯著上調(diào)H3K56ac的表達(圖5H)。使用覆蓋miR-216a-5p-216b-5p-217啟動子的七對引物進行檢測,結(jié)果顯示HG處理增加了miR-216a-5p-216b-5p-217集群啟動子的H3K56ac水平(圖5I)。我們還進一步證實了SIRT6抑制和HG條件下pri-miR-217簇表達增加(圖5J和L),SIRT6過表達后pri-miR-217簇表達下調(diào)(圖5K)。值得注意的是,來自mS6KO小鼠的bmm顯示出增加的pri-miR-217和miR-216a-5p-216b-5p-217簇表達(圖5G和M)。
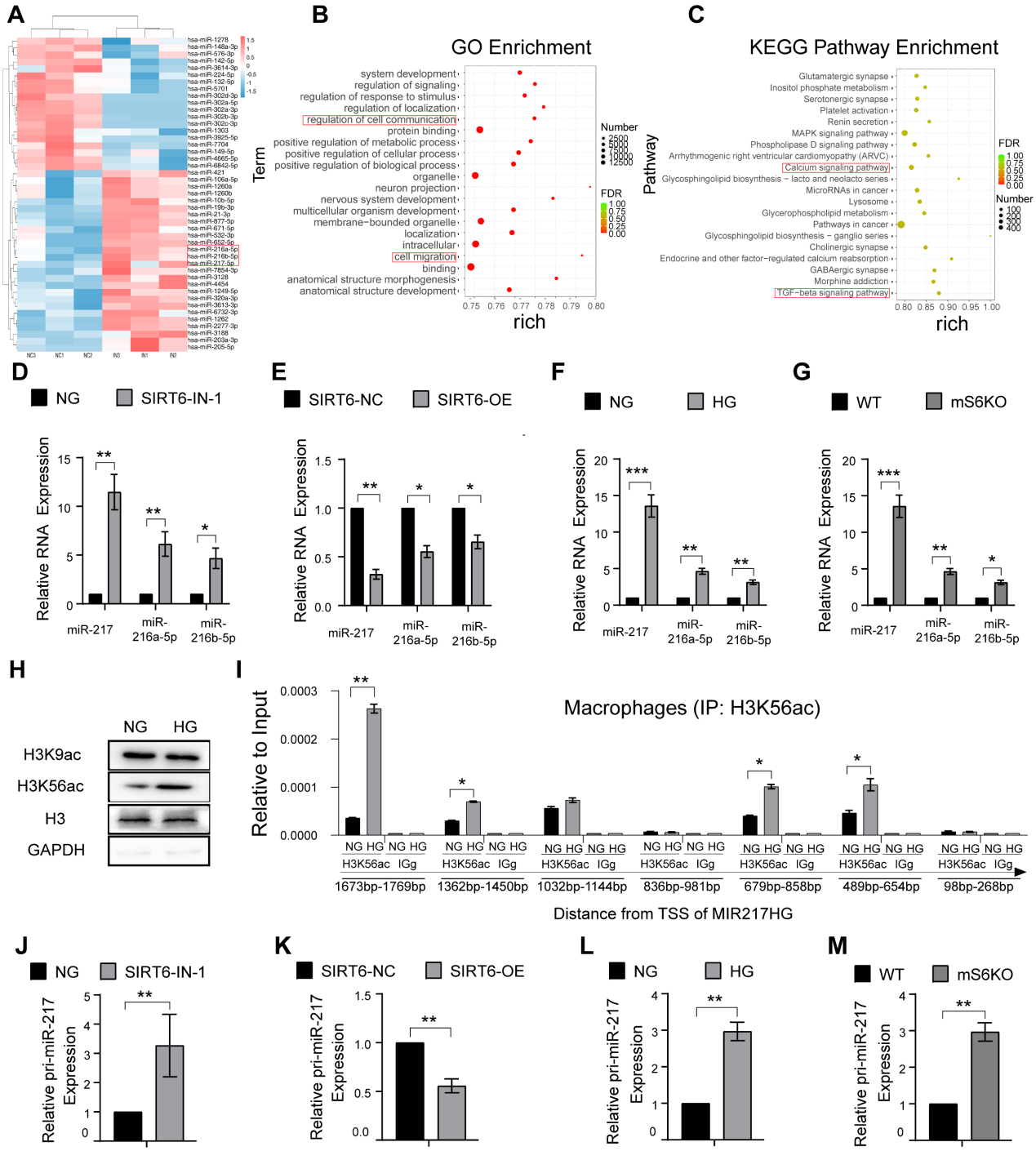
圖5 SIRT6通過H3K56ac抑制miR-216a-5p-216b-5p-217簇的轉(zhuǎn)錄
6.SIRT6 通過“非經(jīng)典”微處理器復(fù)合體抑制 miR-216a-5p-216b-5p-217 簇成熟
有研究發(fā)現(xiàn),葡萄糖代謝影響Drosha蛋白的表達,葡萄糖剝奪促進Drosha表達,HG刺激抑制Drosha表達。同樣,我們的結(jié)果顯示HG刺激可以抑制巨噬細胞中Drosha蛋白的表達(圖6A)。為了進一步探索HG條件下miR216a-5p-216b-5p-217簇成熟的機制,我們設(shè)計了一種特異性的生物素標(biāo)記的pri-miR-217探針,在巨噬細胞中進行RNA下拉實驗,銀染顯示與pri-miR-217結(jié)合的幾個蛋白帶富集(圖6B)。同時,蛋白質(zhì)譜分析顯示hnRNPA2B1在識別蛋白列表中排名靠前,未觀察到Drosha和DGCR8。RIP實驗顯示,與IgG相比,hnRNPA2B1抗體降低了更多的pri-miR-217(圖6C)。據(jù)報道,hnRNPA2B1與microRNA微處理器復(fù)合物蛋白DGCR8相互作用,通過結(jié)合m6A標(biāo)記初級miRNA轉(zhuǎn)錄物來切割初級miRNA。內(nèi)源性hnRNPA2B1蛋白與巨噬細胞中DGCR8和Drosha的共免疫沉淀(Co-IP)表明它們之間存在直接的物理相互作用,hnRNPA2B1與DGCR8結(jié)合,而未觀察到Drosha(圖6F)。我們進一步確定DGCR8可以與Drosha結(jié)合,這意味著hnRNPA2B1與DGCR8結(jié)合,招募Drosha形成微處理器復(fù)合物,“非規(guī)范”微處理器復(fù)合物識別并切割pri-miR-217(圖6E)。Co-IP還顯示SIRT6抑制促進了“非規(guī)范”微處理器復(fù)合物的形成,SIRT6過表達減少了微處理器復(fù)合物(圖6G)。此外,我們進一步發(fā)現(xiàn),高葡萄糖不僅增加了與pri-miR-217結(jié)合的hnRNPA2B1(圖6D)。Chip的結(jié)果還顯示,HG處理增加了hnRNPA2B1啟動子的H3K56ac(圖6H)。為了確定HG是否以hnRNPA2B1依賴的方式影響pri-miR-217的加工,我們對巨噬細胞進行了hnRNPA2B1敲低,發(fā)現(xiàn)成熟miRNA的水平下降,而其pri-miR-217的水平上升(圖6I, J)。FISH染色顯示HG刺激導(dǎo)致細胞核中pri-miR-217的減少,以及敲低hnRNPA2B1后細胞核中pri-miR-217的積累(圖6K)。這些數(shù)據(jù)表明SIRT6不僅可以促進pri-miR-217的轉(zhuǎn)錄,還可以通過促進HG條件下“非規(guī)范”微處理器復(fù)合物的形成來促進miR216a-5p-216b-5p-217簇的成熟。
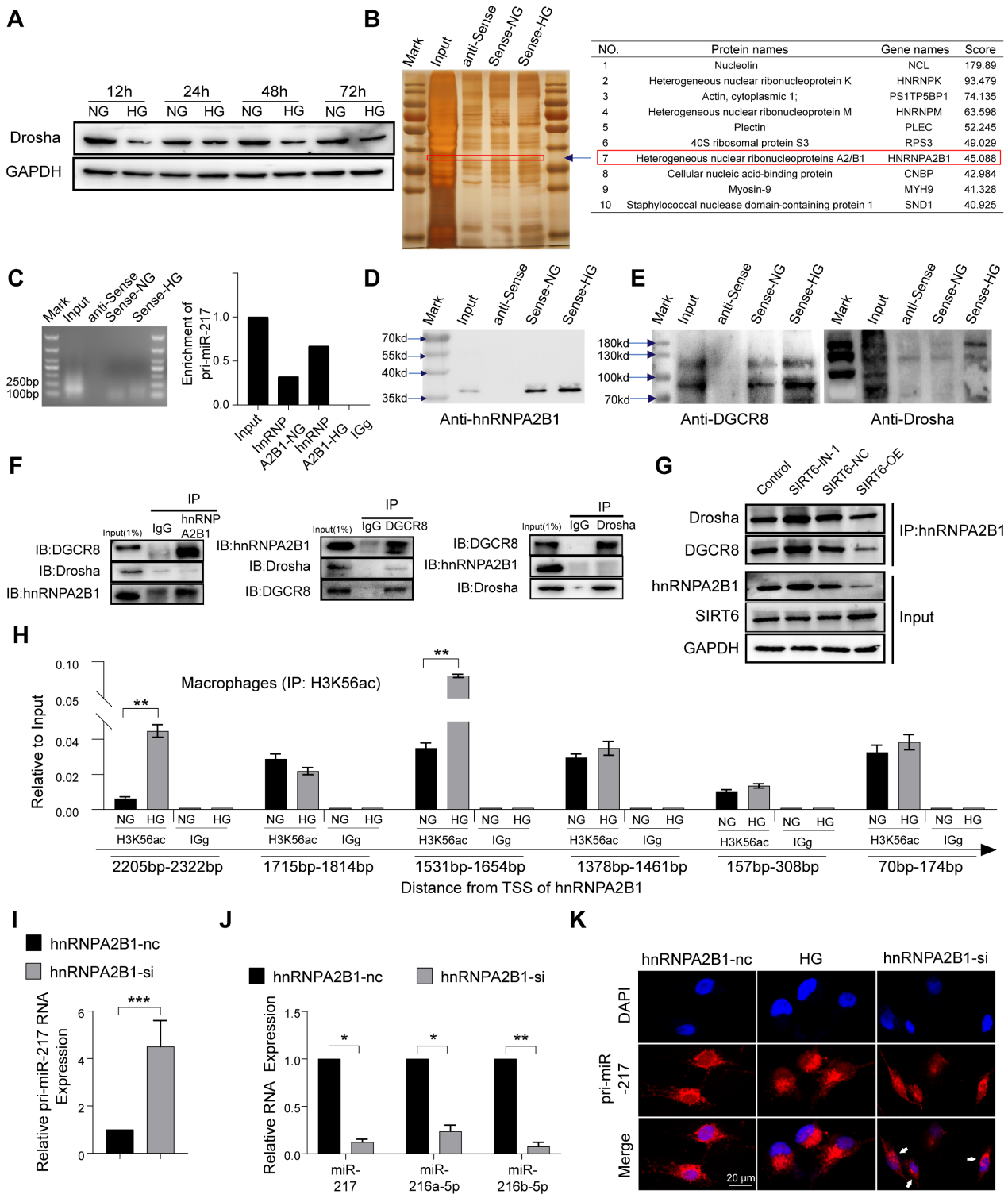
圖6 SIRT6 通過“非經(jīng)典”微處理器復(fù)合體抑制 miR-216a-5p-216b-5p-217 簇成熟
7.miR-216a-5p-216b-5p-217簇通過靶向DEL-1和CD36負性調(diào)節(jié)巨噬細胞的胞葬
DEL-1和CD36已被確定為巨噬細胞胞葬和炎癥清除的關(guān)鍵調(diào)節(jié)分子。我們假設(shè)SIRT6通過miR-216/217簇/ DEL-1 CD36軸調(diào)節(jié)巨噬細胞的胞葬和炎癥的消退。生物信息學(xué)算法(miRwalk)的結(jié)果表明,miR-216a-5p-216b-5p-217簇與DEL-1和CD36 mRNA的3'UTR結(jié)合(圖7A)。隨后,雙熒光素酶報告基因?qū)嶒烇@示,miR216a-5p216b-5p-217簇的共轉(zhuǎn)染降低了WT-DEL-1-3'UTR和WT-CD36-3'UTR的熒光素酶活性,而Mut-DEL-1-3'UTR和Mut-CD36 -3'UTR的熒光素酶活性不受影響(圖7B)。此外,Western blot分析顯示,在miR216a-5p-216b-5p-217 mimic處理的巨噬細胞中,DEL-1和CD36表達降低,而在miR-216b5p-217 inhibitor處理的巨噬細胞中,DEL-1和CD36表達升高(圖7C)。免疫熒光也證實了DEL-1和CD36在糖尿病牙周炎中的低表達(圖7D)。miR216a-5p-216b-5p-217簇的過表達降低了巨噬細胞的吞噬能力(圖7E),在這三種micRNA中,miR-217對巨噬細胞的吞噬作用影響最大。HG環(huán)境下miR-217敲低可以像重組DEL-1蛋白一樣恢復(fù)巨噬細胞的胞葬(圖7F)。總體而言,我們的研究結(jié)果支持SIRT6通過促進pri-miR-217轉(zhuǎn)錄和pri-miR“非規(guī)范”微處理器復(fù)合物的形成負調(diào)控miR216a-5p/ 216b-5p-217簇表達的假設(shè)。該microRNA簇通過靶向關(guān)鍵的胞葬分子DEL-1和CD36抑制巨噬細胞的胞葬,導(dǎo)致巨噬細胞介導(dǎo)的炎癥消退功能失調(diào)。
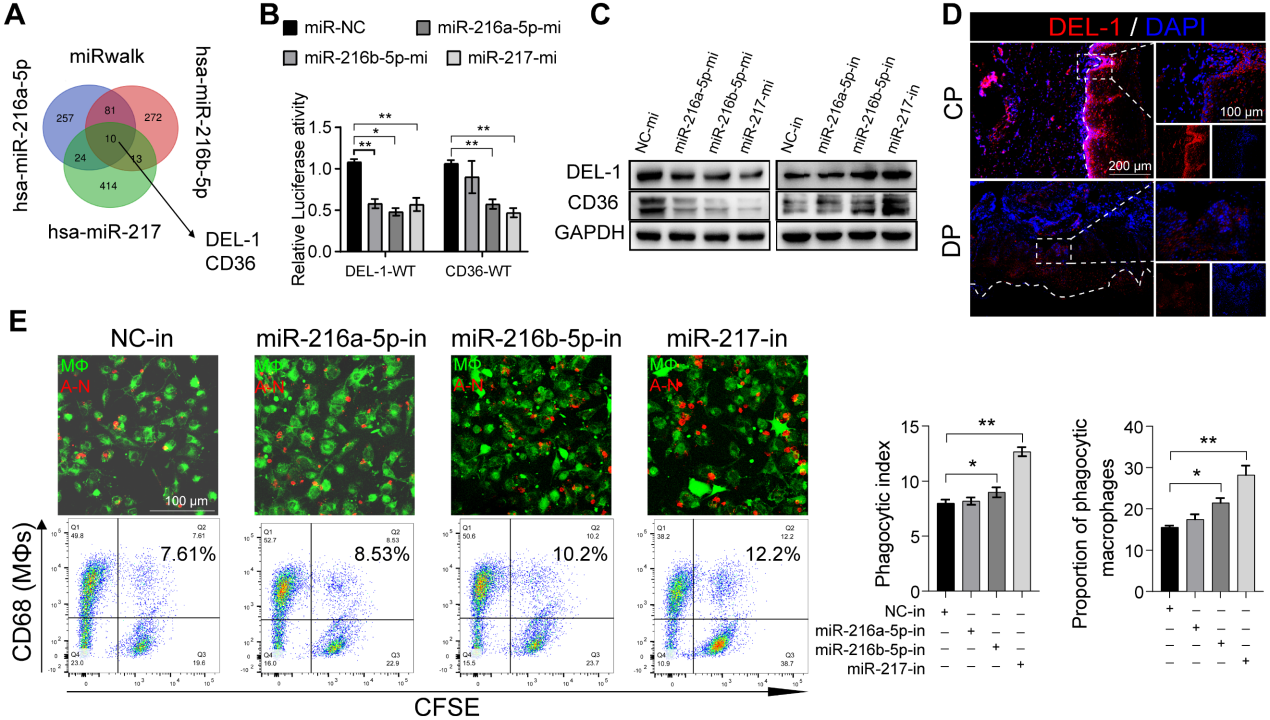
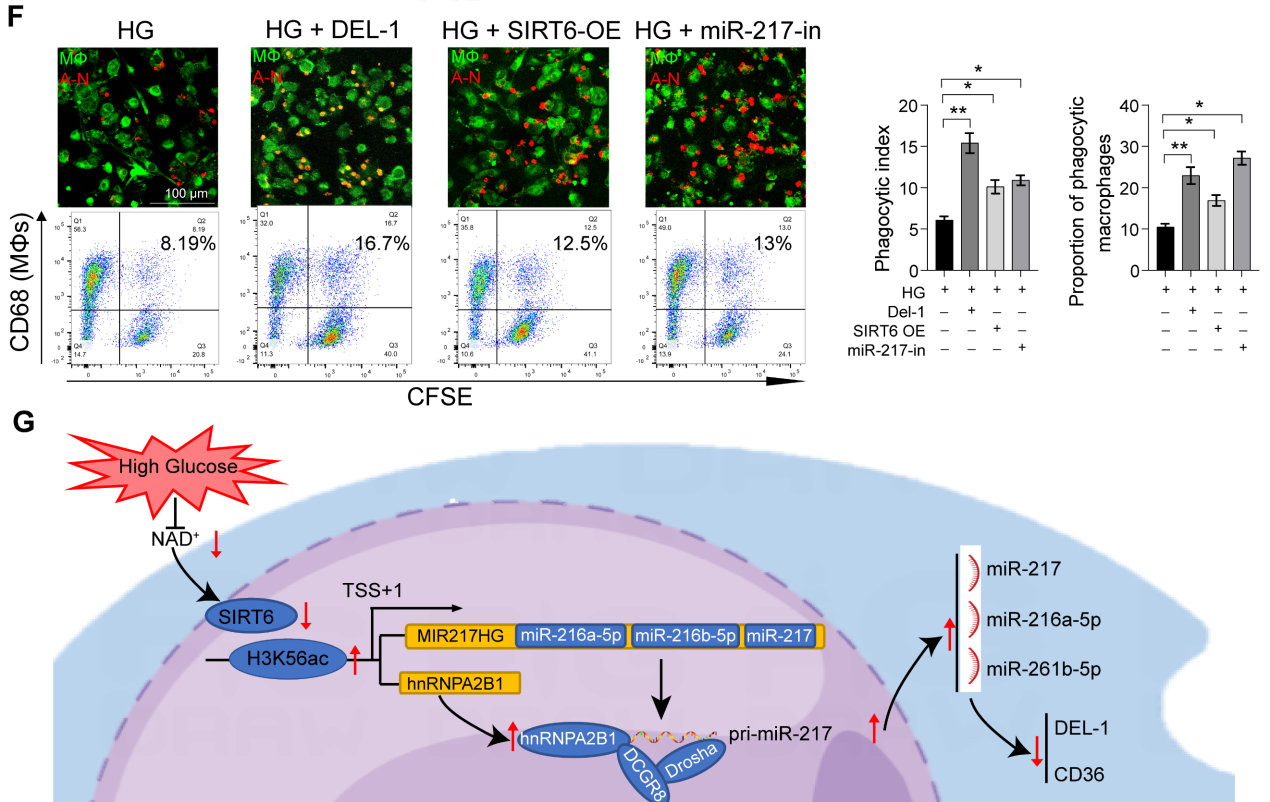
圖7miR-216a-5p-216b-5p-217簇通過靶向DEL-1和CD36負性調(diào)節(jié)巨噬細胞的胞葬
8.局部給藥antagomir-217促進小鼠DP炎癥的消退
根據(jù)上述功能獲得和功能喪失研究中的吞噬指數(shù)觀察,miR-217表現(xiàn)出更好的表型,并被選擇用于體內(nèi)干預(yù)治療。我們在結(jié)扎絲后第3、6、9和12天立即將miR-217特異性拮抗劑或scramble (NC)-miR注射到糖尿病小鼠的牙周組織中(圖8A)。在第7天解除結(jié)扎后,安他哥米-217注射液顯著改善了糖尿病小鼠牙周炎癥和骨質(zhì)丟失(圖8B、C、G、H)。注射安他哥米-217后,糖尿病小鼠牙周組織中DEL-1的表達顯著增加(圖8D和I)。注射安他哥米-217后,糖尿病小鼠牙周組織中Ly6g+中性粒細胞的數(shù)量顯著減少(圖8E和J)。注射安塔戈米爾-217后,MPO+ H3cit+ NET(圖8L)和凋亡細胞的形成明顯減少(圖8F和K)。安塔戈米爾-217治療組M2抗炎巨噬細胞比例較高(圖8O),而對照組大部分巨噬細胞為M1巨噬細胞(圖8M, N, P)。總而言之,這些結(jié)果表明,通過沉默miR-217抑制SIRT6 / miR216a-5p-216b-5p-217簇/ DEL-1和CD36調(diào)節(jié)軸可促進巨噬細胞的胞葬以清除凋亡細胞,這意味著該調(diào)節(jié)軸具有作為糖尿病炎癥解決靶點的潛力。
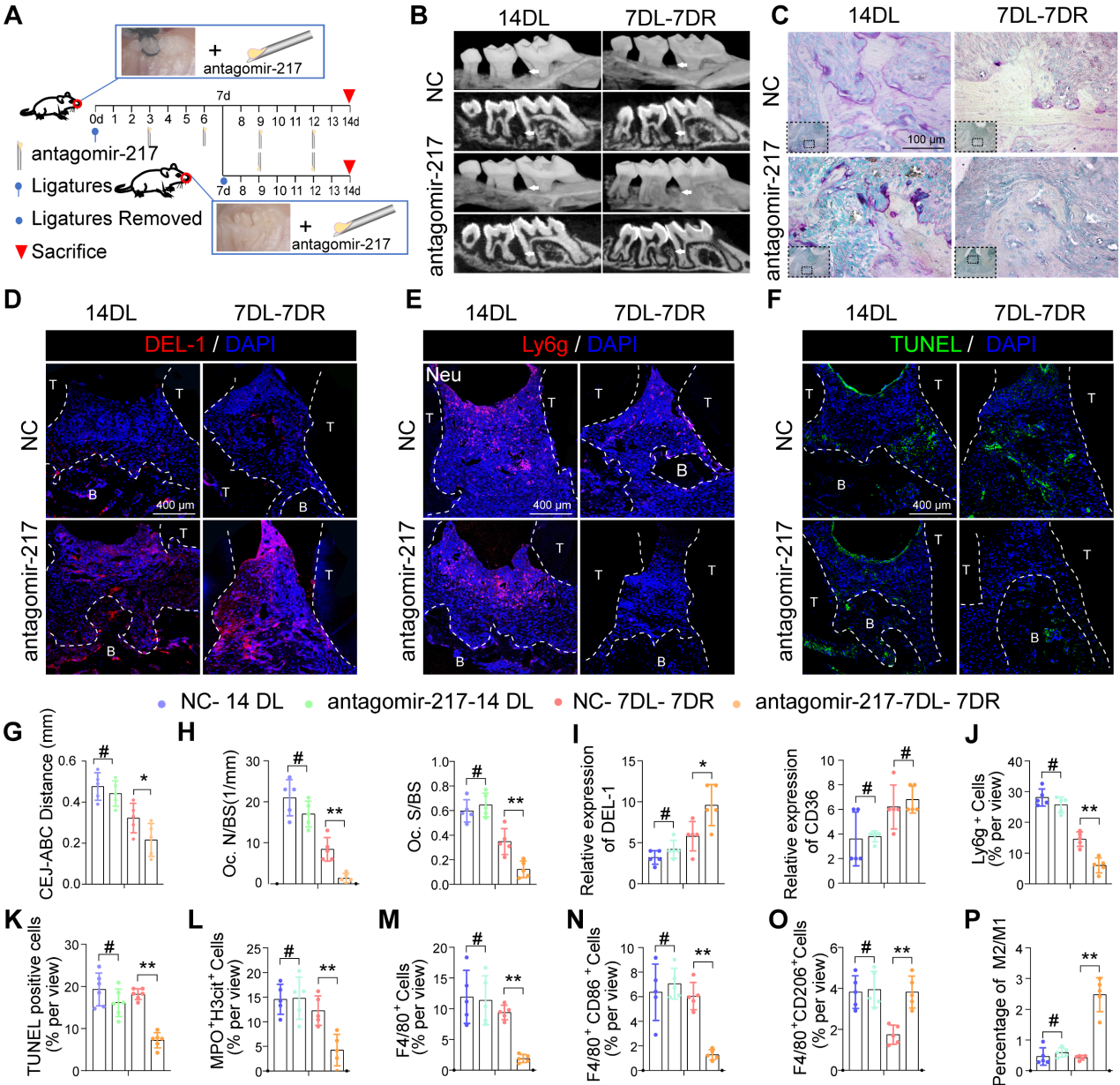
圖8局部給藥antagomir-217促進小鼠DP炎癥的消退
結(jié)論:
綜上所述,作者揭示了SIRT6-miR-216/217軸在糖尿病背景下巨噬細胞胞葬中的重要作用,并概述了通過抑制miR-217來改善炎癥消退和牙周組織修復(fù)的方法。這一策略可能與糖尿病和其他慢性炎癥性疾病的管理相關(guān)。
實驗方法:
小鼠牙周炎和消退造模、蘇木精和伊紅、Masson 染色、免疫熒光染色、流式檢測凋亡細胞的吞噬作用、RNA pull-down 、RIP、ChIP、FISH、Co-IP、雙熒光素酶報告基因。
參考文獻:
Li B, Xin Z, Gao S, et al. SIRT6-regulated macrophage efferocytosis epigenetically controls inflammation resolution of diabetic periodontitis. Theranostics. 2023;13(1):231-249. Published 2023 Jan 1.






