16S測序聯合空間轉錄組確定腸道細菌Akk調控腫瘤內微生物組和代謝結構
盡管腸道微生物群與癌癥存在關聯,但關于腸道微生物與腫瘤內微生物組之間的相互作用知之甚少。本研究的目標是確定腸道Akkermansia muciniphila(Akk)是否參與調控腫瘤內微生物組和代謝結構,從而在肺癌上產生抗癌效果。作者使用Lewis肺癌小鼠模型評估了腸道內源或灌胃外源阿克對腫瘤發生的影響。采集了糞便、血液和腫瘤組織樣本進行16S rDNA測序。然后,進行了空間解析代謝組學分析,直接發現了原位癌代謝產物,并表征了Akk調控的整體代謝特征,隨后進行了腫瘤內細菌與代謝網絡的相關分析。結果顯示,無論是內源還是灌胃外源的Akk都顯著抑制了腫瘤發生。此外,與對照組相比,在灌胃Akk的小鼠中通過16S rDNA測序檢測到了血液循環或腫瘤組織中阿克的增加。有趣的是,灌胃的Akk可能遷移到腫瘤組織中并影響腫瘤內微生物組的組成。空間解析代謝組學分析揭示了腸道來源的Akk能夠調節腫瘤的代謝途徑,從代謝產物到酶。最后,研究確定了腸道Akk調控的腫瘤內細菌與代謝網絡之間的顯著相關性。綜合而言,腸道來源的Akk可能遷移到血液循環,然后定植到肺癌組織中,通過影響腫瘤共生微生物組和重編程腫瘤代謝,有助于抑制腫瘤發生,盡管還需要更多的研究。本文于2023年2月發表在《Gut Microbes》IF:12.2期刊。
技術路線:
主要研究結果:
1、腸道Akk抑制Lewis肺癌小鼠的腫瘤發生
為確定內源性腸道微生物群與肺癌發生的關系,使用肺癌小鼠模型,總共使用108只小鼠。其中,92只小鼠在皮下注射后1周出現可觀察的腫瘤結節(直徑為4-5毫米)(第1組)。另外的16只小鼠(第2組)被進行監測。在這16只小鼠中,有6只在第2周出現可觀察的腫瘤結節(直徑為4-5毫米)(第2a組),其余的10只即使在皮下注射后4周也沒有顯示任何腫瘤生長(第2b組)(圖1a)。
對group 1和group 2進行16S測序,使用beta多樣性分析生成了加權UniFrac PCoA,展示了第1組和第2組之間的聚類關系(圖1b)。LEfSe分析從門到屬的所有分類水平共鑒定出32個具有差異性的分類群。在門的水平上,Verrucomicrobiales、Bifidobacteriaceae和Actinobacteria在第2組中增加,而Bacteroidaceae、Flavobacteriaceae、Helicobacteraceae和Enterobacterales在第1組中富集(圖1c)。此外,Venn圖在物種水平上檢測到第1組和第2組分別有326和319個OTUs,其中兩組共有252個OTUs(圖1d)。在屬的水平上,Akk和Bifidobacterium(Bifidobacterium pseudolongum)的豐度在第2組的小鼠中顯著升高,尤其是在第2b組的小鼠中(圖1e)。
因此,進一步確定外源性腸道Akk對三組小鼠中腫瘤增殖的影響,包括對照組(con.)、Akk組和Akk/Bio組合組(小鼠通過灌胃同時攝入阿克和Bifidobacterium pseudolongum)。Akk或雙歧桿菌(2 × 108 CFU,0.15–0.2毫升PBS)每2天灌胃一次,從在Lewis癌細胞皮下注射前的第2周開始。對照小鼠則用相同體積的PBS進行灌胃,并在犧牲前一直監測小鼠。發現,灌胃Akk顯著抑制了腫瘤的增殖,而Akk組和Akk/Bio組之間沒有顯著差異(圖1f)。然后,在后續實驗中專注于Akk。
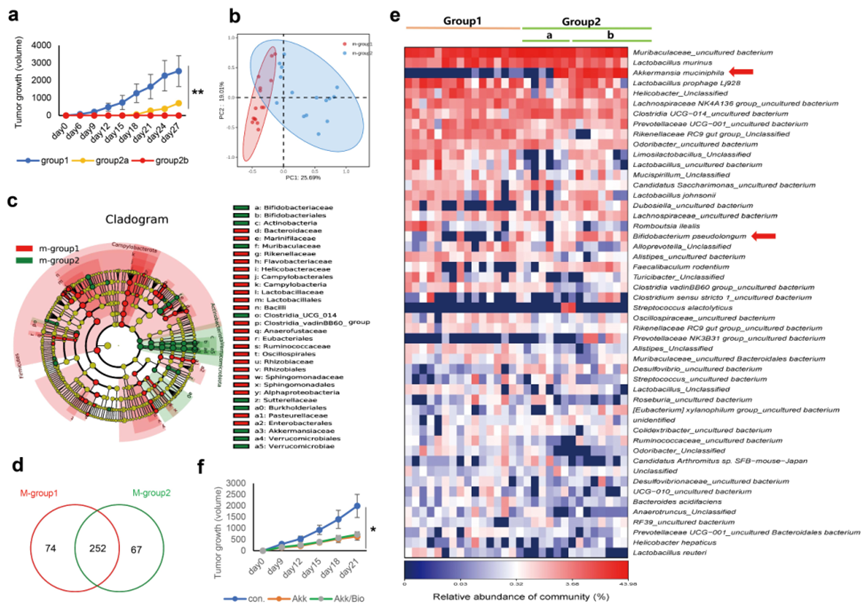
圖1 肺癌小鼠模型腸道微生物群落及多樣性分析
2、使用AFADESI-MSI方法進行空間解析代謝組學的極性代謝物分析
圖2a是本研究的總體設計示意圖。通過基于MSI的原位代謝組學結合代謝途徑分析,在肺癌組織中確定了潛在的Akk介導的與腫瘤相關的代謝物和代謝酶。對于這項分析,根據不同的解剖癌癥亞區域,包括非壞死區域、旁壞死區域和壞死區域,將每個腫瘤切片分為三種組織學類型(圖2b,c)。
首先對小鼠腫瘤的連續切片進行了AFADESI-MSI分析。簇分析和腫瘤切片的H&E染色顯示了腫瘤組織的清晰亞結構。然后,對Lewis肺癌組織中的特定區域分布進行了極性代謝物分析。圖2b顯示了AFADESI-MSI圖像的簇,展示了不同解剖癌癥亞區域中代謝物濃度的變化。H&E染色顯示了癌癥切片中不同解剖癌癥亞區域的清晰亞結構(圖2c)。
接下來,通過ESI探針逐像素掃描腫瘤組織切片,并通過高分辨質譜分析器在正離子和負離子模式下分析解吸附的離子。引用29中精確提取和繪制了乳酸代謝(圖2d)和谷氨酸代謝(圖2e)的特定質譜圖。這些圖像顯示了腫瘤亞區域中特定的異質代謝分布,與癌癥的功能和結構復雜性高度一致(圖片為代表性樣本)。
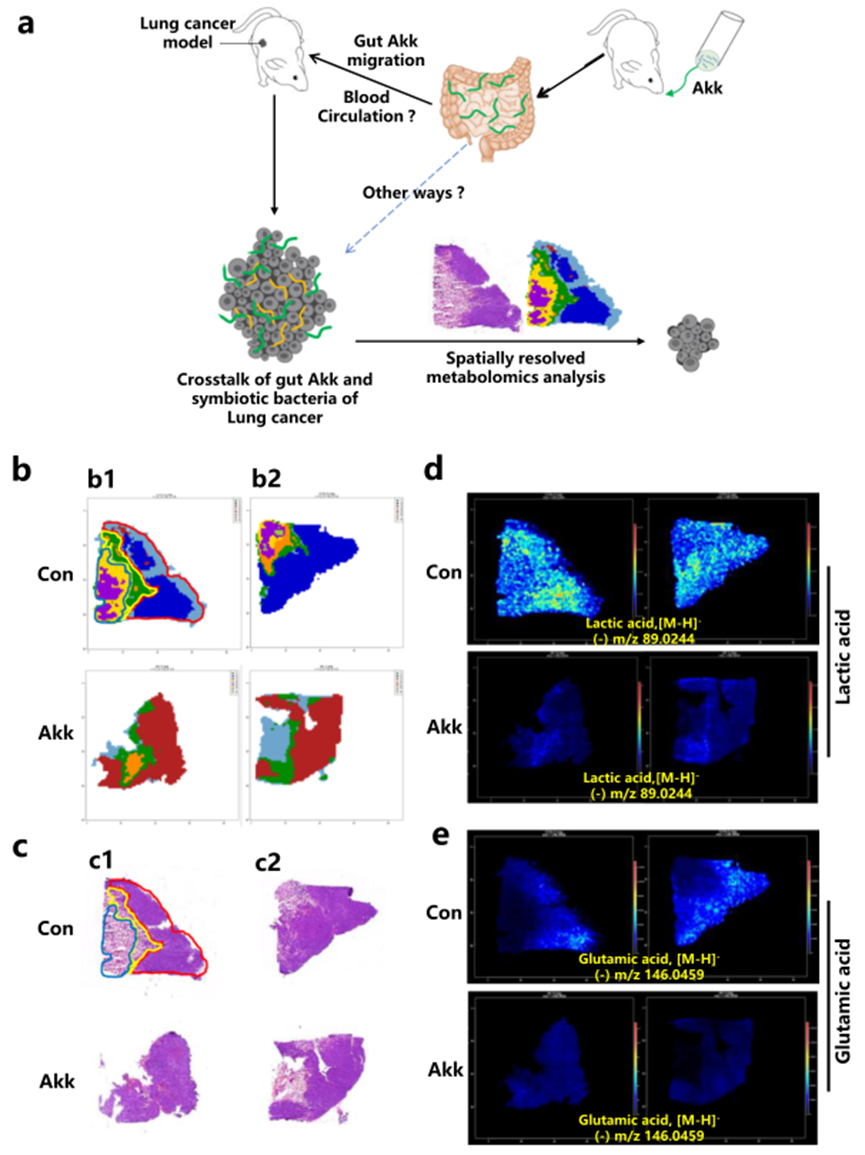
圖2 肺癌小鼠模型腫瘤切片的極性代謝物譜
3、Akk灌胃對腫瘤代謝的影響:描繪區域特定的代謝網絡
然后,顯微鏡圖像與匹配的質譜圖像集成,形成具有空間分辨率的疊加圖像。基于從腫瘤亞區域提取微區域代謝剖面的物理結構,重建了一個代謝網絡。顯微鏡-MSI疊加圖像顯示出每個三個腫瘤亞區域的特定質譜被精確提取(圖3a-3b),并呈現為代謝物剖析。
圖3c–e總結了非壞死區域(圖3c)、旁壞死區域(圖3d)和壞死區域(圖3e)中富集的代謝途徑。根據代謝物剖析,通過氣泡圖(圖3c–e)顯示了富集的途徑。這些結果顯示,在腫瘤組織中,諸如嘌呤代謝、谷胱甘肽代謝、精氨酸和脯氨酸代謝、中心碳代謝、丙氨酸、天冬氨酸和谷氨酸代謝、丙酮酸代謝、糖酵解/糖異生、嘧啶代謝以及脂肪酸生物合成等富集的代謝途徑受到Akk的灌胃顯著影響。
基于KEGG的代謝網絡使作者能夠在系統水平深入了解肺癌的代謝活動。在本研究中,非壞死腫瘤組織中微區域代謝信息及其互動網絡被分為26個KEGG途徑。對上下文途徑的進一步分析表明,谷氨酰胺代謝、嘌呤和嘧啶代謝、糖酵解代謝和谷胱甘肽代謝等多種代謝途徑之間存在密切的調控關系(圖3f)。
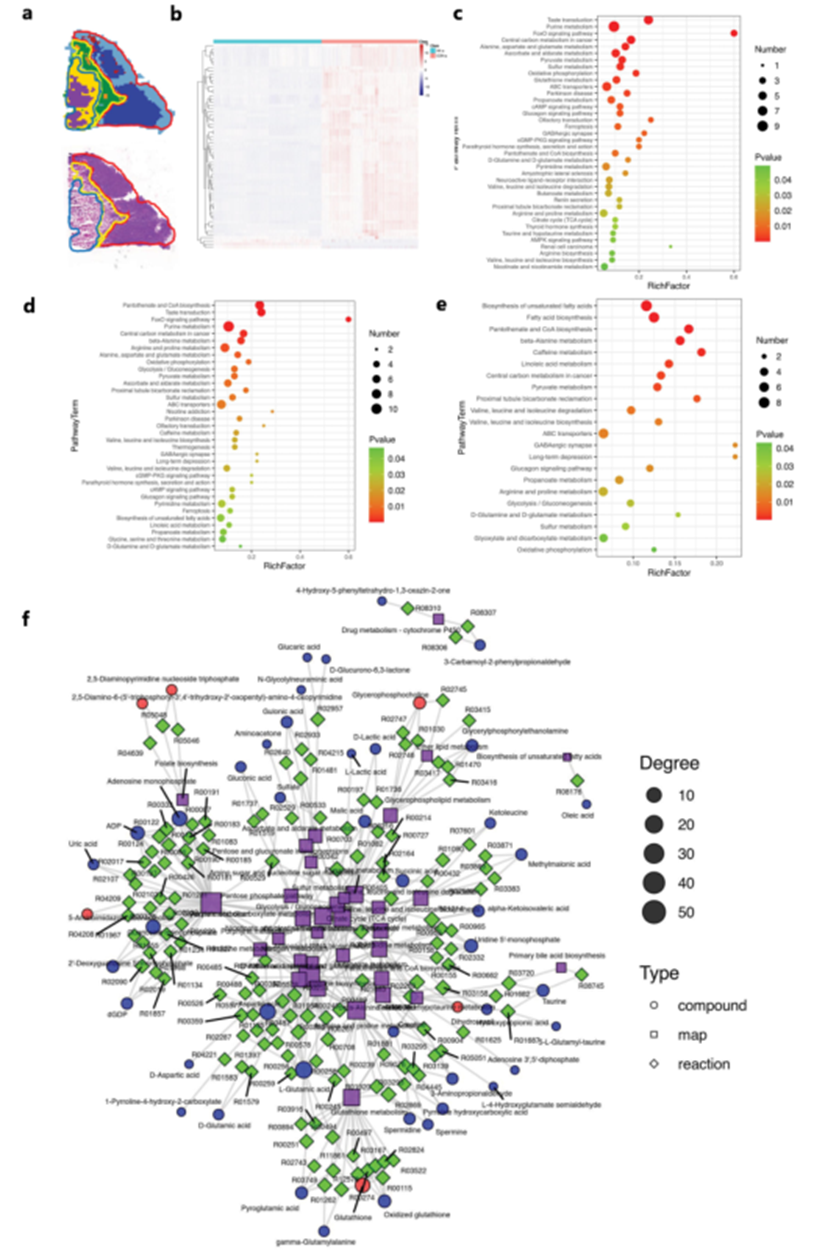
圖3 區域特異性代謝網絡的映射
4、Akk灌胃對腫瘤代謝的影響:Akk調節糖酵解代謝
在這項研究中,根據它們的物理結構,顯微圖像和代謝產物的MSI圖像進行疊加,以提取不同解剖癌癥亞區域中乳酸的微區域代謝剖面(圖4a-e)。顯然,肺癌組織中的糖酵解代謝失調:乳酸的離子強度在整個腫瘤區域中高度表達。灌胃Akk顯著降低了不同解剖癌癥亞區域中乳酸的水平(圖4c)。與代謝物剖析一致,免疫組織化學(IHC)顯示,作為調控糖酵解代謝的酶的LDHA在癌癥區域中高度表達,而在灌胃Akk的組中顯著減少(圖4f)。
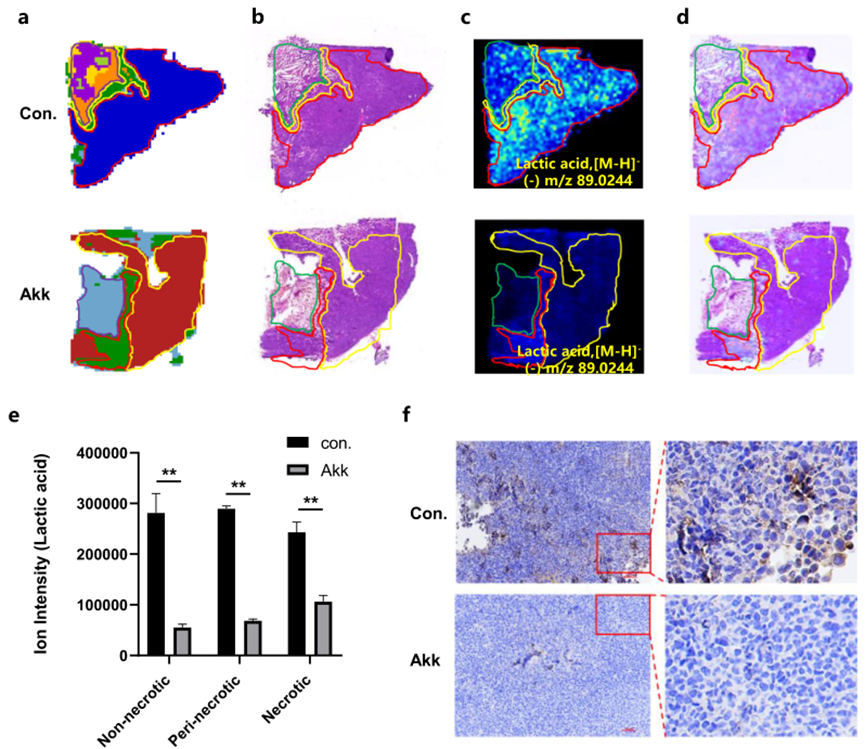
圖4 原位可視化糖酵解代謝途徑中關鍵代謝物和代謝酶
5、Akk灌胃對腫瘤代謝的影響:Akk通過對關鍵代謝產物的原位可視化調控谷氨酰胺代謝
質譜圖像由連續的像素組成,因此可以反映腫瘤中代謝物的相對含量,尤其是來自不同腫瘤亞區域的區域特異性差異代謝產物。研究表明,癌細胞對谷氨酰胺(Gln)有很強的依賴性。谷氨酰胺的分解代謝是通過谷氨酸酶(GLS)介導的,通過水解谷氨酰胺生成谷氨酸。MSI分析顯示,Lewis肺癌組織中Gln代謝明顯失調。如圖5a所示,作為Gln水解產物的谷氨酸、天冬氨酸、琥珀酸和蘋果酸在Lewis肺癌組織中顯著增加,然而與對照組相比,在Akk組中顯著下調。
此外,基于離子強度的MSI提供了一種評估在不同組織區域中強度變化的方法,這可能反映了GLS介導的原位谷氨酸(谷氨酸)水解速率。圖5b顯示了不同癌癥亞區域中Glu、天冬氨酸、琥珀酸和蘋果酸的空間表達。與被改變的代謝物直接相關的代謝途徑中的代謝酶被選擇為潛在的與腫瘤相關的代謝酶。GLS催化Gln分解的主要途徑中的第一反應。免疫組織化學染色顯示,GLS在癌癥組織中顯著上調,而在Akk組中顯著下調(圖5c),與基于離子強度的Glu MS圖像的結果一致。
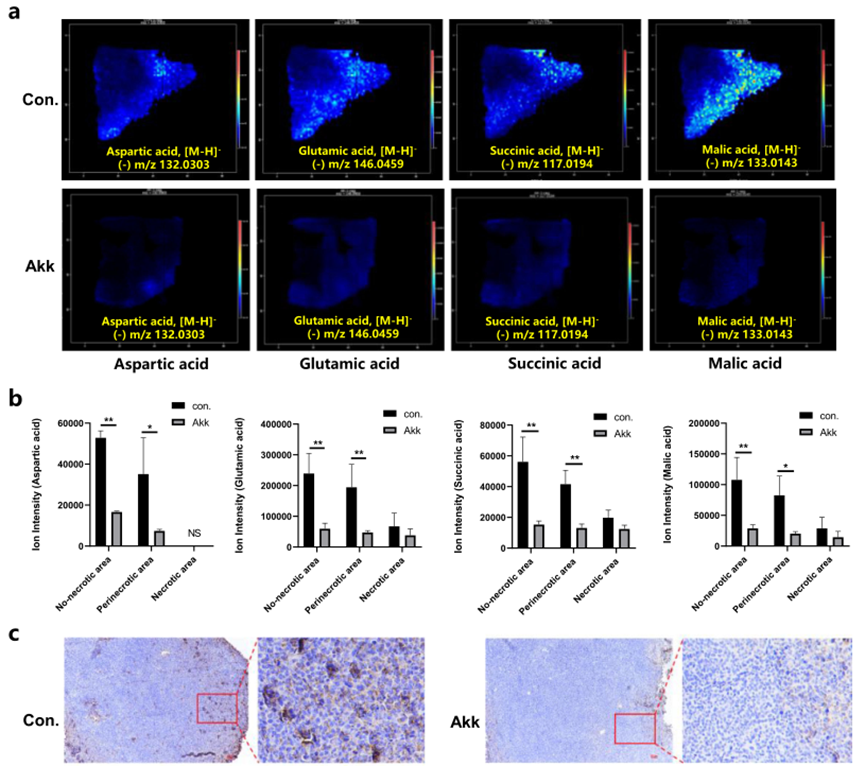
圖5 谷氨酰胺代謝途徑中關鍵代謝物和代謝酶的原位可視化
6、Akk灌胃對腫瘤代謝的影響:Akk調節嘌呤和嘧啶代謝
核苷酸的合成可以通過多種代謝途徑進行調控,這些核苷酸對于維持癌細胞的快速增殖是必不可少的營養物質。其中一種機制是通過增強糖酵解代謝或谷氨酰胺代謝,產生更多核苷酸合成所需的分子前體。MSI分析表明,在對照組的Lewis肺癌中,核苷酸生物合成,如AMP、ADP、GMP和UMP,在腫瘤組織中顯著表達(圖6a),與此同時,在Akk組的癌癥組織中,核苷酸生物合成顯著下調(圖6b)。
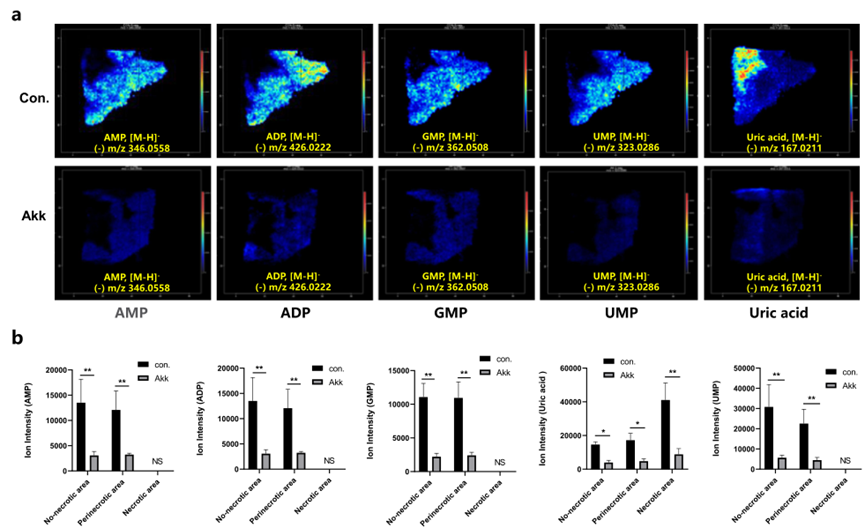
圖6 通過關鍵代謝物的原位可視化和定量分析確定,灌胃Akk下調核苷酸生物合成代謝
7、灌胃Akk對腸道微生物的影響
考慮到灌胃Akk對腸道微生物的影響,作者試圖確定對照組和Akk灌胃組(n = 8)之間的腸道微生物組成和多樣性。通過16S rDNA測序分析腸道微生物的α多樣性,結果顯示在對照組(CFA)和Akk灌胃組(AFA)之間的物種豐富度指數(Chao)(p = .8068)、Shannon指數(p = .9188)和Simpson指數(p = .3884)之間沒有顯著差異(圖7a-c)。通過β多樣性,加權UniFrac主坐標分析(PCoA)顯示了對照組和Akk小鼠之間的聚類關系(圖7d)。此外,如Venn圖所示,在對照組和Akk灌胃組中分別檢測到2350和2259個OTUs,其中有1988個OTUs同時存在于兩組中(圖7e)。為確定與Akk相關的特定微生物群,通過LEfSe分析分析了兩組小鼠的腸道微生物組成。在屬的水平上,Akk的豐度在阿克灌胃小鼠的腸道微生物中升高,而Enterobacterales、螺旋菌屬和擬桿菌門的豐度在對照小鼠的腸道微生物中增加(圖7f)。
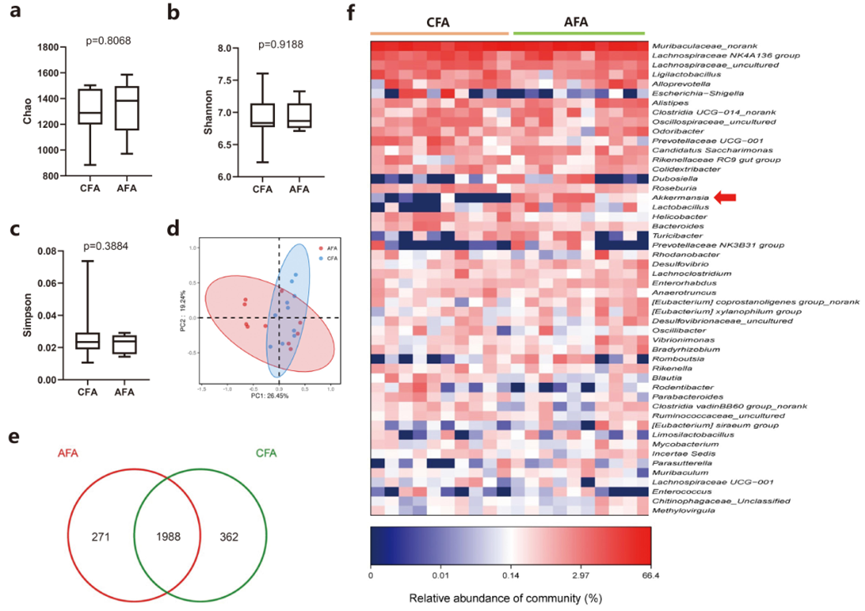
圖7 灌胃Akk對小鼠腸道菌群的影響
8、灌胃Akk對腫瘤微生物群的影響
接下來,作者試圖確定灌胃Akk對腫瘤內微生物群的影響。通過16S rDNA測序分析了腫瘤微生物群的α多樣性。對照組(CT組)和Akk灌胃小鼠(AT組)之間的物種豐富度Chao指數(p = .2575)、Shannon指數(p = .3382)或Simpson指數(p = .2488)沒有差異(圖8a)。β多樣性的PCoA分析顯示了對照組和阿克灌胃小鼠之間的聚類(圖8b)。此外,如Venn圖所示,在對照組和阿克灌胃小鼠中分別檢測到853和424個OTUs,其中有278個OTUs同時存在于兩組中(圖8c)。
LEfSe分析顯示,在門的水平上,Bradyrhizobium、Vibrionimonas Verrucomicrobiales和Lactobacilius的豐度在Akk灌胃組的腫瘤中增加,而Gammaproteobacteria、Sphingomonadales和Acidobacteriae的豐度在對照組中富集(圖8d-e)。如預期的那樣,與對照組相比,Akk在灌胃Akk的肺癌小鼠的腫瘤組織中的豐度升高(AT組對比CT組)(圖8d-8f)。
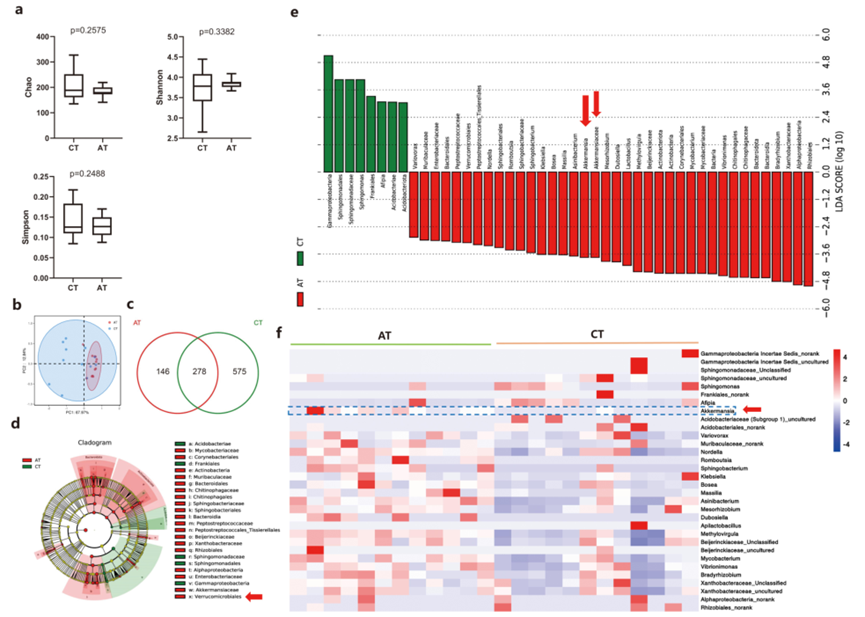
圖8 灌胃Akk對肺癌小鼠瘤內微生物組的影響
9、腸道微生物與腫瘤微生物的相互作用:腸道細菌可能通過全身循環遷移到肺癌組織
腸道Akk與腫瘤內微生物之間的正向關系表明腸道細菌可能會遷移到癌組織中。因此,作者想知道腸道Akk是否通過全身血液循環遷移到腫瘤組織中。在SPF條件下,C57BL/6小鼠被分為兩組,對照組(CB)和灌胃Akk和雙歧桿菌的細菌組(AB)。在細菌灌胃后的2小時和6小時收集血樣進行16S rDNA測序分析。為了確定與Akk和雙歧桿菌灌胃相關的特定微生物群,使用LEfSE方法分析了血樣本中微生物的組成。在門的水平上,細菌灌胃小鼠的血樣本中Verrucomicrobia(Akk屬于Verrucomicrobia)和雙歧桿菌科的豐度增加(圖9a,b)。在屬的水平上,阿克和雙歧桿菌在細菌灌胃后的2小時血液中升高,而在細菌灌胃后的6小時血液中無法明顯檢測到阿克或雙歧桿菌(圖9c)。
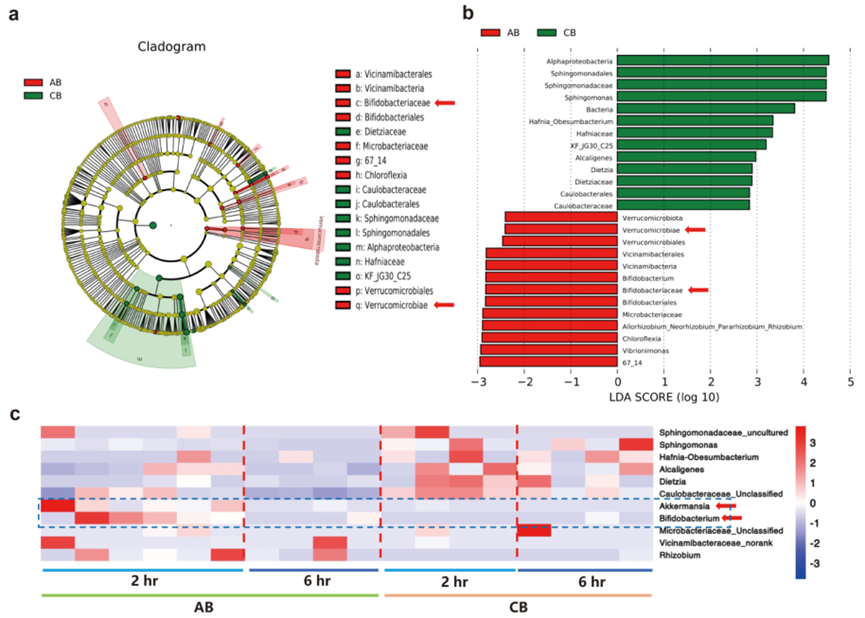
圖9 血液循環中腸道細菌的檢測
10、不同腫瘤微生物群與鑒別代謝物之間的關系
通過斯皮爾曼相關性分析評估了腫瘤組織中差異菌屬與代謝物之間的關聯。圖 10a 顯示了基于 LEfSe 分類學分析的最高差異種屬與糖酵解代謝、Gln 代謝、嘌呤和嘧啶代謝等途徑中最高鑒別代謝物的相關性。
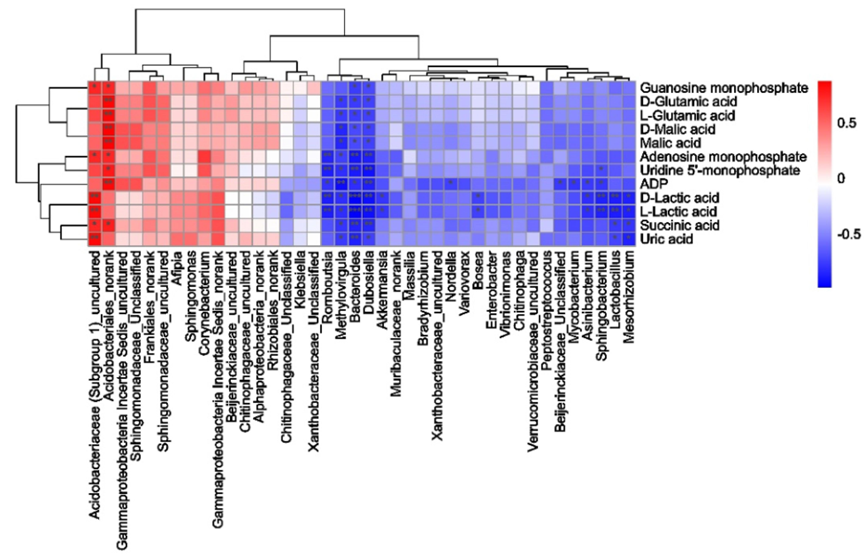
圖10 差異細菌與差異代謝物的關聯分析
實驗方法:
動物建模和藥物處理,細胞培養,Akkermansia muciniphila (Akk)培養,16S rDNA測序,免疫組化(IHC),細菌灌胃定植,HE染色,空間代謝組及其分析
參考文獻:
Zhu Z, Cai J, Hou W, Xu K, Wu X, Song Y, Bai C, Mo YY, Zhang Z. Microbiome and spatially resolved metabolomics analysis reveal the anticancer role of gut Akkermansia muciniphila by crosstalk with intratumoral microbiota and reprogramming tumoral metabolism in mice. Gut Microbes. 2023 Jan-Dec;15(1):2166700. doi: 10.1080/19490976.2023.2166700. PMID: 36740846; PMCID: PMC9904296.






