可生物點擊的小細胞外囊泡-缺血性中風的COCKTAIL療法
通過血腦屏障遞送大分子治療缺血性卒中仍然具有挑戰性。NR2B9c是一種有效的神經保護肽,但將它靶向遞送至大腦需要一種高效、天然和非免疫原性的安全遞送技術。小細胞外囊泡(sEV)作為一種非免疫原性的天然貨物輸送系統已顯示出巨大的潛力。然而,需要對其低效的大腦靶向進行定制。在這里,作者通過生物正交點擊化學反應將狂犬病病毒糖蛋白29與sEVs表面偶聯,然后加載NR2B9c,最終產生中風特異性治療性COCKTAIL(sEVs-COCKTAIL)。體外培養原代神經元和Neuro-2a細胞,并使用瞬時大腦中動脈閉塞模型進行體內研究,以評估sEVs-COCKTAIL的神經元靶向性和抗缺血性卒中潛力。生物可點擊的sEVs被神經元選擇性地吸收,而神經膠質細胞則不吸收。在氧-葡萄糖剝奪的體外缺血性腦卒中模型中,sEVs-COCKTAIL對活性氧和細胞凋亡表現出顯著的潛力。體內研究進一步證明了可生物點擊的sEV的具有大腦靶向性并且半衰期延長,將NR2B9c輸送到缺血性腦并減少中風損傷。用sEVs-COCKTAIL治療顯著促進小鼠行為恢復并減少了短暫性大腦中動脈閉塞后的神經元凋亡。NR2B9c被遞送至與突觸后密度蛋白95結合的神經元,抑制N-甲基-d-天冬氨酸受體介導的氧化應激過度產生,并減輕蛋白B細胞淋巴瘤2和P38蛋白的表達。該研究制備的sEVs-COCKTAIL可促進神經恢復和神經保護,防止缺血性中風,為靶向遞送系統提供了一種有效的方法,是一種很有前途的中風治療方式。該研究于2023年9月發表于《Journal of Controlled Release》,íF = 10.8。
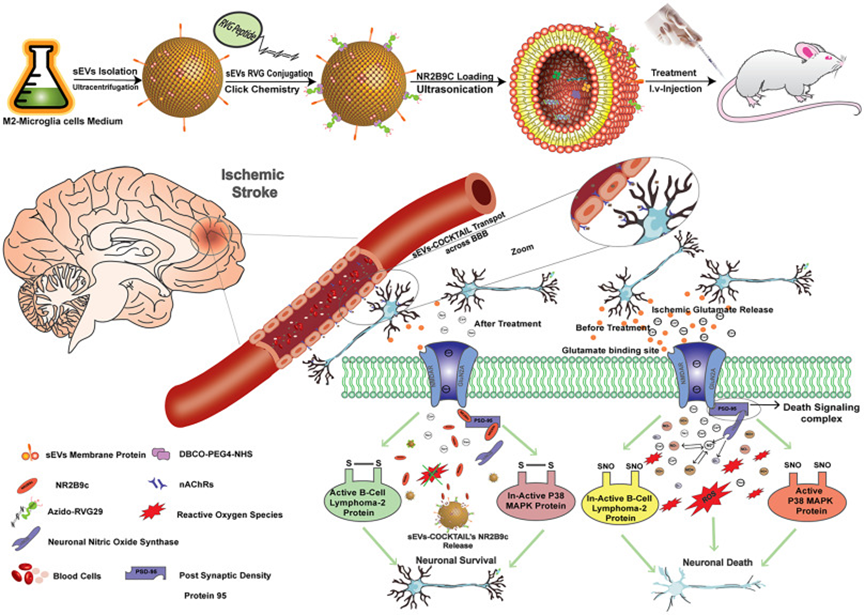
技術路線

研究思路
1.sEV和sEVs-COCKTAIL的制備和表征
采用高效液相色譜法和質譜法對NR2B9c和Azido-RVG29進行了表征,以確定其各自的純度和分子量(附圖1-2)。為了開發sEVs-COCKTAIL,作者選擇首先將RVG29病毒蛋白偶聯到sEV上,然后用NR2B9c加載它,基于在點擊偶聯過程中將NR2B9c預加載到sEVs核心可能導致加載的藥物從sEV中意外釋放。RVG29到sEV的偶聯分兩步實現(圖1A)。N-羥基琥珀酰亞胺-PEG的N-羥基琥珀酰亞胺基團4-DBCO與賴氨酸的sEV表面胺基反應,形成DBCO-sEVs。然后,通過將DBCO-sEVs與Azido-RVG29反應進行簡單的點擊反應。通過熒光顯微鏡驗證了RVG29與sEV結合的成功,作者用FITC標記RVG29,用Dil-Red標記sEV。如圖1B所示,RVG29和sEV的熒光信號重疊,證實了它們的偶聯過程成功。在整個研究過程中都遵循這種綜合方法。
接下來,使用超聲技術將神經保護肽NR2B9c加載RVG-sEV,這是高產量裝載sEV的常見做法。評估了兩種上樣方案,通過簡單的超聲處理獲得了最高的上樣結果。通過分光光度計測得兩種肽的封裝效率分別為29.903±3.32%和18.689±1.64%(圖1C)。通過TEM、NTA、蛋白質印跡和zeta電位分析儀對sEV進行物理表征。透射電鏡證實了所有sEV的球形形貌和完整的膜結構(圖1D),表明脂質雙層被保留,包封肽的過程不影響sEV的完整性。由于NTA分析,sEV的平均尺寸為98.6±17 nm,RVG-sEVs為102.6±16.37 nm,sEVs-COCKTAIL為125±15.4 nm(圖1E )。其次,通過蛋白質印跡法顯示sEV蛋白表達了常用的sEV蛋白標記物CD63和TSG101(圖1F)。sEV(-16.7±0.72 mV)、RVG-sEVs(-11.0±1.10 mV)和sEVs-COCKTAIL(-10.8±1.27 mV)的zeta電位為負值(圖1G)。RVG29是一種帶正電荷的肽,其偶聯增加了zeta電位,而NR2B9c負載的sEV尺寸增加,表明sEV的標記和負載成功。體外研究sEV和sEVs-COCKTAIL的NR2B9c釋放曲線顯示出在前4小時內爆發釋放并且在后續的時間里持續釋放(圖1H)。sEVs-COCKTAIL在含或不含10% FBS的PBS中穩定至少一周(圖1I)。
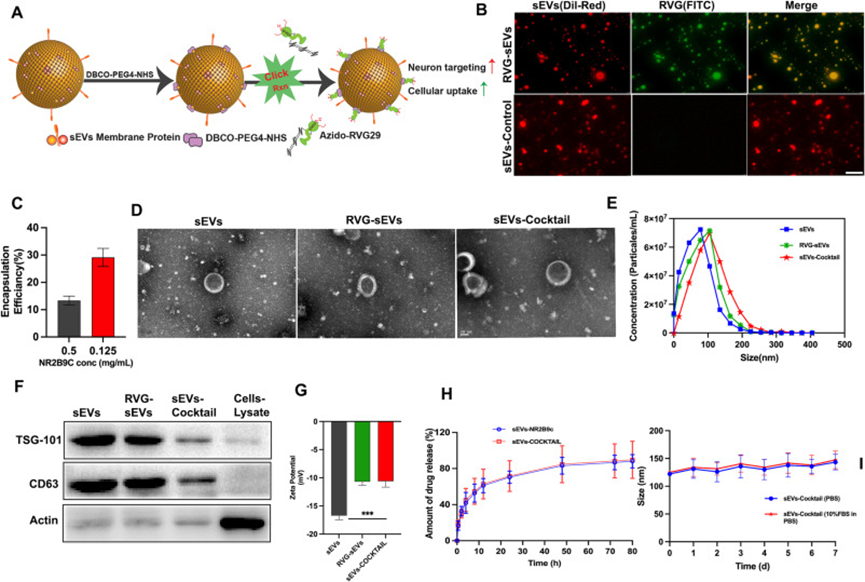 圖1.sEVs-COCKTAIL的制備和表征
圖1.sEVs-COCKTAIL的制備和表征
2.sEVs-COCKTAIL的細胞攝取和體外抗缺血卒中效率
首先,作者通過將sEV制劑(NR2B9cConc,25、50、100、200 nM)與原代神經元孵育來確認體外細胞相容性。6小時后,CCK-8測定結果顯示sEV對神經元活力沒有不利影響(圖2A)。作者選擇負載NR2B9c的濃度為50 nM的sEV-COCKTAIL進行體外研究。
作者通過開發體外缺血性腦卒中OGD模型研究了sEVs-COCKTAIL對Neuro-2a細胞的體外抗缺血性卒中作用。首先,通過酶標儀評估sEV制劑的保護潛力。結果顯示,OGD使細胞活力降低至61.42%,在sEVs-COCKTAIL處理組存在下顯著增加(92.057%)(圖2B)。重要的是,OGD誘導的損傷在僅NR2B9c存在的情況下恢復率為78.420%。
ROS在卒中嚴重程度中起著核心作用,因此抑制ROS產生炎癥通路是抑制卒中治療過程中組織死亡的基礎。采用DCFH-DAROS檢測試劑盒進行細胞間ROS檢測。如圖2C所示,與對照組相比,OGD處理的ROS水平提高到304.693%。sEVs-COCKTAIL處理顯示出ROS水平的顯著降低,減輕了ROS的過量產生并保護細胞免受ROS降解。在僅NR2B9c存在下,ROS水平升高了109.85%,而sEVs-NR2B9c和sEVs-COCKTAIL分別降低了121.745%和149.87%。
sEV細胞內化首先在Neuro-2a細胞中研究。與Neuro-2a細胞孵育sEV4小時后,通過共聚焦顯微鏡分析可以看到細胞攝取的明顯增加(圖2D-E),表明與sEV相比,RVG29偶聯增加了sEV的細胞攝取特性。RVG29靶向Neuro-2a細胞上表達的nAChR受體,sEV可通過受體介導的通路被Neuro-2a細胞有效攝取。
RVG29是獨有的附著在神經元上大量存在的N-乙酰膽堿受體的狂犬病病毒蛋白。因此,為了確認RVG-sEVs的神經元靶向潛力,作者培養了原代神經元,并將它們與sEV制備的組一起孵育。共聚焦顯微鏡結果顯示,與sEVs相比,RVG-sEVs被神經元更有效地吸收(圖2F)。sEV熒光強度的定量分析表明,RVG-sEV神經元靶向比sEV高26.42%,比小膠質細胞高43.69%,比星形膠質細胞高47.8%(圖2G)。這些結果表明,點擊化學技術有效地將RVG29與sEVs表面偶聯,從而有效地靶向sEV神經元。
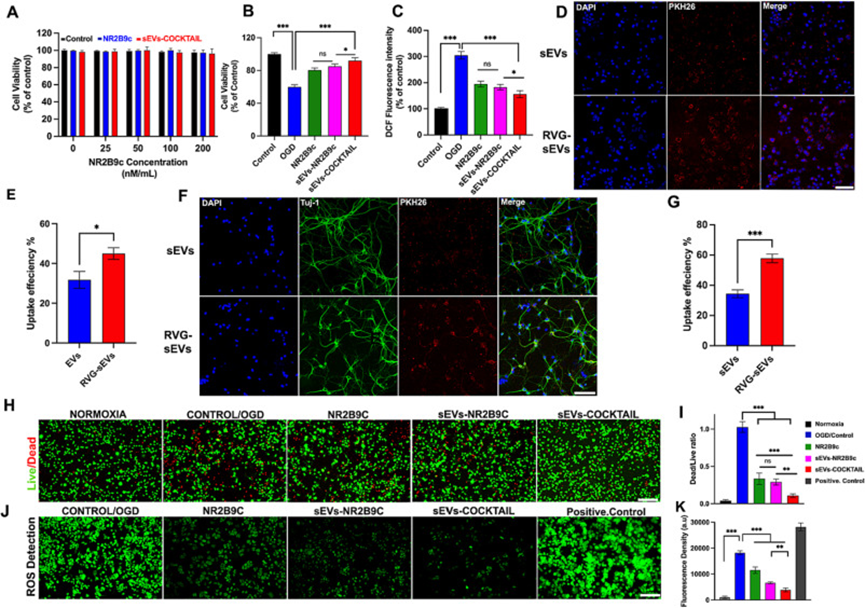 圖2.sEVs-COCKTAIL的體外細胞相容性和細胞攝取
圖2.sEVs-COCKTAIL的體外細胞相容性和細胞攝取
3.tMCAO小鼠模型的大腦靶向研究
為了評估sEV制劑的體內和離體循環行為以及大腦靶向能力,作者使用了tMCAO小鼠模型。使用活體成像系統(IVIS)靜脈注射近紅外熒光染料、DiR標記的游離sEV、RVG-sEV和游離DiR,以跟蹤tMCAO小鼠體內和離體的sEV。體內研究結果顯示,sEV信號主要存在于tMCAO小鼠的腹部和大腦中,并隨著時間的推移而減少(圖3A)。為了確定RVG29修飾是否增加了大腦中sEV的半衰期,作者檢查了24小時、48小時和72小時的熒光信號。有趣的是,RVG-sEVs在缺血性腦中24小時、48小時和72小時的輻射平均效率顯著提高(圖3C),這表明RVG29修飾不僅增加了sEVs的大腦靶向性,而且增加了其半衰期。作者注意到RVG-sEVs的熒光隨著時間的流逝在大腦中增加,而在48小時內沒有減少,這與EVs相反。這些發現表明,RVG-sEVs可以在受傷的大腦中停留更長時間,并且可以有效地釋放藥物。在24小時內在小鼠中觀察到較低量的游離DiR,主要存在于小鼠的肝臟和脾臟中,并在給藥后48小時內從體內完全清除。
對于sEVs的器官分布,處死小鼠,收集主要器官(肺、心臟、脾臟、腎臟、腦、肝和腸)進行離體成像(圖3B)。結果表明,在肝臟、脾臟和肺中檢測到更多的sEV制劑。在胃腸道、腎臟和心臟中觀察到最小的sEV分布(圖3D)。在大腦中,48小時時,與未注射的sEV相比,RVG-Sev處理小鼠觀察到的熒光信號強2.05倍(圖3E)。大量RVG-sEV存在長達48小時,并從體內逐漸清除。
為了進一步確認RVG-sEVs的神經元靶向能力,將PKH-26標記的sEVs制劑靜脈注射到中風小鼠體內,并評估其熒光強度。與sEVs相比,RVG-sEVs組觀察到更高的熒光信號(圖3F)。此外,與大腦的星形膠質細胞和小膠質細胞相比,RVG29偶聯的sEV主要被神經元吸收的量更高(圖3G-H)。
這些發現證實了RVG-sEVs在靶向神經元和大腦方面的潛力。RVG29的常見靶向受體是nAchRs,主要存在于大腦的神經元和內皮細胞上。研究人員已經證實,RVG29靶向主要對神經元具有特異性,不靶向其他神經膠質細胞。相比之下,其他BBB和大腦靶向肽,如T7肽、血管肽2肽和細胞穿透肽,如TAT、SynB、Penetratin、聚精氨酸、轉運蛋白10,共同的靶點不是神經元。例如,T7肽常見的靶向受體是轉鐵蛋白受體,存在于腦內皮細胞、神經元、上皮細胞和神經膠質細胞上。它在肝細胞和紅細胞上也高度表達,使其對大腦不具有特異性,尤其是對神經元而言并非獨有。惡性細胞表達轉鐵蛋白受體水平升高,這就是T7肽主要被研究用于結直腸癌、肺癌和膠質母細胞瘤等癌癥靶向的原因。Angiopep2靶向存在于肝、腎、膀胱和肺等多種組織中的低密度脂蛋白受體相關蛋白1和低密度脂蛋白受體相關蛋白2(LPR),并擴散到整個中樞神經系統(神經元、小膠質細胞、星形膠質細胞、周細胞、惡性星形細胞瘤、內皮細胞和血管平滑肌細胞)。LRP1在腦膠質瘤細胞上大量表達,并利用血管pep2。研究人員已經開發了LRP1靶向能力和angiopep2工程化的sEV、納米顆粒和納米囊泡,用于靶向膠質母細胞瘤。同樣,細胞穿透肽的靶向性也不具有特異性,可以穿透活生物體內的各種類型的細胞,從而產生脫靶效應。
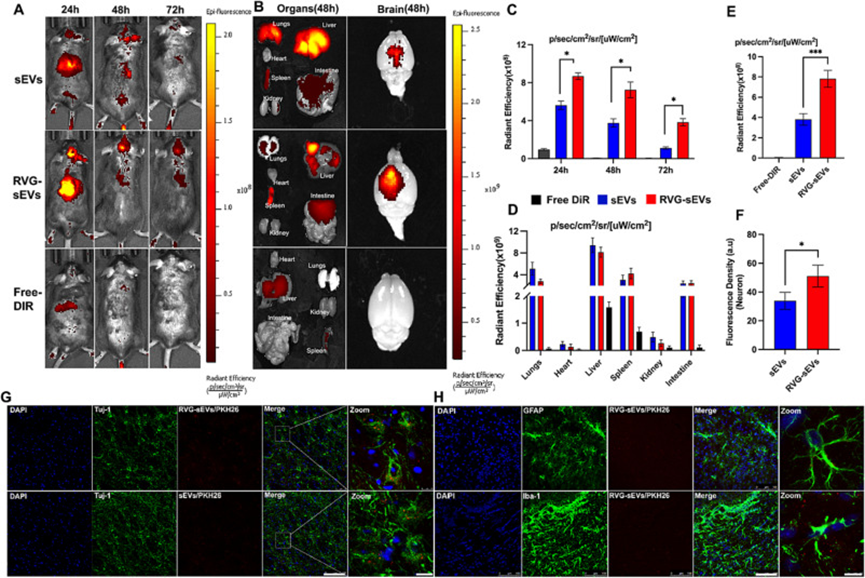 圖3.sEV制劑的體內生物分布研究
圖3.sEV制劑的體內生物分布研究
4.小鼠tMCAO模型中的sEVs-COCKTAIL抗缺血性卒中電位
采用tMCAO小鼠模型評價sEVs-COCKTAIL的體內抗缺血性腦卒中和神經保護效率。tMCAO模型具有高度可重復性,非常適合評估神經保護分子的有效。將小鼠隨機分為5組,檢測局部腦血流量(圖4B)。tMCAO手術組的腦血流量減少和恢復相當(圖4C)。72小時后評估紅外體積,tMCAO90分鐘后每天評估mNSS。如圖4D所示,假手術小鼠未發現梗死,PBS小鼠組明顯增加。重要的是,與其他治療組相比,sEVs-COCKTAIL治療顯著減少了梗死體積(圖4E)。為了更好地了解治療對功能和神經恢復的影響,進行了行為測試。與其他治療組相比,sEVs-COCKTAIL治療組在神經功能缺損的恢復方面的mNSS顯著增加(圖4F)。從EBST中也獲得了類似的結果,與其他組小鼠相比,用sEVs-COCKTAIL治療的小鼠具有更好的平衡能力(圖4G)。在體重減輕的恢復中顯示了相同的治療效果(圖4H)。總體而言,這些結果表明,與其他組相比,sEVs-COCKTAIL治療提供了更高的梗死體積和神經功能缺損恢復效果。
為了確認觀察到的治療效果歸因于NR2B9c向缺血性腦的遞送,在24小時后通過IVIS成像系統在tMCAO小鼠中檢測DiR標記的靜脈注射sEVs制劑。與sEV相比,sEVs-COCKTAIL和RVG-sEVs組的熒光信號明顯更強(圖4I-J),表明RVG-sEVs已成功將NR2B9c遞送至缺血性腦。與TAT相似,靶向RVG29可直接與NR2B9c偶聯,但RVG(29個AAs)的氨基酸(AA)長度比TAT(11個AAs)長。因此,直接偶聯可能會影響NR2B9c的功能特性,影響其介導PDZ與PSD-95結合的能力。此外,與RVG直接偶聯NR2B9c相比,RVG-sEV提供了更長的NR2B9c暴露時間。此外,還研究了sEV在提高貨物穩定性、吸收、控釋和靶向遞送方面的應用。相比之下,與NR2B9c偶聯的RVG29肽可能會觸發免疫反應并被巨噬細胞系統清除出體外,從而降低到達靶位點的機會,導致穩定性差和半衰期短。
為了進一步驗證NR2B9c是否從sEVs-COCKTAIL中釋放并與PSD-95偶聯,作者檢測了PSD-59與NR2B9c在中風小鼠中的共定位。免疫共熒光染色結果顯示PSD-95與NR2B9c偶聯(圖4K)。這些發現證明治療效果是由于sEVs-COCKTAIL釋放NR2B9c,而sEVs-COCKTAIL又與PSD-95結合并破壞NMDAR受體與PSD-95的相互作用,導致一氧化氮的產生減少。相比之下,在缺血核心的對側未觀察到PSD-95與NR2B9c的共定位,代表NR2B9c對缺血核心的靶向。這些結果表明,RVG-sEVs成功地將NR2B9c遞送至缺血小鼠的大腦,發揮了治療作用。先前的研究表明,NR2B9c需要以較高劑量(10 nM/g)給藥,而較低劑量對小鼠無效。作者的研究結果表明,當通過RVG-sEV遞送時,較低劑量的5 nM/g NR2B9c可產生顯著的治療效果。最近的臨床試驗TAT-NR2B9c在一些患者中表現出治療效果。然而,TAT-NR2B9c和tPA的聯合給藥并沒有提高治療效率。聯合給藥缺乏改善的結果很可能是因為高正電荷的TAT介導NR2B9c和tPA的非特異性結合,導致NR2B9c活性喪失。鑒于sEVs是一種出色的生物相容性納米載體,并具有固有的神經保護作用。作者相信,如果使用RVG-sEVs,NR2B9c和tPA的組合而不是TAT,NR2B9c和tPA進行,該臨床試驗可以在缺血性腦卒中治療中取得更大的成功。
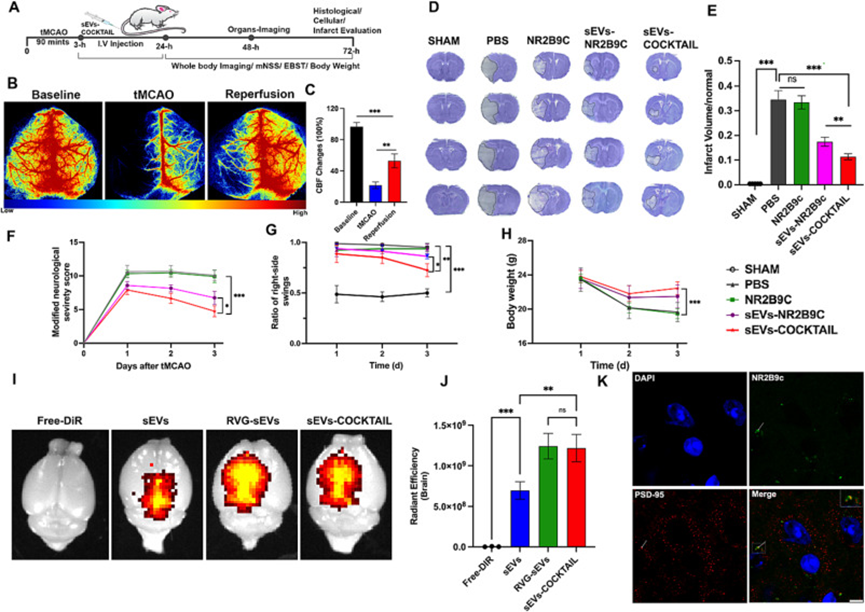 圖4.tMCAO小鼠模型中sEVs-COCKTAIL的抗缺血性卒中潛力
圖4.tMCAO小鼠模型中sEVs-COCKTAIL的抗缺血性卒中潛力
5.sEVs-COCKTAIL療法通過介導NMDAR下游信號蛋白和預防細胞凋亡的神經保護潛力
缺血性損傷影響NMDAR受體的細胞質尾部,NMDAR受體被認為是信號蛋白的主要樞紐。針對NR2B9c發揮神經保護作用的分子機制,研究了tMCAO后NMDAR細胞質尾下游神經元存活信號蛋白Bcl-2和死亡信號轉導P38蛋白表達。在腦海馬CA1區tMCAO24h和72h后測量Bcl-2和p38的表達。Bcl-2表達在卒中24h時顯著降低,在卒中72h時保持低水平。sEVs-COCKTAIL療法相對調節Bcl-2的表達(圖5A)。同樣,P38表達受到缺血性損傷的影響,缺血性損傷在卒中后24h在PBS或其他治療組中上調,并且在sEVs-COCKTAIL治療后顯著下調。在72小時時間點,p38的蛋白表達水平發生了相對變化,但差異無統計學意義(圖5B)。基于這一發現,p38可能不是導致NMDAR下游神經元死亡的獨有信號通路。
為了進一步評估sEVs-COCKTAIL的神經保護作用,作者進行了TUNEL測定以評估缺血性損傷后神經元的凋亡。免疫熒光染色結果顯示tMCAO治療3天后出現TUNELNeuN神經元。在治療組中,PBS和其他治療組的TUNEL細胞密度較高。sEVs-COCKTAIL的TUNEL神經元數量相對顯著減少(圖5I-J)。綜上所述,這些結果表明sEVs-COCKTAIL通過調節Bcl-2和P38的表達并抑制缺血性腦卒中后的細胞凋亡發揮神經保護作用。
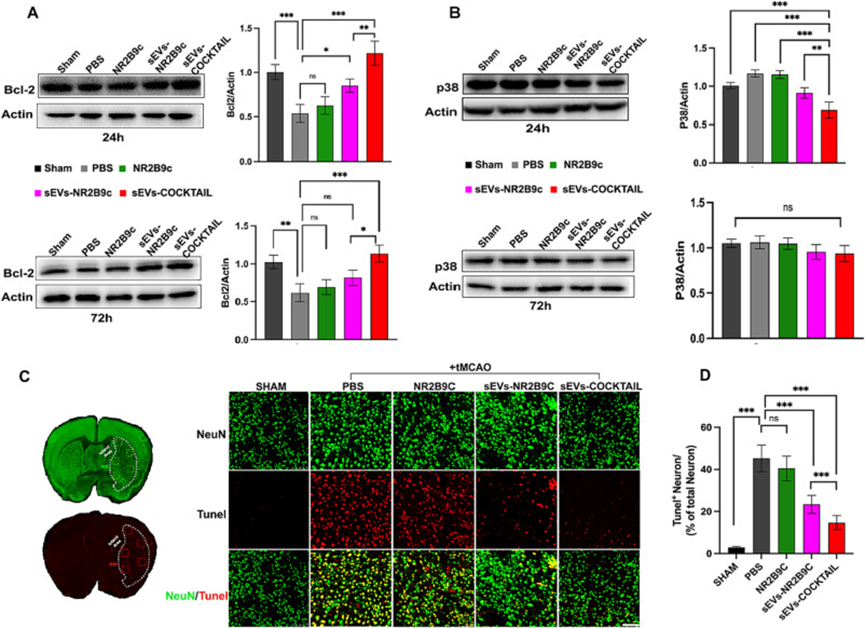
圖5.sEVs-COCKTAIL療法介導NMDAR下游蛋白并在tMCAO后保護神經元
3.6.體內生物安全性評價
為了進行安全性檢測,作者通過尾靜脈向健康小鼠注射sEVs-COCKTAIL或PBS 7天。最后一次給藥后,對小鼠組織(腦、心臟、肺、肝、腎和脾臟)樣本進行全血細胞計數、血清生化分析和HE染色,以監測潛在的毒性。在組織切片中未發現異常或炎癥細胞(圖6A)。血清生化試驗顯示,小鼠組每日給藥1周后無明顯異常(圖6B-C)。這些結果證實了sEVs-COCKTAIL在體內表現出優異的生物相容性。
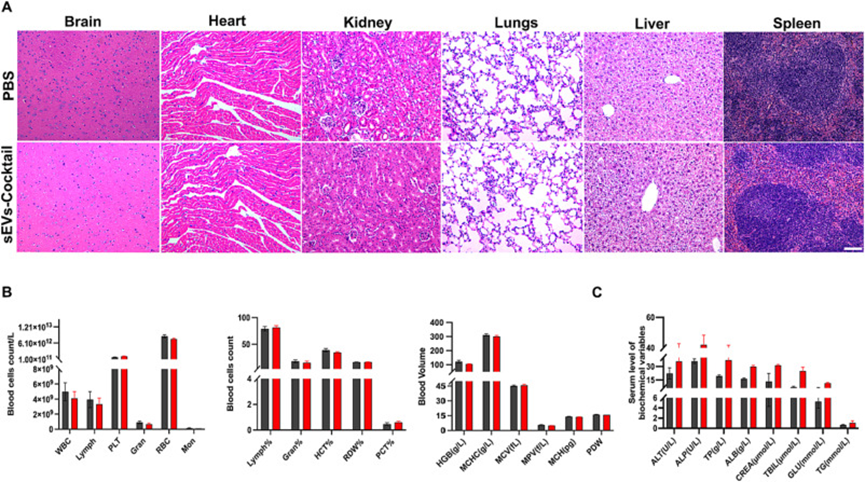
圖6. 體內生物安全性評價
結語
在這項研究中,作者開發了基于sEVs的腦靶向藥物輸送系統,用于缺血性中風的治療。作者將神經保護肽(NR2B9c)遞送至大腦,克服血腦屏障,靶向神經元,增加生物分布和生物利用度。
作者通過點擊反應用神經元靶向肽RVG29設計了sEV,它們將NR2B9c以更高的效率特異性遞送至缺血神經元,以防止腦缺血期間過度產生ROS,在神經元靶向和NR2B9c遞送方面取得了令人滿意的結果。當將sEVs-COCKTAIL靜脈注射給中風小鼠時,神經功能缺損、梗死大小和神經元凋亡顯著恢復。從機制上講,sEVs-COCKTAIL的神經保護作用部分是由于Bcl-2和p38蛋白表達水平的調節。靜脈注射sEVs-COCKTAIL7天后,小鼠主要器官和大腦未產生不良反應。
由于sEVs-COCKTAIL具有抗ROS、神經元靶向和神經保護特性,未來的研究可能會探索其對其他神經系統疾病的治療效率,如出血性腦卒中、創傷性腦損傷和阿爾茨海默病。綜上所述,設想這種基于點擊化學的RVG29修飾的載NR2B9c的sEV,是將sEV與NR2B9c一起用于缺血性卒中治療臨床成功的最佳方法。
參考文獻
Haroon K, Ruan H, Zheng H, Wu S, Liu Z, Shi X, Tang Y, Yang GY, Zhang Z. Bio-clickable, small extracellular vesicles-COCKTAIL therapy for ischemic stroke. J Control Release. 2023 Nov;363:585-596. doi: 10.1016/j.jconrel.2023.10.003. Epub 2023 Oct 11. PMID: 37793483.
實驗方法
藥物釋放曲線、細胞培養、ROS檢測、細胞活死染色、CCK-8實驗、細胞攝取實驗、動物建模、行為學分析、WB、免疫熒光染色、HE染色






