腫瘤微環境新焦點——腫瘤內微生物鐮刀菌通過 GLUT1 驅動的乳酸產生促進口腔鱗狀細胞癌進展
口腔鱗狀細胞癌 (OSCC) 是頭頸部鱗狀細胞癌 (HNSCC) 的一種普遍亞型。盡管 OSCC 的診斷和治療取得了進展,但由于轉移或復發,5年生存率仍然很低。除了遺傳、表觀遺傳和基質微環境因素外,組織內微生物群的特征與癌癥的標志有關,包括風險、病理類型和預后。同樣,鑒于 OSCC 起源于富含微生物群的口腔,微生物群作為調節 OSCC 進展的不可忽略的潛在介質出現。F. nucleatum (鐮刀菌)是一種革蘭氏陰性厭氧菌,與其他口腔細菌相比,被認為是一種主要的促腫瘤細菌。然而,作為OSCC微生物群的組成物種,鐮刀菌如何影響OSCC的進展仍未被探索。
先前的研究表明,鐮刀菌凝集素 Fap2 識別宿主 N-乙酰半乳糖胺 (GalNAc),這是一種在細胞表面表達的糖蛋白,通過碳水化合物部分介導細菌與腫瘤細胞之間的結合,并幫助該細菌大量定位于腫瘤組織中。先前的研究表明,鐮刀菌凝集素 Fap2 識別宿主 N-乙酰半乳糖胺 (GalNAc),這是一種在細胞表面表達的糖蛋白,通過碳水化合物部分介導細菌與腫瘤細胞之間的結合,并幫助該細菌大量定位于腫瘤組織中。然而,這些已確定的機制僅限于細胞內的生理病理過程,無法解釋與腫瘤進展相關的微環境的影響。鐮刀菌定植被認為會引發急性先天免疫反應,尤其是微環境中的巨噬細胞浸潤。鑒于 M2 樣腫瘤相關巨噬細胞 (TAM) 在促進腫瘤侵襲中至關重要,這些報告表明,鐮刀菌驅動的微環境巨噬細胞活化可能與促進腫瘤侵襲有關。
近期,題名為:F. nucleatum facilitates oral squamous cell carcinoma progression via GLUT1-driven lactate production的研究文章發表在EBioMedicine,文章主要表明 F.nucleanum對OSCC微環境的影響及其與OSCC進展的相關性。我們在OSCC樣品中鑒定出F.nucleanum是一種高度富集的物種。F.有核細胞傾向于定植在OSCC的侵襲邊緣。機制分析表明,F.nucleanum通過激活GalNAc自噬-TBC1D5信號軸,促進質膜和糖酵解中葡萄糖轉運1(GLUT1)的聚集,GLUT1是細胞葡萄糖攝取和代謝的關鍵限速因子,導致細胞外乳酸沉積和M2樣TAMs的形成。GalNAc和GLUT1的同時抑制導致微環境中M1樣抗腫瘤巨噬細胞的形成和OSCC進展的消退。這些發現為晚期OSCC患者的靶向治療策略提供了新的前景。
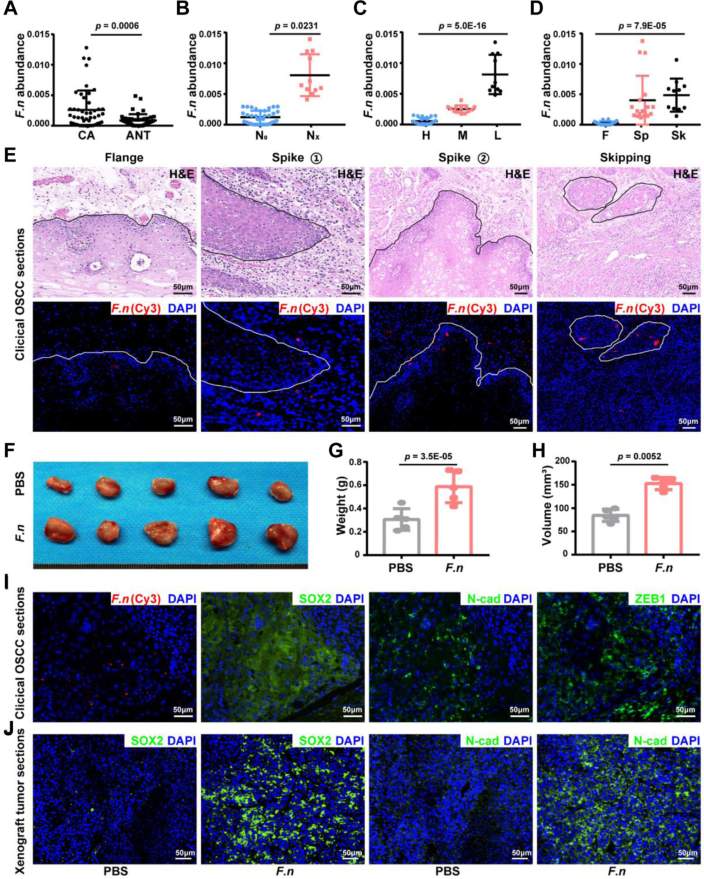
鐮刀菌聚集在 OSCC 的侵襲性邊緣,并與腫瘤侵襲相關
為了確定 鐮刀菌 定植與 OSCC 進展之間的相互關系,分析了來自兩個代表性隊列的 16S rRNA 測序數據。結果表明,鐮刀菌是OSCC組織中定植最普遍的病原體之一,在75.7%的OSCC樣本中觀察到有鐮刀菌亞種,在鄰近正常組織中,鐮刀菌的患病率顯著降低2.25倍。這些結果表明,鐮刀菌 定植與 OSCC 進展之間存在明顯的相關性。FISH檢測OSCC 組織中鐮刀菌表達發現,鐮刀菌通常聚集在所有類型的OSCC的侵襲邊緣,動物實驗表明鐮刀菌促進腫瘤生長和上皮-間充質轉化(EMT)生物標志物SOX2、ZEB1和N-cad表達。
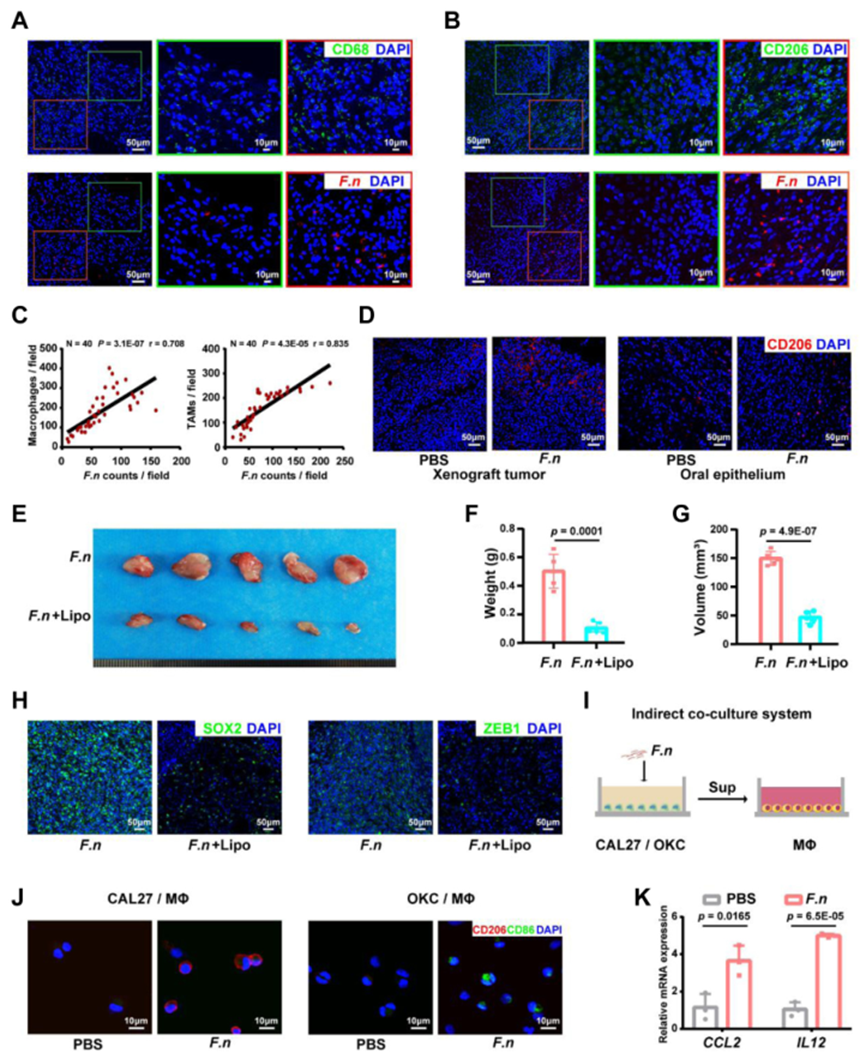
定植的鐮刀菌驅動 M2 樣腫瘤相關巨噬細胞的形成
為了確定 鐮刀菌 是否通過 M2 樣 TAM 促進 OSCC 侵襲,在OSCC臨床樣本檢測鐮刀菌與與CD68和CD206的共表達。CD206(+) M2樣巨噬細胞在單位視圖中顯示出與鐮刀菌的主要重疊,表明 鐮刀菌 接種能夠促進 CD206+ M2 樣 TAM 的形成。通過使用氯膦酸脂質體消除巨噬細胞,有效逆轉鐮刀菌介導的腫瘤進展。這些數據表明腫瘤微環境中的 鐮刀菌 可以促進 CD206+ M2 樣TAM的形成,這對 鐮刀菌 誘導的 OSCC 侵襲具有潛在重要性。
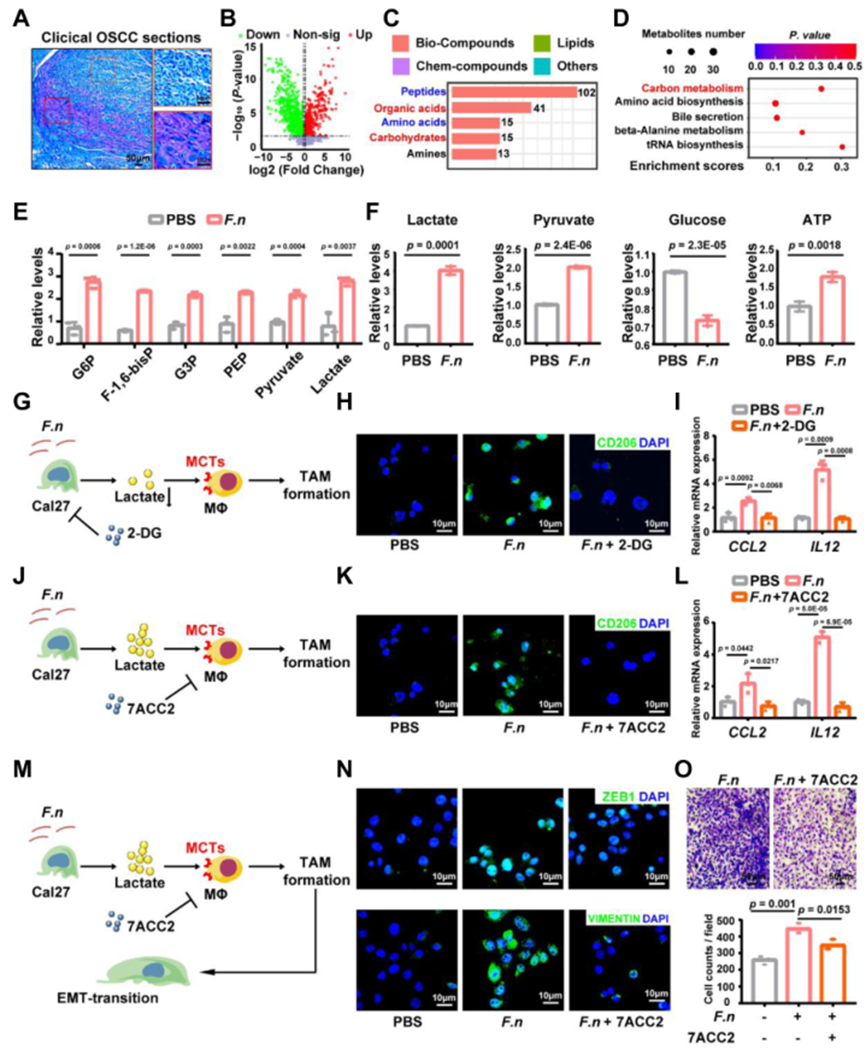
鐮刀菌誘導的OSCC細胞乳酸產生是M2樣腫瘤相關巨噬細胞形成所必需的
為了剖析 鐮刀菌 促進 M2 樣 TAMs 形成的潛在機制,細胞外酸化在 鐮刀菌 聚集的 OSCC 侵襲邊緣和體外共培養系統。代謝組學分析,以獲得鐮刀菌暴露的OSCC細胞差異代謝物途徑富集分析顯示碳代謝顯著。葡萄糖消耗量、乳酸、丙酮酸和ATP合成成比例上升。
為了探討乳酸沉積是否可以促進腫瘤微環境中M2樣TAMs的形成,我們添加了乳酸代謝抑制劑2-DG來抑制OSCC細胞共培養系統中的乳酸沉積。數據顯示,2-DG逆轉了鐮刀菌介導的巨噬細胞M2樣極化。總的來說,這些發現支持了 鐮刀菌 促進 OSCC 細胞糖酵解和乳酸產生,這反過來又增加了細胞外酸化和 M2 樣 TAM 的形成。
鐮刀菌誘導的 GLUT1 積累增加 OSCC 細胞的乳酸產生
為了闡明鐮刀菌感染如何增加OSCC細胞的乳酸產生,研究了鐮刀菌暴露的OSCC細胞中葡萄糖轉運蛋白和糖酵解限速酶的表達。值得注意的是,在OSCC組織中高表達的GLUT1在鐮刀菌刺激下上調約3倍。基于上述暴露于鐮刀菌的OSCC細胞的代謝組學數據的功能富集分析一致地表明,與GLUT1相關的膜轉運是最重要的。臨床OSCC樣本結果表明GLUT1 主要富集于 OSCC 侵襲邊緣,并與 鐮刀菌 共定植。鐮刀菌誘導的乳酸產生可能與OSCC細胞中GLUT1的上調相關。
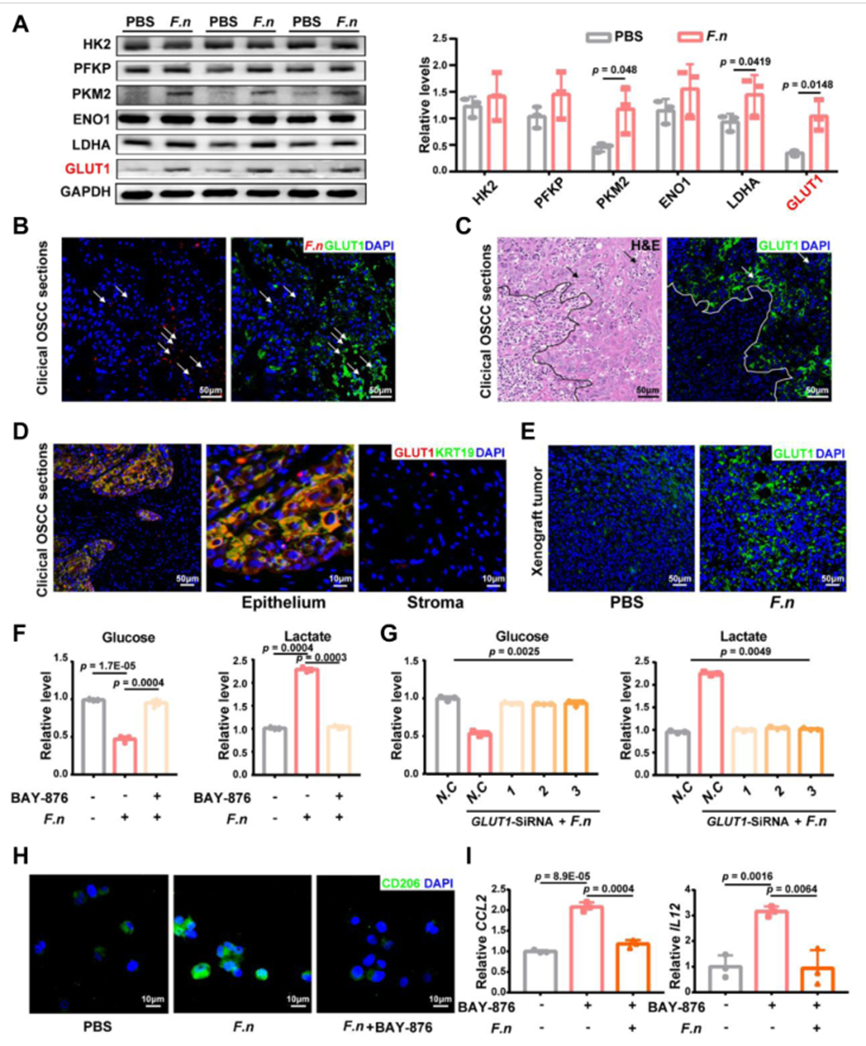
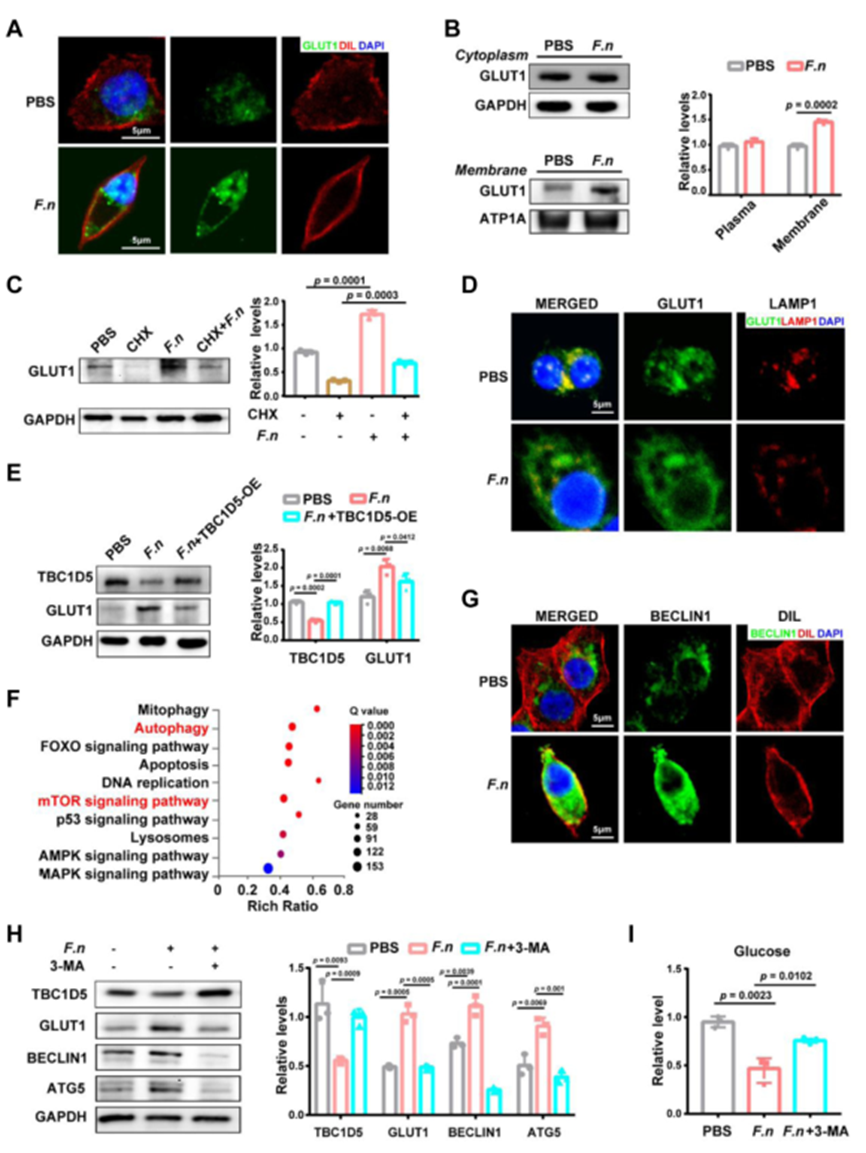
鐮刀菌誘導的 TBC1D5 下調促進 GLUT1 在細胞表面的定位
為了描述鐮刀菌介導的 GLUT1 上調的原因,首先GLUT1 在鐮刀菌孵育的 OSCC 細胞中的轉錄,PCR結果無差異;然而,免疫熒光染色顯示,與對照細胞相比,鐮刀菌孵育細胞表面的GLUT1蛋白更多。WB檢測膜相關GLUT1顯著升高。表明 GLUT1 的蛋白質水平和細胞表面定位均增加。
為了確定蛋白質翻譯的上調是否是上述表型的原因,CHX的應用不能在一定時期內逆轉鐮刀菌介導的GLUT1上調,表明 鐮刀菌 介導的 GLUT1 積累可能是由蛋白質降解抑制引起的。GLUT1 與溶酶體相關膜糖蛋白 1 (LAMP1) 在 鐮刀菌 暴露的 OSCC 細胞中的細胞內分布。免疫熒光染色顯示 GLUT1 在 鐮刀菌暴露細胞,支持鐮刀菌可能抑制GLUT1溶酶體降解。TBC1D5 在 鐮刀菌 孵育的 OSCC 細胞中下調 TBC1D5過表達抵消了OSCC細胞中鐮刀菌誘導的GLUT1上調。這些觀察結果表明,鐮刀菌通過下調 TBC1D1 促進細胞表面存在 GLUT5。