GPNMB+ Gal-3+ 肝實質細胞促進免疫抑制和肝細胞癌發生
摘要:
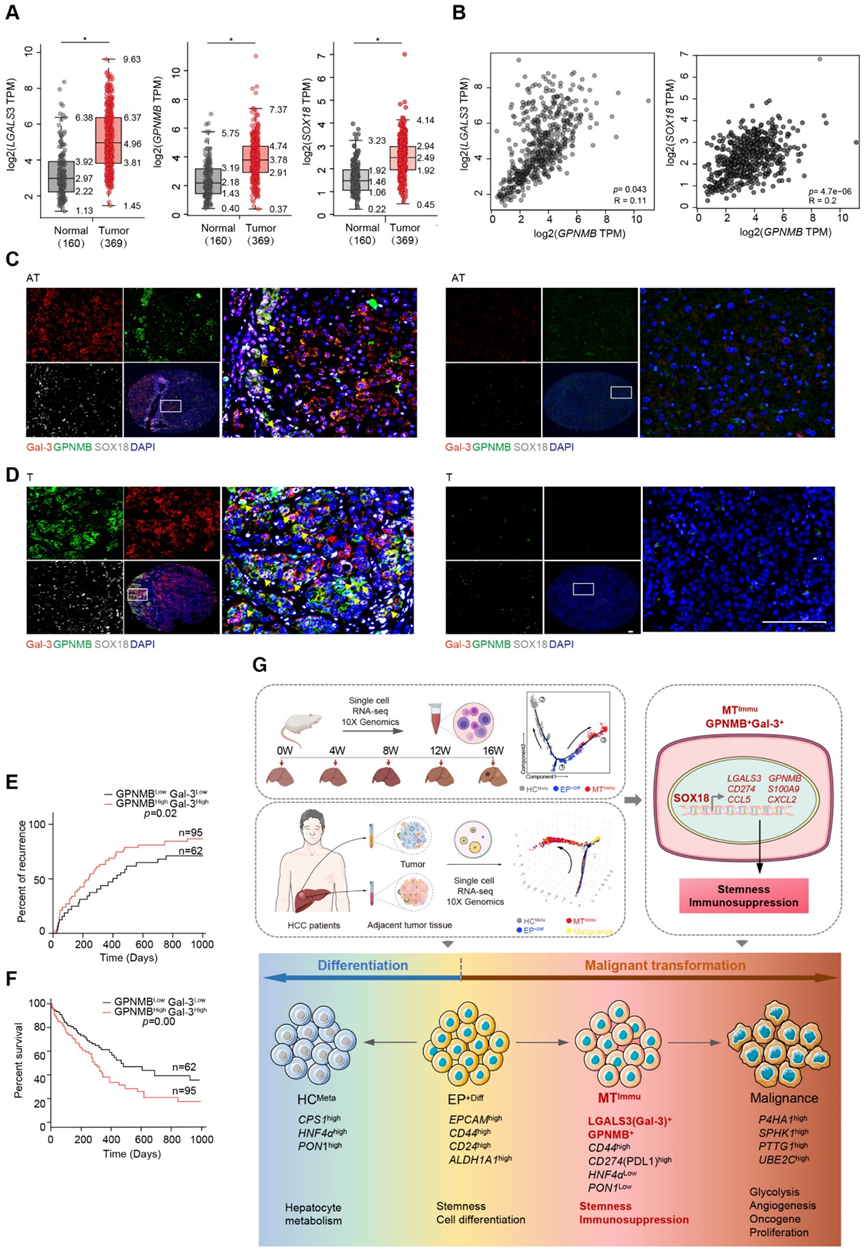
肝細胞癌(HCC)的形成是一個多步驟的病理過程,涉及異質免疫抑制腫瘤微環境的演變。然而,所涉及的特定細胞群及其起源和對 HCC 發展的貢獻仍然很大程度上未知。在這里,應用全面的單細胞轉錄組測序來分析毒素誘導的肝臟腫瘤發生和 HCC 患者的大鼠模型。具體來說,我們鑒定了 HCC 進展過程中出現的三個肝實質細胞群,稱為代謝肝細胞 (HCMeta)、具有分化潛力的 Epcam+ 群 (EP+Diff) 和免疫抑制惡性轉化子集 (MTImmu)。這些不同的亞群形成了描繪肝癌發生動態景觀的致癌軌跡,其特征基因反映了從 EP+Diff 到 MTImmu 的轉變。重要的是,GPNMB+ Gal-3+ MTImmu 細胞表現出惡性和免疫抑制特性。此外,SOX18是GPNMB+ Gal-3+ MTImmu細胞的生成和惡性轉化所必需的。研究發現 GPNMB+ Gal-3+ MTImmu 子集的富集與患者預后不良和較高的復發率相關。總的來說,我們揭示了單細胞 HCC 進展圖譜,并發現 GPNMB+ Gal-3+ 實質細胞是導致免疫抑制微環境的主要亞群,從而導致 HCC 惡性。該研究于2023年11月發表在《The EMBO journa》,IF:11.4。
技術路線:

結果:
1、scRNA-seq 鑒定出肝癌發生過程中具有免疫抑制能力的 MTImmu 細胞群
為了研究惡性轉化過程中的分子和細胞特征,并探索 HCC 發展過程中肝實質細胞群的進化路徑,我們對二乙基亞硝胺(DEN)誘導的大鼠在不同時間點(0、4、8、12、16 周)進行了單細胞 RNA 測序(scRNA-seq)分析 (圖 1A)。經過質量檢查,收集了 45,390 個來自大鼠肝組織的單細胞轉錄組。然后,我們使用統一流形近似和投影(UMAP)分析將所有細胞分類為T細胞、自然殺傷(NK)細胞、B細胞、粒細胞-單核細胞祖細胞(GMP)、單核細胞(Mono)、樹突狀細胞(DC) 、漿細胞樣樹突細胞 (pDC)、巨噬細胞 (Mφ)、中性粒細胞 (Neu)、成纖維細胞 (Fib)、基質細胞 (SC)、膽管上皮細胞 (BEC) 和非惡性實質細胞 (NMPC) --基于已知細胞譜系的特定標記基因(圖 1B)。同時,通過推斷染色體拷貝數變異(CNV)來區分惡性細胞(圖1B)。
接下來,我們收集了 NMPC 和惡性腫瘤,并通過聚類分析將它們分為 10 個亞群,以探索這兩種細胞類型之間潛在的中間狀態(圖 1C 和 D )。簇 1-3 傾向于表達與肝細胞 (HC) 代謝相關的特征基因,例如 Pon1、Cps1 和 Hnf4a,而簇 4-6 高度表達分化相關標記,包括 Epcam、Cd44、Cd24 和 Aldh1a1,顯示出強大的分化潛力(圖1E和F)。基于這些觀察,我們在下文中分別將簇 1-3 和 4-6 表示為 HCMeta 和 EP+Diff(圖 1G)。簇 7-9 保留了一些 EP+Diff 特征(Cd44、Cd24 和 Aldh1a1),但它們特異性表達多種免疫抑制標記物,例如 Cd274、Mgp、Grn 和 Lgals3,以及淋巴細胞和骨髓源性抑制細胞 (MDSC) 招募趨化因子 Ccl5 和 Cxcl2(圖 1F)。鑒于其 EP+Diff 和惡性細胞的混合特性,我們將 C7-9 簇稱為免疫抑制惡性轉化子集 MTImmu(圖 1E-G)。重要的是,隨著肝癌發生的發展,HCMeta群體逐漸縮小,而EP+Diff和MTImmu的比例在HCC進展過程中以時間依賴性方式增加(圖1H),這表明建立腫瘤免疫抑制的動態進化模式微環境。總而言之,這些結果表明在肝癌發生過程中存在一種具有潛在干性和免疫抑制能力的新型 MTImmu 群體。
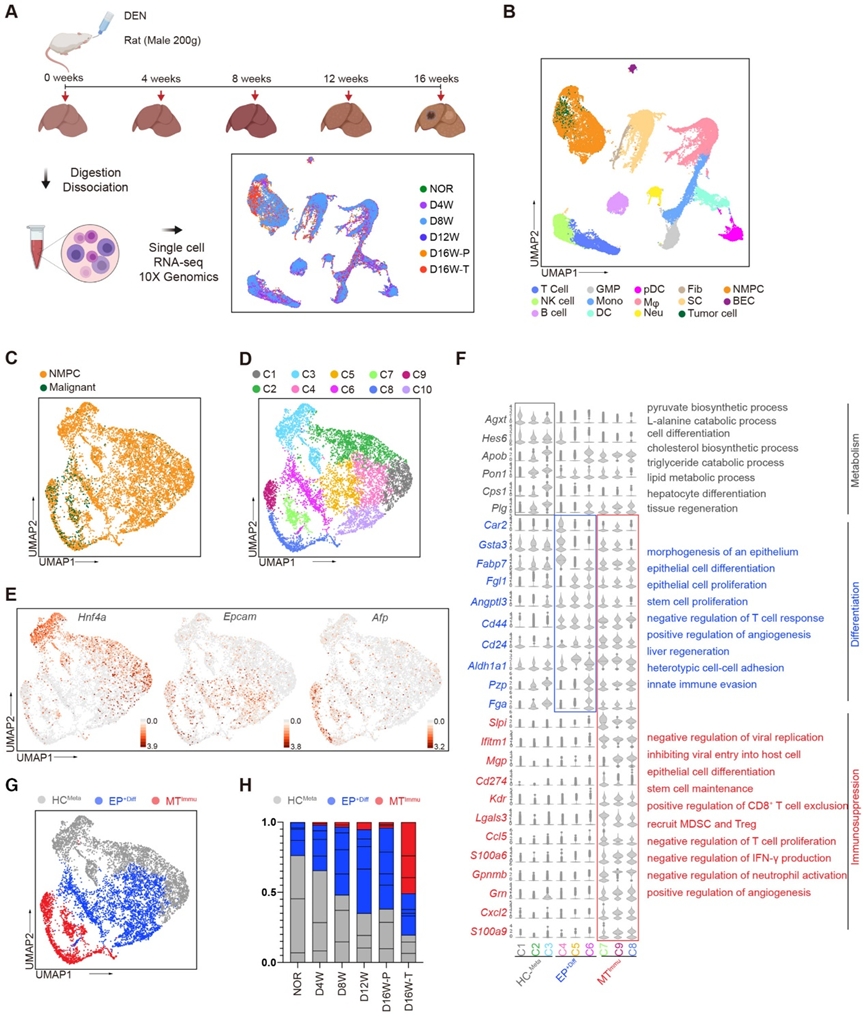
2、人與大鼠 HCC 相關 MTImmu 的跨物種比較分析
HCC 患者肝實質細胞的本體發生和進化仍然是一個尚未充分探索的領域。為此,我們采用 scRNA-seq 來研究從四名 HCC 患者的腫瘤 (T) 和鄰近腫瘤組織 (AT) 中分離的細胞(圖 2A)。我們通過推斷 CNV 將惡性細胞與總細胞區分開來。同時,通過常用的特征標記來識別T細胞、B細胞、Mono、DC、漿細胞(PC)、Mφ、Fib、SC和NMPC(圖2B和C)。樣本中不同細胞類型的比例顯示,與 PCA 相比,腫瘤含有更多的 NMPC、Fib 和 Mφ,但 SC 和 T 細胞更少。
接下來,我們匯集了所有 NMPC 和惡性細胞,隨后將它們分為 11 個簇(圖 2D 和 E)。與大鼠的基因表達譜類似,人類(hC1)簇1是典型的肝細胞(HC)代謝組(稱為HCMeta),其特征為HNF4A、PON1和AGXT(圖2F)。此外,hC2-4簇以分化相關基因(GSTA2、HES1、ALDH1A1和CD24)為特征,因此被稱為EP+Diff(圖2F和G)。在保留 EP+Diff 特征的同時,hC5-7 簇還表達參與 MDSC 和 Treg 趨化性、T 細胞增殖負調節和干細胞維持相關基因的基因,如 S100A9、CXCL17、GPNMB、CCL20、LGALS3 和 SOX4。 hC5-7簇似乎是EP+Diff和惡性細胞的混合狀態,因此我們將其稱為免疫抑制惡性轉化(MT Immu)(圖2F和G)。hC9-11簇顯示出參與糖酵解和糖異生、細胞增殖、EMT、血管生成和脂質積累的惡性腫瘤相關基因(PEG10、ENO3、CCNB1和UBE2C)的較高表達水平(圖2F和G)。
根據大鼠和患者實質細胞各亞群的特定基因表達模式,例如 HCMeta、EP+Diff 和 MTImmu(圖 1D-G 和 2E-G),我們使用 Garnett 評估了這些細胞的跨物種保守性(https://coletrapnell-lab.github.io/garnett/),一種基于回歸的機器學習分類器,用于識別細胞類型特異性基因表達模式。作為原理證明,機器能夠預測具有非常高相關性分數的相似子集。令人驚訝的是,機器檢測到大鼠和患者 MTImmu 子集具有非常高的相似性,特別是 C8、C9(大鼠)和 hC7(患者)(圖 2H)。此外,UMAP 顯示了特定基因的相似表達模式,例如 LGALS3、GPNMB、CD47 和 CD24,再次表明大鼠和患者之間 MTImmu 子集的保守性。
為了進一步驗證更多HCC患者中是否存在相似的細胞簇,我們下載了HCC患者的原始數據(GSE112271、GSE151530、GSE210679和GSE149614)。合并10例患者的樣本(實質細胞超過1000個細胞)。然后,我們使用已知的細胞譜系特異性標記基因進行 UMAP 分析。實質細胞分為 11 個簇。我們觀察到,來自鄰近肝組織(N)的實質細胞與腫瘤組織緊密纏繞,顯示出與我們當前研究中發現的相似的簇。肝臟代謝特征基因(HNF4A、CPS1和PON1)高表達的簇5,8;簇 2、4 呈現干細胞分化潛力基因(CD24、EPCAM、CD47、LGALS3 和 SOX4);簇1、9和11過表達免疫抑制相關基因LGALS3和GPNMB,與LGALS3+ GPNMB+ MTIMMU子集極其相似(圖2F和G)。
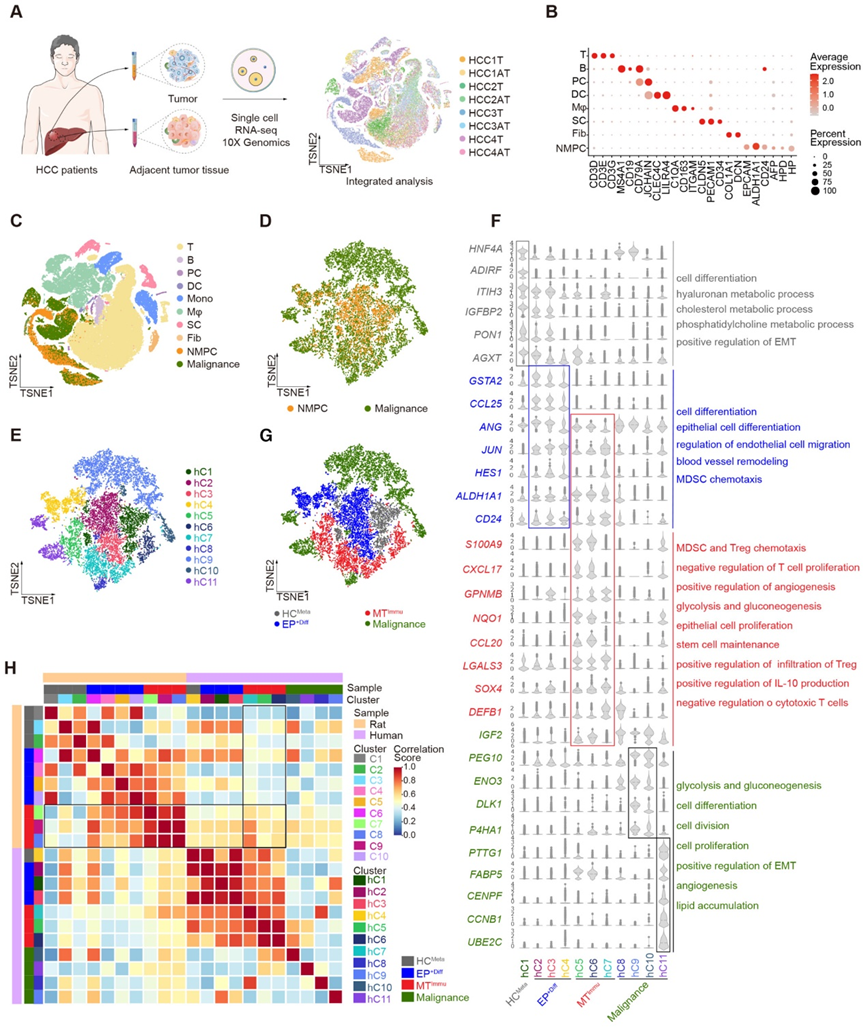
3、MTImmu展示EP+Diff的潛在轉變
為了縱向觀察惡性細胞的起源,我們進行了 RNA 速度分析,并揭示了可能分別源自 EP+Diff 子集到 HCMeta 和 MTImmu 子集的多個分支的流形(圖 3A)。通過沿偽時間對細胞進行著色,EP+Diff的分支主要位于軌跡樹的起始區域(①),最終在一個分支中演化為HCMeta(②),或者在另一個分支中直接轉化為MTImmu(③)(圖3B和D)。 MTImmu 在正常組(NOR)或 DEN 治療后早期時間點(4 或 8 周)的樣本中幾乎觀察不到,但在暴露于 DEN 12 和 16 周的大鼠中顯著增加(圖 3C 和 D)。
此外,我們提取了從分支①到分支②的轉換中上調的基因。 GO分析顯示,與肝細胞功能相關的生物過程,如膽固醇代謝和穩態、脂質生物合成和運輸,在分支②中富集。同時,分支①轉變為分支③的上調基因在炎癥反應、免疫反應負調節、細胞分裂和干細胞維持方面顯著富集。一致地,作為肝細胞功能指標的幾個基因,包括 Pon、Cps1 和 Agxt,也在 HCMeta 中高表達(②,圖 3E)。干性相關基因 Mgp 和 Cd44 以及 Epcam 在 EP+Diff(①)和 MTImmu(③)中均富集;而 Lgals3、Gpnmb 和 Kdr 在 MTImmu 中特別升高(③,圖 3E)。
接下來,我們檢查了 HCC 患者是否可以觀察到這些現象。事實上,RNA速度分析表明EP+Diff作為潛在的根轉化為HCMeta、MTImmu和惡性細胞,而MTImmu表現出更傾向于轉化為不同簇的惡性細胞,這可能解釋了肝癌的高度異質性(圖3F) 。偽時間分析發現,在從 EP+Diff 到 MTImmu 的潛在轉變過程中,與免疫抑制(LGALS3 和 GPNMB)和干性(SOX4、EPCAM 和 CD47)相關的基因逐漸升高(圖 3G),表明干性和MTImmu 的免疫抑制特性。總的來說,這些結果表明MTImmu具有免疫抑制和干細胞特性,并可能在HCC腫瘤發生過程中表現出EP+Diff的惡性轉化。
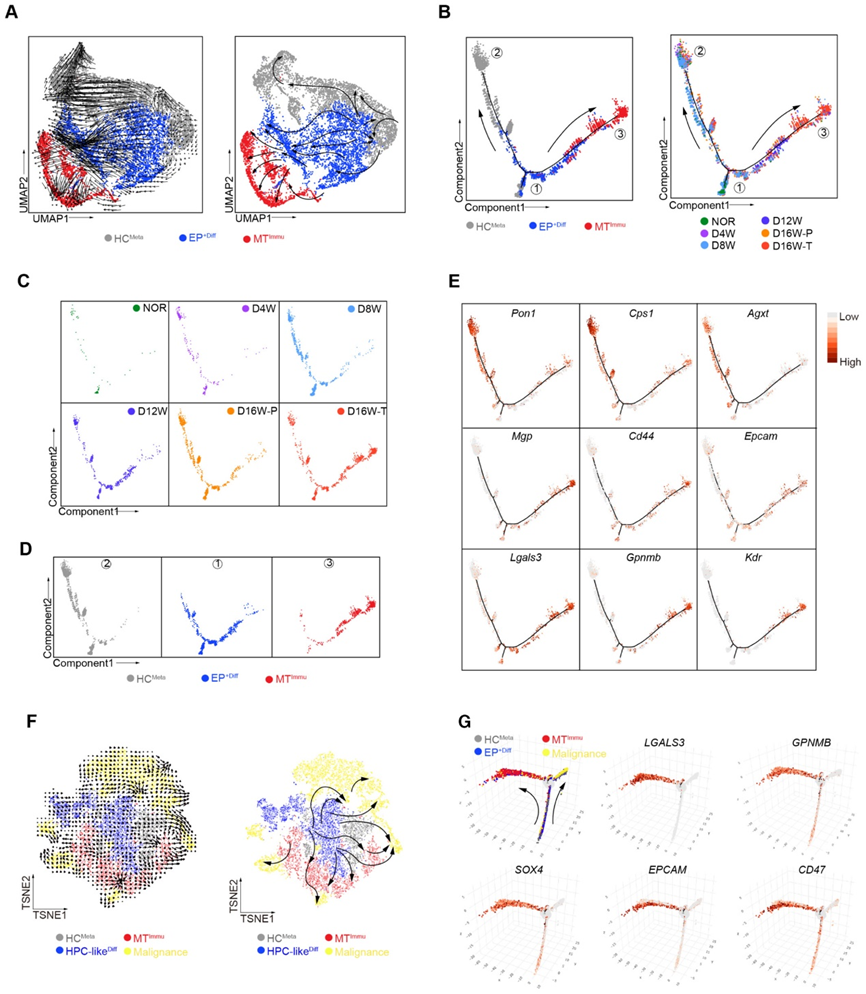
4、GPNMB+ Gal-3+ MTImmu 細胞表現出致瘤能力
為了驗證 MTImmu 群體的存在并對其進行功能表征,我們采用了通過外源注射原代 EPCAM+ 細胞并結合 DEN 治療誘導的大鼠 HCC 模型。我們從 GFP 標記的胎肝(13.5 天)中分選了原代 EPCAM+ 細胞,并將其注射到用 DEN 預處理 2-5 周的雄性大鼠中。受體大鼠接受 DEN 治療 16 周,同時使用 0.9% NaCl 作為模擬對照。我們發現接受 EPCAM+ 細胞的大鼠早在植入后 12 周就出現了腫瘤,而對照組則沒有觀察到腫瘤。此外,DEN 治療后 16 周時,受體大鼠表現出更高的腫瘤發生率和更大的腫瘤尺寸。此外,通過蘇木精-伊紅染色,EPCAM+細胞注射組在12周或16周DEN誘導的大鼠中比對照組有更多更大的微觀損傷。
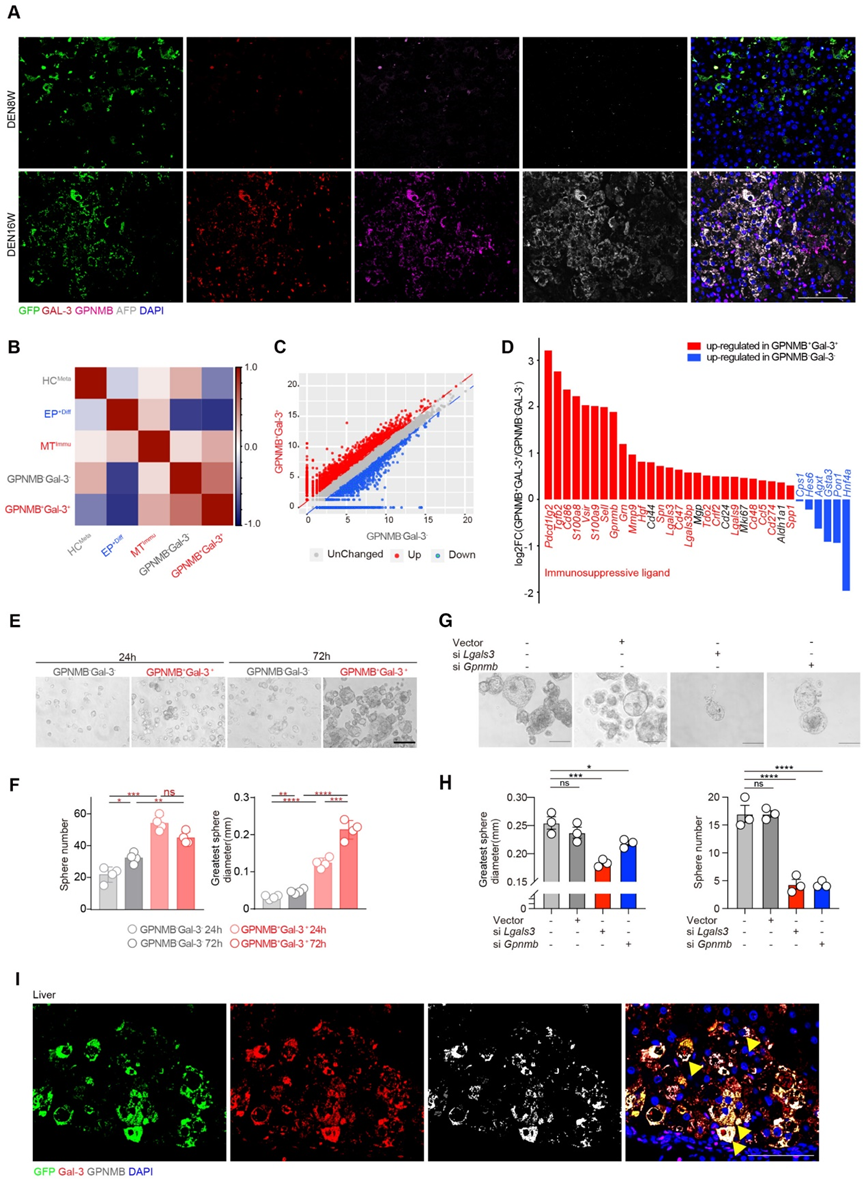
為了研究將 EPCAM+ 細胞注射到肝臟中的效率及其隨后的命運,我們檢查了注射后 2 周時肝臟中重新填充的 GFP 標記細胞的數量。我們通過尾靜脈注射 1 × 108 GFP 標記的 EPCAM+ 細胞 3 次。流式細胞術顯示,獲得的1.6×1010個細胞中,有5.26%(即8.4 × 108 個細胞)源自注射的 GFP 標記細胞,表明注射的 EPCAM+ 細胞在肝臟中駐留和擴增。為了研究注射的 EPCAM+ 細胞的細胞命運,我們檢測了注射的 GFP 標記細胞轉化為惡性和 MTImmu 群體的可能性。隨后,我們在 DEN 治療后 8 周和 16 周的時間點追蹤了受體大鼠中 GFP 標記的 EPCAM+ 細胞。支持我們的假設的是,在 DEN 治療后 16 周時,發現 Gal-3+ GPNMB+ (MTImmu) 和 AFP+(惡性腫瘤)細胞分別占 GFP 陽性細胞的 28.7% 和 14.2%。與這些結果一致,免疫熒光染色證實了受體大鼠腫瘤中 GFP 與 Gal-3、GPNMB 和 AFP 的共染色(圖 4A)。總之,這些數據證實了 EPCAM+ 細胞惡性轉化為 GPNMB+ Gal-3+ MTImmu 細胞的可能性。
為了用 MTImmu 表明 GPNMB+ Gal-3+ 細胞的身份,我們對 GPNMB+ Gal-3+ 和 GPNMB Gal-3 細胞進行了轉錄組測序。在 GPNMB+ Gal-3+ 細胞和 MTImmu 細胞的轉錄組之間發現了很強的相關性,表明它們具有重疊的身份(圖 4B)。為了表征 MTImmu 細胞的分子特征和功能,我們篩選了 1,851 個在 GPNMB+ Gal-3+ 與 GPNMB Gal-3 細胞中上調的基因(圖 4C)。這 1,851 個基因在免疫調節相關基因集中顯著富集。一致地,免疫抑制配體和細胞干性相關基因在 GPNMB+ Gal-3+ 細胞中高表達,而 HCMeta 特征基因在 GPNMB Gal-3 細胞中高表達(圖 4D)。總之,這些結果表明 GPNMB+ Gal-3+ 細胞最有可能是 MTImmu 細胞。
為了測試 MTImmu 亞群的干性,我們進行了球體形成測定,發現 GPNMB+ Gal-3+ 細胞在 24 小時和 72 小時時表現出比 GPNMB Gal-3 組更高的自我更新能力(圖 4E 和 F)。為了驗證 GPNMB 和 Gal-3 對干性的作用,我們敲低 GPNMB 或 Gal-3 并進行球體形成實驗,以評估 GPNMB+ Gal-3+ 細胞 1 周后的自我更新能力。 EPCAM+細胞中Gal-3和GPNMB的敲低顯著降低了它們的球體形成效率(圖4G和H)。免疫熒光 (IF) 染色證實了 DEN 治療后 16 周時 GFP 與 Gal-3 和 GPNMB 在大鼠腫瘤中的共定位(圖 4I)。此外,我們在EPCAM+細胞注射組中觀察到肺和結腸轉移的形成,并通過HE染色進一步證實。與 16 周 DEN 誘導大鼠的腫瘤一致,IF 染色在肺和結腸轉移中顯示出 GFP 與 Gal3 和 GPNMB 共定位的強烈信號。總之,這些數據表明 GPNMB+ Gal-3+ MTImmu 細胞在 HCC 原發性和轉移性微環境中均具有干性特征。
5、GPNMB+ Gal-3+ MTImmu 細胞抑制 CD8+ T 細胞抗腫瘤免疫
耗竭的 T (Tex) 和調節性 T (Treg) 細胞參與免疫抑制和腫瘤進展的事實已得到充分證實。我們根據 scRNA-seq 數據中標記基因的差異表達,將來自不同時間點大鼠的 T 細胞分為六個不同的亞群:自然殺傷 T (NKT)、Tex、終末分化效應記憶 T細胞 (TEMRA)、naive T 細胞、細胞毒性 T 細胞 (CTL) 和 Treg。為了驗證 GPNMB+ Gal-3+ 細胞的免疫抑制活性,我們通過細胞-細胞相互作用分析破譯了 HCMeta、EP+Diff、MTImmu 和 T 細胞亞群之間的配體-受體 (L-R) 相互作用。正如預期的那樣,T 細胞(尤其是 Tex 和 Treg)與 MTImmu 細胞的相互作用次數比與 HCMeta 和 EP+Diff 細胞的相互作用更頻繁(圖 5B)。在MTImmu和Tex之間的強相互作用中,存在多個免疫抑制配體-受體對,例如Cd274-Pdcd1、Grn-Tnfrsf1b、Bag6-Ncr3和Cd112-Tigit(圖5C)。同時,在MTImmu和Treg之間發現了多對相互作用,包括Ccl5-Ccr5、CD274-Pdcd1、Icam1-Itgal和Crlf2-Tslpr。
同樣,我們還從 HCC 患者的 scRNA-seq 數據中提取了 T 細胞,并將其分為七個亞群:NKT、Tex、記憶 T 細胞 (Mem T)、naive T、細胞毒性 T 細胞 (CTL)、黏膜相關恒定T細胞(MAIT)和Treg(圖5D)。有趣的是,絕大多數T細胞被捕獲在鄰近的腫瘤組織(AT)中,而浸潤到腫瘤組織(T)的總T細胞明顯減少。此外,NKT、Cyto T、MAIT 和 Mem T 細胞幾乎只存在于鄰近腫瘤組織(AT)中,而腫瘤組織(T)中的大多數 T 細胞是 Tex、Na?ve T 和 Treg(圖 5D)。 L-R相互作用分析表明T細胞與MTImmu細胞形成緊密的聯系(圖5E)。一組與免疫抑制相關的 L-R 對在 MTImmu 和 Tex 之間表現出較高水平,例如 TNFSF9-TNFRSF9、LGALS9-CD44、LGALS9-HAVCR2 和 PRR3-TIGHT(圖 5F)。同樣,免疫抑制相關的 L-R 對,包括 SPP1-CD44、SIRPG-CD47 和 LGALS9-CD44,在 MTImmu 和 Treg 之間顯著富集。這些結果表明MTImmu細胞可能通過直接與T細胞相互作用發揮免疫抑制功能。
為了驗證 MTImmu 細胞對 T 細胞的潛在免疫抑制作用,我們使用分選的 GPNMB+ Gal-3+ 細胞和大鼠血源性 CD45+ CD3+ T 細胞進行共培養實驗,并評估 CD8+ T 細胞產生效應細胞因子的情況(圖5G,左)。流式細胞術分析顯示,與 GPNMB+ Gal-3+ 細胞共培養后,血液中 CD8+ IFNc+ (21.2%) 和 CD8+ GZMB+ (45.3%) T 細胞的比例分別急劇下降至 10.9 和 21.1%(圖5G 和 H)。相反,當與 GPNMB Gal-3 細胞共培養時,T 細胞的比例沒有顯著改變(18.8% 和 33.3%)(圖 5G 和 H)。一致地,IF染色證實了腫瘤組織中GPNMB+ Gal-3+ MTImmu和PD1+ T細胞之間的共定位(圖5I)。總之,這些結果表明 MTImmu 在肝癌發生過程中具有免疫抑制能力。
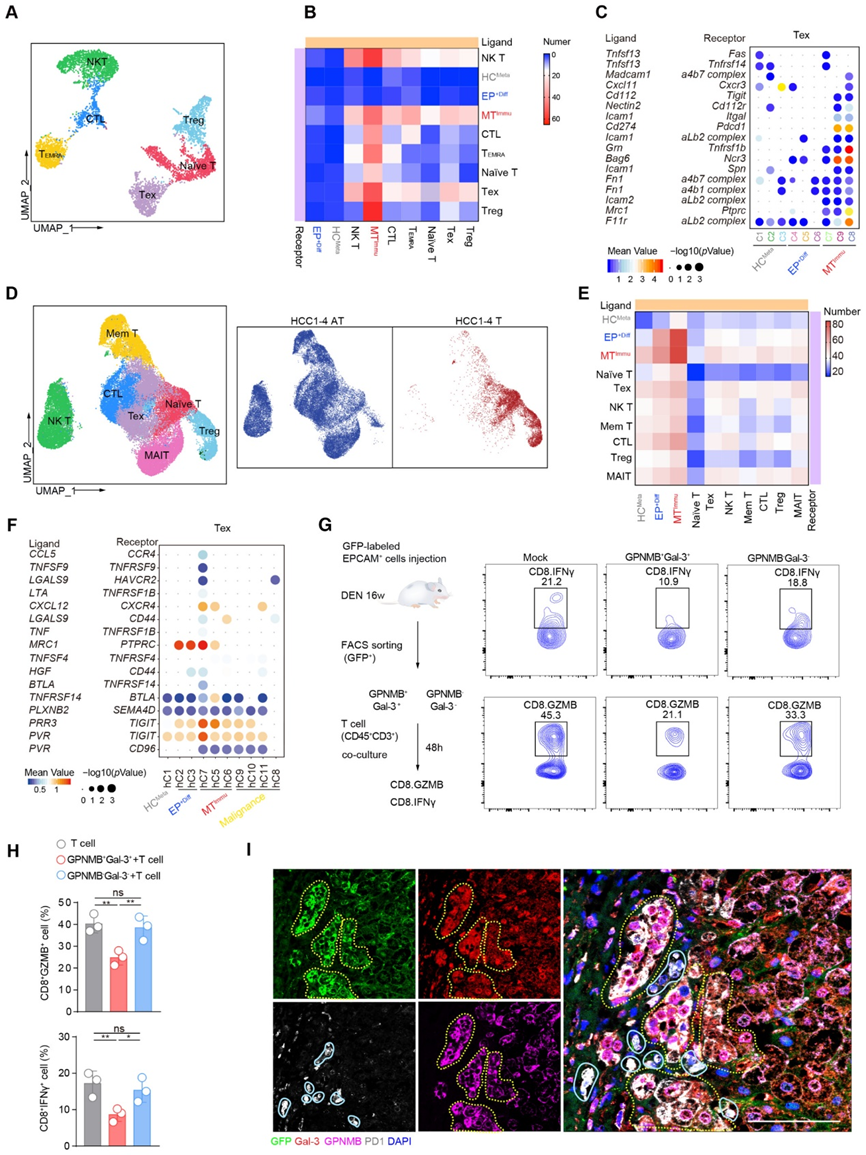
6、SOX18在GPNMB+Gal-3+MTimu細胞惡性轉化和免疫抑制能力中的作用
為了進一步探討轉錄因子在GPNMB+Gal-3+MTImu細胞惡性轉化過程中的動態變化,我們在大鼠和患者中進行了單細胞調控網絡推理和聚類(SCENIC)分析。根據對HCMeta、EP+diff和MTImu的TF活性的比較,我們在大鼠和肝細胞癌患者中確定了MTImu特異性的TF網絡,包括Jun、Egr1和MYC,它們已被證明與免疫抑制活性有關(圖6A和圖B)。重要的是,這項分析還發現了三個新的調節基因HDAC2、SOX18和TEAD2,在大鼠和肝細胞癌患者的MTImu中顯示出更高的調節活性(圖6A和B)。接下來,我們對MTImu亞群中SOX18和TEAD2的活性進行了評分,并觀察到大鼠肝細胞癌模型中的MTImu與肝細胞癌患者的MTImu之間具有高度一致性(圖6C)。
為了驗證這些因子在MTImu相關干性中的調節作用,我們使用siRNA敲擊法耗盡每個TF,并進行球體形成實驗來評估GPNMB+Gal-3+MTImu細胞的球體大小和形成效率。Sox18、YAP和HDAC2的耗盡顯著降低了球體的形成效率(圖6D和E)。此外,Lgals3在Sox18和Tead2被擊倒后下調,而GPNMB在HDAC2和Sox18被擊倒后下調。為了驗證SOX18在免疫抑制中的作用,我們在GPNMB+Gal-3+細胞中進行了SOX18基因敲除和挽救實驗,并將其與血源性CD45+CD3+T細胞共同培養。事實上,與SOX18基因敲除的GPNMB+Gal-3+共培養顯著增加了CD8+GZMB+T細胞的百分比(6.22vs.。13.7%),而耗竭CD8+PD-1+T細胞比例(9.24%比6.41%)降低。值得注意的是,在GPNMB+Gal-3+細胞中重新引入SOX18顯著降低了CD8+GZMB+T細胞的比例至9.13%,并有效地將耗盡的CD8+PD-1+T細胞恢復到15.6%(圖6F和G)。綜上所述,這些結果再次證實了SOX18在GPNMB+Gal-3+細胞的干性和免疫抑制中的重要作用。
為了進一步評估 Sox18 在 EPCAM+ 細胞惡性轉化中的作用,我們將大約 1 × 10 8 EPCAM+ 細胞(WT 或通過慢病毒敲低 SOX18)注射到 DEN 治療的雄性大鼠中(圖 6H 和 I)。 DEN 治療后 16 周時,SOX18 敲低組的腫瘤形成發生率和腫瘤大小均較 WT 組顯著減小(圖 6H 和 I)。在腫瘤中 GFP+ 標記的細胞中觀察到 SOX18 與 Gal-3 和 GPNMB 的共染色(圖 6J)。此外,Gal-3和帶有GFP+標記的細胞的GPNMB在SOX18敲低樣品中處于較低水平(圖6J)。此外,我們在 DEN 治療后 8 周或 12 周至 16 周期間通過 Sm4(一種已知的 SOX18 小分子抑制劑)抑制 SOX18。值得注意的是,為了評估 SOX18 對腫瘤發生和進展的作用,我們獲得了 DEN 暴露后 12 周和 16 周的肝組織。我們發現從第 8 周開始接受 Sm4 治療的大鼠的癌前病變明顯少于模擬組,在 DEN 治療后第 12 周,模擬組顯示出幾個小的、白色的囊腫樣病變,這表明 SOX18 的抑制顯著抑制了癌前病變的發生。 HCC。從 12 周開始接受 Sm4 治療的大鼠并未出現與模擬組一樣嚴重的腫瘤,這表明 SOX18 的抑制顯著抑制了 HCC 進展。此外,在暴露于 DEN 16 周后的大鼠中,從 8 周開始抑制 SOX18 顯著減弱了內源性 EPCAM+ 細胞的擴增及其與 Gal-3、GPNMB 和 AFP 的共染色。從第 12 周開始抑制 SOX18 并沒有顯著抑制內源性 EPCAM+ 細胞的擴增,但在 16 周后暴露于 DEN 的大鼠中顯著降低了 EPCAM+ 細胞與 Gal-3、GPNMB 和 AFP 的共表達。結果驗證了SOX18在腫瘤發生和進展以及EPCAM+細胞轉化過程中的重要作用。
隨后的綜合分析結合了 MTImmu 中上調的 1,400 個基因和 SOX18 的 1,746 個靶基因,確定了 353 個重疊基因。免疫抑制相關基因,包括 Ccl5、S100a9、Gpnmb、Cd274、Lgals3 和 Mgp在 MTImmu 中明顯增加。實時定量聚合酶鏈反應 (ChIP-qPCR) 測定表明 SOX18 有效結合 Cd274、S100a9 和 Cxcl2 的啟動子區域。此外,缺乏 SOX18 時這些基因的表達顯著降低。這些結果表明,SOX18是GPNMB+ Gal-3+ MTImmu亞群在惡性轉化過程中獲得免疫抑制能力所必需的。
7、SOX18、GPNMB和Gal-3的高表達與肝癌惡性程度的關系
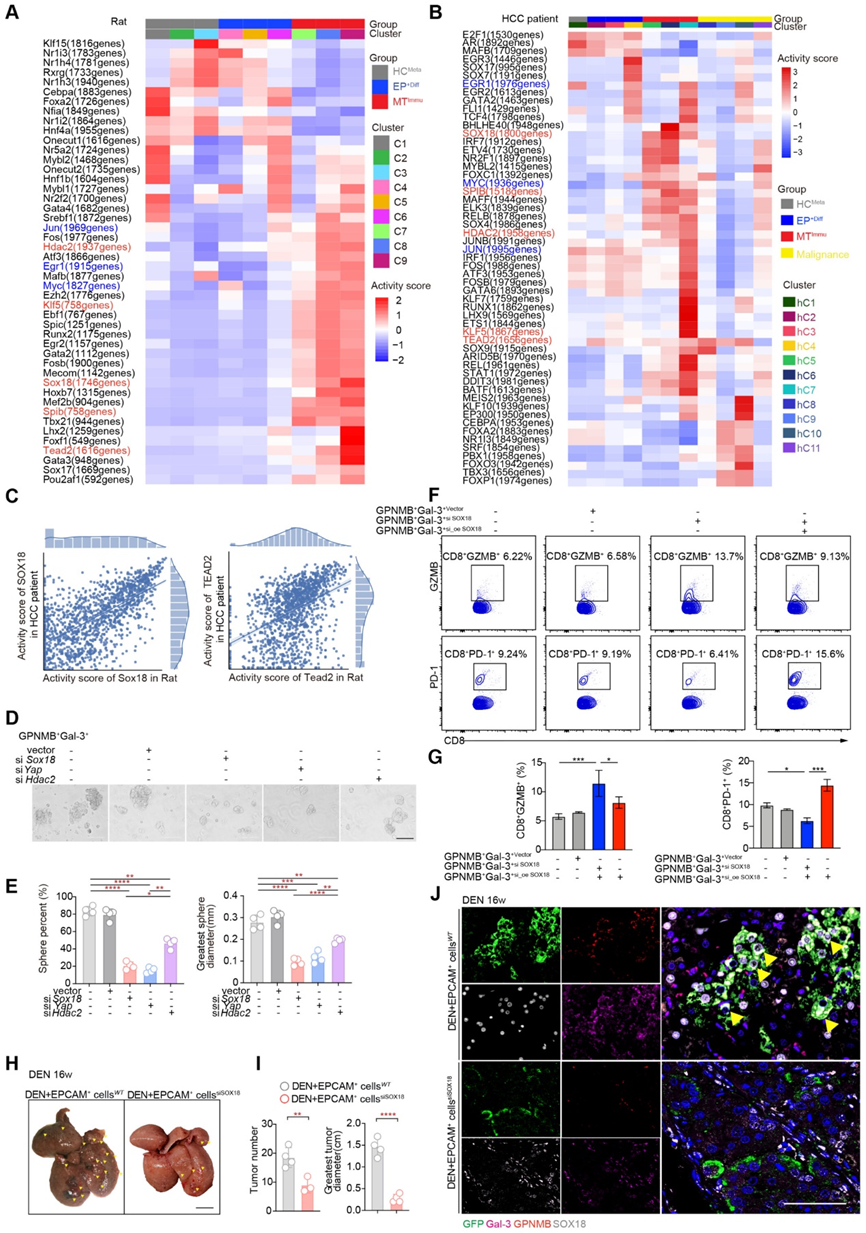
為了評估 SOX18、GPNMB 和 Gal-3 在 HCC 中的臨床相關性,我們首先使用癌癥基因組圖譜 (TCGA) 的 HCC 數據集分析了 SOX18、GPNMB 和 LGALS3 (Gal3) 的表達。與鄰近腫瘤組織(n = 160,圖 7A)相比,HCC 患者(n = 369)腫瘤中 SOX18、GPNMB 和 LGALS3 的 mRNA 水平均顯著增加。此外,GPNMB和LGALS3之間觀察到強烈的正相關性(R2 = 0.11,P = 0.043),以及GPNMB和SOX18表達之間(R2 = 0.2,P < 0.0001)(圖7B)。
為了進一步驗證 SOX18、GPNMB 和 Gal-3 (LGALS3) 的預后價值,我們對 157 例具有長期臨床隨訪記錄的 HCC 病例的組織微陣列進行了這些蛋白的 IF 染色。值得注意的是,在鄰近腫瘤組織 (AT) 中觀察到 GPNMB、Gal-3 的表達升高以及與 SOX18 的共染色模式(圖 7C)。同時,在腫瘤(T)中也觀察到高蛋白水平的 GPNMB、Gal-3 以及與 SOX18 的共染色模式(圖 7D)。 GPNMB和Gal-3的表達與HCC患者的高復發率相關(P = 0.02)(圖7E)。此外,GPNMB和Gal-3水平高的HCC患者生存時間較短,而GPNMB和Gal-3水平低的HCC患者生存時間較長(圖7F)。總的來說,這些結果表明 GPNMB 和 Gal-3 上調與 HCC 復發和不良預后存在病理關聯。
實驗方法:
scRNA-seq、SCENIC分析、RNA速率分析、RT-PCR、ChIP-qPCR、慢病毒敲除。
參考文獻:
Meng Y, Zhao Q, Sang Y, et al. GPNMB+ Gal-3+ hepatic parenchymal cells promote immunosuppression and hepatocellular carcinogenesis. EMBO J. Published online November 27, 2023.






