m7G修飾摘要分享
m7G是tRNA和mRNA 5‘帽子的經典修飾,而最近的研究表明在mRNA內部也存在m7G修飾。METTL1-WDR4復合體是可將m7G加到tRNA和一部分mRNA內部。目前已有基于抗體和化學方法的m7G檢測技術(m7G-MeRIP-Seq和m7G miCLIP-Seq)。得益于這些技術,mRNA內部的m7G被認為與翻譯相關。但是,考慮到m7G在tRNA上的富集,今后的研究還需更謹慎的區別m7G在不同RNA上的功能。
最新相關文章摘要:
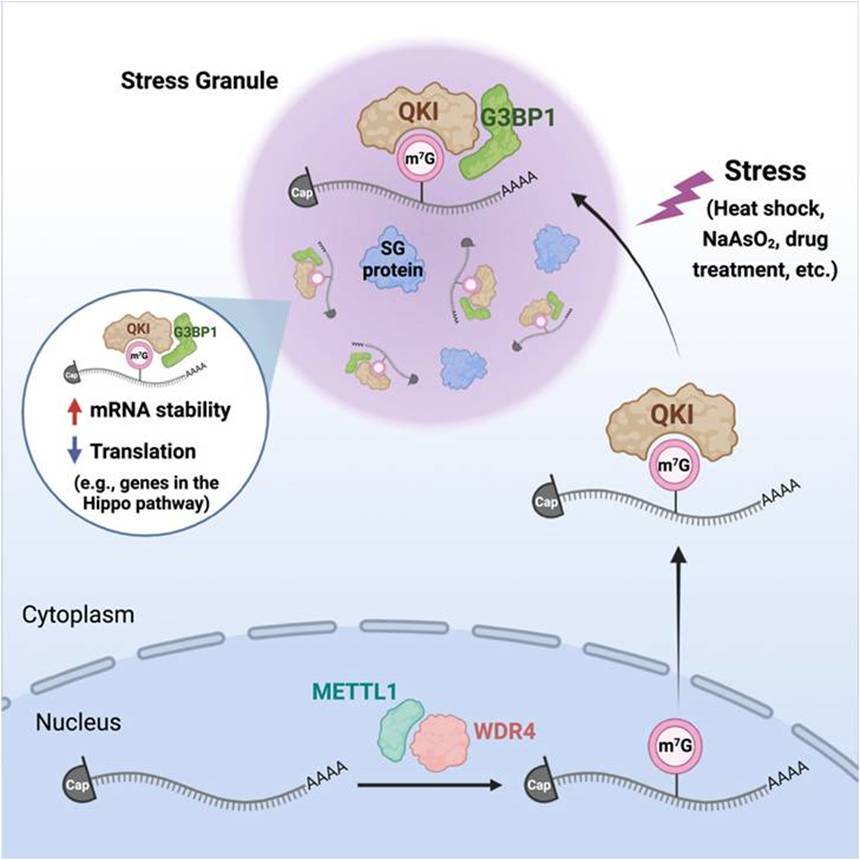
1. QKI shuttles internal m7G-modified transcripts into stress granules and modulates mRNA metabolism
《Cell》 IF = 64.5 2023.06
N7-甲基鳥苷(m7G)修飾通常發生在mRNA 5 ‘cap 或tRNA / RNAs中,也存在于信使RNA (mRNA)內部。盡管m7G-cap對mRNA前加工和蛋白質合成至關重要,但mRNA內部m7G修飾的確切作用尚不清楚。本研究報道了m7G內部的mRNA被Quaking protein (QKIs)選擇性識別。通過轉錄組分析/繪制內部m7G甲基組和QKI結合位點,確定了1000多個具有保守的“GANGAN (N = A/C/U/G)”基序的高置信度m7G修飾和QKI結合的mRNA靶標。引人注目的是,QKI7(通過C端)與應激顆粒(SG)核心蛋白G3BP1相互作用,并將內部m7G修飾的轉錄物轉運到SGs中,以調節mRNA在應激條件下的穩定性和翻譯。具體來說,QKI7降低了Hippo信號通路中必需基因的翻譯效率,從而使癌細胞對化療敏感。總的來說,將QKIs描述為mRNA內部m7G結合蛋白,可調節靶mRNA代謝和細胞耐藥性。
2. METTL1 promotes tumorigenesis through tRNA-derived fragment biogenesis in prostate cancer
《Mol Cancer》 IF = 37.3 2023.06
越來越多的新證據強調了表轉錄組標記在許多癌癥的發展中發揮的重要作用;然而,對改變的表轉錄組沉積在前列腺癌中的作用和意義知之甚少。在這里,我們發現轉移RNA N7 -甲基鳥苷(m7G)轉移酶METTL1在原發性和晚期前列腺腫瘤中高度表達。在機制上,我們發現METTL1的缺失導致m7G tRNA甲基化的缺失,并促進了一類來自5‘tRNA片段的新型小非編碼rna的生物發生。5’ tRNA衍生的小RNA引導翻譯控制,有利于腫瘤生長抑制、干擾素途徑和免疫效應器的關鍵調節因子的合成。在前列腺癌臨床前模型中,METTL1的敲低增加了促炎免疫細胞在腫瘤內的浸潤,增強了對免疫治療的反應。總的來說,本研究結果揭示了METTL1導向的m7G tRNA甲基化在癌細胞翻譯控制和腫瘤生物學中的治療作用。
3. Structural basis of regulated m7G tRNA modification by METTL1-WDR4
《Nature》 IF = 64.8 2023.01
RNA的化學修飾在許多生物過程中起著關鍵作用。N7-甲基鳥苷(m7G)是tRNAs4-7大亞群完整性和穩定性所必需的。甲基轉移酶1-WD重復包含蛋白4 (METTL1-WDR4)復合物是修飾某些tRNA可變環中的G46的甲基轉移酶,其失調驅動許多癌癥類型的腫瘤發生。WDR4突變導致包括小頭畸形在內的人類發育表型。METTL1-WDR4如何修飾tRNA底物并調控仍不清楚。在這里,我們通過對人METTL1-WDR4的結構、生化和細胞研究表明,WDR4作為METTL1和tRNA T-arm的支架,在tRNA結合后,METTL1的αC區轉化成一個螺旋,與α6螺旋一起固定tRNA可變環的兩端。出乎意料的是,我們發現METTL1的無序N端區域是催化口袋的一部分,對甲基轉移酶活性至關重要。此外,我們發現METTL1 N端區域的S27磷酸化通過局部破壞催化中心來抑制甲基轉移酶的活性。我們的研究結果提供了tRNA底物識別和磷酸化介導的METTL1- WDR4調控的分子理解,并揭示了METTL1紊亂的N端區域與甲基轉移酶活性的關系。
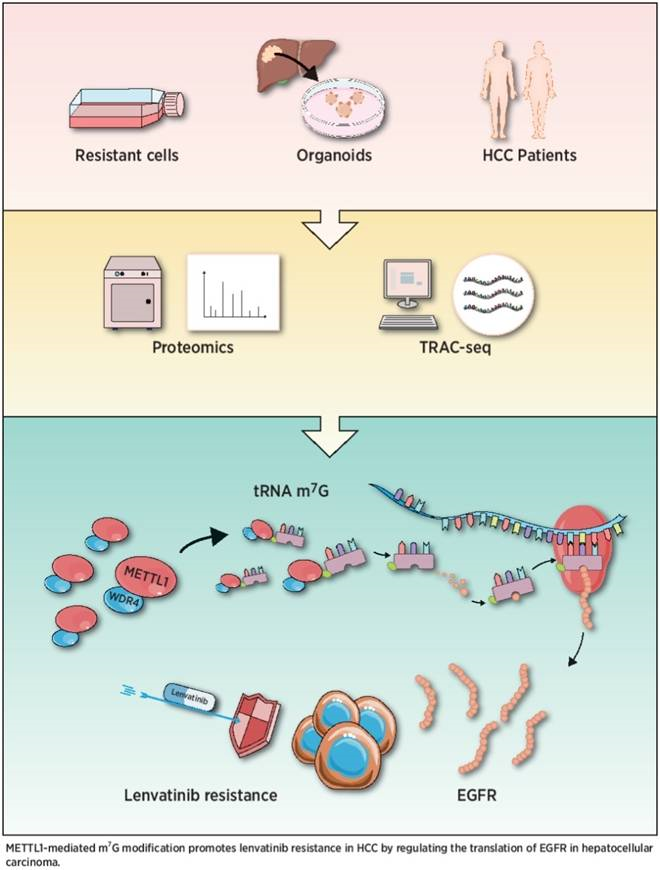
4. METTL1-Mediated m7G tRNA Modification Promotes Lenvatinib Resistance in Hepatocellular Carcinoma
《Cancer Research》 IF = 11.2 2023.01
酪氨酸激酶抑制劑lenvatinib是治療晚期肝細胞癌(HCC)的一線藥物。然而,其療效受到耐藥性的嚴重阻礙。深入了解lenvatinib耐藥的分子機制可以為改善和延長反應提供新的策略。在這里,作者對親本和lenvatinib耐藥的HCC細胞進行了蛋白質組學篩選,發現tRNA N7-甲基鳥苷(m7G)甲基轉移酶復合物的兩個關鍵成分甲基轉移酶樣蛋白-1 (METTL1)和WD重復結構域4蛋白(WDR4)在lenvatinib耐藥細胞中顯著上調。敲低METTL1通過降低lenvatinib作用下肝癌細胞的增殖能力和促進細胞凋亡來克服耐藥性。此外,過表達野生型METTTL1但不表達其催化死亡突變體誘導lenvatinib抗性。動物實驗包括水動力注射、皮下植入和原位異種移植小鼠模型,進一步證明了METTL1/WDR4介導的m7G tRNA修飾在體內促進lenvatinib耐藥中的關鍵作用。從機制上講,METTL1促進EGFR通路基因的翻譯,從而引發耐藥性。本研究揭示了METTL1介導的m7G tRNA修飾在促進lenvatinib耐藥中的重要作用,為耐藥提供了有希望的預測標記和干預靶點。
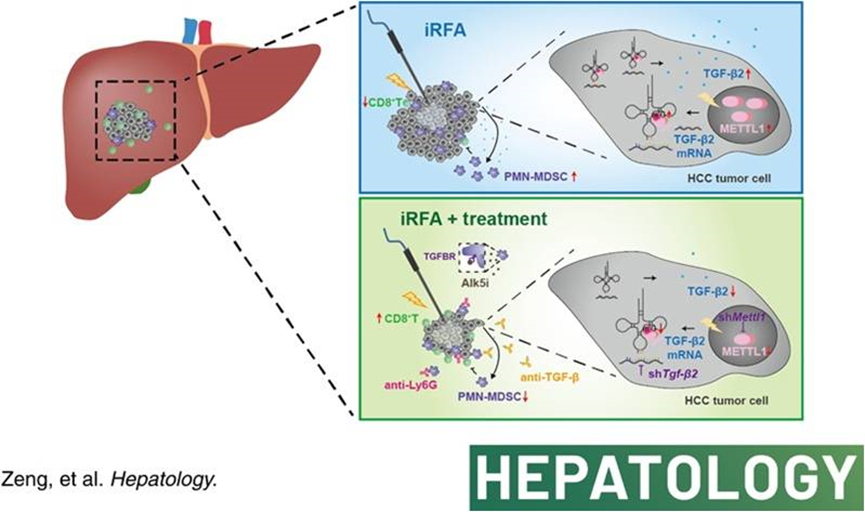
5. Eliminating METTL1-mediated accumulation of PMN-MDSCs prevents hepatocellular carcinoma recurrence after radiofrequency ablation
《Hepatology》 IF = 13.5 2023.04
背景及目的:
射頻消融術(RFA)是肝細胞癌(HCC)的一種重要治療方法,但其復發率仍然與所有其他HCC治療方式一樣高。甲基轉移酶1 (METTL1)是一種用于m7G tRNA修飾的酶,據報道可促進HCC的發展。在這里,作者評估了METTL1在RFA (iRFA)不足后形成免疫抑制腫瘤微環境中的作用。
方法與結果:
通過免疫組織化學和多重免疫熒光(mIF)染色,我們發現METTL1表達在RFA后復發的HCC中增強,同時伴有CD11b+CD15+多形核-髓源性抑制細胞(PMN-MDSCs)的增加和CD8+ T細胞的減少。在機制上,熱介導的METTL1上調通過誘導髓源性抑制細胞增強TGF-β2的翻譯形成免疫抑制環境。肝臟特異性過表達或敲低METTL1顯著影響PMN-MDSCs的積累,并隨后影響CD8+ T細胞的浸潤。完整RFA成功地消除了腫瘤,而與假手術相比,iRFA處理的小鼠表現出腫瘤生長和轉移增強,PMN-MDSC積累增加,CD8+ T細胞減少。通過抗Ly6G抗體阻斷METTL1-TGF-β2-PMN-MDSC軸,或敲低肝癌固有的METTL1或Tgfb2,或TGF-β信號阻斷可顯著緩解iRFA誘導的腫瘤進展,恢復CD8+ T細胞群。
結論:
我們的研究揭示了METTL1在調節免疫抑制微環境中的關鍵作用,并證明阻斷METTL1-TGF-β2-PMN-MDSC軸可能是一種恢復抗腫瘤免疫和預防RFA治療后HCC復發的治療策略,值得進一步的臨床研究。
參考文獻:
Zhao Z, Qing Y, Dong L, Han L, Wu D, Li Y, Li W, Xue J, Zhou K, Sun M, Tan B, Chen Z, Shen C, Gao L, Small A, Wang K, Leung K, Zhang Z, Qin X, Deng X, Xia Q, Su R, Chen J. QKI shuttles internal m7G-modified transcripts into stress granules and modulates mRNA metabolism. Cell. 2023 Jul 20;186(15):3208-3226.e27. doi: 10.1016/j.cell.2023.05.047. Epub 2023 Jun 27. PMID: 37379838; PMCID: PMC10527483.
García-Vílchez R, A?azco-Guenkova AM, Dietmann S, López J, Morón-Calvente V, D'Ambrosi S, Nombela P, Zamacola K, Mendizabal I, García-Longarte S, Zabala-Letona A, Astobiza I, Fernández S, Paniagua A, Miguel-López B, Marchand V, Alonso-López D, Merkel A, García-Tu?ón I, Ugalde-Olano A, Loizaga-Iriarte A, Lacasa-Viscasillas I, Unda M, Azkargorta M, Elortza F, Bárcena L, Gonzalez-Lopez M, Aransay AM, Di Domenico T, Sánchez-Martín MA, De Las Rivas J, Guil S, Motorin Y, Helm M, Pandolfi PP, Carracedo A, Blanco S. METTL1 promotes tumorigenesis through tRNA-derived fragment biogenesis in prostate cancer. Mol Cancer. 2023 Jul 29;22(1):119. doi: 10.1186/s12943-023-01809-8. PMID: 37516825; PMCID: PMC10386714.
Li J, Wang L, Hahn Q, Nowak RP, Viennet T, Orellana EA, Roy Burman SS, Yue H, Hunkeler M, Fontana P, Wu H, Arthanari H, Fischer ES, Gregory RI. Structural basis of regulated m7G tRNA modification by METTL1-WDR4. Nature. 2023 Jan;613(7943):391-397. doi: 10.1038/s41586-022-05566-4. Epub 2023 Jan 4. PMID: 36599985.
Huang M, Long J, Yao Z, Zhao Y, Zhao Y, Liao J, Lei K, Xiao H, Dai Z, Peng S, Lin S, Xu L, Kuang M. METTL1-Mediated m7G tRNA Modification Promotes Lenvatinib Resistance in Hepatocellular Carcinoma. Cancer Res. 2023 Jan 4;83(1):89-102. doi: 10.1158/0008-5472.CAN-22-0963. PMID: 36102722.
Zeng X, Liao G, Li S, Liu H, Zhao X, Li S, Lei K, Zhu S, Chen Z, Zhao Y, Ren X, Su T, Cheng AS, Peng S, Lin S, Wang J, Chen S, Kuang M. Eliminating METTL1-mediated accumulation of PMN-MDSCs prevents hepatocellular carcinoma recurrence after radiofrequency ablation. Hepatology. 2023 Apr 1;77(4):1122-1138. doi: 10.1002/hep.32585. Epub 2022 Jul 8. PMID: 35598182.






