MAF擴(kuò)增通過表觀遺傳重塑許可ERα驅(qū)動乳腺癌轉(zhuǎn)移
MAF擴(kuò)增增加乳腺癌(BCa)轉(zhuǎn)移的風(fēng)險,其機(jī)制尚不清楚,但具有重要的臨床意義。雌激素受體陽性(ER+) BCa的生長和轉(zhuǎn)移都需要雌激素,盡管其機(jī)制尚不清楚。在這里,作者整合了蛋白質(zhì)組學(xué)、轉(zhuǎn)錄組學(xué)、表觀基因組學(xué)、染色質(zhì)可及性和人類和同基因小鼠BCa模型的功能分析,表明MAF直接與雌激素受體α (ERα)相互作用,從而促進(jìn)了一種獨特的染色質(zhì)景觀,有利于轉(zhuǎn)移擴(kuò)散。作者確定了在雌激素暴露后以MAF依賴方式重新許可的促進(jìn)轉(zhuǎn)移的基因。組蛋白去甲基化酶KDM1A是表觀基因組重塑的關(guān)鍵,它促進(jìn)了促轉(zhuǎn)移性MAF/雌激素驅(qū)動基因表達(dá)程序的表達(dá),而KDM1A活性的喪失阻止了這種轉(zhuǎn)移。因此,作者已經(jīng)確定MAF/雌激素介導(dǎo)的轉(zhuǎn)移的分子基礎(chǔ)需要來自全身環(huán)境的遺傳、表觀遺傳和激素信號,這些信號影響BCa細(xì)胞轉(zhuǎn)移的能力。本文于2023年11月發(fā)表于《Nature Cell Biology》, IF: 21.3,Q1。
技術(shù)路線:

主要實驗結(jié)果:
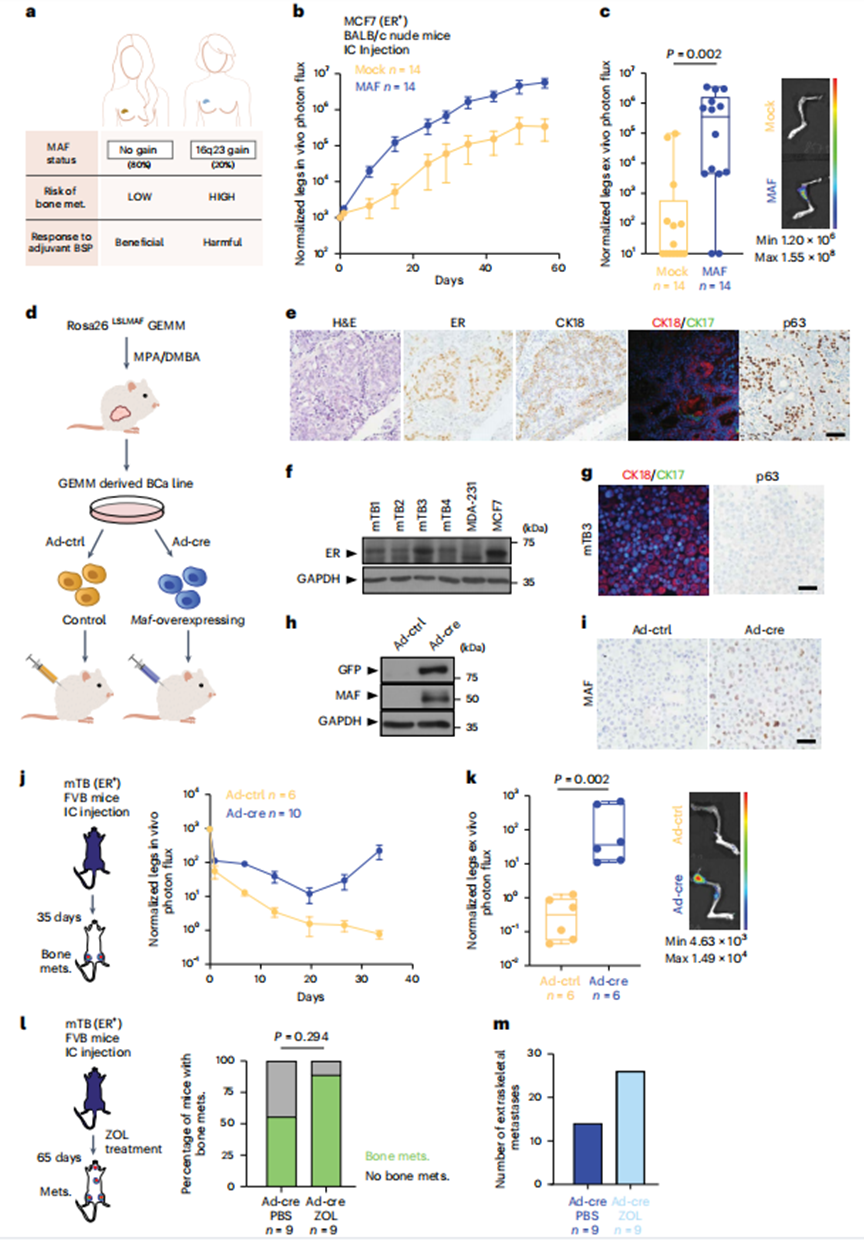
1、MAF過表達(dá)促進(jìn)ER+BCa細(xì)胞骨轉(zhuǎn)移
為了分析MAF在ER+BCa中的作用,作者首先分析了ER+BoM2 BCa細(xì)胞,這些細(xì)胞是從親本ER+MCF7 BCa細(xì)胞群中選擇的小鼠骨趨向性細(xì)胞,因為它們在體內(nèi)驅(qū)動轉(zhuǎn)移的能力。值得注意的是,MCF7細(xì)胞可能有局限性,但與其他腔內(nèi)BCa細(xì)胞(如T47D和ZR-75)相比,不存在內(nèi)質(zhì)網(wǎng)和雄激素受體活性之間的混淆相互作用。在體內(nèi),MAF過表達(dá)足以顯著增加MCF7細(xì)胞接種于胸腺裸鼠左心室時的骨轉(zhuǎn)移率,而在其他部位無轉(zhuǎn)移差異(圖1b、c)。體內(nèi)腫瘤生長需要補(bǔ)充雌激素。接下來,作者測試了MAF過表達(dá)是否以E2依賴的方式增強(qiáng)體外細(xì)胞增殖。與模擬E2處理的細(xì)胞或激素剝奪(HD)對照相比,MAF陽性細(xì)胞中E2刺激的細(xì)胞增殖增強(qiáng),表明MAF表達(dá)與E2之間存在生物學(xué)相互作用。
接下來,作者建立了一個條件Maf過表達(dá)敲入小鼠模型(Rosa26LSLMAF),以:(1)提供一種獨立的方法,(2)排除人BCa細(xì)胞系中獲得性遺傳改變的存在,(3)直接測試MAF表達(dá)增加對E2依賴性BCa轉(zhuǎn)移的影響。為了誘導(dǎo)小鼠BCa腫瘤,作者用醋酸甲孕酮和7,12-二甲基苯并蒽(MPA-DMBA)處理Rosa26LSLMAF小鼠,使用已建立的BCa化學(xué)致癌方案(圖1d,e)。作者在體外擴(kuò)增小鼠腫瘤源性細(xì)胞系(mTB細(xì)胞);值得注意的是,這些保留了內(nèi)質(zhì)網(wǎng)和角蛋白的表達(dá)(圖1f,g)。然后用Ad-Cre顆粒感染誘導(dǎo)Maf(或不誘導(dǎo),作為對照),作者得到了具有相同基因組背景的等基因細(xì)胞系對,無論是否有Maf過表達(dá)(圖1d,h,i)。無論注射部位如何,Maf陽性的mTB細(xì)胞比Maf陰性的對照mTB細(xì)胞產(chǎn)生更多的骨轉(zhuǎn)移(圖1j,k)。最后,作者證實Maf誘導(dǎo)的骨轉(zhuǎn)移對雙磷酸鹽治療是不耐受的,并且骨外轉(zhuǎn)移(肺、肝、腎、卵巢和腦)顯著促進(jìn),如患者所述(圖1l,m)。
總的來說,這些結(jié)果證實了MAF -陽性細(xì)胞在骨定植過程中具有競爭優(yōu)勢,可以被MAF -陰性細(xì)胞所吸收,產(chǎn)生以MAF -陽性克隆為主的異質(zhì)性轉(zhuǎn)移。因此,作者接下來重點闡明(1)E2信號與ER+BCa細(xì)胞中MAF -過表達(dá)之間相互作用的分子機(jī)制,以及(2)這些相互作用如何促進(jìn)骨轉(zhuǎn)移。
 MAF擴(kuò)增驅(qū)動E2/ER信號依賴性BCa轉(zhuǎn)移
MAF擴(kuò)增驅(qū)動E2/ER信號依賴性BCa轉(zhuǎn)移
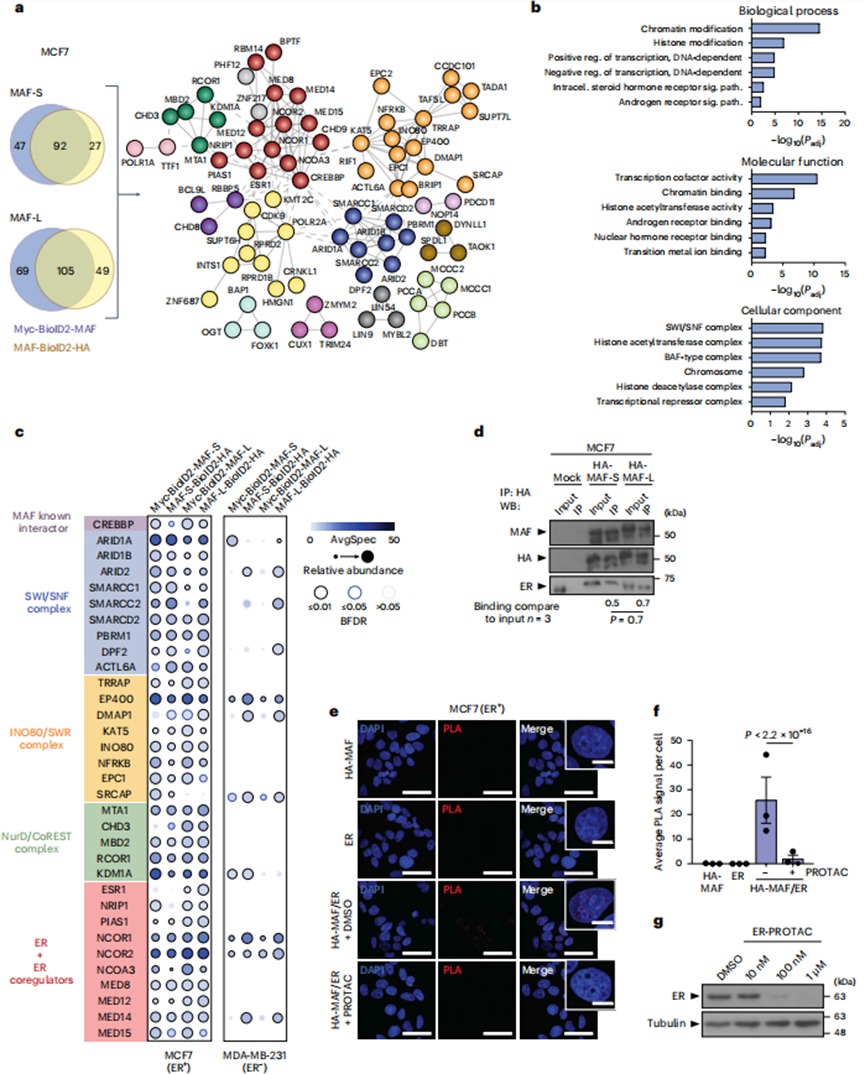
2、MAF、ER和染色質(zhì)因子在ER+BCa細(xì)胞中相互作用
MAF編碼AP1家族轉(zhuǎn)錄因子(TF),其DNA結(jié)合(因此其促轉(zhuǎn)移活性)可能取決于與細(xì)胞環(huán)境特異性表達(dá)的相互作用伙伴。為了以無偏倚的方式鑒定活BCa細(xì)胞中與MAF相互作用的蛋白質(zhì),作者進(jìn)行了鄰近依賴的生物素鑒定(BioID2),可以檢測到微弱和短暫的相互作用。雖然在功能上沒有區(qū)別,但作者同時使用了短(MAF-S)和長(MAF-L)亞型,以避免任何潛在的亞型依賴偏差。每個MAF異構(gòu)體在框架內(nèi)融合到BioID2的N或C端,分別產(chǎn)生MAF-BioID2- HA和myc-BioID2-MAF(圖2a)。從含有BioID2- MAF或(作為對照)BioID2的生物素處理細(xì)胞中提取鏈霉親和素后,通過串聯(lián)質(zhì)譜(nanoLC-MS/MS)鑒定共沉淀蛋白。作者獲得了許多高置信度的交互作用因子(方法):139 N -末端標(biāo)記的MAF-S,119 C -末端標(biāo)記的MAF-S,174 N -末端標(biāo)記的MAF-L,154 C -末端標(biāo)記的MAF-L(圖2a)。然后,作者選擇了92個MAF-S條件共有的相互作用因子,以及105個MAF- L條件共有的相互作用因子,來定義一個126個MAF高置信度相互作用因子的網(wǎng)絡(luò)(其中71個在所有四種條件下都是常見的)。這組126個基因中包括表征良好的MAF相互作用因子CREBBP,并且在已知蛋白質(zhì)-蛋白質(zhì)相互作用的高度互聯(lián)網(wǎng)絡(luò)中被強(qiáng)烈富集(P < 1 × 10?16),表明MAF相互作用因子之間存在生物相關(guān)復(fù)合物(圖2b)。事實上,存在一些主要的染色質(zhì)重塑復(fù)合物,如SWI/SNF、INO80、NurD和CoREST。GO富集分析還確定了影響基因表達(dá)的分子功能,包括激素受體信號家族的成員。值得注意的是,ER本身作為生物學(xué)相關(guān)的MAF相互作用物出現(xiàn)(圖2a-c)。內(nèi)質(zhì)網(wǎng)和其他相互作用因子隨后通過共免疫沉淀(co-IP;圖2d)進(jìn)行驗證。為了確定ER的存在是否會影響MAF的相互作用,使用ER- MDA-MB-231 BCa細(xì)胞進(jìn)行BioID(圖2c)。在這些ER-細(xì)胞中,MAF保留了與SWI/SNF、INO80、NurD和CoREST染色質(zhì)重塑復(fù)合物的某些組分的相互作用,但不與ER和/或關(guān)鍵ER共激活子相互作用(圖2c)。總的來說,這些數(shù)據(jù)表明MAF和特定伙伴之間的相互作用依賴于細(xì)胞類型。
 MAF與內(nèi)質(zhì)網(wǎng)轉(zhuǎn)錄復(fù)合物相互作用
MAF與內(nèi)質(zhì)網(wǎng)轉(zhuǎn)錄復(fù)合物相互作用
3、MAF的N端轉(zhuǎn)激活結(jié)構(gòu)域與ER相互作用
接下來,作者使用HA標(biāo)記的MAF- S和MAF- L在MCF7細(xì)胞中通過co-IP驗證MAF的相互作用(圖2d)。通過近距離連接試驗(PLAs),作者證實了MAF-ER相互作用和共定位,與單一抗體對照相比,HA和ER抗體聯(lián)合在細(xì)胞核中檢測到和量化的熒光信號明顯更高(圖2e,f)。基于在MCF7 ER+BCa細(xì)胞中使用ER特異性PROTAC誘導(dǎo)ER降解,作者證實了MAF-ER相互作用的特異性(圖2e-g)。然后,作者使用PLA通過比較全長MAF- L與缺少部分或全部轉(zhuǎn)錄激活域的截斷版本(分別為ΔN-t 1, aa 85-403和ΔN-t 2, aa 120-403)來研究與ER相互作用的MAF的蛋白質(zhì)結(jié)構(gòu)域。然而,作者不能排除與ER AF1或AF2結(jié)構(gòu)域的相互作用具有不同的作用,如前所述。
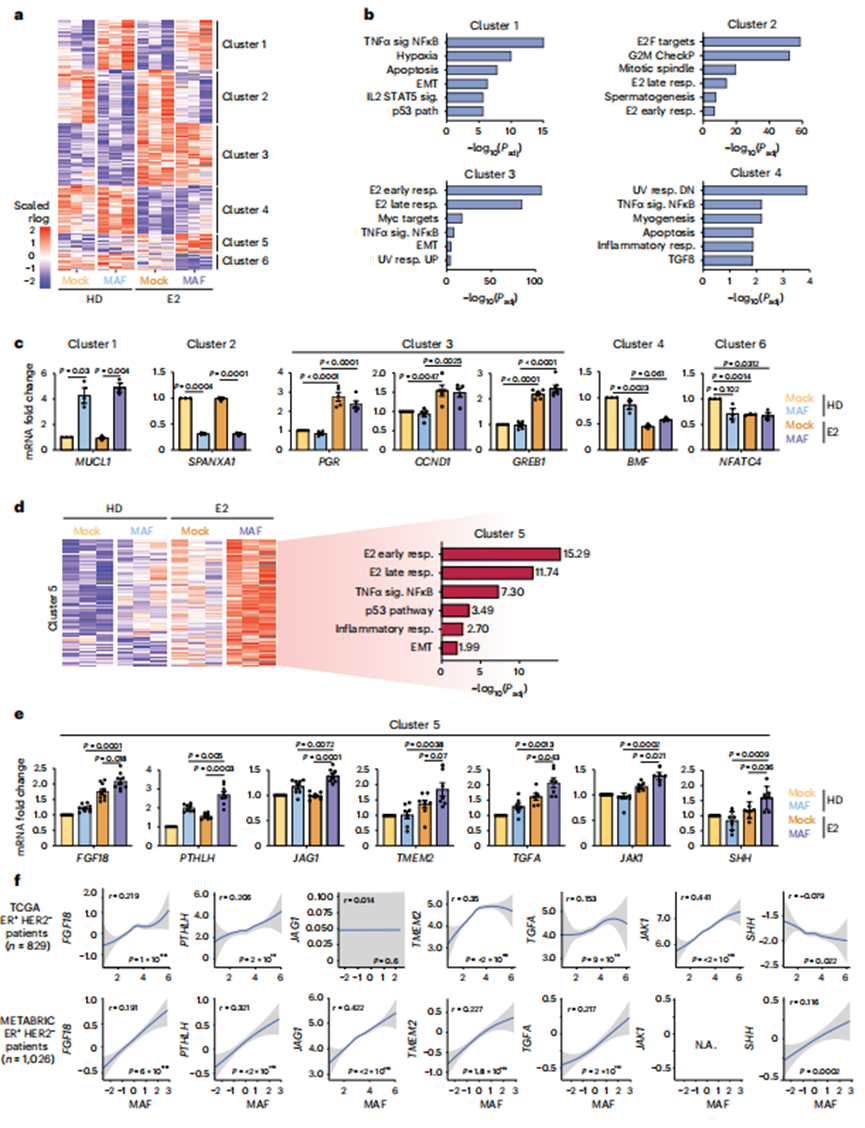
4、MAF-ER相互作用導(dǎo)致轉(zhuǎn)錄重編程
接下來,作者對激素剝奪(HD)或E2處理6小時的MCF7細(xì)胞進(jìn)行RNA測序(RNA-seq)(圖3a,b)。作者確定了轉(zhuǎn)錄變化需要(1)MAF過表達(dá)(簇1和2),(2)E2(簇3和4)和(3)MAF和E2(這里,MAF/E2依賴;簇5和6)(圖3a)。與E2刺激的增殖一致,E2處理與E2早期和晚期基因應(yīng)答(簇3)正相關(guān)(圖3a,b),包括已建立的ER介導(dǎo)的應(yīng)答基因GREB1, CCND1和PGR(圖3c)。值得注意的是,MAF/E2依賴性基因標(biāo)記(簇5)與E2早期和晚期反應(yīng)、炎癥和上皮向間質(zhì)轉(zhuǎn)化(EMT)基因反應(yīng)呈正相關(guān),包括PTHLH、JAG1、FGF18、TMEM2、TGFA、JAK1和SHH;這些基因產(chǎn)物支持轉(zhuǎn)移適應(yīng)能力,尤其是骨(圖3d,e)。重要的是,作者觀察到在ER+BCa患者基因表達(dá)數(shù)據(jù)集中,包括乳腺癌國際分子分類協(xié)會(METABRIC)和癌癥基因組圖譜(TCGA) BCa隊列中,MAF的表達(dá)水平與FGF18、PTHLH、JAG1、TMEM2、TGFA、JAK1和SHH的表達(dá)水平呈正相關(guān)(圖3f)。總的來說,這些數(shù)據(jù)表明MAF過表達(dá)在E2刺激下以ER依賴的方式擴(kuò)大了ER+BCa細(xì)胞的轉(zhuǎn)錄庫。作者提出MAF過表達(dá)支持BCa在增殖和原發(fā)腫瘤生長之外的進(jìn)展,可能是通過直接激活骨微環(huán)境使其更容易接受轉(zhuǎn)移狀態(tài)。
 MAF調(diào)節(jié)E2/ ER誘導(dǎo)的轉(zhuǎn)移轉(zhuǎn)錄基因程序
MAF調(diào)節(jié)E2/ ER誘導(dǎo)的轉(zhuǎn)移轉(zhuǎn)錄基因程序
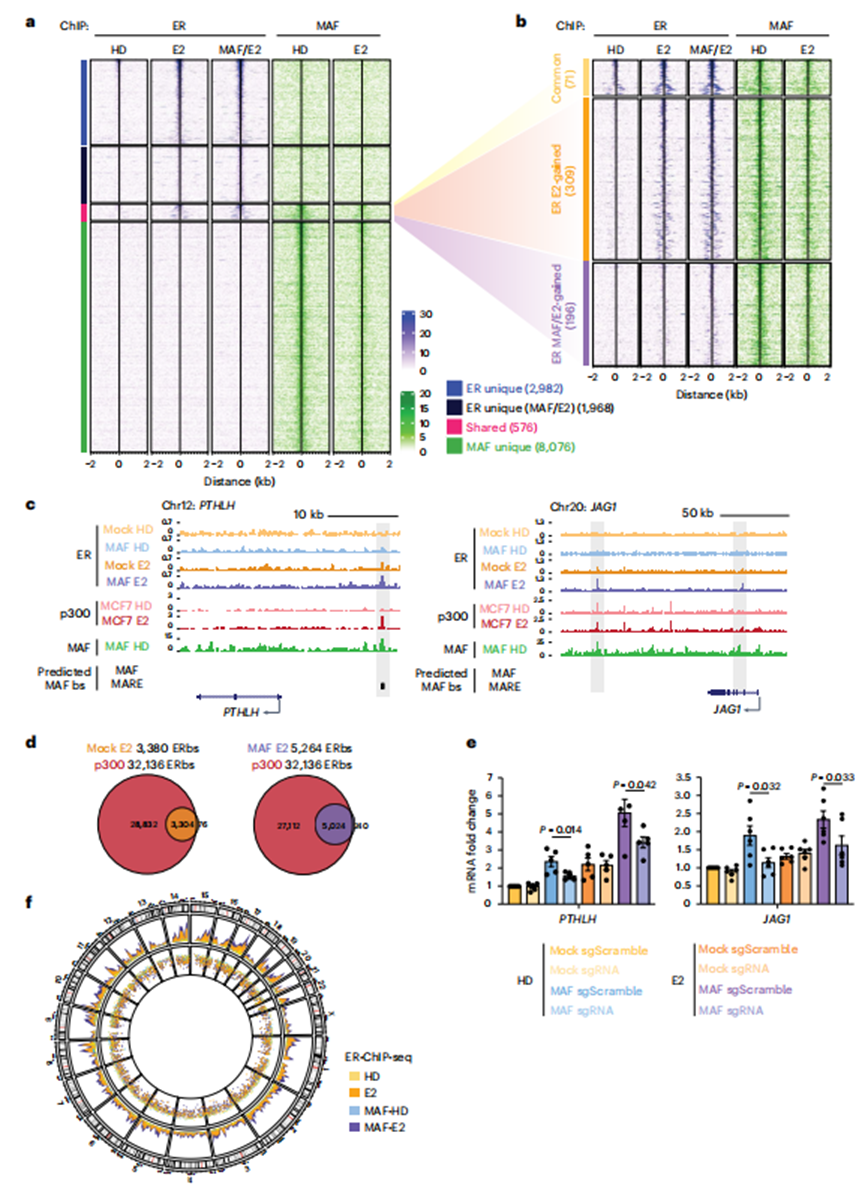
5、MAF在染色質(zhì)上重新分配內(nèi)質(zhì)網(wǎng)以靶向轉(zhuǎn)移相關(guān)基因
為了深入了解MAF的全基因組定位,并評估其在E2處理后與ERα的潛在直接相互作用,作者在對照和MAF過表達(dá)的MCF7 BCa細(xì)胞中進(jìn)行了ERα和MAF染色質(zhì)免疫沉淀和高通量測序(染色質(zhì)免疫沉淀和測序,ChIP-seq)。事實上,只有在E2處理后,才觀察到ER與染色質(zhì)的廣泛結(jié)合,這表明E2在內(nèi)質(zhì)網(wǎng)向染色質(zhì)募集中的作用(圖4a)。相反,MAF的結(jié)合在很大程度上獨立于E2(圖4a)。然而,有趣的是,在E2的作用下,ER和MAF都結(jié)合了一組共享的基因組位點(576),其中一些位點(196)僅在MAF過表達(dá)的細(xì)胞中被ER結(jié)合(圖4a,b)。在基因組瀏覽器中對這些位點進(jìn)行目視檢查,發(fā)現(xiàn)E2誘導(dǎo)的MAF-E2依賴性ER與MAF-E2靶轉(zhuǎn)移支持基因相關(guān)增強(qiáng)子中的未知靶點結(jié)合,如FGF18、PTHLH、JAG1、TMEM2、TGFA、JAK1和SHH(圖4c;注意GREB1、CCND1和PGR被用作真正的ER/E2靶點)。這些假定的順式調(diào)控元件在MAF共識結(jié)合基序(MARE和MAF)中富集,并且與增強(qiáng)子標(biāo)記p300的ChIP-seq峰相吻合(圖4d)。
接下來,作者使用CRISPR干擾(CRISPRi)來抑制PTHLH和JAGGED1轉(zhuǎn)錄起始位點(TSSs)附近的這些假定的MAF應(yīng)答元件,以確認(rèn)它們的功能作用。在使用特定的單導(dǎo)RNA (sgRNA)對共享的MAF/ER峰位點和dCas9失活后,MAF/ER依賴的轉(zhuǎn)錄對PTHLH和JAGGED1的轉(zhuǎn)錄誘導(dǎo)顯著減弱,與E2無關(guān)(圖4e)。總的來說,作者的數(shù)據(jù)表明MAF的存在直接或間接地增加了ER與染色質(zhì)的結(jié)合。此外,MAF直接與ERα相互作用,因此其在BCa中的過表達(dá)與ER順反組相關(guān)聯(lián)并擴(kuò)大(圖4f)。作者假設(shè)MAF過表達(dá),通過其與染色質(zhì)重塑物的直接相互作用(圖2c),啟動染色質(zhì)引物,響應(yīng)E2,促進(jìn)ER基因調(diào)控,最終促進(jìn)ER+BCa的轉(zhuǎn)移過程。
 MAF染色質(zhì)結(jié)合與內(nèi)質(zhì)網(wǎng)重疊并擴(kuò)展其結(jié)合
MAF染色質(zhì)結(jié)合與內(nèi)質(zhì)網(wǎng)重疊并擴(kuò)展其結(jié)合
6、ER/MAF協(xié)同提供了一個特定的染色質(zhì)景觀
接下來,作者在E2刺激下生成了高度轉(zhuǎn)移的MAF陽性MCF7 BCa細(xì)胞的染色質(zhì)可及性圖。與對照細(xì)胞相比,MAF過表達(dá)和E2刺激都在細(xì)胞染色質(zhì)狀態(tài)上留下了明顯的印記,這是通過染色質(zhì)可及性的變化來測量的;作者可以定義MAF依賴簇A和B(分別為97和80個峰),E2依賴簇C和D(分別為40和76個峰)以及MAF/E2依賴簇E和F(分別為621和797個峰)(圖5a-c)。MAF/E2依賴性簇特有的廣泛染色質(zhì)重塑在ER耗盡時丟失,主要是在帶注釋的啟動子/ TSSs(圖5d)。重要的是,與其他簇相比,MAF依賴簇A和E的啟動子/TSS區(qū)域的ATAC(轉(zhuǎn)座酶可及染色質(zhì)測定)峰的寬度顯著增加(圖5e)。值得注意的是,MAF依賴的ATAC峰與BCa細(xì)胞中的組蛋白標(biāo)記重疊,并與啟動子區(qū)域的轉(zhuǎn)錄激活(H3K27Ac, H3K4me3)相關(guān)(圖5f)。
為了確定這些鑒定出的染色質(zhì)可及性峰的變化是否反映了觀察到的轉(zhuǎn)錄變化(圖3a),作者整合了ATAC-seq和RNA-seq數(shù)據(jù)集。MAF過表達(dá)E2處理細(xì)胞的ATAC-seq數(shù)據(jù)顯示,MAF和E2同時調(diào)控表達(dá)的基因顯著富集(圖5g;集群A至F如圖5a所示)。
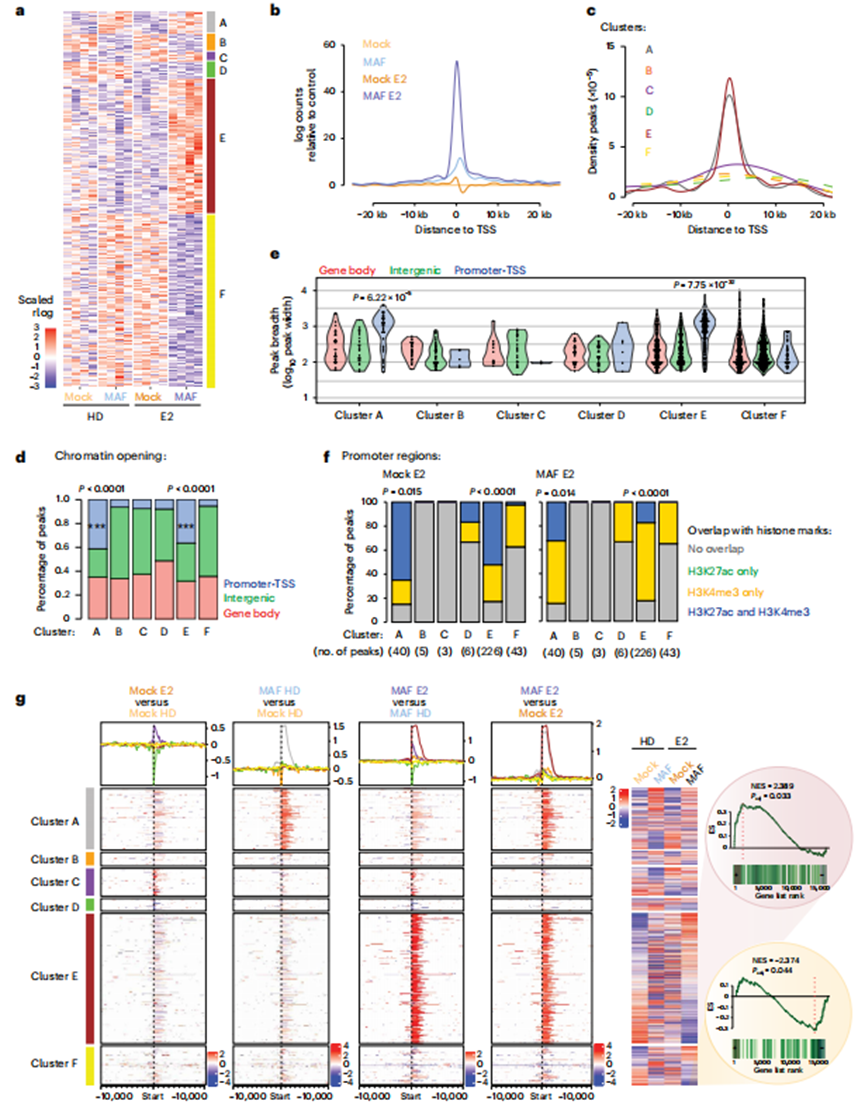 MAF擴(kuò)增引起染色質(zhì)景觀的變化
MAF擴(kuò)增引起染色質(zhì)景觀的變化
7、MAF和ER調(diào)控轉(zhuǎn)移基因表達(dá)程序
為了將這些染色質(zhì)結(jié)合事件與轉(zhuǎn)錄調(diào)控聯(lián)系起來,作者使用先前描述的RNA-seq數(shù)據(jù)進(jìn)一步表征了MAF/E2依賴性基因(圖3a)。GO分析顯示,E2上調(diào)的一些基因是已知的雌激素反應(yīng)基因(如ple、MYC和細(xì)胞周期介質(zhì))。其他MAF/E2依賴基因?qū)儆谝郧拔磁cE2信號相關(guān)的途徑(圖3b,d),包括與侵襲性和高度轉(zhuǎn)移性BCa表型相關(guān)的基因(例如,EMT,炎癥)。重要的是,MAF和ER之間共享的染色質(zhì)結(jié)合位點是最近發(fā)現(xiàn)的E2靶向基因附近最富集的位點,以及經(jīng)典的E2應(yīng)答(圖6a)。同樣,在MAF/E2條件下,差異開放和關(guān)閉的染色質(zhì)區(qū)域在ER ChIP峰中富集(開放峰363個,關(guān)閉峰193個)(圖6b)。總的來說,這些數(shù)據(jù)表明,在本文發(fā)現(xiàn)的E2靶基因附近以前未被發(fā)現(xiàn)的順式調(diào)控元件可能被MAF用于支持ERα結(jié)合并激活轉(zhuǎn)錄。
根據(jù)多個TCGA患者腫瘤中500 kb范圍內(nèi)RNA-seq和ATAC-seq信號的相關(guān)性,作者可以推斷患者樣本中MAF-ER結(jié)合直接控制的靶基因(而不僅僅依賴于基因接近性)。重要的是,作者發(fā)現(xiàn),在MCF7細(xì)胞中同時被ER和MAF占據(jù)的患者乳腺腫瘤中,ATAC-seq峰通過啟動子-增強(qiáng)子連接在功能上與E2靶基因表達(dá)的控制相關(guān)聯(lián),其程度高于偶然預(yù)期(例如,SOX9與近似隨機(jī)排列相比,P < 0.0001;圖6 c, d)。相比之下,單獨由MAF結(jié)合的位點沒有顯示出這種實質(zhì)性的富集(圖6c)。總的來說,這些結(jié)果表明E2主要通過ER位點發(fā)出信號,然而,在MAF表達(dá)時,ER能夠與MAF一起結(jié)合到以前未被發(fā)現(xiàn)的基因組位點,從而從經(jīng)典的E2應(yīng)答基因程序中擴(kuò)展E2誘導(dǎo)的轉(zhuǎn)錄庫。事實上,通過整合RNA-seq轉(zhuǎn)錄組學(xué)和MAF-和MAF/E2依賴性ER ChIP-seq數(shù)據(jù)產(chǎn)生的MAF-依賴性基因標(biāo)記確定了ER+患者的一個子集,其最初經(jīng)歷骨骼復(fù)發(fā)的可能性更高(圖6e)。
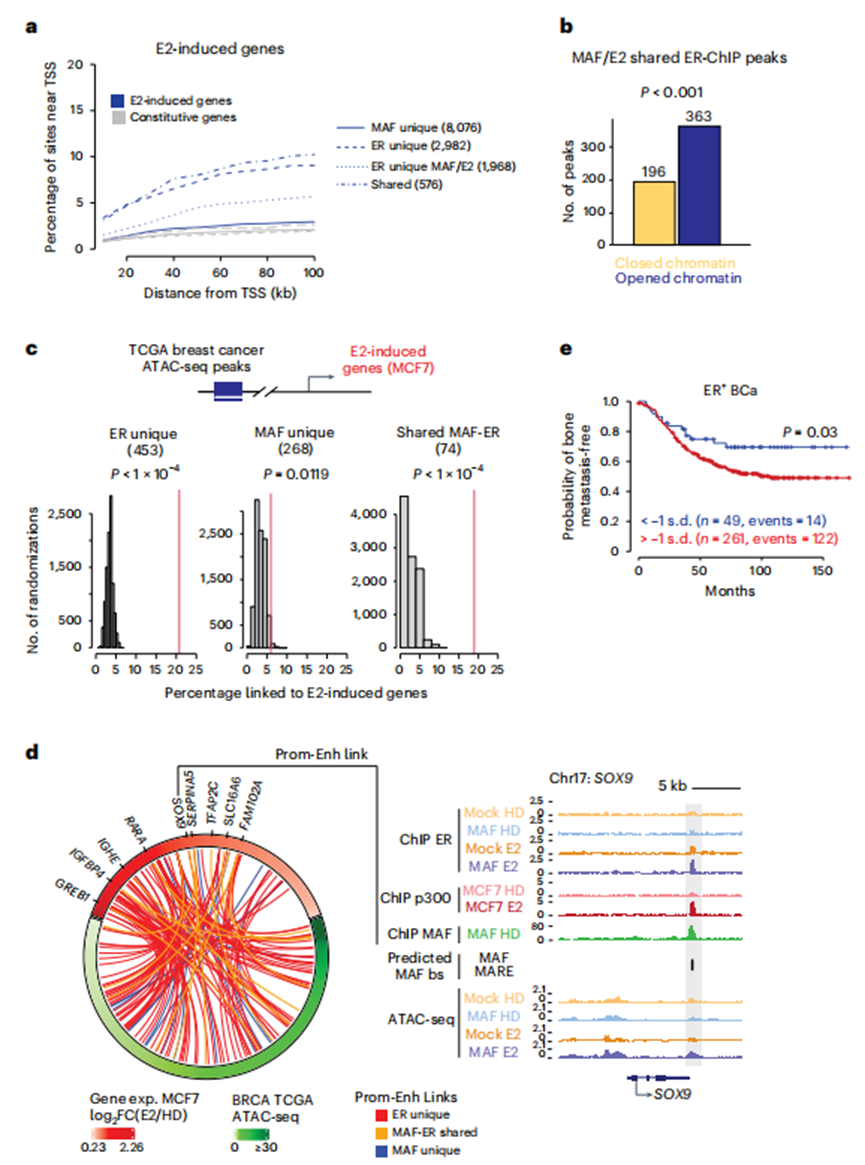 共享ER-MAF結(jié)合位點控制E2誘導(dǎo)的轉(zhuǎn)移基因程序
共享ER-MAF結(jié)合位點控制E2誘導(dǎo)的轉(zhuǎn)移基因程序
8、定義ER BCa轉(zhuǎn)移的表觀遺傳開關(guān)
接下來,作者將重點放在高可信度的MAF相互作用物上,這些相互作用物可能通過組蛋白甲基化與MAF介導(dǎo)的全局染色質(zhì)打開有關(guān),并且以前與癌癥有關(guān)。KDM1A在貝葉斯錯誤發(fā)現(xiàn)率(BFDR) < 0.001的相互作用組中進(jìn)行了顯著性分析(圖2c),它編碼一種黃素依賴的單胺氧化酶,可以去甲基化單和二甲基化賴氨酸(K),特別是組蛋白3和賴氨酸4和賴氨酸9 (H3K4和H3K9)。值得注意的是,高KDM1A活性存在于許多癌癥類型中,包括BCa。為了確定在MAF過表達(dá)的情況下,抑制KDM1A活性對E2介導(dǎo)的轉(zhuǎn)錄重布線的影響,作者在MCF7 BCa細(xì)胞中進(jìn)行了PLA測定和KDM1A和MAF的co-IP(圖7a)。與對照細(xì)胞相比,KDM1A敲除的細(xì)胞PLA信號明顯減少(具有短針亂置(shSc))(圖7a-c)。這些結(jié)果證實了MAF直接與KDM1A結(jié)合,并表明這種相互作用有助于促進(jìn)MAF - ER相互作用。
為了分析KDM1A敲低是否會影響MAF/ E2介導(dǎo)的基因應(yīng)答,作者比較了HD與E2處理細(xì)胞的RNA-seq數(shù)據(jù)(圖3a中簇5和6)(圖7d)。在MAF過表達(dá)的細(xì)胞中,作者觀察到缺乏KDM1A活性降低了E2/ ER誘導(dǎo)和MAF依賴性基因的表達(dá)(例如,FGF18, PTHLH, SOX9, TMEM2, JAK1和SHH)(圖7d,e),但其他基因沒有(圖7d,e)。綜上所述,這些結(jié)果表明KDM1A有助于MAF依賴性基因反應(yīng),包括MAF/ E2依賴性基因反應(yīng)的一個子集。
 KDM1A抑制破壞E2/ER和MAF依賴的信號傳導(dǎo)并阻止轉(zhuǎn)移
KDM1A抑制破壞E2/ER和MAF依賴的信號傳導(dǎo)并阻止轉(zhuǎn)移
9、KDM1A阻斷可拮抗MAF依賴性轉(zhuǎn)移
接下來,作者測試了KDM1A的高選擇性共價抑制劑iaddemstat (ORY -1001)是否可以阻斷MAF介導(dǎo)的轉(zhuǎn)移。經(jīng)ORY-1001處理后,MCF7和mTB細(xì)胞顯示H3K9me2積累,顯示KDM1A去甲基化酶活性的功能性抑制(圖7f,g)。為了測試KDM1A抑制是否會阻止表達(dá)MAF的BCa細(xì)胞形成骨轉(zhuǎn)移,作者使用了體外骨培養(yǎng)陣列(BICA)。然后,作者將對照或表達(dá)Maf -的mTB細(xì)胞接種到免疫無能力的同基因小鼠(FVB背景)的脛骨中。值得注意的是,ORY -1001治療顯示骨病變的數(shù)量和大小均顯著減少,但僅在表達(dá)Maf的組(圖7i),這表明KDM1A介導(dǎo)的Maf表達(dá)細(xì)胞的表觀遺傳變化驅(qū)動了骨適應(yīng)和轉(zhuǎn)移。
結(jié)論:
作者報告了一種以前未知的MAF-ER相互作用,這種相互作用是由表觀基因組機(jī)制驅(qū)動的,并有助于BCa臨床相關(guān)的轉(zhuǎn)移結(jié)果。這涉及MAF驅(qū)動的染色質(zhì)擾動,大大擴(kuò)展了ER轉(zhuǎn)錄范圍,超出了目前描述的目標(biāo)。總的來說,作者的研究結(jié)果支持E2存在下MAF擴(kuò)增后ER+BCa骨轉(zhuǎn)移增強(qiáng)。重要的是,作者證明了在ER+腫瘤中,MAF的擴(kuò)增和過表達(dá)將典型細(xì)胞重新編程,使其包含以前未知的增強(qiáng)子和轉(zhuǎn)錄活性,從而促進(jìn)骨轉(zhuǎn)移。該程序重定向DNA可及性,并通過KDM1A介導(dǎo)的轉(zhuǎn)錄通道促進(jìn)轉(zhuǎn)移。這些數(shù)據(jù)表明,染色質(zhì)失調(diào)是BCa轉(zhuǎn)移的早期事件,而基因組擴(kuò)增在這一過程中起著核心作用。作者的結(jié)果為探索KDM1A在這種臨床背景下的抑制作用打開了大門。
實驗方法:
Maf轉(zhuǎn)基因小鼠的產(chǎn)生;Southern blot;長PCR分析;細(xì)胞培養(yǎng);小鼠Bca誘導(dǎo)腫瘤及衍生細(xì)胞外植體;MAF過表達(dá)細(xì)胞的產(chǎn)生;慢病毒加工;鄰近依賴生物素鑒定(BioID);網(wǎng)絡(luò)分析;Dot-plot分析;BioID相互作用富集分析;免疫印跡法;免疫熒光;免疫共沉淀;聚乳酸實驗;PROTAC用于目標(biāo)降解;RNA-seq;預(yù)處理和差異表達(dá)分析;內(nèi)質(zhì)網(wǎng)降解的RNA-seq;RNA-seq(與敲除KDM1A后的樣品比較);逆轉(zhuǎn)錄定量聚合酶鏈反應(yīng)(qRT-PCR);患者隊列的相關(guān)性和生存數(shù)據(jù)分析;體外BrdU摻入測定;組織病理學(xué)和免疫治化學(xué);細(xì)胞增殖試驗及半最大抑制濃度(IC50)測定;ATAC-seq;內(nèi)質(zhì)網(wǎng)降解的ATAC-seq;ATAC-seq和RNA-seq數(shù)據(jù)的整合;ER和MAF ChIP-seq;H3K27Ac和H3K4me3 ChIP-seq;ChIP-seq和RNA-seq數(shù)據(jù)的整合;超增強(qiáng)子的識別和分配;CRISPRi;循環(huán)腫瘤細(xì)胞;細(xì)胞競爭試驗;BICA。
參考文獻(xiàn):
Llorente A, Blasco MT, Espuny I, Guiu M, Ballaré C, Blanco E, Caballé A, Bellmunt A, Salvador F, Morales A, Nu?ez M, Loren G, Imbastari F, Fidalgo M, Figueras-Puig C, Gibler P, Graupera M, Monteiro F, Riera A, Holen I, Avgustinova A, Di Croce L, Gomis RR. MAF amplification licenses ERα through epigenetic remodelling to drive breast cancer metastasis. Nat Cell Biol. 2023 Nov 9. doi: 10.1038/s41556-023-01281-y. Epub ahead of print. PMID: 37945904.






