單細胞測序聯合空間轉錄組學揭示HNSCC新型腫瘤相關成纖維細胞亞群

盡管免疫療法可以延長一些頭頸部鱗狀細胞癌(HNSCC)患者的生存期,但應答效率仍然很低。闡明腫瘤微環境(TME)中調節CD8+T細胞浸潤和功能障礙的關鍵機制有助于最大限度地提高免疫療法治療HNSCC的益處。在這里,作者對具有不同免疫浸潤的HNSCC標本進行空間轉錄組分析,并對五對腫瘤和鄰近組織進行單細胞RNA測序(scRNA-seq),揭示了與CD8+T細胞浸潤限制和功能障礙相關的特定腫瘤相關成纖維細胞CAF亞群。這些CAFs表現出CXCL(CXCL9、CXCL10、CXCL12)和主要組織相容性復合體I類(MHC-I)的高表達,以及半乳糖凝集素-9(Gal-9)的富集。MHC-IhiGal-9+CAF細胞比例與CD8+T細胞TCF1+GZMK+亞群豐度呈負相關。CAFs中的 Gal-9誘導CD8+T細胞功能障礙,并降低腫瘤浸潤TCF1+CD8+T細胞比例。該研究于2023年11月發表在《cancer research》,IF 11.2。
技術路線
主要研究結果
1.腫瘤間質中存在CD8+T細胞
作者首先通過分析TCGA數據庫中HNSCC和正常樣本中CD3E和CD8A的表達來研究CD8+T細胞浸潤(圖1A)。腫瘤組織中CD3E和CD8A的TPM值較高,表明HNSCC腫瘤組織中CD8+T細胞浸潤增加。此外,在HPV陽性的HNSCC中,CD3E和CD8A轉錄水平遠高于HPV陰性的HNSCC(圖1A),這表明CD8+T細胞浸潤更高。為準確表征HNSCC中CD8+T細胞的空間分布,通過免疫組織化學(IHC)評估具有不同免疫亞型的HNSCC患者組織的CD8α染色(圖1B)。免疫浸潤類型也通過CD4/CD20分析確定。為比較腫瘤和鄰近正常組織,特別選擇了包含這兩種組織類型的切片。在所有三種免疫浸潤類型中(浸潤型,沙漠型,排斥型),淋巴細胞浸潤在浸潤邊緣的纖維化區域受到限制(圖1B)。在免疫浸潤腫瘤的腫瘤底部中,一些CD8α+細胞在腫瘤巢中浸潤,盡管CD8α+細胞更喜歡纖維化區域(圖1B左)。對于免疫沙漠型腫瘤,在腫瘤侵襲邊緣的纖維化區域也檢測到大量的CD8α+細胞,正如預期的那樣,在腫瘤底部發現的CD8α+細胞很少(圖1B中間)。有趣的是,在免疫排斥型腫瘤的纖維化區域中有大量的CD8α+細胞,很少有CD8α+細胞浸潤到腫瘤巢中(圖1B右)。這些結果表明,大多數CD8+T細胞局限于間質,而不是浸潤于腫瘤巢中。
為進一步探索限制CD8+T細胞浸潤的因素,作者對三種免疫類型的HNSCC組織進行空間轉錄組測序。這些組織來自相同的患者,但不同的樣本用于確定圖1B中的“免疫亞型”。用H&E染色處理標本(圖1C),將10x Visium捕獲的所有三個標本的spots分為10個簇,并與H&E圖像對齊(圖1D-G)。正如預期的那樣,通過淋巴細胞相關基因的空間表達證實HNSCC的三種免疫類型由多個spots簇組成,并且在這些標本中表現出異質性。當浸潤型樣本和沙漠型樣本比較時,沙漠型樣本僅具有簇5和簇8的spots,排斥型樣本僅具有聚類4和簇9的spots(圖1H)。簇4是由肌肉細胞組成的簇(圖1D)。根據H&E圖像上簇的排列,高表達COL11A1、GRP、HOXCB2、BMP8A 和 NKD1的簇9(圖1I),主要由腫瘤巢周圍的成纖維細胞組成(圖1D)。最近,John Grout等人發現,通過優先選擇XI膠原蛋白和XII膠原蛋白的細胞外基質(ECM)重編程,α-SMA+CAF在人類肺部腫瘤的T細胞邊緣化中發揮重要作用。在此,作者探討了COL11A1、COL11A2和COL12A1在三種免疫類型中的表達和空間分布。一致地,排斥型標本基質富含COL11A1和COL12A1,浸潤型標本缺乏COL11A1、COL11A2和COL12A2,而沙漠型標本具有COL12A1的高表達,但COL11A1與COL11A2低表達。然而,作者也注意到,在排斥型標本中,COL11A1和COL12A1也在簇9之外的簇1的spots中表達。作者進一步評估了免疫排斥人類HNSCC中α-SMA+CAF、CD8α+細胞和腫瘤巢之間的空間關系。大多數CD8α+細胞僅限于富含α-SMA+的區域,但作者也注意到,即使在α-SMA+纖維化區域和腫瘤巢之間的實際邊界中,CD8α+細胞也從未浸潤到腫瘤巢中。這些結果表明,CD8+T細胞在腫瘤間質中受到限制,除了細胞外基質重編程外,還有其他分子機制將CD8+T淋巴細胞限制在間質中。
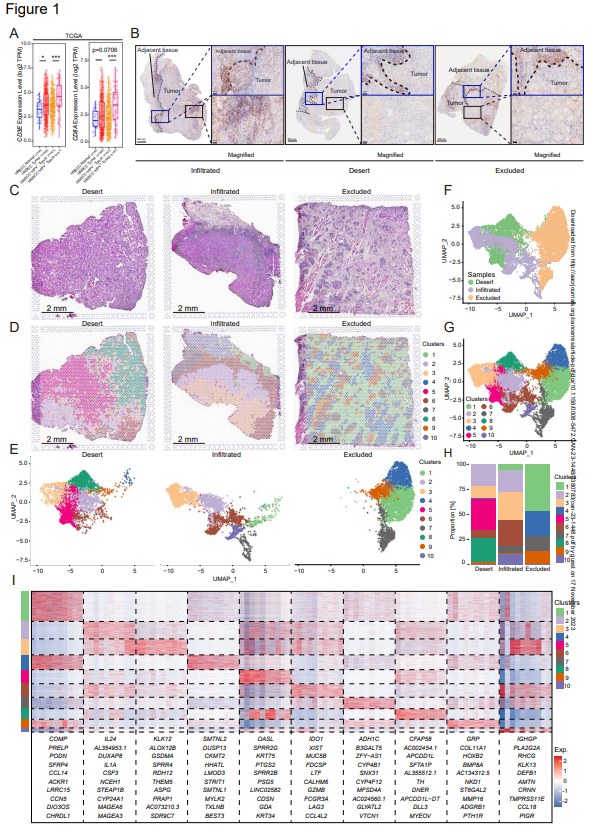
圖1:CD8a+細胞在所有三種免疫類型的HNSCC的基質中存在
2. 單細胞分析揭示HNSCC中CAFs的異質性
為進一步研究HNSCCs的周圍基質,作者通過scRNA-seq定義了成纖維細胞的異質性。將來自五名HNSCC患者不同位置的腫瘤和鄰近正常組織樣本消化成單細胞懸浮液,并捕獲活細胞進行scRNA-seq。在質量控制和批量校正后,選擇23485個具有成纖維細胞特征的細胞進行下游分析。作者首先比較了經t-SNE降維的來自腫瘤和鄰近組織的成纖維細胞簇,并鑒定了10組成纖維細胞(圖2A)。與先前的假設一致,來自腫瘤和鄰近正常組織的成纖維細胞是多樣的。來自相鄰正常組織不同樣本的成纖維細胞簇有很大差異,這可能是采集這些組織不同解剖部位的結果(圖2A和2B)。除了簇1和簇4外,其他五個正常成纖維細胞簇在這五個正常相鄰組織中幾乎不共享。相反,來自腫瘤組織的成纖維細胞幾乎不存在于相鄰的正常組織中,即所謂的CAFs,僅表現為三個簇,簇5、簇6和簇10(圖2A)。簇5和6在所有五個腫瘤組織中被識別,簇5是only一個幾乎不存在于正常鄰近組織中的簇,并且幾乎只存在于所有五個癌癥樣本中。為進一步識別這些簇,作者確定了這些成纖維細胞的標志物,并試圖揭示每個簇的可能性作用。然而,與成纖維細胞的多樣性相反,所有這些成纖維細胞簇的標記物都不是only的,并且幾個簇共享這些標記物的相似表達(圖2C和D)。對于CAFs的三個細胞簇,top標記物(如簇5的COL7A1、簇6的LRCC15和簇10的CACNA2D3)也由其他簇共享(圖2C)。事實上,很少有標記物可以專門標記每一簇的CAF。這些結果表明,CAFs表型在很大程度上取決于微環境,而不是其細胞系。
此外,為了將HNSCCs的CAF簇與其他類型腫瘤的CAF進行比較,作者評估了先前胰腺導管腺癌、乳腺癌和膀胱尿路上皮癌研究中鑒定的標志物表達(圖2D)。在其他腫瘤中描述的大多數標記物具有與簇5、簇6和簇10中CAFs相似的表達模式。然而,作者發現簇6比簇5具有更高的iCAF的幾種標記物表達,如IL6和CXCL12,而簇5表達myCAFs的標記物,如POSTN和ACTA2(圖2D)。盡管iCAF的標記物(例如,PLA2G2A、IL6、CXCL12、CFD、DPT)可以區分簇6和簇5,但正常成纖維細胞表達的這些iCAF相關基因水平與簇6相似或更高。對于簇10,在三個簇中數量最低,這些細胞表達iCAF和myCAF的標記物(圖2D和E),并且它們的表達模式位于簇5和簇6中間,這表明簇10處于過渡和瞬時狀態。此外,成纖維細胞的擬時序分析也證實了簇10的過渡狀態(圖2F和G)。作者還注意到,簇5和簇6在擬時序分析中都顯示出兩個軌跡(圖2G),這可能是簇中不同細胞系的結果。CD105,最近被鑒定為CAFs不同譜系的關鍵標志物之一,并沒有區分CAFs的兩個軌跡,這表明需要鑒定其他譜系決定分子。
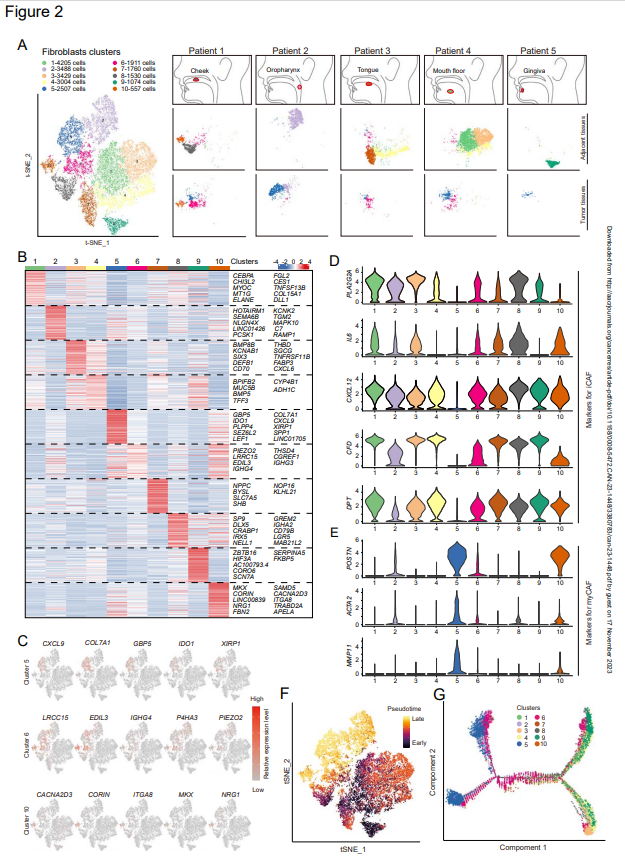
圖2:HNSCC腫瘤及鄰近組織成纖維細胞的整體分析
3. MHC-I和CXCL分子的高水平表達與CAFs和CD8+T細胞有關
為進一步研究和鑒定CAFs和正常成纖維細胞之間的差異,作者比較了相鄰正常組織中CAFs的表達譜和正常成纖維細胞(NFs)的表達譜。關于上述成纖維細胞的多個簇,作者首先將CAFs和NFs作為整體進行比較。通過比較簇5和簇6的表達譜,發現CAFs和NFs的比較中幾乎所有的top差異表達基因都在簇5中富集(圖3A),這表明簇5在CAFs與NFs之間的差異中起著決定因素的作用。與先前的研究一致,CAFs具有獨特的表達模式,并表達一組促腫瘤基因,如POSTN。差異表達基因的GO分析揭示了與細胞外基質相關術語的富集,強調CAFs通過TME重塑和與TME中細胞發生相互作用促進腫瘤發生(圖3B)。此外,富集分析表明,CAFs在細胞因子信號傳導(如IL17)和ECM受體相互作用中發揮作用(圖3C)。有趣的是,作者注意到CAFs還表現出與T細胞受體信號傳導和抗原處理和呈遞相關基因的富集,富集分數僅棑在ECM受體相互作用后(圖3C)。
然后,作者探索了CAFs的兩個主要聚類,簇5和簇6,以驗證先前比較中基因集的富集。MHC-I分子,包括HLA-A、HLA-B、HLA-C和B2M,在簇5中表現出更高的表達水平(圖3D)。GSEA進一步證實,與抗原處理和呈遞相關的基因在簇5中具有更高的表達(圖3E)。由于先前的工作揭示了胰腺導管腺癌中的抗原呈遞CAFs群體,作者還在scRNA-seq數據中探索了CD74和HLA-DRA(MHC-II)的表達,但在簇5中沒有發現任何富集。相反,作者證實了MHC-I分子(包括B2M、HLA-A、HLA-B和HLA-C)在簇5中的表達增加(圖3F)。此外,在三種免疫類型的HNSCC標本中,腫瘤底部具有較高的MHC I類分子表達水平,并且MHC I類分子高表達的spots大多位于排斥型標本的腫瘤巢周圍。
由于簇5與免疫細胞具有更活躍的相互作用,并表現出調節造血細胞分化基因集的富集(圖3E),作者在scRNA-seq數據中進一步評估簇5中 CAFs與不同類型免疫細胞之間的相互作用。就配體-受體與簇5的相互作用數量而言,髓系細胞和CD8+T細胞是排名最高的細胞,盡管CAF(簇5和簇6)之間的內部相互作用最頻繁。為了定量分析相互作用,作者考慮了配體和受體的表達水平,并評估了傳入和傳出信號(圖3G和H)。簇5中髓系細胞和CAFs表現出強大的傳入和傳出信號網絡。對于CD8+T細胞,MHC-I、半乳糖凝集素、CD22、LCK和CXCL是最強的傳入信號(圖3G)。就傳出信號而言,簇5高水平表達的MHC-I和CXCL用于信號傳導(圖3H)。就CXCL相互作用而言,據報道參與T細胞維持的CXCL12-CXCR4/CKR3軸是主要貢獻者。此外,作者注意到CXCL9和CXCL10在最近的一項皮膚成纖維細胞研究中被確定為CD8+T細胞募集的關鍵趨化因子,它們在第5簇而不是第6簇中高度表達(圖3D)。正如預期的那樣,GEPIA相關性分析揭示了CD8A表達與CXCL9/CXCL10/CXCL12之間的顯著正相關性,證實了CXCL9/CXCL10/CXCL12對CD8+T細胞的趨化作用。有趣的是,作者注意到CXCL9、CXCL10和CXCL12在不同免疫類型的HNSCC中具有特殊的表達模式。CXCL9和CXCL10在沙漠型和浸潤型標本中豐富,在排斥型標本的基質中表達有限且。相反,沙漠型標本幾乎沒有CXCL12的表達,而排斥型標本具有高水平的CXCL12。浸潤型標本在惡性區域顯示CXCL12的表達,但在鄰近正常區域具有較高水平的CXCL12。
這些結果表明,簇5負責CAFs的不同表達譜,并與MHC-I分子和CXCL趨化因子介導的CD8+T細胞具有強烈而頻繁的相互作用。
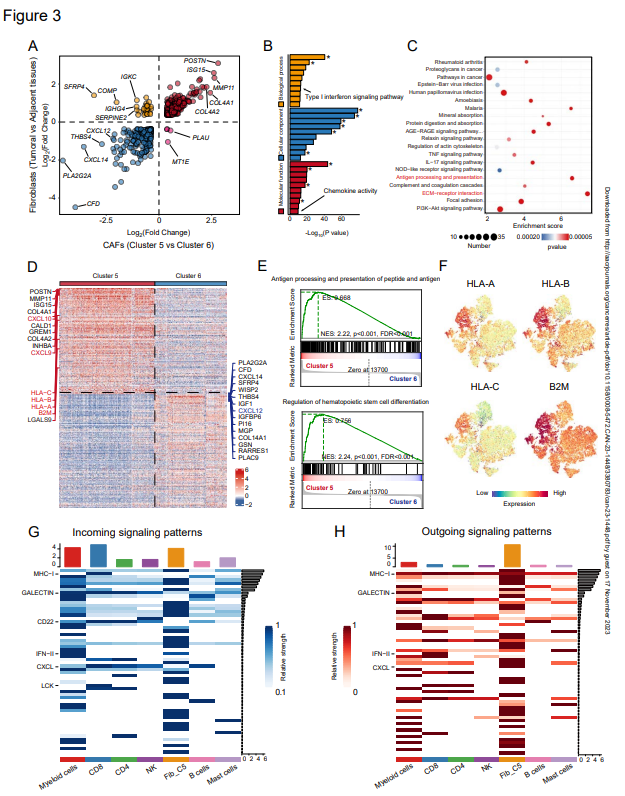
圖3:CXCL和MHC I類分子的高表達水平與簇5 CAFs和CD8+T細胞有關
4. CAFs中MHC-I高表達限制了CD8+T細胞的抗腫瘤功能
為進一步闡明MHC-I分子在CAFs中表達增加的意義,作者首先通過腫瘤免疫組織估計資源(TIMER)分析了MHC分子對HNSCC患者生存的貢獻。與預期相反,在累積生存率與免疫浸潤呈正相關的HPV陽性HNSCC患者中,較高水平的MHC I類分子(HLA-a、HLA-B、HLA-C和B2M)與較差的結果相關。然后,作者從HNSCC腫瘤組織中分離CAFs,并敲低B2M的表達,其與HN6共同注射入裸鼠中(缺乏適應性免疫)。腫瘤生長或組織學形態沒有顯著變化,表明CAFs中的B2M沒有直接改變腫瘤生長。
為進一步確定具有不同MHC-I表達水平的成纖維細胞是否影響體內腫瘤生長和抗腫瘤免疫,應用具有完整免疫系統的小鼠模型進行進一步研究。由于HNSCC自發致瘤小鼠模型的局限性,本研究使用了由SCC VII(一種不斷應用于HNSCC研究的鱗狀細胞系)和成纖維細胞形成的皮下荷瘤模型。作者使用從小鼠舌頭分離的正常成纖維細胞(小鼠舌頭成纖維細胞,MTFs)作為替代品,其有助于CAFs(圖4A)。作者首先敲低了MTFs中B2m的表達(圖4B),并證實敲低B2m不會影響SCC VII細胞的生存能力。然后,作者將SCC VII和成纖維細胞共同皮下注射到C3H/He小鼠中。有趣的是,與對照組相比,SCC VII和B2m KD MTFs形成的腫瘤在終點生長較慢且小得多,CD8+T細胞的耗竭挽救了觀察到的表型(圖4C)。為了研究B2m-KD成纖維細胞如何限制腫瘤生長,作者分離了皮下腫瘤進行進一步分析。耗竭標記物和免疫檢查點分子,包括T細胞免疫球蛋白和粘蛋白結構域包含-3(TIM3)、淋巴細胞活化基因-3(LAG3)、細胞毒性淋巴細胞相關抗原-4(CTLA4)和具有Ig和ITIM結構域的T細胞免疫受體(TIGIT),在來自皮下腫瘤的CD8+T細胞中進行了檢測,并在B2m-KD腫瘤中顯示出TIGIT的輕微降低,但在其他腫瘤中沒有顯示出顯著變化(圖4D)。相反,具有B2m KD MTFs的腫瘤含有大量分泌抗腫瘤分子(穿孔素和IFN-γ)的CD8+T細胞,并且表達顆粒酶B的CD8+T細胞略有增加(圖4D)。作者還注意到記憶CD8+T細胞(TCF1+CD8+T細胞)在B2m KD腫瘤中也略有增加(圖4D)。作者還將SCC VII和B2m-KD小鼠胚胎成纖維細胞(MEFs)共同注射到C3H/He小鼠中,并獲得類似的結果。然后,作者從轉移淋巴結中分離并擴增CD8+T細胞,并將其與來自相同患者的CAFs共同培養(圖4E)。作者發現在與B2M-KD CAFs的共培養中,當TIGIT的表達在B2M-KD組中減少時(圖4H),結合CD8+T細胞的CAFs數量減少(圖4F),穿孔素和TCF1的表達增加(圖4G)。然后,用抗CD3/CD28抗體激活從HNSCC腫瘤患者中分離的CD8+T細胞(圖4I)。證實了來自HNSCC腫瘤的CD8+T細胞中TCF1在激活后降低(圖4J)。并注意到CXCR3(CXCL9和CXCL10的受體)顯著增加,CXCR4(CXCL12的受體)保持不變(圖4K),表明CD8+T細胞對CXCL9或CXCL10信號變得更敏感,這些信號通過簇5 CAFs高度表達(圖3D)。這些發現表明,高表達MHC-I的CAFs可能限制CD8+T細胞的抗腫瘤能力。
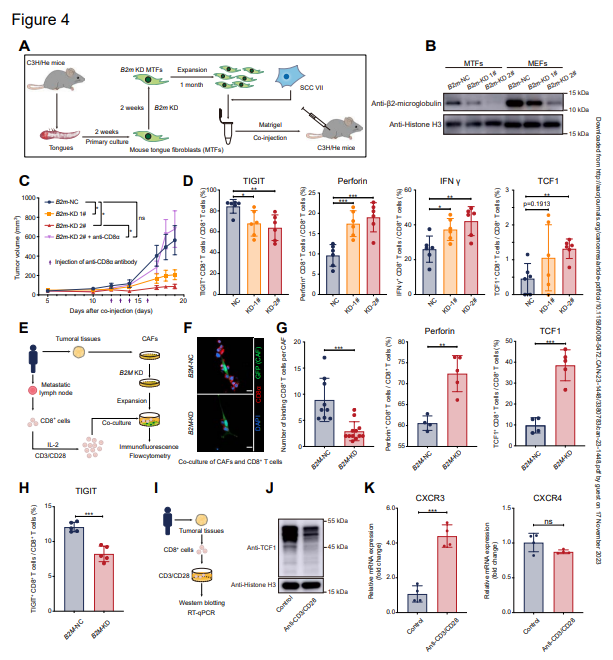
圖4:MHC I類高表達限制了CD8+T細胞的抗腫瘤功能
5. 檢查點分子配體半乳糖凝集素-9在MHC Ihi CAFs中富集
Jacqueline D.Shields先前的工作揭示了具有FASL和PD-L2的CAFs的CD8+T細胞以MHC-I依賴的方式發生抗原特異性缺失。因此,作者進一步檢測了HNSCC成纖維細胞中免疫檢查點配體的表達。有趣的是,在所有檢查點配體中,半乳糖凝集素-9是only在MHC-Ihi CAFs中富集的分子(簇5)(圖5A)。為了驗證半乳糖凝集素-9在MHC-Ihi CAFs中的表達,采集了幾個HNSCCs的腫瘤樣本進行流式細胞術和免疫熒光染色。事實上,作者發現半乳凝集素-9在α-SMA+CAF中表達(圖5B),且表達半乳凝集素-9的CAFs具有更高水平的MHC-I分子(圖5C)。LGALS9(編碼galectin-9的基因)存在于HNSCC特異性的所有三種免疫型中。為進一步確定腫瘤中galectin-9的分布,在70名HNSCC患者的較大隊列中對galectin-9表達進行測試。在這些患者中,作者將galectin-9的表達模式分為四類(圖5D):(i)基質細胞和惡性胰島均未表達galectin-9(6/70,8.57%);(ii)galectin-9僅存在于腫瘤巢中,但不存在于基質中(4/70,5.71%);(iii)galectin-9僅存在于基質中(33/70,47.14%)。此外,作者注意到,CAF在體外培養兩周后失去了Galectin-9的表達,當與HN6(HNSCC細胞系)培養時,細胞表面的HLA-A/B/C水平較高,HN6上的HLA-A/B/C水平下降(圖5E),這暗示HMC-I高表達和galectin-9(MHC-IhiGal-9+CAF)正向表達的CAF表型取決于TME中的信號網絡。
為了隨后研究TME信號網絡對MHC-IhiGal-9+CAF形成的貢獻作用,使用SCENIC分析來鑒定scRNA-seq數據中的關鍵轉錄因子。正如預期的那樣,CAFs簇具有高活性分數的不同調節子,MHC-IhiGal-9+CAF對STAT1、PRDM1和STAT2的調節子表現出高活性分數,也對調節因子特異性表現出高分數。此外,在CAFs簇的比較中,GSEA結果表明干擾素(IFN)和腫瘤壞死因子(TNF)信號通路在MHC-IhiGal-9+CAF中是活躍的(圖5F)。然后,作者通過體外培養CAFs,以進一步探索信號網絡的貢獻(圖5G和H)。在IFN和TNF-α處理下,CAFs具有更高的半乳糖凝集素-9和MHC I類分子(HLA/B/C和B2M)表達(圖5G和H)。具體而言,IFN-β誘導半乳糖凝集素-9表達的最高倍數變化,而IFN-γ誘導MHC I類分子表達的高倍數變化(圖5G和H)。正如預期的那樣,當POSTN信號誘導高水平的CXCL12時,IFN和TNF信號與CXCL9和CXCL10的高表達相關(圖5G)。作者還檢測了用不同細胞因子處理的CAFs中PD-L1表達的變化。然而,在IFN刺激的CAFs中,PD-L1表達的變化與半乳糖凝集素-9表達的變化并不完全一致。與先前的報道一致,TGF-β信號傳導與膠原表達相關(COL11A1、COL11A2、COL12A1)(圖5G)。
作者還評估了用IFN和TNF-α處理的惡性細胞系(CAL27、HN6、HN30)中MHC I類分子和半乳糖凝集素-9的表達。正如預期的那樣,HLA-A/B/C和半乳糖凝集素-9的表達在所有三種細胞系中增加,但水平不同。在這些細胞中,HN6細胞是對IFN最敏感的細胞,它們對IFN和TNF-α的反應與CAFs的反應相似。
這些結果表明,半乳糖凝集素-9是only一種在MHC-Ihi CAFs中富集并由TME中的IFN信號誘導的免疫檢查點配體,在HNSCC患者中普遍由CAFs表達。
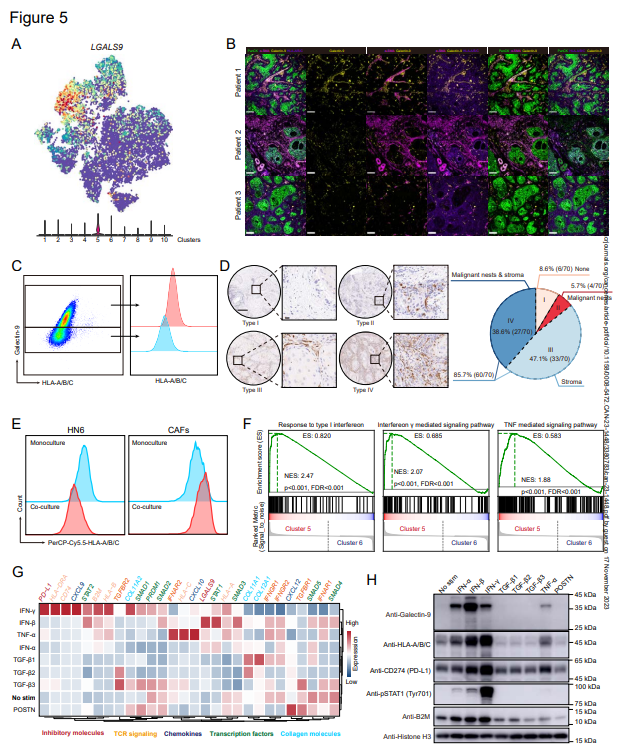
圖5:免疫檢查點配體分子半乳糖凝集素-9在CAFs的簇5中富集
6. Gal-9+CAFs誘導TCF1+GZMK+CD8+T細胞分化異常
為進一步鑒定Gal-9+CAF的作用并確定與Gal-9+CAFs相互作用的CD8+T細胞亞群,作者進一步分析了來自前五對腫瘤鄰近正常組織的CD8+T細胞的scRNA-seq結果。這些CD8+T細胞聚類成八組,簇1和簇2在腫瘤組織和正常組織中共享(圖6A-C)。腫瘤組織在簇3、簇5和簇6中具有更多的細胞(圖6B)。簇4、簇7和簇8幾乎是正常組織獨有的(圖6C)。根據擬時序分析,來自腫瘤和鄰近組織的CD8+T細胞具有不同的分化軌跡,并且簇1在來自腫瘤組織的CD8+T細胞中位于初級過渡階段(圖6D)。為確定每個CD8+T細胞簇的狀態,作者檢測了八個簇中編碼細胞毒素(GMZA、GMZB、GMZK、IFNG和PRF1)、檢查點分子(CTLA4、HAVCR2、PDCD1、LAG3、TIGIT)和TCF1基因的表達(圖6E),表明簇1和簇2是前效應CD8+T細胞,如先前報道的。表達高水平GZMA、GZMB、IFNG和PRF1的簇3-6是效應CD8+T細胞(圖6E)。
為了定義與Gal-9+CAF相互作用的簇,選擇五種腫瘤組織來分析Gal-9+CAFs與八種CD8+T細胞簇之間的相關性(圖6F)。作者發現CD8+T細胞簇1是only一個與Gal-9+CAFs具有顯著相關性的簇(圖6F)。這些細胞表現出較高水平的CXCR3/CXCR4和半乳糖凝集素-9、CD44和P4HB受體(圖6E)。此外,半乳糖凝集素-9的表達也與檢查點分子(TIM3、CTLA4、TIGIT、LAG3、PDCD1)呈正相關,這進一步表明Gal-9+CAF和CD8+T細胞之間的相互作用與CD8+T的功能障礙有關。此外,TCF1+CD8+T細胞和半乳糖凝集素-9的相似空間分布也證實了Gal-9+CAF與TCF1+CCD8+T細胞的相互作用潛力(圖6G)。
為闡明galectin-9在成纖維細胞中對CD8+T細胞的功能,作者構建了動物模型,作者將LGALS9敲低的MTF與SCC VII共注射,并分析了浸潤CD8+T細胞變化(圖7A)。具體而言,作者分析了免疫檢查點分子(TIM3、TIGIT、CTLA4)和GZMB的表達(圖7B)。正如預期的那樣,TIM3、TIGIT和CTLA4在CD8+細胞中下調,細胞毒性細胞因子在LGALS9-KD組中上調(圖7B)。此外,下調的galectin-9還誘導腫瘤中CD8+T細胞和TCF1+CD8+T細胞比例上調(圖7C和D)。此外,對來自同一患者的LGALS9-kD CAF和CD8+T細胞進行共培養實驗,其結果與動物實驗相似(圖7E和F)。將CD8+T細胞結合到CAF的數量在LGALS9-KD組中沒有變化。這些結果表明galectin-9(由lgals9編碼)導致CD8+T細胞功能障礙。
然后,作者在三種免疫類型的HNSCC標本的多重免疫熒光染色中定量評估Gal-9+CAF和TCF1+CD8+T細胞之間的空間關系(圖7G-J),并對來自新患者隊列的排斥型和浸潤型腫瘤的FFPE中CD8+T細胞和Gal-9+CAF之間的位置相關性進行了另一種多重免疫組織化學分析(圖7G)。浸潤型和排斥型的腫瘤具有較高比例的Gal-9+CAF,并且這些細胞特異性地位于腫瘤巢周圍(PanCK+區域)。在浸潤型和排斥型腫瘤中,TCF1+CD8+T細胞(CD3ε+CD8α+TCF1+細胞)在CD8+T細胞中的百分比以及CD8+T淋巴細胞與Gal-9+CAF的比率較高。在腫瘤巢中,如先前在作者數據中所證明的,具有較高MHC-I水平的半乳糖凝集素-9+CAF與較高密度的CD8+細胞呈正相關(圖7I)。TCF1+CD8+T細胞和Gal-9+CAFs之間的距離較短,TCF1+CCD8+T細胞在浸潤型中優選Gal-9+CAF(圖7H和J)。隨著CXCR3/CXCR4在TCF1+CD8+T細胞中的較高表達和CXCL9/CXCL10在Gal-9+CAF中的較高表達(圖3D),這些結果進一步驗證了TCF1+CCD8+T細胞在空間分布上對Gal-9+CAFs的偏好。
所有結果表明,具有高水平MHC I類分子的Gal-9+CAF捕獲并與效應前CD8+T細胞相互作用,并與這些CD8+T功能失調分化相關(圖7K)。
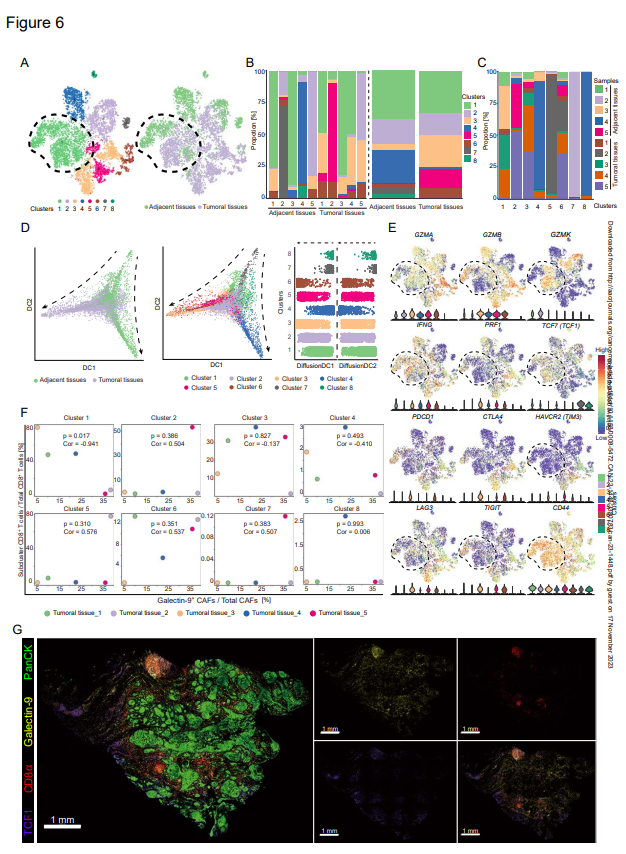
圖6:TCF1+GZMK+CD8+T細胞與半乳糖凝集素-9+CAF呈負相關
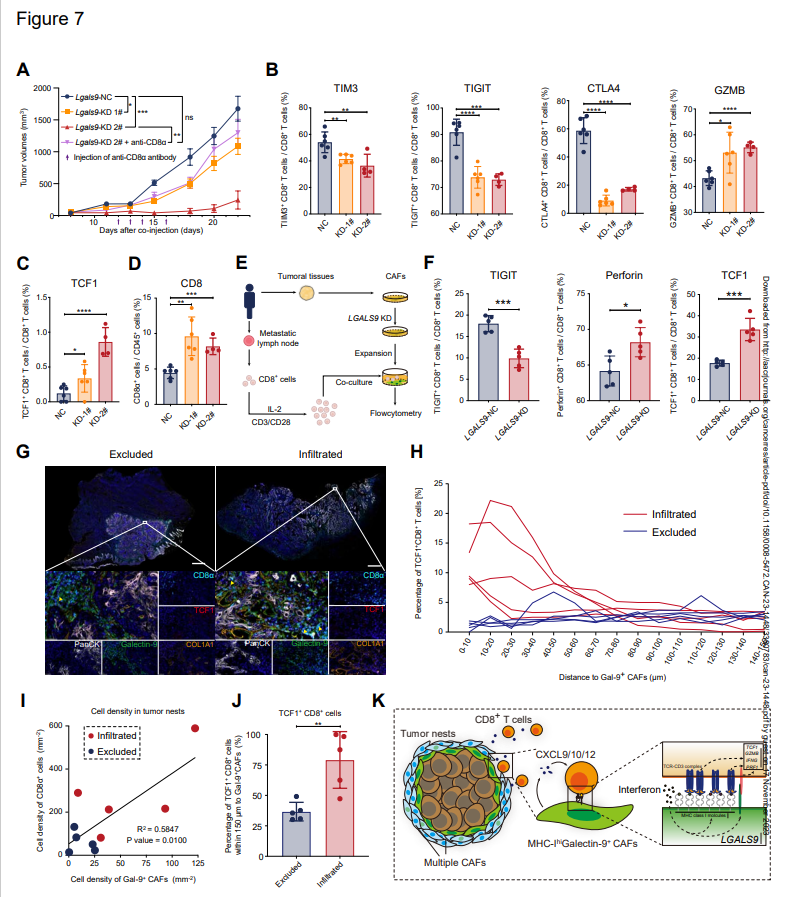
圖7:半乳糖凝集素-9+CAF與TCF1+CD8+T細胞分化異常有關
結論
作者的研究確定了一簇CAFs,其以CXCL和MHC-I依賴的方式捕獲TCF1+GZMK+CD8+T細胞,并通過半乳糖凝集素-9進一步誘導功能失調的轉化。作者的工作為影響CD8+T細胞分布和功能障礙的因素提供了新的見解,并有可能應用于提高免疫療法的療效。
實驗方法
細胞培養,免疫組化,空間轉錄組測序,scRNA-seq,流式細胞術,慢病毒轉染,小鼠腫瘤模型構建,免疫熒光,real-time PCR,免疫印跡
參考文獻:
Li C, Guo H, Zhai P, Yan M, Liu C, Wang X, Shi C, Li J, Tong T, Zhang Z, Ma H, Zhang J. Spatial and single-cell transcriptomics reveal a cancer-associated fibroblast subset in HNSCC that restricts infiltration and anti-tumor activity of CD8+ T cells. Cancer Res. 2023 Nov 6. doi: 10.1158/0008-5472.CAN-23-1448. Epub ahead of print. PMID: 37930937.






