國自然熱點-遷移體的最近新文章:PI(4,5)P -Rab35軸調(diào)節(jié)遷移體形成

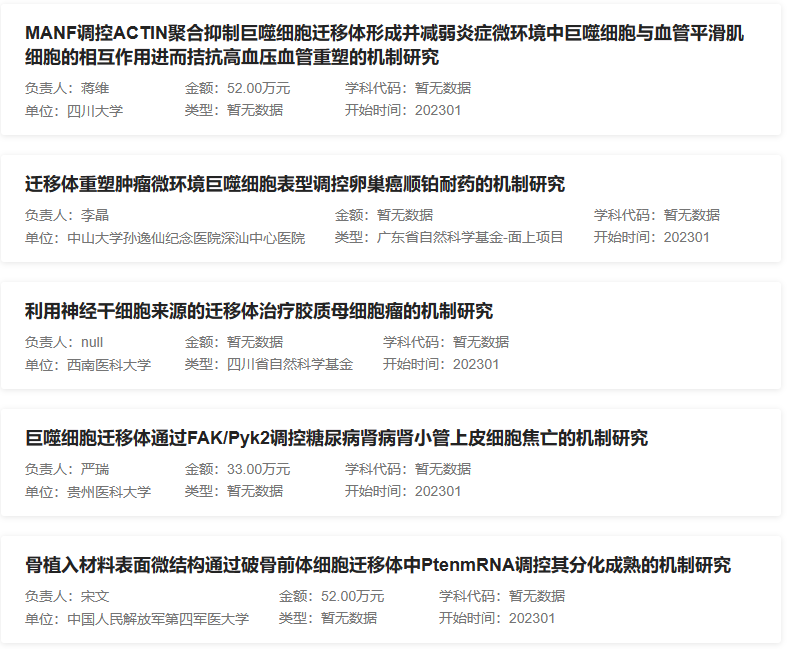
遷移體是最近發(fā)現(xiàn)的新興細胞器,其形成與細胞遷移密切相關(guān)。當細胞在胞外基質(zhì)上遷移時,被稱為收縮纖維(RFs)的長膜突起從細胞后部的質(zhì)膜上拉出。RFs就像連接細胞體和基質(zhì)的繩索。遷移體是一種大的囊泡狀結(jié)構(gòu),在RFS形成開始數(shù)小時后開始在RFs上生長。遷移體內(nèi)部包含多個小囊泡,像石榴一樣,可攜帶多種生物分子。遷移體提供了一種整合和傳遞時空化學信息的機制,用于細胞間的交流。目前關(guān)于遷移體的中標項目逐漸增多,遷移體的功能和機理研究仍待發(fā)掘,因此不失為基金申請的好方向。下圖為2023年部分遷移體中標項目的題目:
那么,如何在課題中引入和研究遷移體呢?下面,作者通過一篇最近的新高分文章解讀來了解。
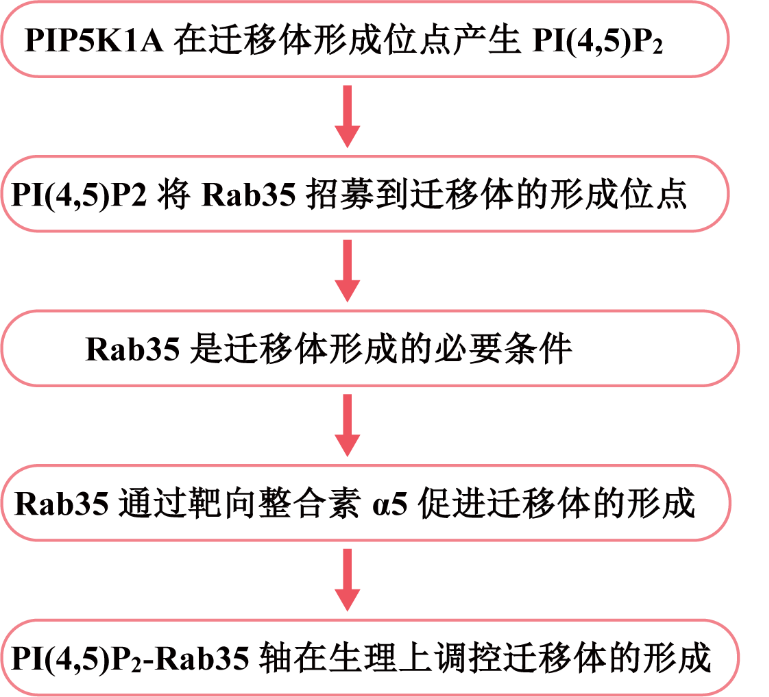
遷移體是最近發(fā)現(xiàn)的細胞器,它形成于遷移細胞后緣的RFs的末端或分支點上。先前,作者發(fā)現(xiàn)整合素在遷移體形成部位的募集對遷移體的生物發(fā)生至關(guān)重要。在這項研究中,作者發(fā)現(xiàn)在遷移體形成之前,PIP5K1A(一種將PI4P轉(zhuǎn)化為PI(4,5)P2的PI4P激酶)被募集到遷移體形成位點。PIP5K1A的募集導致在遷移體形成位點產(chǎn)生PI(4,5)P2。一旦積累,PI(4,5)P2通過與Rab35的C端多堿性簇相互作用將Rab35招募到遷移體形成位點。作者進一步證明,活性Rab35通過在遷移體形成位點募集和聚集整合素α5來促進遷移體的形成,這可能是由整合素α5和Rab35之間的相互作用介導。該研究確定了協(xié)調(diào)遷移體生物形成的上游信號通路,于2023年8月發(fā)表在《Journal of Cell Biology》,IF = 44.1。
研究思路
主要研究結(jié)果
1. PIP5K1A在遷移體形成位點產(chǎn)生PI(4,5)P2
之前,作者發(fā)現(xiàn)PI(4,5)P2的探針PLCγ-PH-TagBFP可以標記遷移體,作者在這里證實了這一點(圖1A)。使用抗PI(4,5)P2抗體對細胞進行染色也顯示遷移體中PI(4,5)P2信號的富集(圖1B)。這些結(jié)果表明遷移體含有PI(4,5)P2。為了研究PI(4,5)P2在遷移體上的動態(tài)分布,作者進行了延時成像發(fā)現(xiàn)PI(4,5)P2的探針PLCγ-PH-TagBFP在TSPAN4之前被募集到遷移體(圖1C)。接下來,作者比較了PLCγ-PH-TagBFP與整合素α5的動態(tài)關(guān)系。作者發(fā)現(xiàn)PLCγ-PH-TagBFP的募集速度略快于整合素α5(圖1D, E)。這些數(shù)據(jù)表明在遷移體生長之前,PI(4,5)P2在遷移體形成部位產(chǎn)生或聚集。PI4P激酶可將PI4P轉(zhuǎn)化為PI(4,5)P2,從而產(chǎn)生PI(4,5)P2。為了檢測PI4P激酶是否參與遷移體形成部位PI(4,5)P2的生成,作者對細胞進行了染色,作者發(fā)現(xiàn)PIP5K1A定位在遷移體上(圖1F)。同樣,異位表達的PIP5K1A-GFP定位在遷移體上,延時成像顯示PIP5K1A-GFP被招募到遷移體形成的位置,比TSPAN4的招募要早(圖1G)。這與PI(4,5)P2信號的外觀一致(圖1C)。
接下來,作者測試了PIP5K1A是否在遷移體形成位點負責PI(4,5)P2的生成。使用PIP5K1A抑制劑ISA2011B處理細胞,發(fā)現(xiàn)ISA2011B處理阻斷了遷移體的形成(圖1H, I)。為了進一步證實PI(4,5)P2是遷移體形成所必需的,在PIP5K1A敲除(KO)細胞中,遷移體的形成明顯減少,而異位表達的野生型(WT) PIP5K1A恢復了遷移體的形成(圖1J, K)。這表明PIP5K1A的酶活性是遷移體形成所必需的,并進一步證明PI(4,5)P2的水平是遷移體形成的決定因素。總之,這些結(jié)果表明PIP5K1A在遷移體形成部位產(chǎn)生PI(4,5)P2是遷移體生物發(fā)生所必需的。由于PI(4,5)P2可以被脂質(zhì)磷酸酶水解,作者接下來研究了已知PI(4,5)P2磷酸酶的定位,發(fā)現(xiàn)PLCD3定位在遷移體上為了進一步測試PI(4,5)P2在遷移體形成中的作用,作者構(gòu)建了PLCD3 KO細胞系。在該細胞系中,遷移體的形成明顯增強,PLCD3的異位表達使遷移體的形成恢復到正常水平。總之,這些證實PI(4,5)P2在遷移體形成中的作用。
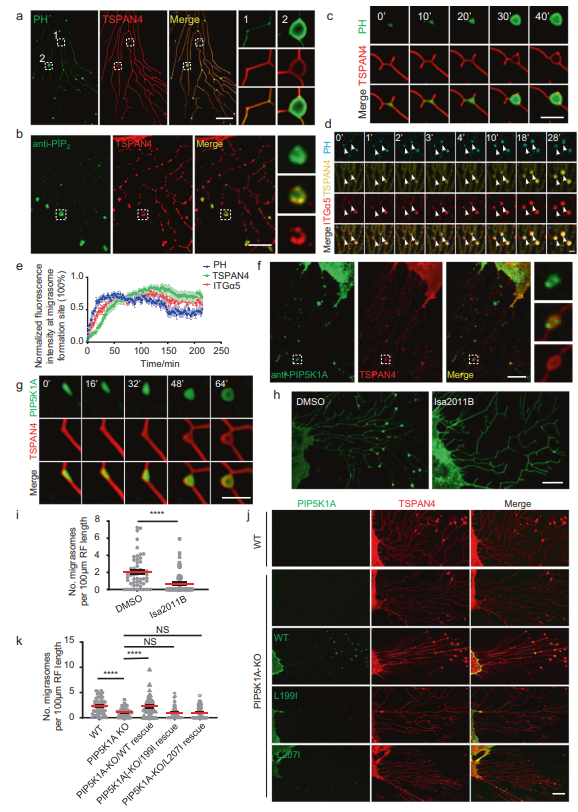
圖1 PIP5K1A在遷移體形成位點產(chǎn)生PI(4,5)P2。
2. PI(4,5)P2將Rab35招募到遷移體的形成位點
接下來,作者研究了PI(4,5)P2如何調(diào)控遷移體的形成。作者推斷PI(4,5)P2可能通過募集PI(4,5)P2結(jié)合蛋白調(diào)控遷移體的形成,而這些蛋白是遷移體形成所必需的。為了篩選可能定位于遷移體的PI(4,5)P2結(jié)合蛋白,作者首先編制了大鼠基因組中所有PI(4,5)P2結(jié)合蛋白的列表。接下來,作者將此列表與遷移體中的蛋白質(zhì)列表進行比較,作者之前通過純化遷移體的質(zhì)譜(MS)分析發(fā)現(xiàn)了23個PI(4,5) P2結(jié)合蛋白MS列表,包括Rab35(圖2a)。然后,作者為其中的19個蛋白生成了mcherry標記的構(gòu)建體,并發(fā)現(xiàn)其中一些蛋白定位在遷移體上。在這些蛋白中,作者選擇Rab35進行進一步的研究,因為Rab35在細胞器生物發(fā)生中起著關(guān)鍵作用。
首先用抗Rab35抗體染色細胞來證實Rab35的募集。作者發(fā)現(xiàn)內(nèi)源性Rab35確實定位于遷移體和沿著RFs的小點上(圖2B)。同樣,異位表達的mCherry-Rab35定位于遷移體和遷移體形成位點(圖2C)。為了研究Rab35招募的動態(tài),作者使用mCherry-Rab35進行了延時成像(圖2D),發(fā)現(xiàn)Rab35信號首先沿RFs均勻擴散分布。在遷移體形成之前,Rab35信號逐漸集中在分支點,并變得更加強烈。最終,Rab35陽性點開始擴大并長成遷移體(圖2D)。這些結(jié)果表明Rab35在遷移體生物發(fā)生之前被募集到遷移體形成的位點。接下來,作者測試了Rab35在遷移體形成位點的募集是否依賴于PI(4,5)P2。作者用PIP5K1A抑制劑ISA2011B處理細胞,觀察到Rab35在遷移體形成位點的募集受損(圖2E, F)。同樣,在PIP5K1A KO細胞中,Rab35未能被募集到遷移體形成位點(圖2G, H)。這些結(jié)果證實Rab35的募集依賴于PI(4,5)P2。
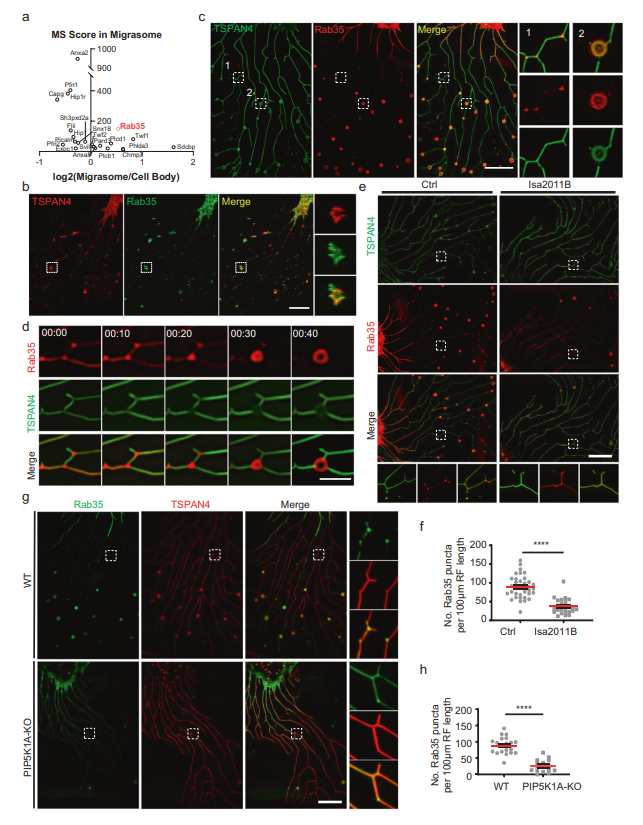
圖2 PI(4,5)P2將Rab35招募到遷移體的形成位點
3. Rab35是遷移體形成的必要條件
接下來,為了測試Rab35是否需要遷移體的形成,作者產(chǎn)生了Rab35 KO細胞系。作者發(fā)現(xiàn),Rab35的KO嚴重損害了遷移體的形成(圖3A, B)。有趣的是,Rab35的KO增加了RFs的數(shù)量和長度(圖3A, C)。Rab35 KO細胞系中WT Rab35和組成型活性Rab35-q67l的穩(wěn)定表達挽救了遷移體的形成,而Rab35-s22n的顯性陰性突變體的穩(wěn)定表達未能挽救遷移體的形成(圖3D, F)。這些結(jié)果表明,活性Rab35是遷移體形成所必需的。先前的文獻表明,PI(4,5)P2通過與其C端多堿性氨基酸團簇(由一段帶正電的賴氨酸和精氨酸殘基組成)相互作用將Rab35招募到質(zhì)膜上當作者用非極性中性氨基酸Ala (Rab35-7a)取代多堿性氨基酸簇時,作者發(fā)現(xiàn)突變體Rab35不能被招募到遷移體中,也不能挽救遷移體的形成(圖3D, E)。為了進一步證實Rab35在遷移體形成中的作用,作者建立了穩(wěn)定表達WT Rab35、顯性陰性Rab35-s22n和組成活性Rab35-q67l的細胞系。與拯救實驗一致,作者發(fā)現(xiàn)過表達WT Rab35和組成活性Rab35-q67l增強了遷移體的形成,而表達顯性陰性的Rab35-s22n減少了遷移體的形成。此外,表達顯性陰性的Rab35-s22n增強遷移體形成(圖3F)。綜上所述,這些數(shù)據(jù)表明Rab35在調(diào)節(jié)RFs長度和遷移體形成中起重要作用。
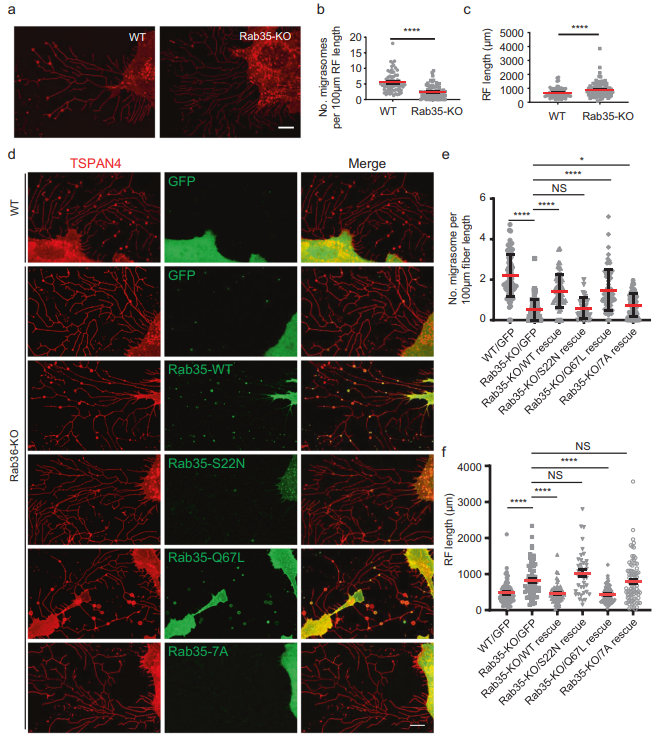
圖3 Rab35是遷移體形成所必需的
4. Rab35通過靶向整合素α5促進遷移體的形成
最后,作者研究了Rab35如何促進遷移體的形成。先前的文獻表明Rab35是整合素運輸所必需的,因此作者選擇研究整合素和Rab35之間的關(guān)系。先前作者發(fā)現(xiàn)整合素異源二聚體與細胞外基質(zhì)(ECM)蛋白的配對決定遷移體的形成具體來說,作者發(fā)現(xiàn)當細胞在包被特定ECM蛋白的培養(yǎng)皿中生長時,可以與特定ECM蛋白結(jié)合的整合素異二聚體在遷移體形成位點高度富集,并在遷移體的生物發(fā)生中發(fā)揮重要作用。在纖維連接蛋白上生長的細胞中,整合素α5β1在遷移體中高度富集。在WT細胞中,大部分整合素α5集中在遷移體上,縮回纖維中很少有整合素α5。相反,作者發(fā)現(xiàn)在Rab35 KO細胞中,ITGα5-GFP不是集中在遷移體形成部位,而是沿RFs均勻彌散分布(圖4A-C)。這表明在Rab35缺失的情況下,整合素對遷移體形成位點的靶向作用受損。接下來,作者研究了rab35依賴性募集ITGα5-GFP的分子機制。先前的報道表明,所有整合素α亞基都可以通過保守的膜-近端GFFKR基序與Rab21結(jié)合,該基序也存在于整合素α5.14中。作者想知道Rab35是否可以通過該基序與整合素α5結(jié)合。為了驗證這一假設(shè),作者制作了一個整合素α5突變蛋白,GFFKR突變?yōu)锳AAAA (1-5A)。作為對照,作者還生成了另外4個突變體,其中整合素α5細胞質(zhì)部分的4組連續(xù)5個氨基酸突變?yōu)锳AAAA (2-5A, 3-5A, 4-5A, 5-5A)(圖4D)。總之,這些突變體覆蓋了大部分整合素α5細胞質(zhì)結(jié)構(gòu)域。作者發(fā)現(xiàn)GFFKR/AAAAA (1-5A)突變體對遷移體形成位點的靶向性受損(圖4E, F)。這表明GFFKR基序是將整合素α5靶向到遷移體形成位點所必需的,可能是通過影響與Rab35的關(guān)聯(lián)。
接下來,作者想直接測試Rab35和整合素α5之間可能的相互作用。使用雙色熒光相互關(guān)聯(lián)光譜(dcFCCS)捕捉Rab35與整合素α5的胞質(zhì)結(jié)構(gòu)域(ITGα5-cyto)之間的相互作用(圖4)。作者首先純化了GFP-Rab35-WT和GFPRab35-Q67L(組成型活性突變體)蛋白,合成了用熒光團Cy5 (Cyanine5)標記的ITGα5-cyto-WT和ITGα5-cyto-1-5A。當GFP-Rab35-WT與Cy5-ITGα5-cyto-WT或Cy5熒光團混合時,兩者均未表現(xiàn)出顯著的互相關(guān)信號(圖4H),說明WT-Rab35與Cy5-ITGα5-cyto-WT沒有結(jié)合。而本構(gòu)活性突變體GFP-Rab35-Q67L在類似實驗條件下與Cy5-ITGα5-cytoWT表現(xiàn)出較強的相互關(guān)聯(lián)信號(圖4H),表明GFP-Rab35-Q67L可以結(jié)合Cy5-ITGα5-cyto-WT。相比之下,GFP-Rab35-Q67L與Cy5-ITGα5-cyto-1-5A沒有交叉相關(guān)信號(圖4H),這表明整合素α5的胞質(zhì)結(jié)構(gòu)域與Rab35的活性形式結(jié)合需要GFFKR基序。值得注意的是,重組GFP-Rab35-WT是從大腸桿菌中純化出來的,因此應(yīng)該處于失活狀態(tài)。作為對照,作者還測試了GFP-Rab35-S22N與Cy5-ITG-α5-cyto-WT的結(jié)合,發(fā)現(xiàn)GFP-Rab35-S22N與Cy5-ITG-α5-cyto-WT之間沒有結(jié)合。這些數(shù)據(jù)表明,活性Rab35可以通過GFFKR基序結(jié)合到整合素α5的細胞質(zhì)結(jié)構(gòu)域。作者推斷,如果Rab35通過與整合素α5的GFFKR基序相互作用將整合素α5招募到遷移體的形成位點,那么將含有GFFKR基序的整合素α5衍生肽加載到細胞中應(yīng)該會競爭性地抑制Rab35介導的整合素α5招募到遷移體的形成位點,從而減少遷移體的形成。事實上,作者發(fā)現(xiàn)用質(zhì)膜滲透肽Tat-ITGα5-cyto-WT處理細胞減少了整合素對遷移體形成部位的靶向和遷移體的形成。相比之下,用GFFKR/AAAAA突變肽處理細胞未能阻斷整合素靶向或遷移體的形成(圖4I-L)。這些結(jié)果表明Rab35通過將整合素靶向到遷移體形成位點來促進遷移體的形成。
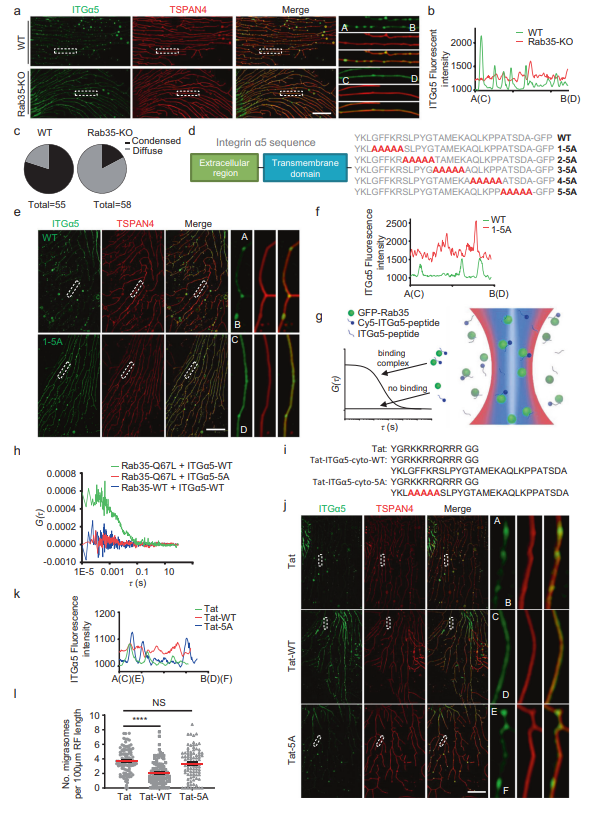
圖4 Rab35通過靶向整合素α5促進遷移體的形成
5. PI(4,5)P2-Rab35軸在生理上調(diào)控遷移體的形成,并且在進化上是保守的
最后,作者測試了PI(4,5)P2-Rab35軸是否在不同環(huán)境下調(diào)節(jié)遷移體的形成。作者首先測試了BJ細胞,這是一種從新生兒男性正常包皮皮膚上建立的成纖維細胞系。作者發(fā)現(xiàn),用PIP5K1A抑制劑ISA2011B(圖5A, B)或敲低PIP5K1A(圖5C, D)處理BJ細胞,會顯著損害遷移體的形成。此外,用Tat-ITGα5-cyto-WT處理BJ細胞,可以阻斷遷移體的形成(圖5E, F)。這些觀察結(jié)果表明,PI(4,5)P2-Rab35軸對遷移體形成的調(diào)節(jié)在人類細胞中是保守的。最后,作者在體內(nèi)測試了PI(4,5)P2-Rab35軸是否調(diào)控遷移體的形成。以前,作者報道斑馬魚在胚胎發(fā)育過程中形成遷移體。這里,作者發(fā)現(xiàn)與GFFKR/AAAAA突變肽相比(圖5K, L),用PIP5K1A抑制劑(圖5G, H)處理斑馬魚胚胎可以顯著減少遷移體的形成。此外,使用反義morpholino寡核苷酸(MO)敲除Rab35可顯著降低斑馬魚胚胎中遷移體的形成(圖5I, J)。總之,這些發(fā)現(xiàn)表明PI(4,5)P2-Rab35軸在一系列生理環(huán)境中調(diào)節(jié)遷移體的形成,并且在不同的脊椎動物中是保守的。
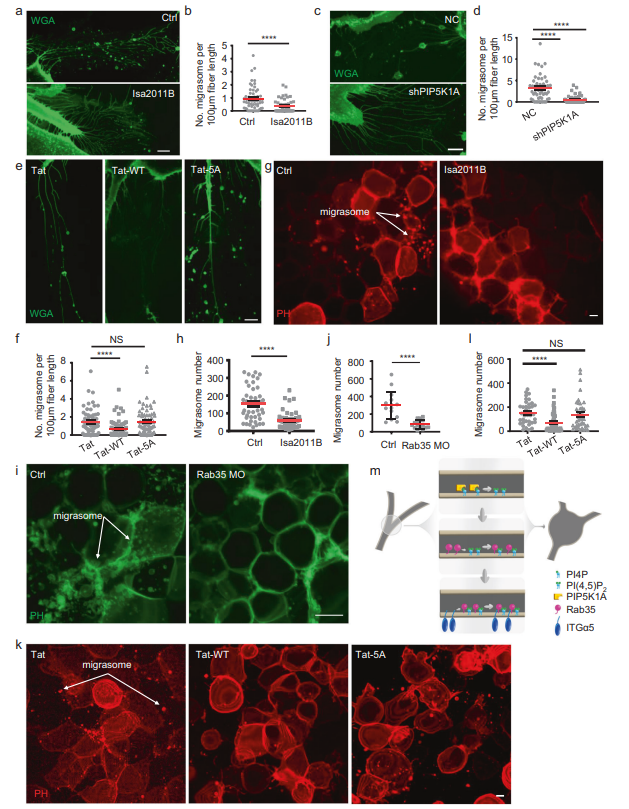
圖5 PI(4,5)P2-Rab35軸在生理上調(diào)控遷移體的形成,并且在進化上是保守的
討論
作者提出調(diào)節(jié)遷移體生物發(fā)生的信號事件的臨時模型(圖5)。PIP5K1A的募集和遷移體形成位點上PI(4,5)P2的重新合成可能是遷移體形成的觸發(fā)信號。一旦PI(4,5)P2達到濃度閾值,活性Rab35通過其多堿性簇被招募到遷移體形成部位。然后,Rab35作為適配器將整合素募集到遷移體形成位點。因此,活性Rab35和整合素之間的相互作用為遷移體的形成創(chuàng)造了必要的粘附點。
細胞器的生物發(fā)生通常受到信號通路的嚴格調(diào)控。在許多情況下,脂質(zhì)激酶是這些信號級聯(lián)反應(yīng)的核心,它將代謝、機械和其他信號結(jié)合起來,啟動特定細胞器的生物發(fā)生。這項研究結(jié)果揭示了PI(4,5)P2-Rab35軸在遷移體形成中的重要作用。遷移體可以添加到越來越多的細胞器列表中,其生物發(fā)生由磷酸肌苷信號控制。此外,作者的數(shù)據(jù)表明,遷移體的形成是一個受信號通路嚴格調(diào)控的主動生物發(fā)生過程,而不是一個膜脫落過程,在這個過程中,膜碎片被動地從遷移細胞的后緣丟失。作者發(fā)現(xiàn)PIP5K1A在遷移體形成之前被招募到遷移體形成的部位,這個過程中的分子機制仍不清楚,可能是由遷移體形成部位的特定脂質(zhì)/蛋白質(zhì)組成決定的;也有可能生物物理特性,如膜曲率,可能有助于PIP5K1A的優(yōu)先招募。未來的研究需要解決這個重要的問題。PIP5K1A募集后PI(4,5)P2的快速積累,表明至少有一部分遷移體形成位點上的PI(4,5)P2是由位于這些位點的PIP5K1A重新合成的。遷移體上高度富集的PI(4,5)P2不會擴散到RFs上,這表明遷移體形成部位可能具有獨特的特性,有利于PI(4,5)P2的駐留。作者推測,從頭合成加上PI(4,5)P2的駐留可能解釋了PI(4,5)P2在遷移體形成部位的快速積累。研究證實整合素α5靶向遷移體形成位點依賴于活性Rab35。dcFCCS分析表明,整合素α5的胞質(zhì)部分可以通過其GFFKR基序與活性Rab35相互作用。這些數(shù)據(jù)表明Rab35可能通過直接相互作用將整合素α5募集到遷移體形成位點。然而,Rab35與整合素α5的相互作用也有可能是間接的。除了整合素,Rab35可能還有其他效應(yīng)蛋白和銜接蛋白參與遷移體的生物發(fā)生。此外,Rab35的活性如何在遷移體的生物發(fā)生中受到調(diào)節(jié)尚不清楚。為了回答這些重要的問題,未來的研究應(yīng)關(guān)注遷移體生物發(fā)生的復雜調(diào)控網(wǎng)絡(luò)。
實驗方法
細胞培養(yǎng)和轉(zhuǎn)染,免疫熒光,成像和圖像分析,蛋白純化,多肽合成,ITGα5-細胞肽標記,dcFCCS測量和數(shù)據(jù)分析
參考文獻
Ding T, Ji J, Zhang W, Liu Y, Liu B, Han Y, Chen C, Yu L. The phosphatidylinositol (4,5)-bisphosphate-Rab35 axis regulates migrasome formation. Cell Res. 2023 Aug;33(8):617-627. doi: 10.1038/s41422-023-00811-5.






