病理性高眼壓通過Drp1誘導線粒體功能障礙導致青光眼視網膜神經節細胞泛凋亡

泛凋亡作為近年來的研究熱點,是一種細胞炎癥性程序性死亡,由特定的觸發器激活,并由泛凋亡復合體(PANoptosome)調控,具有焦亡、凋亡和(或)壞死性凋亡的關鍵特征,但不能單獨由這三種程序性死亡通路中的任何一種來解釋。下圖是2023年部分關于泛凋亡的中標題目:
青光眼是一種常見的神經退行性疾病,其特征是視網膜神經節細胞(RGC)缺失和視野缺損。病理性高眼壓(ph-IOP)是青光眼的重要危險因素,它會觸發控制 RGC 死亡和軸突變性的分子不同級聯反應。動力蛋白相關蛋白1(Drp1)介導的線粒體動力學異常與青光眼發病機制有關。然而,對調節RGC損傷和死亡的確切途徑知之甚少。在這里,我們旨在研究ERK1/2-Drp1-活性氧 (ROS) 軸在 RGC 死亡中的作用以及 Drp1 介導的線粒體動力學與 ph-IOP 損傷中 與泛凋亡之間的關系。作者研究表明抑制ERK1/2-Drp1-ROS通路是治療ph-IOP誘導損傷的潛在治療策略。此外,抑制 Drp1 可以通過調節 ph-IOP 模型中 NLRP3介導的細胞焦亡和 RIP介導的細胞壞死來調節 RGC泛凋亡。該研究發表在《Redox Biology》,IF:11.4。
技術路線

主要研究結果
1. 氧和葡萄糖剝奪再灌注(OGD/R )模型誘導 R28 細胞線粒體損傷和死亡
OGD/R細胞模型建立:將R28細胞傳代后更換為無葡萄糖DMEM培養基并且將細胞置于缺氧室中培養4個小時,然后在正常完全培養基中復氧1小時、3小時或 6 小時(圖1A)。使用 Hoechst 33342和PI雙重染色檢測發現OGD/R 誘導細胞死亡(圖1B和C)。OGD/R 3小時后,JC-1染色檢測線粒體膜電位發現線粒體膜電位下降,預示著細胞開始出現凋亡(圖1D和E)。免疫熒光檢測線粒體外膜蛋白Tom20來檢查線粒體形態變化,發現OGD/R后線粒體明顯碎片化增加(圖1F和G)。OGD/R 損傷也增加了 線粒體ROS含量,(圖1H)。之后檢測了與線粒體動力學相關的蛋白水平的變化,發現線粒體裂變相關蛋白Drp1(Ser616)的磷酸化增加。為了探究Drp1(Ser616)激活的上游靶點,我們對RNA測序(RNA-seq)結果進行了分析,KEGG顯示差異基因在MAPK通路中富集。之后進一步驗證OGD/R后ERK1/2和p-ERK1/2的表達水平,發現發現 p-Drp1 (Ser616) 和 p-ERK1/2 表達水平在 OGD/R 后 1 h 達到峰值,而 Drp1 和 ERK1/2 的表達基本保持不變 (圖1J 和 M)。證明在 OGD/R 后 3 小時進行了后續表型研究。這些結果初步表明,OGD/R模型可以誘導R28細胞的線粒體功能障礙和細胞死亡。
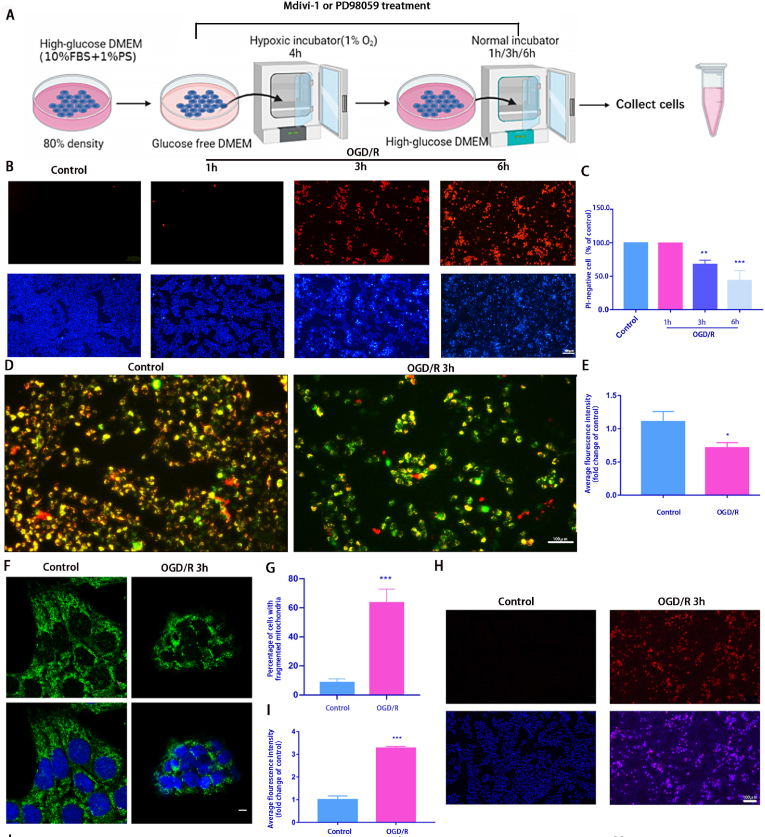
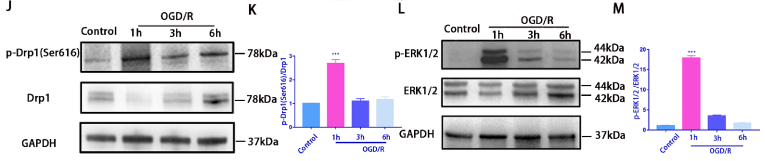
圖1.氧和葡萄糖剝奪再灌注(OGD/R )模型誘導 R28 細胞線粒體損傷和死亡
2. Drp1抑制劑和敲低Drp1處理減弱了 R28 細胞中 OGD/R 誘導的細胞損傷
siRNA敲低Dpr1方法:將 R28 細胞鋪板并培養至 30% 匯合度進行轉染。轉染4 h后,將R28細胞再培養48 h,然后進行OGD/R建模(圖2A)。為了進一步確定Drp1介導的線粒體裂變對OGD/R誘導損傷的影響,在OGD/R模型中分別使用Mdivi-1(Drp1抑制劑)或 siRNA 研究了p-Drp1(Ser616)對R28細胞的影響,發現使用Mdivi-1或者敲低p-Drp1能夠顯著降低PI陽性細胞(圖2B和C)。OGD/R誘導的和ATP產量減少在Mdivi-1處理組中部分恢復(圖2D 和 E。在用Mdivi-1和siRNA處理后,OGD/R誘導的線粒體片段化和mtROS含量顯著降低 (圖2F 和 G、2I 和 J)。說明Mdivi-1或siRNA處理都能夠對線粒體功能產生保護作用從而緩解細胞損傷。
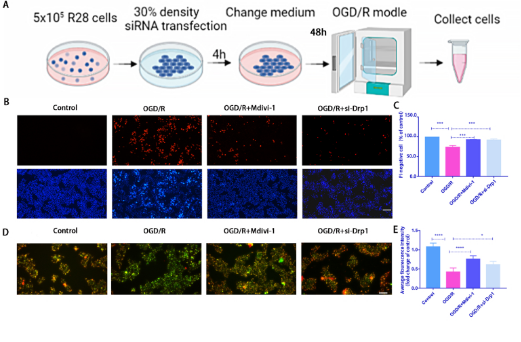
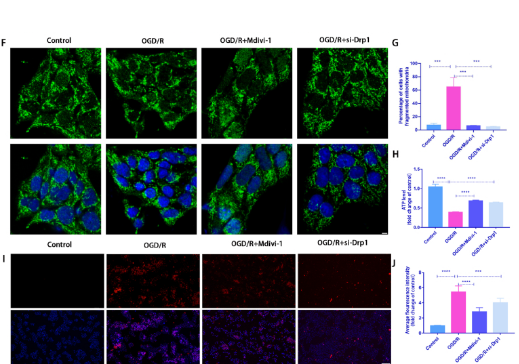
圖2.Drp1抑制劑和敲低Drp1處理減弱了 R28 細胞中 OGD/R 誘導的細胞損傷
3. ERK1/2介導的 Drp1 Ser616磷酸化調節R28細胞OGD/R誘導損傷期間的線粒體變化
由于 OGD/R 模型中 p-ERK1/2 顯著升高,接著使用 p-ERK1/2 抑制劑 PD98059 來確定它是否可以通過 p-Drp1(Ser616)預防OGD/R損傷,以闡明 p-ERK1/2 和 p-Drp1(Ser616)之間的關系。圖3A和B表明實驗發現,OGD/R誘導的p-Drp1(Ser616)在PD98059處理后被顯著抑制。Hoechst 33342 和 PI 雙染色結果顯示,與單獨使用 OGD/R 相比,PD98059 或 敲低 p-ERK1/2 顯著提高了細胞存活率(圖3C和D)。此外,線粒體功能部分恢復,ATP水平顯著增加(圖3E和F,3I)。此外,PD98059 和敲低 p-ERK1/2減少了線粒體片段化和 mtROS 的產生 (圖3G 和 H、3J 和 K)。這些結果表明,抑制ERK-Drp1(Ser616)通路通過挽救線粒體功能障礙和清除mtROS產生來防止OGD/R誘導的損傷。


圖3. ERK1/2介導的 Drp1 Ser616磷酸化調節R28細胞OGD/R誘導損傷期間的線粒體變化
4. ph-IOP 損傷誘導的小鼠 中出現RGC 線粒體損傷和細胞死亡
HE結果顯示,ph-IOP組的視網膜結構逐漸不規則,視網膜層明顯疏松無序,RGCs數量處理隨時間減少。視網膜GCL和內叢狀層(IPL)明顯水腫,48 h視網膜厚度明顯減小,ph-IOP損傷顯著降低視網膜GCL細胞數量(圖4A和B),在視網膜石蠟切片的RBPMS免疫熒光染色中也呈現相同趨勢,對照組標記的RGCs數量更多(圖4C和D)。視網膜 ph-IOP 損傷后 TUNEL 染色陽性細胞數量也顯著增加 (圖4E 和 F)。此外,ROS總量在視網膜ph-IOP損傷后24 h達到峰值,48 h后略有下降。
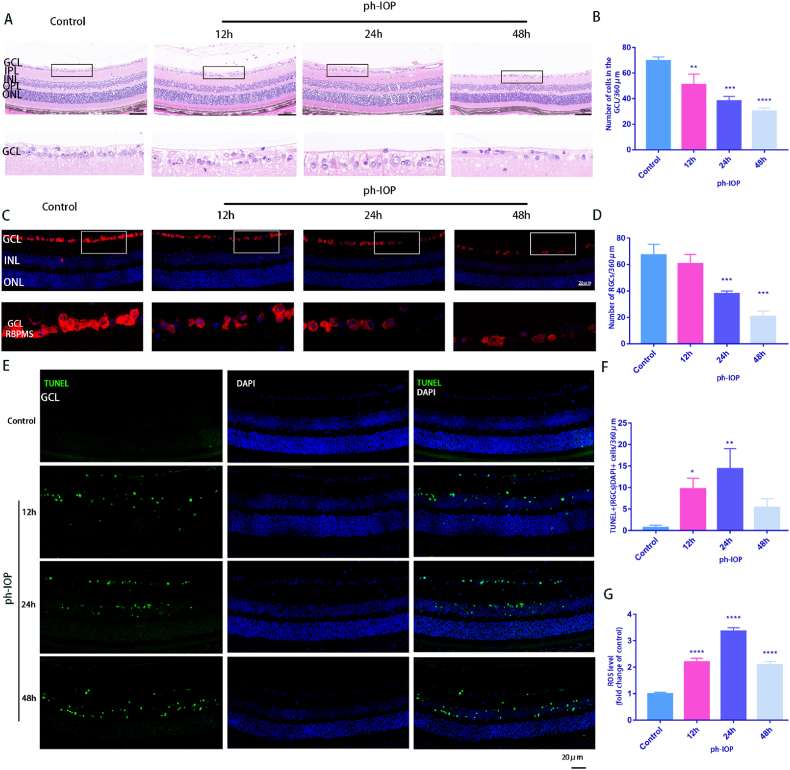
圖4.ph-IOP 損傷誘導的小鼠 中出現RGC 線粒體損傷和細胞死亡
5. ph-IOP損傷激活的ERK1/2-Drp1(Ser616)-ROS信號通路
在ph-IOP損傷后3 h、6 h、12 h、24 h和48 h檢測小鼠視網膜中ERK1/2和Drp1(Ser616)蛋白的表達。p-ERK1/2 表達在 3 h 時升高,并在 12 h 達到峰值。同時,p-Drp1(Ser616)表達在6 h時顯著升高,并在24 h時達到峰值(圖5A-C)。同時,RBPMS與p-Drp1(Ser616)和p-ERK1/2共染色進行免疫熒光分析,結果與WB結果一致(圖5D-G)。p-ERK1/2和p-Drp1(Ser616)的熒光強度分別在12 h和24 h達到峰值。WB 結果顯示,視網膜PD98059治療可降低 ph-IOP 誘導的 p-Drp1(Ser616) 升高 (圖5H 和 I),表明 p-ERK1/2 可能通過 p-Drp1 (Ser616) 在 RGC 損傷中發揮作用。隨后,Mdivi-1 和 PD98059 分別用于抑制 p-Drp1 (Ser616) 和 p-ERK1/2,顯著降低小鼠視網膜 (圖5J 和 K)。這些結果表明,ERK1/2-Drp1信號通路可能促進ph-IOP損傷中ROS的產生。
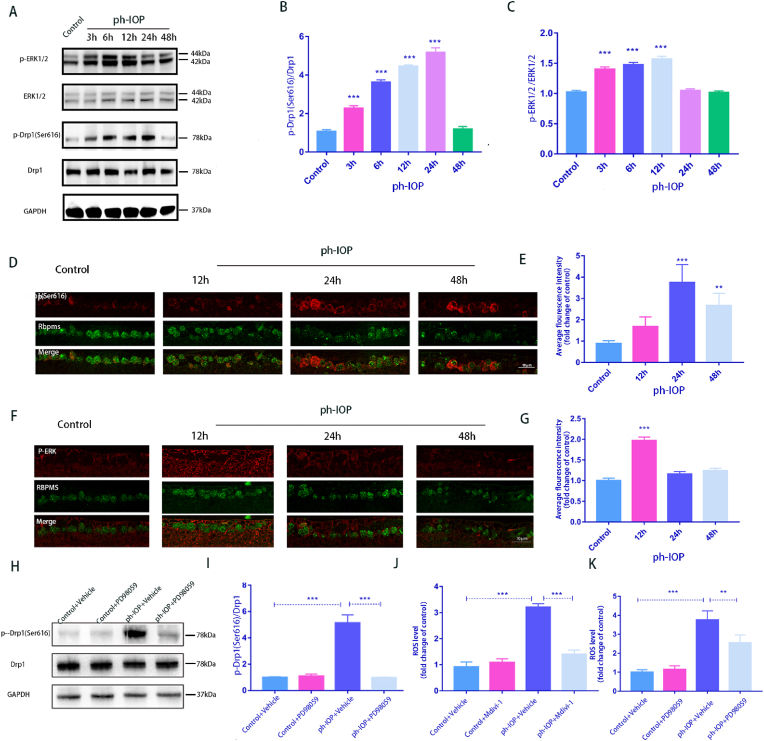
圖5.ph-IOP損傷激活的ERK1/2-Drp1(Ser616)-ROS信號通路
6. 抑制 ERK1/2-Drp1-ROS 信號通路可減少 ph-IOP 誘導的小鼠 RGC 損傷
接下來使用PD98059、Mdivi-1和Mito-TEMPO(ROS抑制劑)研究抑制ERK1/2-Drp1-ROS通路是否可以預防視網膜形態損傷和RGC丟失。HE結果顯示,ph-IOP損傷后24 h,對照組視網膜GCL的視網膜形態和細胞數量均有明顯損傷。PD98059、Mdivi-1或Mito-TEMPO治療后,視網膜形態部分恢復,隨后GCL細胞數量也在一定程度上反彈(圖6A和B)。該結果通過RBPMS染色(圖6C和D)。對于平坦的視網膜(圖6E和F)。注射抑制劑后,TUNEL陽性RGCs和其他視網膜細胞的數量顯著減少(圖6G和H)。此外,PD98059和Mdivi-1治療可防止視網膜 ATP 的耗竭。ph-IOP損傷后視網膜ATP含量明顯低于正常組。抑制劑處理后ATP含量顯著升高(圖6I 和J)。Mdivi-1 和 PD98059 治療保留了 ph-IOP 損傷后GCL中線粒體結構的形態,因為這些組中結構混亂的線粒體數量較低(圖6K).
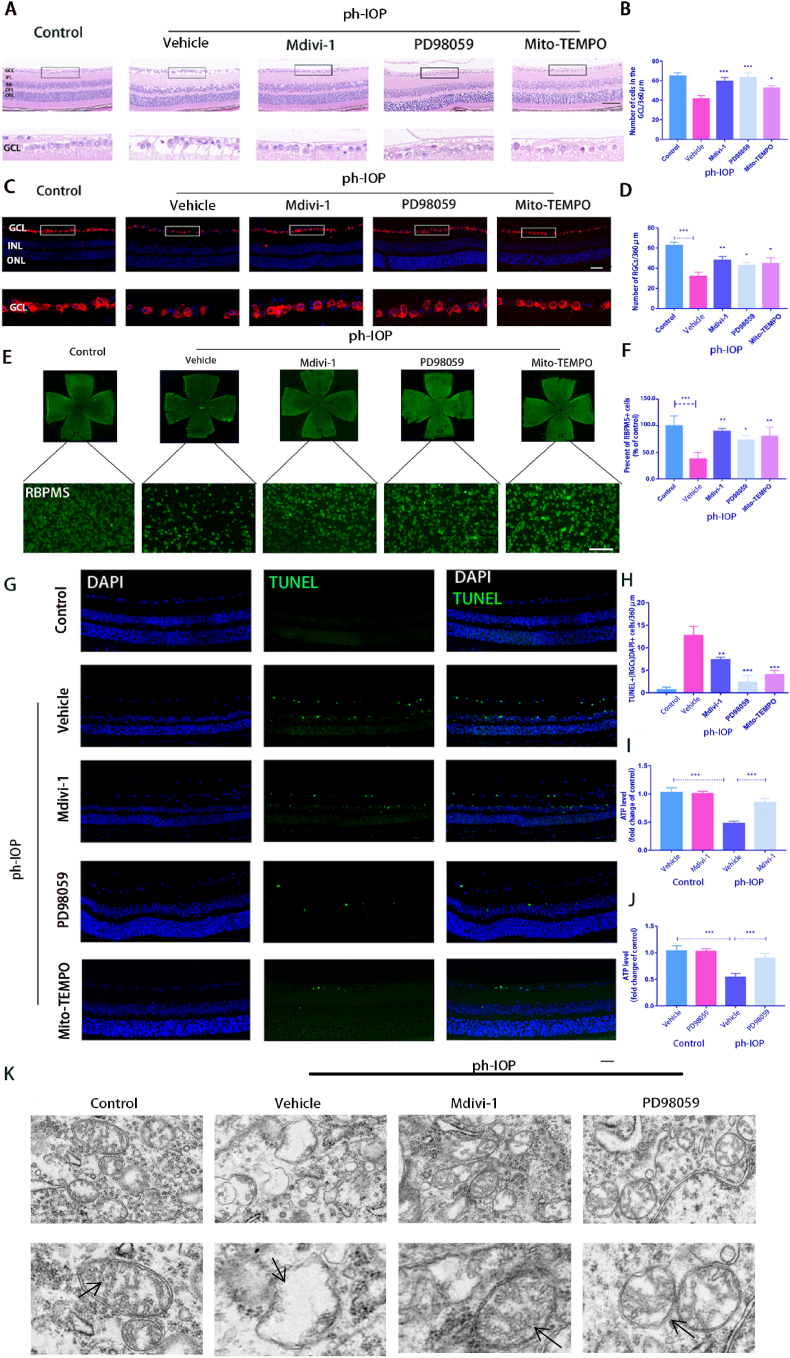
圖6.抑制 ERK1/2-Drp1-ROS 信號通路可減少 ph-IOP 誘導的小鼠 RGC 損傷
7.使用Mdivi-1抑制Drp1或siRNA 處理可挽救 ph-IOP 誘導的 RGC 泛凋亡
玻璃體內注射Drp1 siRNA敲低Drp1,siRNA注射72 h后構建ph-IOP模型,以闡明Drp1在ph-IOP誘導的青光眼中的作用。檢查siRNA治療后的視網膜形態和RGC細胞丟失,發現si-Drp1有效地挽救了ph-IOP誘導的視網膜損傷和RGC丟失(圖7A-D)。WB結果顯示,與對照+NC組相比,si-Drp1顯著降低試驗組p-Drp1(Ser616)表達(圖7E 和 F)。為了研究Drp1與RGCs的泛凋亡的關系,我們采用WB和免疫熒光法分析了泛凋亡相關蛋白的表達。WB 結果顯示,在敲低Dpr1后,細胞凋亡標志物(cleaved-caspase3)(圖 7J)、細胞焦亡(NLRP3/caspase1/GSDMD)(圖7G–I)和壞死性凋亡(p-RIP1/p-RIP3/p-MLKL)(圖7K-M)顯著下調。使用 Mdivi-1在處理ph-IOP模型小鼠,WB和免疫熒光檢測發現,Mdivi-1或si-Drp1處理后GCL中cleaved-caspase3、caspase1和p-MLKL表達水平顯著降低(圖8A-C)。總的來說,作者認為推斷Drp1參與調節 ph-IOP 誘導的視網膜細胞泛凋亡(圖9)。
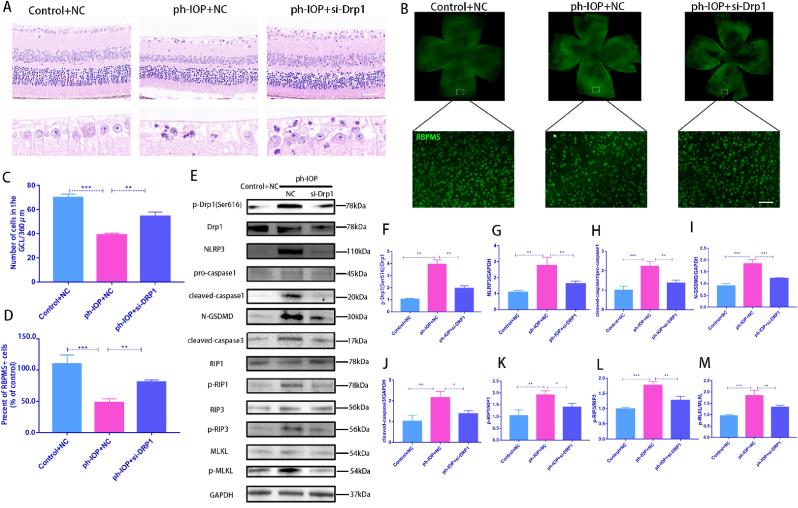
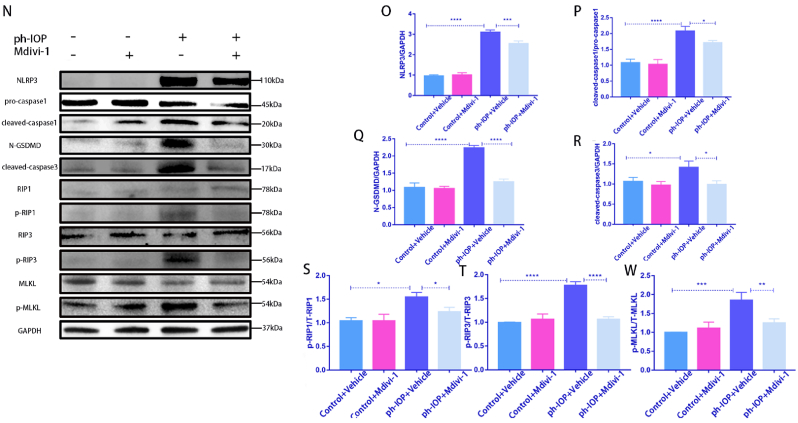
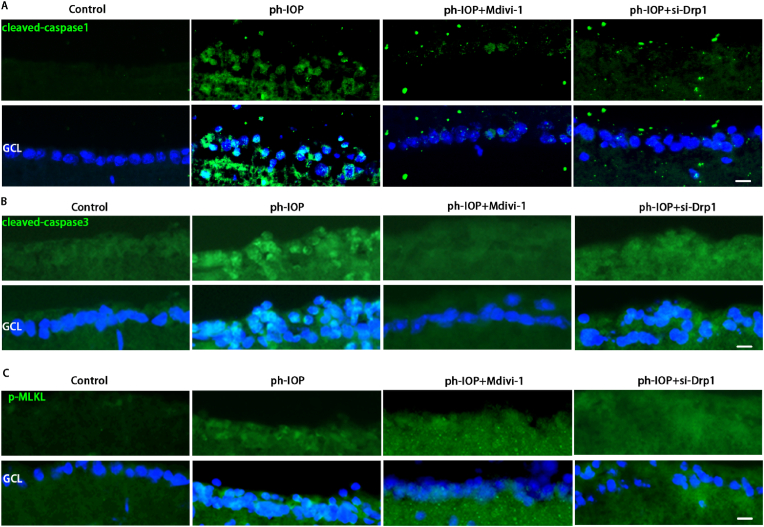
圖7&8.使用Mdivi-1抑制Drp1或siRNA 處理可挽救 ph-IOP 誘導的 RGC 泛凋亡
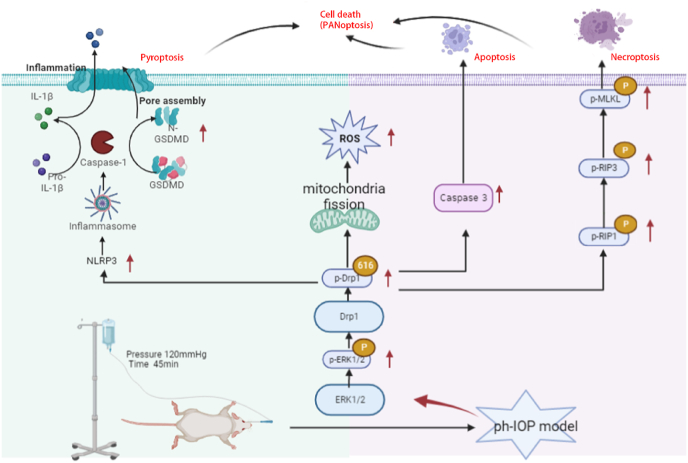
圖9.ph-IOP - 通過 ERK1/2-Drp1-ROS 信號通路誘導 RGC 死亡
結論
作者發現抑制ERK1/2-Drp1-ROS通路是治療ph-IOP誘導損傷的潛在治療策略。為可能的保護性干預措施提供了新的見解,這些干預措施可以調節線粒體動力學以提高RGC的存活率。
實驗方法
細胞培養,大鼠氧-葡萄糖剝奪/再灌注(OGD/R)模型,小鼠p-IOP模型,Hoechst 33342/碘化丙啶(PI)雙染色測定,免疫熒光(IF)染色,透射電子顯微鏡(TEM),蛋白質印跡(WB)分析,RNA測序(RNA-seq)及數據分析,HE染色,TUNEL染色測定,三磷酸腺苷(ATP)測量,小干擾RNA(siRNA)轉染,線粒體膜電位測定,ROS檢測
參考文獻
Zeng Z, You M, Fan C, Rong R, Li H, Xia X. Pathologically high intraocular pressure induces mitochondrial dysfunction through Drp1 and leads to retinal ganglion cell PANoptosis in glaucoma. Redox Biol. 2023 Jun; 62:102687. doi: 10.1016/j.redox.2023.102687.






