組織蛋白酶促進BMI1高表達肝癌細胞的侵襲驅動膽管癌血栓形成
膽管癌栓(BDTT)是一種可能發生于晚期肝細胞癌(HCC)患者的嚴重并發癥,可導致生活質量迅速下降,并與較差的臨床結局相關。然而,由于其細胞起源和發病機制不明,合并BDTT的HCC患者常被誤診誤治。因此,開發一種有效的肝癌合并膽管癌栓的診斷和治療方法是臨床上的迫切要求。既往研究主要集中在探索BDTT的HCC患者的臨床病理或治療措施,而對BDTT的發展過程知之甚少。根據初步的臨床研究,有研究推測高度侵襲性的腫瘤細胞可能通過鄰近膽管壁的上皮下侵襲,導致癌栓的形成。此外,他們注意到BMI1在有BDTT12的HCC患者中表達上調。BMI1在一系列細胞過程中發揮關鍵作用,包括干細胞自我更新、增殖和保存基因組穩定性。此外,它涉及多種癌癥,包括血液系統惡性腫瘤和實體瘤,其過表達常與侵襲性腫瘤行為、腫瘤起始細胞(TICs)的存在和不良預后相關。miRNA是已知的小非編碼分子,參與調節基因表達,其異常表達與TICs特征相關。然而,由于缺乏專門設計的BDTT動物模型,BMI1及其下游效應miRNA在BDTT中的潛在作用仍未被探索。溶酶體組織蛋白酶B(CTSB)是溶酶體半胱氨酸蛋白酶家族的一種成員,積極調節細胞外基質成分的蛋白水解、破壞細胞內通訊、降解基底膜和改變細胞-細胞之間的相互作用,因此在癌癥進展中具有多重潛在作用。然而,BMI1是否通過表觀遺傳調控CTSB在TICs中的分泌從而通過miRNA調控BDTT的發育仍不清楚。該研究發表在《Nature Communications》,IF: 16.6。
技術路線
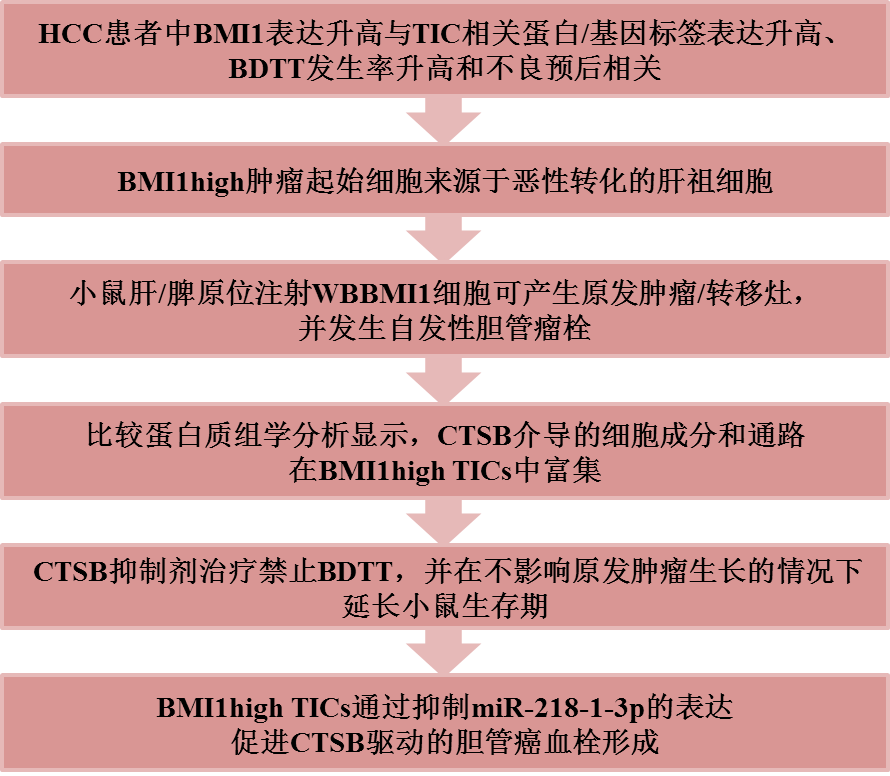
主要研究結果
1. 在HCC患者中,BMI1表達升高與TIC相關蛋白/基因標簽表達升高、BDTT發生率升高和不良預后相關
由于BMI1表達與HCC患者預后之間的關系尚未得到充分探索,因此研究者對來自癌癥基因組圖譜(TCGA)數據庫的臨床和RNA測序數據進行了生物信息學分析。此外,對收集的HCC患者隊列進行了IHC檢查,發現在HCC患者中,BMI1的高表達水平與較差的總生存期、增加的腫瘤大小和升高的癌癥進展相關(圖1a-c)。與之前的研究相比,研究者還收集了一個相對較大的有或無BDTT的HCC患者的樣本隊列,并使用他們對BMI1表達進行了IHC分析,結果表明有BDTT的患者與較差的總生存率相關(圖1d),而BDTT和BMI1高表達的患者與較低的總生存率相關(圖1e)。此外,研究者發現BMI1表達的升高區分了那些BDTT發生率增加的HCC患者(圖1f)。
鑒于BMI1表達在控制TIC自我更新中的作用,進一步研究了HCC患者中TIC相關標簽與BMI1蛋白和mRNA表達之間的關系。在腫瘤區域中,TIC相關蛋白標簽和BMI1的表達呈正相關(圖1g,h)。進一步的臨床研究表明,在HCC患者中,TIC相關蛋白/基因標簽的高表達與BDTT發病率的增加、較差的總生存率相關(圖1i-k)。最后,研究者發現與低表達TIC相關蛋白/基因標簽和BMI1的HCC患者相比,高表達TIC相關蛋白/基因標簽和BMI1的HCC患者的總生存率較差(圖1l,m)。綜上所述,該研究揭示了BMI1與TIC相關標志物的表達之間的潛在關聯,提示BMI1在BDTT的發生和HCC的癌癥進展中發揮作用。這一發現促使研究者深入研究其在調節癌細胞特性中的功能。
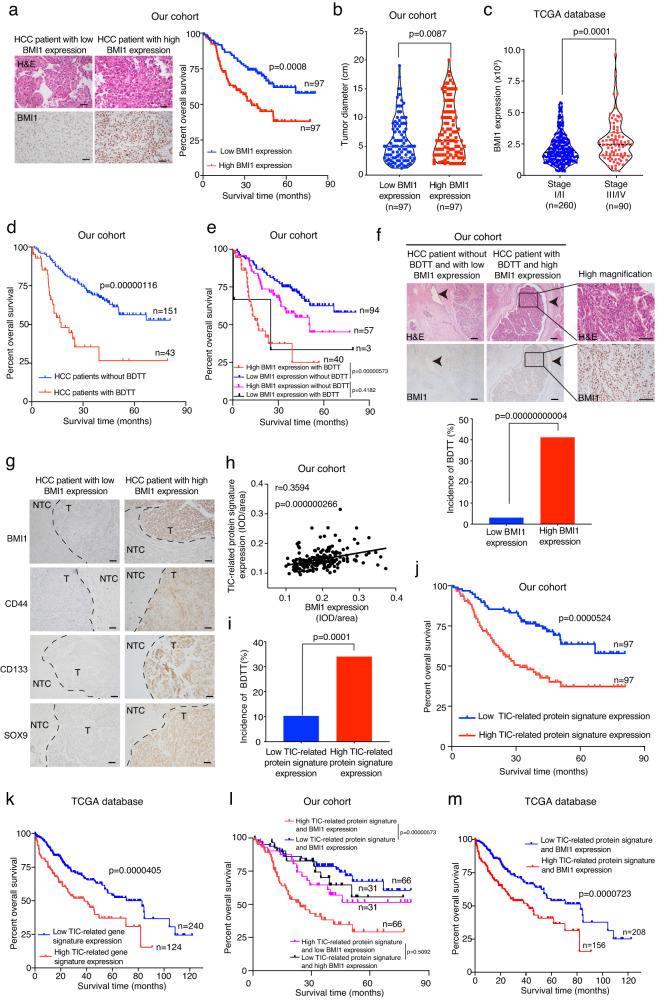
圖1 在HCC中,BMI1高表達與TIC相關基因標簽表達增強、BDTT發生率增加和總體生存率降低相關
2. BMI1high腫瘤起始細胞來源于惡性轉化的肝祖細胞
為了檢測BMI1在HCC發生中的細胞功能,研究者在大鼠LPC細胞系WBF344和人HCC細胞系中對BMI1的表達進行了遺傳修飾(圖2a,b)。研究者的結果表明,與對照細胞相比,BMI1過表達增加了WBBMI1和PLCBMI1細胞的細胞生長(圖2c,d)、集落形成(圖2e,f)、細胞遷移(圖2g,h)和細胞侵襲(圖2i,j)以及腫瘤球形成(圖2k,l)。
為了確定穩定表達BMI1的細胞是否可以通過旁分泌效應調節其侵襲能力,研究者在transwell matrigel侵襲系統中,將WBCtrl或PLCCtrl細胞暴露于來自WBBMI1/WBCtrl細胞或PLCBMI1/PLCCtrl細胞的條件培養基(CM),表明與分別暴露于來自WBCtrl和PLCCtrl細胞的CM的細胞相比,暴露于來自WBBMI1/PLCBMI1細胞的CM增加了WBCtrl和PLCCtrl細胞的侵襲(圖2m-o)。接下來,研究者通過向裸鼠皮下注射少量WBBMI1或WBCtrl細胞來檢測它們在體內的成瘤性,表明注射5000個WBBMI1細胞足以在裸鼠體內形成皮下腫瘤,并且100%有效。相反,WBCtrl細胞未能產生任何可觸及的腫瘤(圖2p,q)。總體而言,這些發現表明,BMI1的過表達可誘導LPC惡性轉化為BMI1high TICs,稱為WBBMI1。
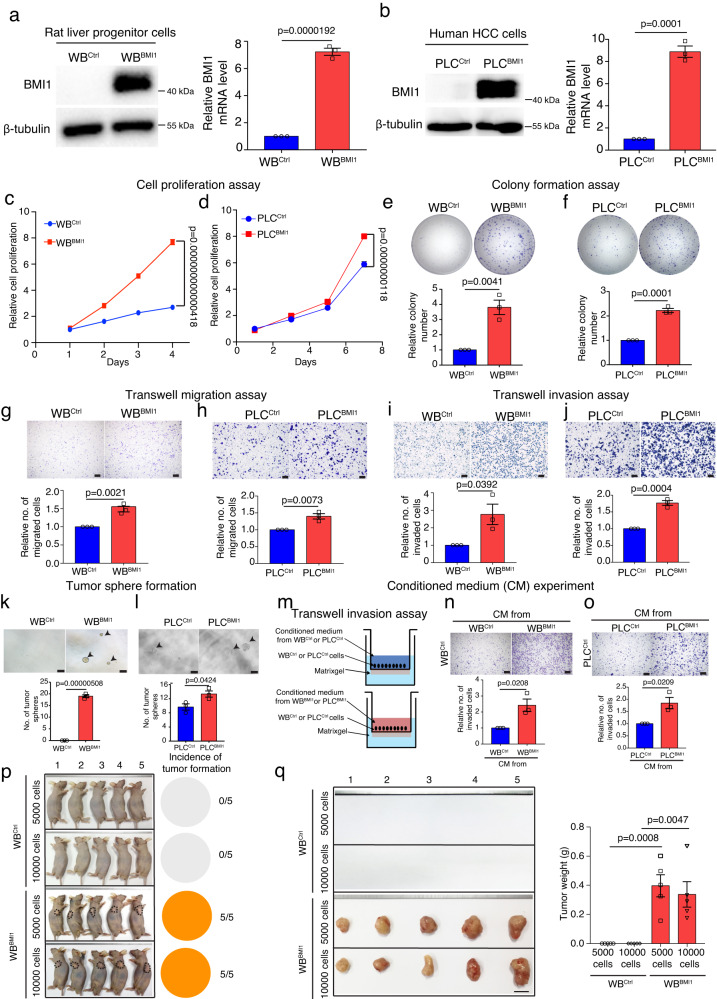
圖2 過表達BMI1可自發地將肝祖細胞轉化為腫瘤起始細胞
3. 小鼠肝/脾原位注射WBBMI1細胞可產生原發腫瘤/轉移灶,并發生自發性膽管瘤栓
為了檢查BMI1high TICs是否可以啟動原位腫瘤形成和BDTT,研究者在裸鼠中將WBBMI1細胞原位植入肝臟的Glisson包膜(圖3a),表明40%植入WBBMI1細胞的小鼠在注射后4周出現黃疸(圖3b)。黃疸的出現是合并BDTT2的HCC患者的臨床表現之一。磁共振成像顯示,將WBBMI1細胞原位植入裸鼠肝臟Glisson包膜后4周內產生了肝臟腫瘤。而WBCtrl移植細胞未能形成任何腫瘤(圖3c)。研究者還表明,WBBMI1植入細胞以100%的發生率產生了原發性肝臟腫瘤,而40%的WBBMI1荷瘤小鼠出現了膽囊和膽管增大(圖3d)。相比之下,WBCtrl植入小鼠均未顯示任何這些表型(圖3c,d)。對腫瘤連續切片的進一步組織病理學研究表明,在黃疸的WBBMI1原位腫瘤荷瘤小鼠中存在膽管癌栓,但在植入WBCtrl細胞的小鼠中未見膽管癌栓(圖3e)。重要的是,研究者證明了瘤栓是由原發腫瘤部位的WBBMI1細胞侵襲膽管腔引起的(圖3e)。由于細胞角蛋白7(CK7)和細胞角蛋白19(CK19)一般表達于膽管上皮,因此研究者在WBCtrl或WBBMI1細胞移植的小鼠的肝組織/腫瘤切片中進行了CK7和CK9的IHC染色,表明在WBBMI1移植的黃疸小鼠的癌栓表面存在CK7和CK19陽性的膽管上皮碎片(圖3e)。
為了進一步證實研究者的觀察結果,研究者在裸鼠中進行了脾內注射WBCtrl/WBBMI1細胞(圖3f),表明注射WBBMI1細胞的小鼠中約有17%在注射后4周出現黃疸,并且血清膽紅素水平升高(圖3g)。研究者的數據顯示,WBBMI1細胞脾內種植形成原發性脾腫瘤的發生率為100%(圖3h),而67%的小鼠形成肝轉移,約17%的WBBMI1種植小鼠出現膽囊和膽管增大(圖3h)。再次,腫瘤連續切片的組織病理學研究顯示,在僅黃疸的WBBMI1移植小鼠中存在BDTT,同時還表明,癌栓源于肝轉移灶WBBMI1細胞侵襲膽管腔(圖3i)。隨后對這些組織切片中CK7和CK19表達的IHC分析支持了這一觀察結果(圖3i)。相比之下,WBCtrl移植小鼠沒有發生原發性脾腫瘤和肝轉移以及BDTT(圖3h,i)。總體而言,研究者的數據表明,原位肝/脾移植BMI1high TICs可以產生原發性腫瘤/肝轉移,并誘導自發性BDTT。更重要的是,本研究建立了肝細胞癌膽管癌栓的臨床前動物模型,為探索膽管癌栓的分子機制提供了機會。
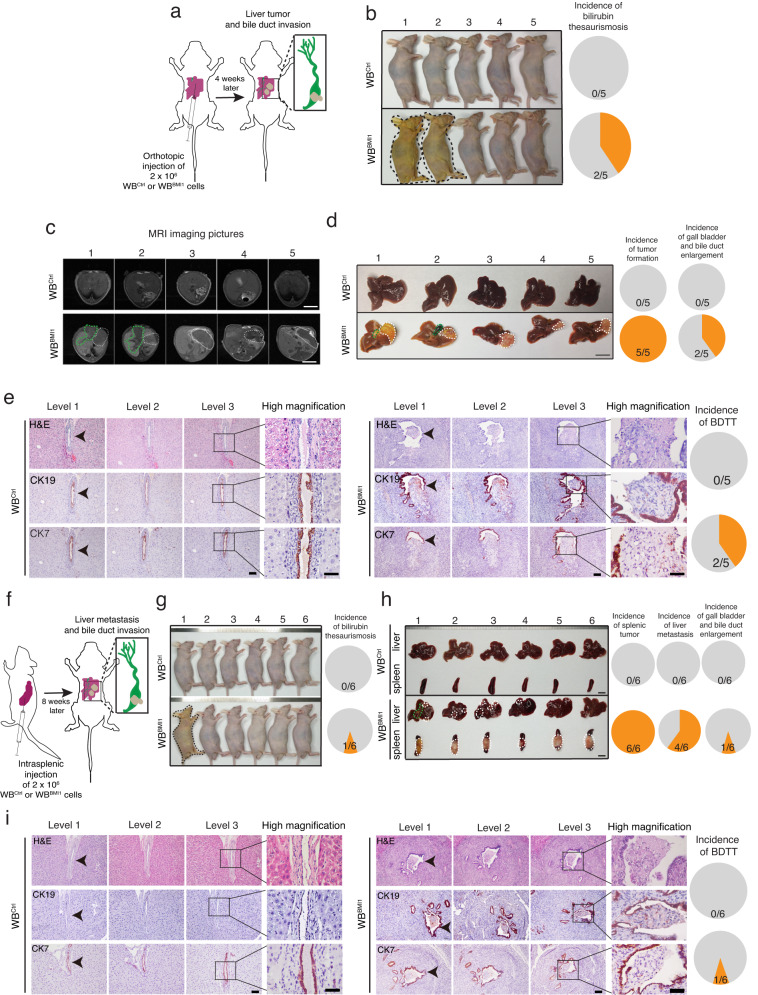
圖3 WBBMI1細胞原位移植入小鼠肝臟/脾臟可形成原發性肝臟腫瘤/轉移灶,并誘導自發性膽管瘤栓形成。
4. 比較蛋白質組學分析顯示,CTSB介導的細胞成分和通路在BMI1high TICs中富集
接下來,研究者試圖研究BMI1high TIC介導BDTT的分子機制。通過與WBCtrl和WBBMI1細胞進行比較蛋白質組學分析,與WBCtrl細胞相比,分泌因子CTSB在WBBMI1細胞中表達上調,而進一步的GO富集分析表明,在WBBMI1細胞中,CTSB相關的細胞成分和通路富集(圖4a,b)。能夠降解細胞外基質,并破壞細胞黏附和連接,從而刺激癌細胞侵襲。蛋白質印跡分析表明,與對照細胞相比,WBBMI1/PLCBMI1細胞中CTSB的表達在翻譯水平上調,但在mRNA水平沒有上調(圖4c,d)。此外,ELISA和CTSB活性測定實驗均表明,與來自WBCtrl或PLCCtrl細胞的CM相比,來自WBBMI1或PLCBMI1細胞的CM中CTSB的表達水平和酶活性顯著增強(圖4e-h)。在臨床上,研究者的數據表明,在HCC患者中,CTSB表達升高與較差的總生存期和癌癥進展增加相關(圖4i,k),但其表達與腫瘤大小無關(圖4l)。有趣的是,研究者還發現在HCC中,CTSB的高表達水平與BDTT的發生率增加相關(圖4m,n)。重要的是,患BDTT的HCC患者血清CTSB水平上調(圖4o)。此外,研究者發現在HCC患者中,BMI1和CTSB的高表達與較差的總生存期強相關(圖4p),而它們的表達也呈正相關(圖4q)。最后,研究者的數據顯示,在HCC患者中,TIC相關蛋白標簽和CTSB的高表達與較差的總生存期強相關(圖4r),同時它們的表達呈正相關(圖4s)。綜上所述,該研究表明,CTSB可能作為BMI1介導的HCC進展的下游效應分子,為HCC合并BDTT患者提供了一個有價值的血清標志物的前景。
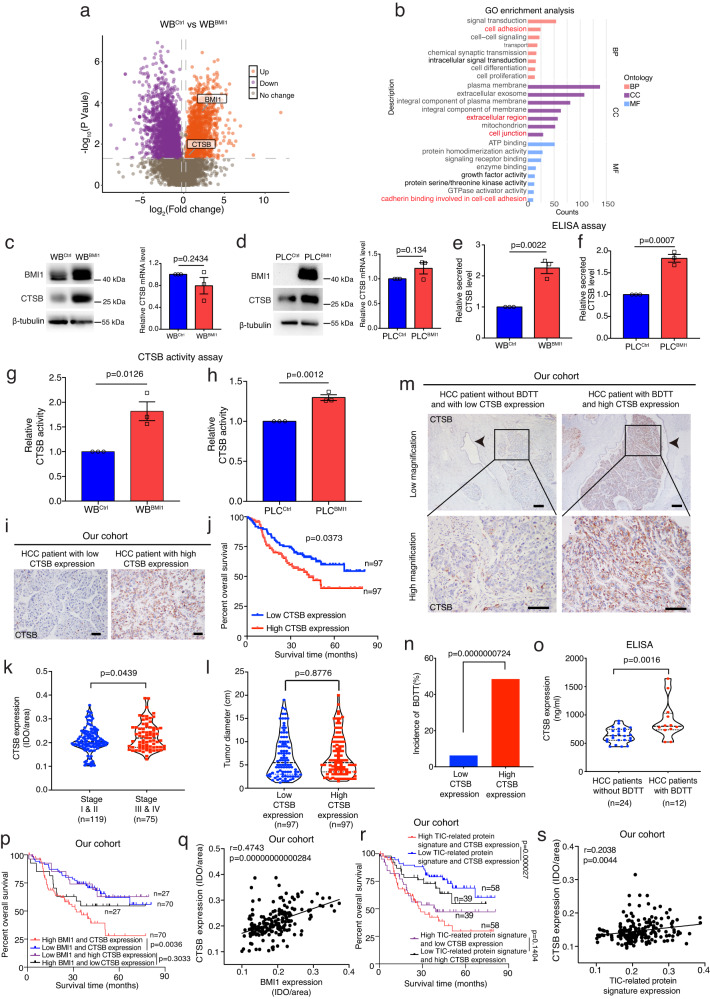
圖4 比較蛋白質組學分析揭示了BMI1high TICs中CTSB依賴的細胞成分和通路的富集
5. CTSB抑制劑治療禁止BDTT,并在不影響原發腫瘤生長的情況下延長小鼠生存期
為了確定CTSB在BMI1介導的癌細胞特性中的作用,研究者對WBBMI1/PLCBMI和BMI1敲除的MHCC97H細胞中的CTSB表達進行了遺傳修飾。與非沉默對照siRNA(siNSC)轉染/安慰劑處理的細胞相比,通過siRNA或CTSB抑制劑CA-074敲除CTSB降低了WBBMI1和PLCBMI1細胞的侵襲能力(圖5a-d)。此外,與使用siNSC轉染的WBBMI1/PLCBMI1細胞的CM處理的細胞相比,使用來自CTSB敲除的WBBMI1/PLCBMI1細胞的CM處理的細胞相比,使用來自CTSB敲除的WBBMI1/PLCBMI1細胞的CM處理的細胞降低了其侵襲性(圖5e,f)。接下來,研究者創建了體外跨肝內膽管上皮遷移模型,將HCC細胞置于單層的人肝內膽管上皮細胞上,在transwell小室的上室中,transwell小室涂有Matrigel基質,下室裝載DMEM + 20%胎牛血清(圖5g)。值得注意的是,研究者的數據表明,BMI1過表達增強了人PLC細胞的跨肝內膽管上皮遷移,而通過siRNA或抑制劑去除CTSB降低了PLCBMI1細胞中觀察到的增強的跨肝內膽管上皮遷移能力(圖5h,i)。此外,與scramble轉染細胞相比,在MHCC97H細胞中去除BMI1降低了其跨肝內膽管上皮遷移能力(圖5j)。
為了進一步驗證體內觀察結果,研究者將WBBMI1細胞注射到裸鼠皮下,然后用安慰劑或CTSB抑制劑CA-074處理裸鼠。正如預期,CA-074治療對WBBMI1皮下腫瘤的生長沒有影響(圖5k,1)。相反,與安慰劑治療的小鼠相比,在WBBMI1原位荷瘤小鼠中,CA-074降低了黃疸、膽紅素水平升高、膽囊和膽管增大或BDTT的發生率(圖5m-o),而在這些小鼠中,它不影響腫瘤的形成和原發腫瘤的生長(圖5n-p)。最后,與安慰劑治療組相比,CTSB抑制劑治療延長了WBBMI1原位荷瘤小鼠的生存期(圖5q)。綜上所述,這些發現表明CTSB在BMI1依賴的膽管癌栓中發揮重要作用,并確定了肝癌合并膽管癌栓患者的潛在治療靶點。
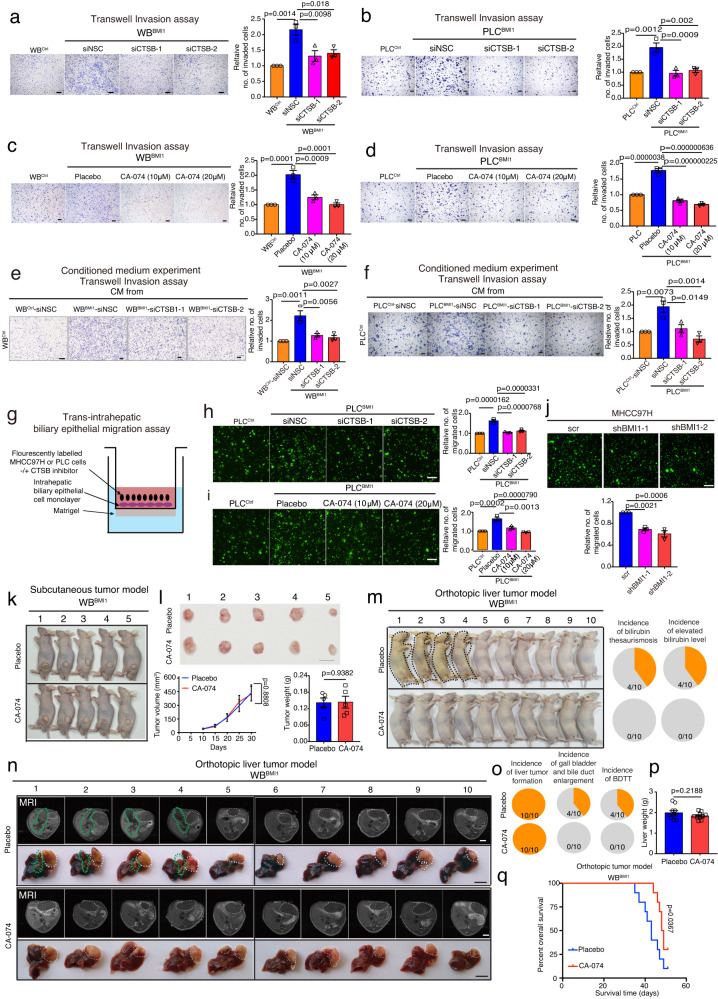
圖5 CTSB抑制劑治療可抑制WBBMI1荷瘤小鼠的膽管腫瘤血栓形成,與原發腫瘤生長無關
6. BMI1high TICs通過抑制miR-218-1-3p的表達促進CTSB驅動的膽管癌血栓形成
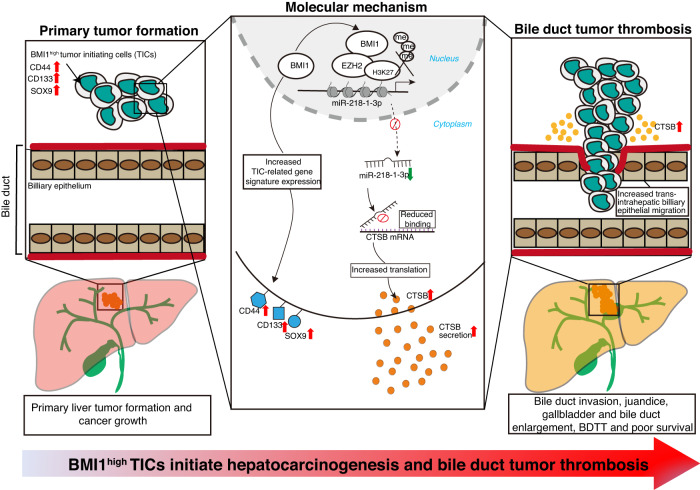
目前的研究數據表明BMI1在蛋白水平上調節CTSB的表達。研究者使用三種不同的在線搜索工具,使用CTSB mRNA序列預測其調控miRNA,而維恩圖分析表明,這些預測的miRNA中有41個被所有這些工具共同識別(圖6a)。接下來,研究者在BMI1基因修飾的肝癌細胞中對這些miRNA進行了RT-PCR定量。特別是,與對照細胞相比,miR-218-1-3p在BMI1穩定表達的PLC細胞中表達下調,而在BMI1敲除的MHCC97H細胞中表達顯著增加(圖6b)。維恩圖分析表明,miR-218-1-3p是only與BMI1表達相關的miRNA(圖6c)。接下來,研究者使用之前發表的PRE序列分析了miR-218-1-3p的啟動子,表明其啟動子包含2個假定的PRE位點(圖6d),而染色質免疫沉淀分析表明,與PLCCtrl細胞相比,PLCBMI1細胞中BMI1和三甲基化H3K27在這兩個PRE位點上的結合增加(圖6e)。BMI1可能與組蛋白甲基轉移酶EZH2協同作用,通過重塑染色質結構抑制miR-213-1-3p的表達。為了研究miR-218-1-3p對CTSB表達的調控作用,分別在WBBMI1, MHCC97H和PLCBMI1細胞中過表達miR-218-1-3p,結果顯示與陰性對照模擬物轉染細胞相比,在表達miR-218-1-3p的WBBMI1/MHCC97H細胞/PLCBMI1細胞中CTSB的表達降低(圖6f,g)。這表明溶酶體CTSB是潛在的靶點之一,因為其CTSB的3'UTR區域攜帶保守的miR-218-1-3p種子匹配序列(圖6h)。為了確定miR-218-1-3p是否與CTSB的3'UTR結合位點結合,將含有野生型或突變型CTSB 3'UTR結合位點的熒光素酶報告載體與miR-218-1-3p模擬物或NC模擬物共轉染MHCC97H和PLCBMI1細胞。值得注意的是,在轉染了攜帶WT-CTSB 3'UTR結合位點序列的報告載體的MHCC97H和PLCBMI1細胞中,miR-218-1-3p過表達抑制了熒光素酶活性,而在轉染了含有突變的CTSB 3'UTR結合位點序列的報告載體構建的細胞中,miR-218-1-3p不影響熒光素酶活性(圖6i)。這些結果表明,BMI1和EZH2通過miR-218-1-3p協同調控CTSB的表達。
通過對HCC腫瘤切片進行miR-218-1-3p的熒光原位雜交實驗,研究者發現在HCC腫瘤中,miR-218-1-3p的表達水平分別與BMI1/CTSB的表達呈負相關(圖6j)。為了檢測體內miR-218-1-3p表達在BDTT中的重要性,將miR-218-1-3p或NC模擬物穩定轉染WBBMI1細胞的裸鼠肝臟原位注射到裸鼠肝臟中,表明與NC模擬物轉染組相比,miR-219-1-3p過表達降低了WBBMI1種植小鼠的黃疸、膽紅素升高、膽囊和膽管增大或BDTT的發生率,而不影響原發性肝臟腫瘤的生長(圖6k-n)。
總之,該研究揭示了BMI1過表達將LPCs惡性轉化為BMI1high TICs,而在小鼠原位肝移植中,這些細胞可以產生原發腫瘤和自發性BDTT。在機制上,BMI1通過PRC依賴的機制沉默miR-218-1-3p的表達,然后表觀遺傳上調BMI1high TICs中的CTSB分泌,從而促進其侵襲膽管形成BDTT。
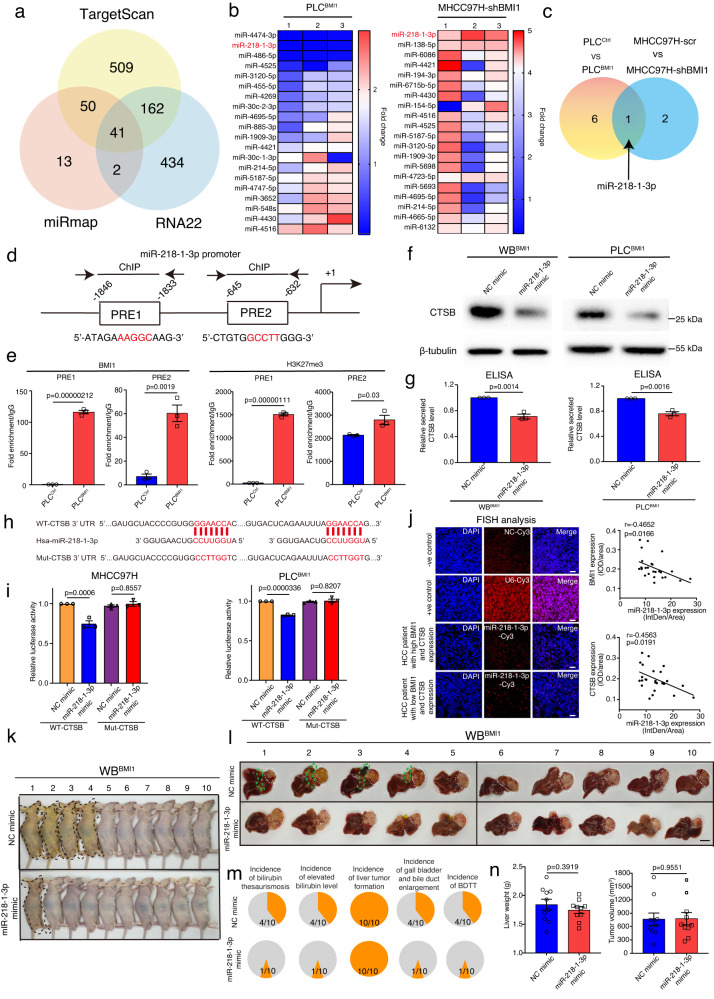
圖6 BMI1通過抑制miR-218-1-3p的表達表觀遺傳上調CTSB的表達
結論
該研究結果解決了肝癌生物學領域中關于BDTT細胞起源和發病機制的謎題,表明BMI1high TICs誘導肝癌發生并經歷CTSB驅動的膽管侵犯形成癌栓。更重要的是,該研究為HCC合并BDTT患者提供了潛在的診斷標志物和治療途徑,為未來的臨床應用打開了大門。
機制圖
實驗方法
細胞培養和轉染,體外腫瘤發生試驗,蛋白質印跡,RT-PCR,免疫組化,免疫染色實驗,熒光素酶報告基因檢測,體內致瘤性測定,外科原位肝/脾癌模型,蛋白質組學分析,經肝內膽道上皮遷移試驗,ELISA檢測,CTSB活性測定法,染色質免疫沉淀實驗,熒光原位雜交(FISH)實驗
參考文獻
Xu LB, Qin YF, Su L, Huang C, Xu Q, Zhang R, et al. Cathepsin-facilitated invasion of BMI1-high hepatocellular carcinoma cells drives bile duct tumor thrombi formation. Nat Commun. 2023 Nov 3;14(1):7033. doi: 10.1038/s41467-023-42930-y.






