剪接體成分Usp39通過調(diào)節(jié)自噬參與肝脂質(zhì)穩(wěn)態(tài)
選擇性剪接(AS)的調(diào)節(jié)使單個轉(zhuǎn)錄產(chǎn)物產(chǎn)生多個亞型,從而增加轉(zhuǎn)錄組和蛋白質(zhì)組的多樣性。在這里,作者報道剪接體成分Usp39在肝細胞脂質(zhì)穩(wěn)態(tài)調(diào)節(jié)中起作用。作者證明Usp39在非酒精性脂肪性肝病(NAFLD)和非酒精性脂肪性肝炎(NASH)受試者的肝組織中表達下調(diào)。小鼠肝細胞特異性Usp39缺失導致脂質(zhì)積累增加,自發(fā)脂肪變性和自噬受損。RNA免疫沉淀(RIP-seq)和大量RNA測序(RNA-seq)數(shù)據(jù)的聯(lián)合分析顯示,Usp39調(diào)節(jié)了幾個自噬相關(guān)基因的AS。特別是,Usp39的缺失導致熱休克轉(zhuǎn)錄因子1(Hsf1)外顯子6的5'剪接位點選擇,從而導致其表達減少。重要的是,過表達Hsf1可以減輕Usp39缺乏引起的脂質(zhì)積累。綜上所述,作者的研究結(jié)果表明,Usp39介導的AS對于維持肝臟的自噬和脂質(zhì)穩(wěn)態(tài)是必需的。該研究與2023年11月發(fā)表于《Nature Communication》上,IF:16.6。
技術(shù)路線

主要研究內(nèi)容
1、NAFLD和NASH患者肝臟Usp39表達降低
識別U4/U6的組件。U5tri-snRNP復合物參與脂肪肝疾病的發(fā)展,作者分析了編碼16個核心U4/U6的基因mRNA水平。利用GEO數(shù)據(jù)庫(GSE165855)中食糧和HFD喂養(yǎng)的小鼠肝臟轉(zhuǎn)錄組學數(shù)據(jù),以及GEO數(shù)據(jù)庫(GSE154892)中另一組食糧和CDAHFD喂養(yǎng)的小鼠肝臟轉(zhuǎn)錄組學數(shù)據(jù)研究U5 tri-snRNP成分。其中在HFD和NASH小鼠的RNA-seq數(shù)據(jù)中,Usp39和Ddx23均顯著下調(diào)(圖1a,b)。接下來,作者對16個U4/U6進行交互網(wǎng)絡(luò)分析。U5 tri-snRNP成分使用兩個RNA-seq數(shù)據(jù)集,發(fā)現(xiàn)Usp39是與NAFLD和NASH小鼠肝臟中U5 snRNP和U4/U6 snRNP成分相互作用最強烈的樞紐因子之一(圖1c)。有趣的是,在一個隊列(GSE193084)的NAFLD患者中,USP39的表達與NAFLD活動評分呈負相關(guān)(圖1d)。然后作者將重點放在USP39上進行進一步調(diào)查。作者分析了USP39在人類NAFLD患者隊列中的表達水平,發(fā)現(xiàn)與低NAFLD活動評分組相比,高NAFLD活動評分組USP39明顯下調(diào)(圖1e)。相應(yīng)地,USP39水平在纖維化晚期(2-4)低于纖維化早期(0-1)(圖1f)。在NAFLD和NASH小鼠模型的轉(zhuǎn)錄組數(shù)據(jù)中也檢測到USP39表達降低(圖1)。接下來,作者通過免疫印跡和qPCR檢測了HFD喂養(yǎng)和蛋氨酸膽堿缺乏(MCD)喂養(yǎng)的小鼠肝臟中USP39的表達,并將其與低食喂養(yǎng)的對照組小鼠進行了比較。HFD喂養(yǎng)和MCD喂養(yǎng)的小鼠肝臟中Usp39的表達水平明顯低于正常小鼠(圖1g、h)。重要的是,研究還發(fā)現(xiàn),與非NASH患者相比,NASH患者肝臟中USP39的表達降低(圖1i)。值得注意的是,除了全長波段(65 kDa左右)外,還有一個較低的波段(約55 kDa)(圖1g-i)。作者還進行了免疫組化染色,發(fā)現(xiàn)Usp39主要定位于細胞核,并且在HFD和MCD喂養(yǎng)的小鼠中,其蛋白水平顯著降低(圖1j)。總的來說,Usp39在NAFLD和NASH肝臟中的表達降低,暗示了這些疾病的進展中Usp39的作用。
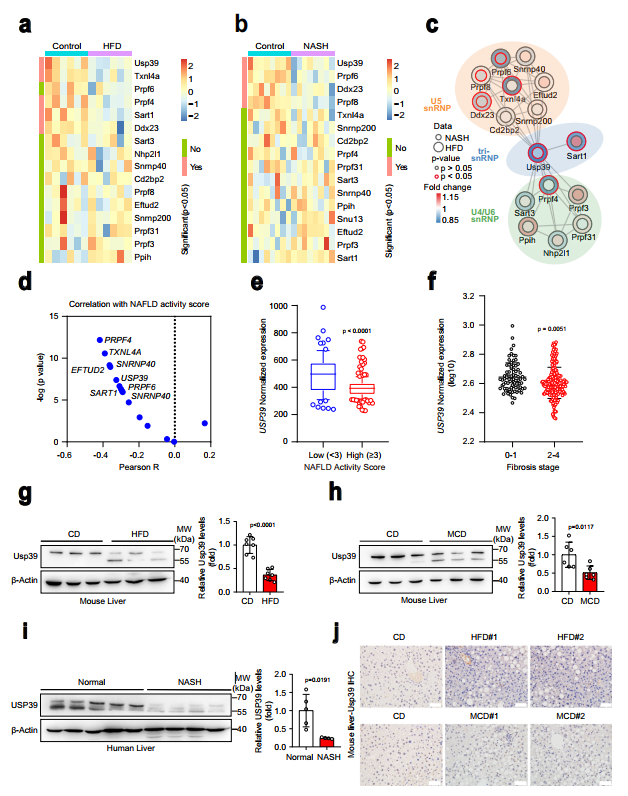
圖1NAFLD和NASH患者肝臟Usp39表達降低
2、肝臟Usp39缺失損害肝臟發(fā)育和穩(wěn)態(tài)
為探索Usp39在肝臟發(fā)育和穩(wěn)態(tài)中的作用,作者通過qPCR和免疫印跡技術(shù)檢測了Usp39的表達,發(fā)現(xiàn)隨著年齡的增長,Usp39在小鼠肝臟中的表達水平逐漸降低。然后,作者通過將Usp39fl/fl小鼠與Alb-Cre小鼠雜交,產(chǎn)生肝臟特異性Usp39敲除小鼠(Usp39-HKO)(圖2a,b)。Usp39-HKO小鼠在出生后4至8周期間體重顯著降低(圖2c,d)。在5周齡時,Usp39-HKO小鼠的體重、肝臟體重和肝臟/體重比也有所降低(圖2e-g)。H&E染色顯示,與對照組相比,Usp39-HKO肝臟中心靜脈纖維化,雙核細胞數(shù)量減少(圖h左)。作者還觀察到,與對照組相比,Usp39-HKO肝臟中增殖標志物(Ki67和Pcna)肝細胞增殖的表達增加(圖2h-j)。值得注意的是,Afp和H19(祖細胞標記物)mRNA表達量顯著增加,而Alb蛋白表達量降低(圖2k–m)。作者還測量了肝功能的幾種標志物(ALT、AST、LDH、白蛋白水平和免疫細胞浸潤)。結(jié)果顯示,在5周齡時,Usp39缺失誘導自發(fā)性肝損傷,表現(xiàn)為ALT、AST、LDH水平升高,Alb水平降低(圖2n)。通過天狼星紅染色和纖維化標志物qPCR分析評估Usp39缺失誘導肝纖維化(圖2o,p)。結(jié)果顯示,這個年齡的Usp39-HKO小鼠未發(fā)現(xiàn)凋亡細胞、炎癥細胞和祖細胞活化,Usp39缺失在5周齡時誘導自發(fā)性肝損傷(圖2o,p)。有趣的是,與5周齡Usp39-HKO小鼠相比,10周齡Usp39-HKO小鼠的肝損傷顯著減輕(圖2n-p)。這些數(shù)據(jù)提示Usp39在小鼠出生后早期肝臟發(fā)育中的重要作用。
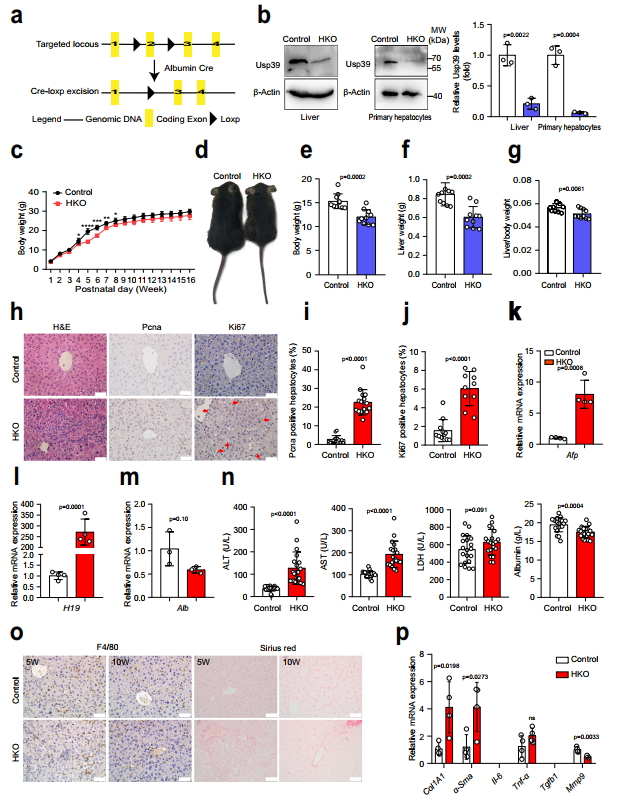
圖2 肝臟Usp39基因敲除會損害肝臟穩(wěn)態(tài)和功能
3、肝細胞特異性Usp39缺失誘導自發(fā)性脂肪變性
為了確定肝臟Usp39在肝臟穩(wěn)態(tài)和功能中的具體作用,作者在12月齡時檢測了Usp39-HKO和對照小鼠。Usp39-HKO小鼠與對照小鼠的體重和肝臟重量均無顯著差異(圖4a-d)。有趣的是,Usp39-HKO小鼠脾臟增大,肝臟呈淺色(圖3a)。H&E染色和Sirius Red染色顯示大脂質(zhì)液滴大量積聚,纖維化(圖3b)。與此一致,Usp39-HKO小鼠的肝臟TG水平高于對照組(圖3c)。此外,炎癥和纖維化基因(Col1a1、α-Sma、Tnf-α和Tgfb1)普遍上調(diào)(圖3d)。
為了進一步闡明Usp39在肝脂肪變性中的作用,我們用HFD喂養(yǎng)12周的HKO和對照小鼠進行Usp39-刺激。HFD喂養(yǎng)的Usp39-HKO小鼠表現(xiàn)出更明顯的肝臟脂肪化和纖維化形成(圖3e,f)。肝臟TG水平和炎癥和纖維化基因mRNA表達也更顯著地增加(圖3g,h)。進一步,作者分別通過LC/MS和RNA seq對5周齡Usp-HKO小鼠和對照小鼠的肝臟進行轉(zhuǎn)錄組學和脂質(zhì)組學表征。在肝臟樣本中共鑒定出31類脂質(zhì)中的1692種脂質(zhì),其中發(fā)現(xiàn)與對照小鼠相比,Usp39-HKO小鼠中TG、二甘油酯(DG)、磷脂酰肌醇(PIP2)和鞘堿(So)顯著增加(3i,j)。脂質(zhì)組和轉(zhuǎn)錄組聯(lián)合分析顯示在Usp39-HKO小鼠中肝纖維化和脂肪變性高度富集(圖3k-n)。綜上所述,這些結(jié)果表明Usp39-HKO小鼠更容易患脂肪肝疾病。
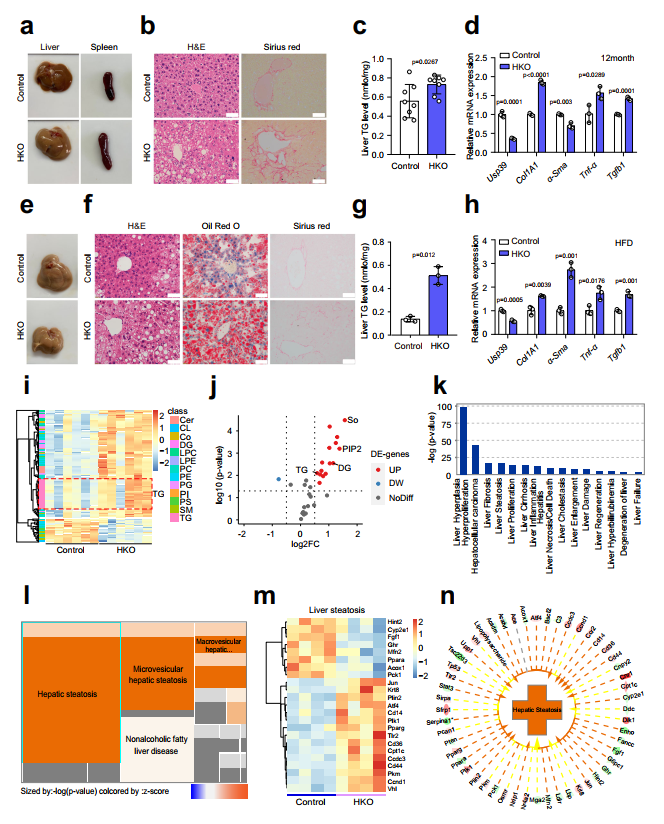
圖3 肝細胞特異性Usp39敲除小鼠的自發(fā)性脂肪變性
4、肝細胞特異性Usp39缺失小鼠的自噬受到抑制
自噬在肝臟脂滴降解中起著關(guān)鍵作用,作者對脂質(zhì)組和轉(zhuǎn)錄組數(shù)據(jù)的Ingenuity通路分析顯示,與對照組相比,Usp39-HKO肝臟中自噬、TG降解和脂肪酸β-氧化(FAO)通路顯著減弱,而mTOR信號通路被激活(圖4a)。作者假設(shè)Usp39耗竭可能阻斷自噬,從而增加肝臟中的脂滴積累。為了探討這一點,作者通過qPCR評估了自噬相關(guān)基因的表達,發(fā)現(xiàn)與對照組相比,Usp39-HKO肝臟中的Ulk1、Atg3和Atg7顯著下調(diào)(圖4b)。同樣,在Usp39敲低后,AML12細胞(小鼠肝細胞細胞系)和原代肝細胞中Ulk1、Atg3和Atg7的mRNA水平降低(圖4c)。此外,免疫印跡顯示,敲除Usp39后,Ulk1、Atg7和LC3II降低,p62升高(圖4d-f)。作者還通過RT-qPCR檢測了p62和LC3BmRNA水平,但未發(fā)現(xiàn)對照組和Usp39敲低組之間存在顯著差異。在電鏡下,Usp39-HKO肝臟中自噬小泡的形成明顯減少(圖4g)。此外,Plin2和Lamp2的共免疫熒光染色顯示Plin2的豐度增加,Lamp2的分布減少(圖4h)。同樣,在原代肝細胞和AML12細胞中,當Usp39耗盡后,EGFP-LC3點顯著減少(圖4i)。重要的是,原代細胞和AML12細胞中Usp39的敲除減少了與BODIPYC12染色脂質(zhì)共定位的EGFP-LC3點的數(shù)量(圖4j)。這些結(jié)果表明Usp39-HKO肝臟中的脂質(zhì)積累可能是由于自噬受損而發(fā)生的。
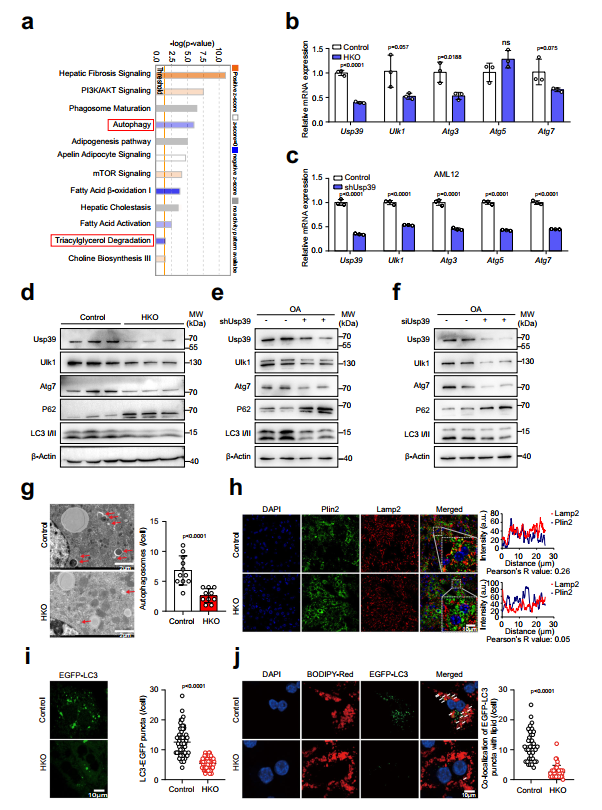
圖4缺乏Usp39的肝細胞自噬受損
5、肝細胞特異性Usp39缺失導致自噬相關(guān)基因的異常剪接
鑒于Usp39是U4/U6的一個組成部分。U5 tri-snRNP,作者假設(shè)Usp39的缺失可能會破壞肝脂質(zhì)自噬所需的基因的RNA剪接。為此,作者對Usp39-HKO和對照小鼠的肝臟組織(n=4)進行了RNA seq。使用rMATs軟件進行AS事件分析,共檢測到1472個基因的1993個剪接事件。Usp39缺失的主要AS事件是外顯子跳躍(55%),替代5’剪接位點(12%)和內(nèi)含子保留(12%)(圖5a)。熱圖顯示了Usp39-HKO小鼠與對照小鼠相比,肝臟組織中表達的自噬相關(guān)基因的差異(圖5b),并構(gòu)建了火山圖來顯示Usp39缺乏時AS事件的差異分布(圖5c)。為了確定Usp39的全基因組結(jié)合位點和靶點,作者在AML12細胞中進行了RNA免疫沉淀測序(RIP-seq)。RNA的超聲破碎和嚴格的洗滌條件提高了結(jié)合信號的特異性和分辨率。RIP峰分布分析顯示,Usp39主要映射到內(nèi)含子(29%)、外顯子(18%)和3'UTR(19%)上(圖5d)。對RIP-seq數(shù)據(jù)進行Motif富集分析,發(fā)現(xiàn)GGCCAC和GCCAUA是兩個最豐富的元素(圖5e)。進一步分析發(fā)現(xiàn),Usp39結(jié)合Motif1在自噬基因剪接位點附近明顯富集。為了鑒定由Usp39調(diào)控的AS候選靶點,作者利用RIP-seq和RNA-seq數(shù)據(jù)整合了Usp39結(jié)合的基因和AS相關(guān)基因,鑒定了611個常見基因(圖5f)。對611個基因進行基因本體分析發(fā)現(xiàn),與細胞分解代謝過程、剪接體復合體組裝、肽基絲氨酸磷酸化和自噬調(diào)控相關(guān)的通路顯著富集(圖5g)。為確定由Usp39調(diào)控的肝臟脂質(zhì)積累的功能靶點,作者檢查了自噬相關(guān)基因的AS模式,這些基因富集于Usp39結(jié)合和選擇性剪接的轉(zhuǎn)錄本中,包括Ulk3、Nrbp2、Tcirg1、Trp53inp1和Hsf1。然后作者通過AS綁定峰和RT-qPCR發(fā)現(xiàn)了這些基因的可變剪接。
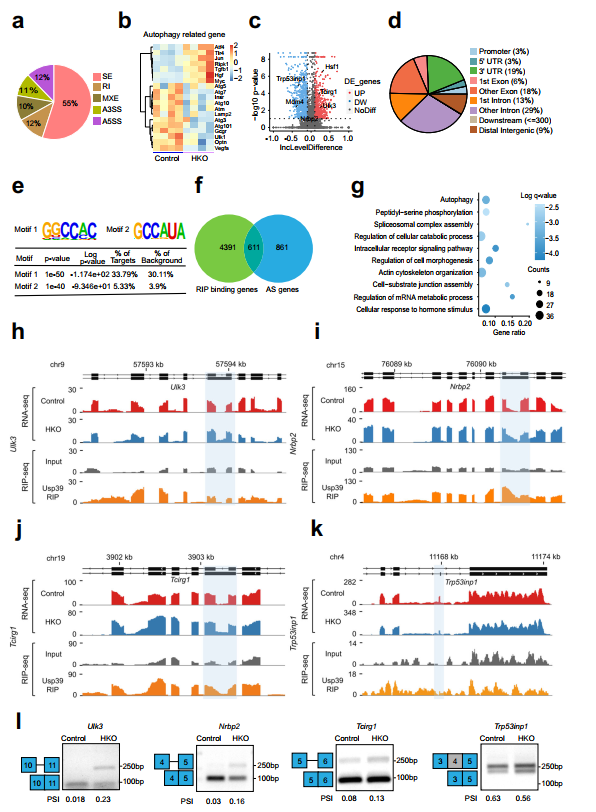
圖5 Usp39缺失導致肝細胞中自噬相關(guān)基因剪接改變
6、Usp39缺失導致肝細胞中Hsf1的錯誤剪接和降解
作者下面重點研究了熱休克反應(yīng)的主要轉(zhuǎn)錄調(diào)節(jié)因子Hsf1,它可以促進細胞保護性自噬。作者對Hsf1的剪接事件進行了分析,發(fā)現(xiàn)Usp39的缺失導致外顯子6的5'剪接位點發(fā)生了選擇性,引入了一個提前終止密碼子(PTC),可能導致無義介導的mRNA衰變(NMD)(圖6a,b)。事實上,通過半定量RT-PCR在Usp39-HKO小鼠肝臟中驗證了Hsf1的可變剪接(圖6c)。小基因剪接實驗進一步證實了Hsf1的剪接改變結(jié)果隨著Usp39添加量的增加而降低,而當Usp39缺失時,Hsf1的剪接改變結(jié)果增加(圖6d)。隨后,作者通過qPCR分析了Hsf1在肝組織中的典型亞型和NMD亞型,發(fā)現(xiàn)在Usp39缺失后,典型亞型顯著減少,而NMD亞型顯著增加(圖6e)。與正常喂養(yǎng)的小鼠相比,HFD喂養(yǎng)的和MCD喂養(yǎng)的小鼠在Usp39缺失后,典型亞型也顯著減少,而NMD亞型則增加。為了驗證NMD亞型通過NMD途徑被降解,作者測量了NMD亞型在Upf1敲低和用Actinomycin D處理的AML12細胞中的RNA半衰期,正如預(yù)期的那樣,Hsf1亞型的NMD半衰期在Upf1敲低細胞中相對于對照組顯著增加(圖6f)。為了進一步證明Usp39與Hsf1的直接結(jié)合,作者在過表達FLAG-Usp39的AML12細胞中進行了RIP實驗。RIP-qPCR表明,Usp39結(jié)合到Hsf1的外顯子6周圍的四個位點(圖6g),RNA下拉實驗進一步顯示,生物素標記的Hsf1探針成功地下拉了Usp39(圖6h)。因此,與對照組相比,Usp39-HKO肝臟和Usp39敲低的AML12細胞中Hsf1和自噬相關(guān)基因的mRNA表達顯著降低。相反,在過表達Usp39的AML12細胞中,Hsf1和自噬相關(guān)基因的表達顯著增加。作者進一步發(fā)現(xiàn),在喂食(圖6i)、禁食(圖6j)和HFD(圖6k)條件下,當Usp39耗盡時,Hsf1、Ulk1、Atg7和LC3II的蛋白水平顯著降低,p62的蛋白水平升高。他莫昔芬誘導的Usp39基因敲除小鼠模型(Usp39fl/fl;ugc-creERT2)進一步證實了Usp39缺失后Hsf1蛋白水平的下降。在人細胞系Huh7和HepG2中,Usp39敲低后Hsf1蛋白水平也同樣下降。此外,作者觀察到HFD喂養(yǎng)的小鼠和MCD喂養(yǎng)的小鼠肝臟中Hsf1蛋白水平較低(圖61、m)。最后,與非NASH患者相比,在NASH患者的肝臟中也檢測到HSF1表達降低(圖6n)。綜上所述,這些發(fā)現(xiàn)表明Usp39的缺失導致Hsf1剪接改變和快速降解。
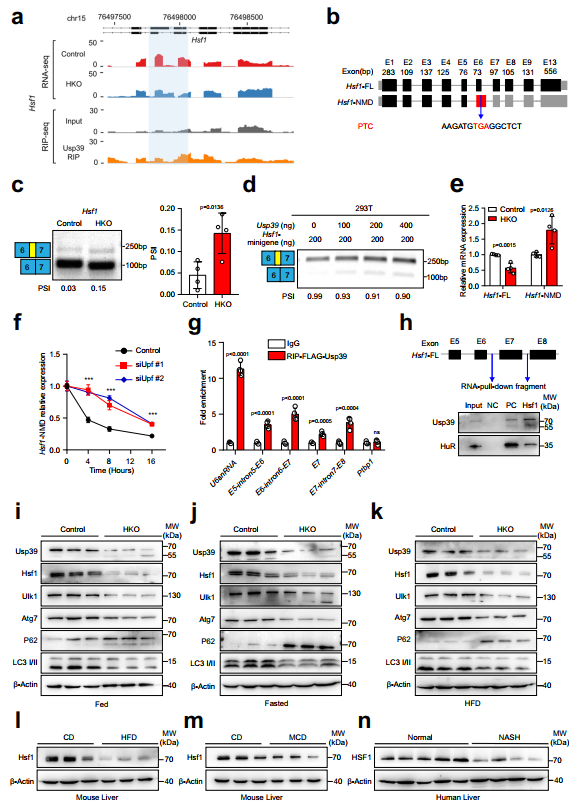
圖6 在肝細胞中,Usp39缺失導致Hsf1的錯誤剪接和快速降解
7、Hsf1促進自噬,減輕Usp39缺失引起的肝脂肪變性
接下來,作者進行了回復實驗,以確定Hsf1的下調(diào)是否介導了Usp39缺失導致的脂質(zhì)積累。AML12細胞的BODIPY染色顯示,通過強制表達Hsf1可以挽救Usp39缺失引起的脂質(zhì)積累(圖7a,b)。相反,siRNA敲低Hsf1會損害Usp39過表達引發(fā)的脂質(zhì)降解。Plin2和Lamp2染色的免疫熒光進一步顯示,在AML12細胞中,通過強制逆轉(zhuǎn)Hsf1的表達,Usp39缺失導致的自噬受損得以恢復(圖7c)。相反,在Usp39過表達的AML12細胞中沉默Hsf1會產(chǎn)生相反的效果。免疫印跡顯示,在AML12細胞中,特別是在血清饑餓情況下,強行表達Hsf1可以挽救因Usp39缺失而受損的自噬(圖7d)。相反,通過敲低Hsf1可消除過表達Usp39引起的自噬增強。為了加強Hsf1是Usp39的功能靶點并促進肝臟脂質(zhì)代謝自噬的結(jié)論,作者向Usp39 floxed小鼠注射AAV8-TBG-Cre或AAV-TBG-Null,以生成肝臟特異性Usp39-HKO小鼠。雖然AAV-TBG-Cre小鼠的體重、肝臟重量和肝/體重比沒有差異,但肝臟蒼白,肝臟TG水平顯著升高。然后將這些小鼠感染表達Hsf1或空載體的腺病毒,然后進行4周的正常飲食。異位Hsf1表達明顯減輕了Usp39缺失引起的肝脂肪變性(圖7e)。通過Plin2和Lamp2的免疫染色(圖7f)和自噬相關(guān)基因的免疫印跡(圖7g)可以一致地證明,由Usp39缺失引起的自噬受損得以恢復。總之,這些結(jié)果表明,由Usp39缺失引起的肝脂肪變性部分是由Hsf1下調(diào)和隨后的自噬損傷介導的。
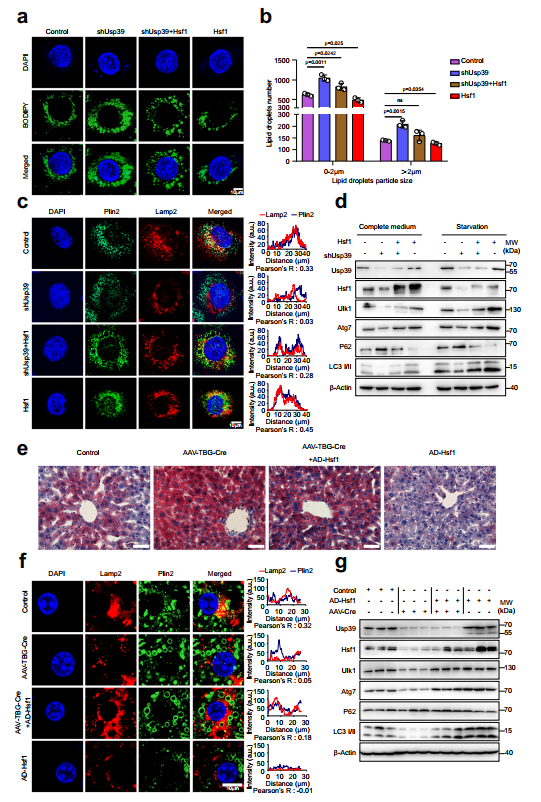
圖7 Hsf1促進自噬,減輕Usp39缺失引起的肝臟脂肪變性
結(jié)論
該研究結(jié)果證明了剪接體成分Usp39在自噬和肝細胞脂質(zhì)穩(wěn)態(tài)調(diào)節(jié)中的作用。肝細胞Usp39缺乏導致自噬缺陷和脂質(zhì)積累,從而導致自發(fā)性脂肪變性。在機制上,Usp39調(diào)節(jié)自噬相關(guān)基因的AS,包括Hsf1,以促進自噬。總之,作者的發(fā)現(xiàn)AS在調(diào)節(jié)自噬和肝細胞脂質(zhì)穩(wěn)態(tài)中的作用使成為治療脂肪肝疾病的潛在靶點。
實驗方法
Usp39fl/+和Albumin-Cre小鼠,小鼠原代肝細胞的分離與培養(yǎng),組織學分析,免疫熒光染色,體脂和油紅O染色,小鼠血清測定及肝功能測定,小鼠代謝評估,透射電子顯微鏡觀察,RNA-seq,RIP-seq,生信分析,線粒體呼吸測量,脂質(zhì)組學分析,免疫印跡,臨床樣本分析,RNApulldown
參考文獻
Cui D, Wang Z, Dang Q, Wang J, Qin J, Song J, Zhai X, Zhou Y, Zhao L, Lu G, Liu H, Liu G, Liu R, Shao C, Zhang X, Liu Z. Spliceosome component Usp39 contributes to hepatic lipid homeostasis through the regulation of autophagy. Nat Commun. 2023 Nov 3;14(1): 7032. doi: 10.1038/s41467-023-42461-6. PMID: 37923718; PMCID: PMC10624899.






