外泌體circ_0001785延緩動脈粥樣硬化的發生
內皮細胞功能障礙是早期動脈粥樣硬化的主要原因。盡管細胞外囊泡在穩定動脈粥樣硬化斑塊中的作用已得到證實,但循環外泌體對斑塊形成的影響尚不清楚。在這里,我們基于外泌體可以作用于細胞間通訊的功能,探討了外泌體對動脈粥樣硬化的影響。體外共培養結果顯示,冠狀動脈疾病患者血漿來源外泌體數量增加,內皮細胞炎癥和凋亡加重。過表達circ_0001785可通過miR513a-5p/TGFBR3的ceRNA網絡途徑減輕內皮細胞損傷。circ_0001785在冠狀動脈疾病患者循環外周血中的表達量減少,而在人和小鼠動脈粥樣硬化斑塊組織中表達量增加。體內實驗結果表明,circ_0001785可減輕小鼠主動脈內皮細胞損傷和斑塊內新血管形成,增強左室舒張功能,從而延緩動脈粥樣硬化的發展。我們的研究結果證明了一種新的動脈粥樣硬化生物標志物—外泌體來源的circ_0001785,它可以通過miR-513a-5p/TGFBR3 ceRNA網絡機制減少內皮細胞損傷,從而延緩動脈粥樣硬化的發生,為動脈粥樣硬化提供了一種基于外泌體的干預策略。本文于2023年10月發表于“Journal of Nanobiotechnology”(IF=10.2)上。
技術路線

結果
1)血漿外泌體對冠狀動脈疾病患者內皮細胞的影響
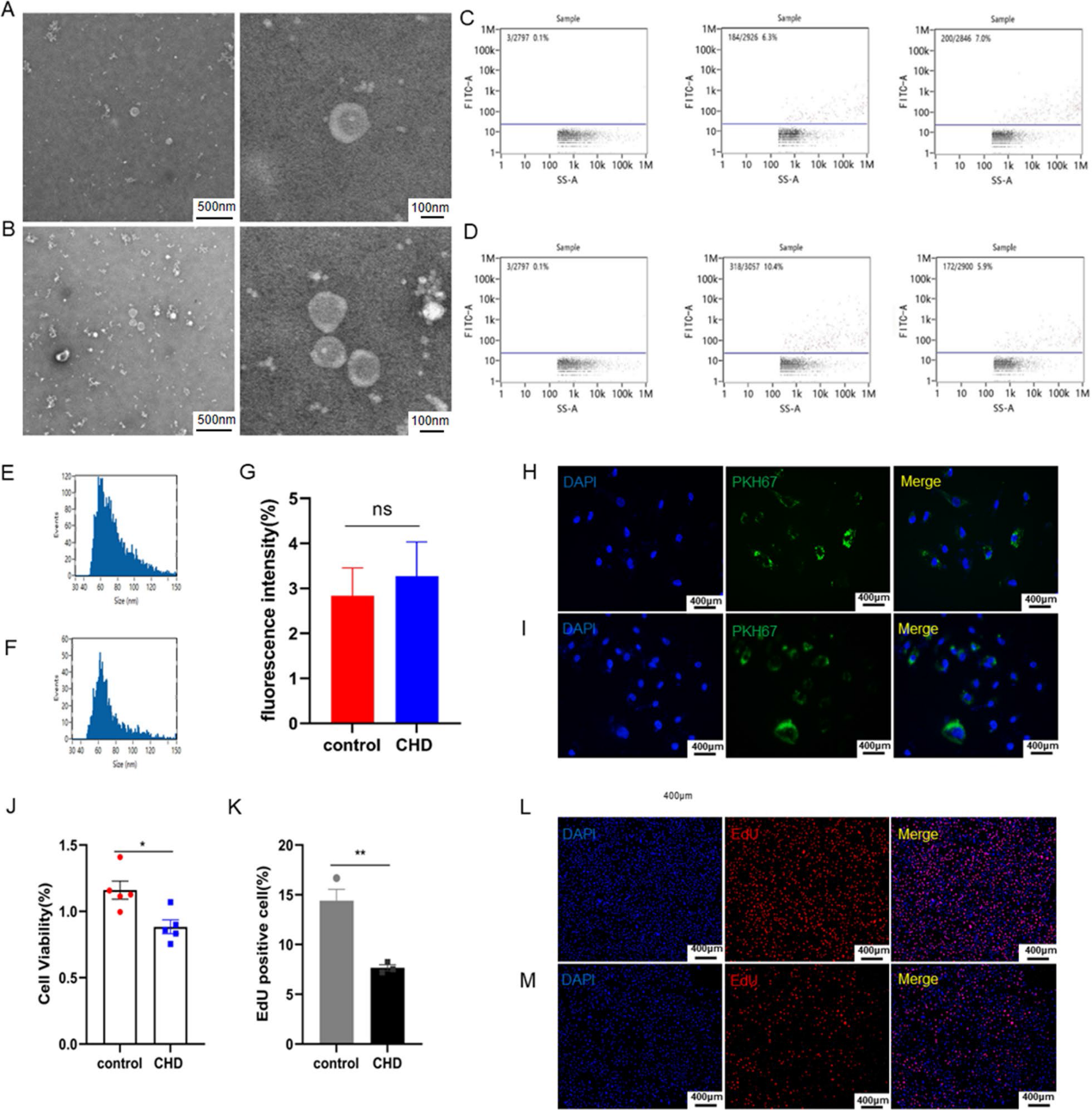
首先,我們分離冠狀動脈疾病患者和非冠狀動脈疾病患者的外泌體。我們通過透射電子顯微鏡(TEM)觀察到直徑為30-150nm的球形顆粒(圖1A, 1B),這與外泌體的大小和形態一致。對于外泌體的標記蛋白CD9和CD81,我們通過納米流式細胞術(nFCM)對它們進行了檢測(圖1C, 1D)。此外,我們通過納米顆粒跟蹤分析(NTA)技術確定了外泌體的大小(圖1E,1 F)。有趣的是,在不同疾病的外泌體樣本的電子顯微鏡下,我們發現冠狀動脈疾病患者釋放的外泌體比非冠狀動脈疾病患者多(圖1A,1B)。為了探索這些外泌體對內皮細胞的影響,我們用PKH67標記患有和未患有冠狀動脈疾病的患者的外泌體,并將其培養到人臍靜脈內皮細胞(HUVECs)中。連續標記24小時后,我們用共聚焦顯微鏡觀察到外泌體已被HUVECs有效內化。但在有和沒有冠狀動脈疾病的患者中,內皮細胞被外泌體內化的程度沒有明顯變化(圖1G,1I)。我們隨后測試了內皮細胞的增殖能力和細胞活力(圖1J, 1M)。結果表明,冠狀動脈疾病患者的血漿外泌體削弱了內皮細胞的活力和增殖能力。
2)circ_0001785在冠狀動脈疾病患者中的表達
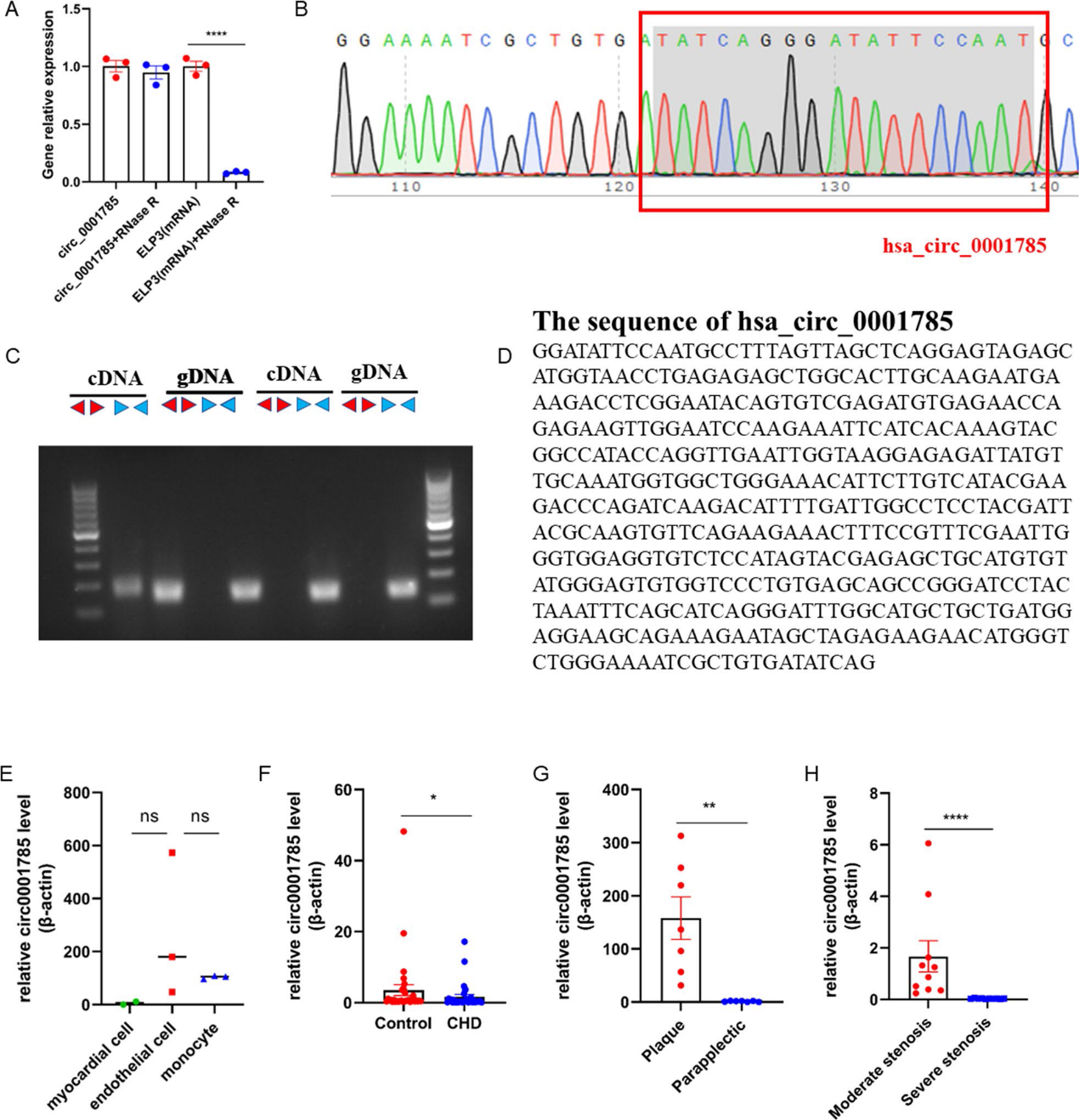
為了確定circ_0001785的結構特征,我們首先檢測了它對RNase R消化的耐受性。結果表明,circ_0001785對RNase R具有顯著的耐受性,進一步證明了circ_0001785的環狀結構(圖2A)。為了驗證circ_0001785的反向剪接位點,我們進行了Sanger測序。從測序結果可以看出,circRNA含有ELP3基因外顯子背對背剪接位點(圖2B)。此外,我們發現cDNA中的circ_0001785可以在HUVECs的cDNA中檢測到,但不能在HUVECs的gDNA中檢測到(圖2C)。我們隨后研究了外泌體circ_0001785對冠狀動脈疾病患者動脈粥樣硬化的影響。我們首先確定了circ_0001785的細胞起源。我們發現circ_0001785在單核細胞中表達穩定,且其表達量明顯高于其他兩組。因此,我們確定circ_0001785主要來源于單核細胞(即主要來源于白細胞)(圖2E)。接下來,我們提取冠狀動脈疾病患者的白細胞,通過qRT-PCR檢測circ_0001785的表達,發現circ_0001785在冠狀動脈疾病患者白細胞中的表達水平明顯低于健康對照患者(圖2F)。當我們檢查下肢動脈粥樣硬化斑塊患者的斑塊組織時,我們發現斑塊組織中的circ_0001785明顯多于斑塊旁邊的其他組織(圖2G)。因此,我們認為circ_0001785可能在斑塊形成或內皮細胞損傷期間通過外泌體轉移到損傷部位。為了進一步確定circ_0001785與臨床冠狀動脈疾病患者之間的關系,我們根據冠狀動脈狹窄程度將20例患者分為兩組(III級50%-75%,IV級75%-100%),結果顯示嚴重冠狀動脈狹窄患者的circ_0001785水平明顯低于中度冠狀動脈狹窄患者(圖2H)。
3)內皮細胞損傷模型的功能科學驗證
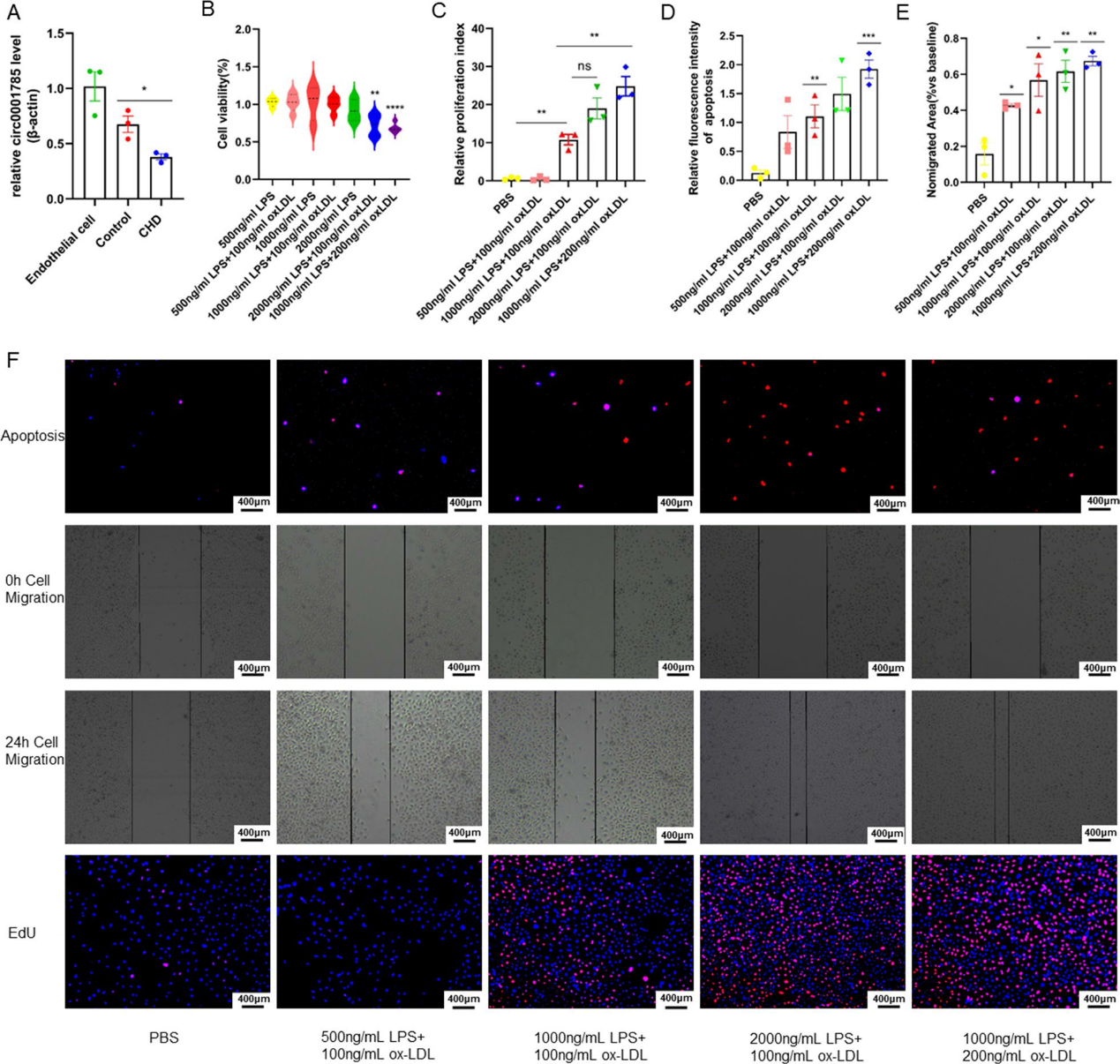
首先,我們研究了外泌體與內皮細胞共培養后circ_0001785的表達,發現circ_0001785在冠狀動脈疾病病患者組中的表達明顯降低(圖3A)。因此,我們認為外泌體來源的circ_0001785可能在冠狀動脈疾病中發揮重要作用。為了更好地模擬人類冠狀動脈疾病發生的環境,本研究建立了一種新的動脈粥樣硬化內皮細胞損傷模型。我們用ox-LDL聯合LPS共刺激內皮細胞,通過內皮細胞功能實驗證實模型建立成功,并再次分析模型的生物學功能。為了更好地模擬人類冠狀動脈疾病的發展環境,本研究建立了一種新的AS伴炎癥浸潤模型。模型采用ox-LDL聯合LPS共同刺激ECs。通過CCK-8實驗發現,與2000 ng/ml LPS + 100 ng/ml ox-LDL相比,1000 ng/ml LPS + 200 ng/ml oxLDL對ECs的毒性更大,且具有統計學意義(圖3B)。通過對ECs損傷模型的功能驗證,我們發現在ECs凋亡實驗中,1000 ng/ml LPS + 100 ng/ml ox-LDL和1000 ng/ml LPS + 200 ng/ml ox-LDL的凋亡程度更強且顯著,而2000 ng/ml LPS + 100 ng/ml ox-LDL的凋亡程度不那么顯著(圖3D-3F)。ECs的傷口愈合實驗和細胞增殖實驗顯示,當ox-LDL和LPS濃度達到500 ng/ml LPS + 100 ng/ml ox-LDL時,ECs的遷移能力開始增強(圖3E, 3F)。當ox-LDL和LPS濃度超過1000 ng/ml LPS + 100 ng/ml ox-LDL時,內皮細胞的增殖顯著下降(圖3C-3F)。本研究為模擬人類AS提供了較優質的內皮細胞損傷模型。
4)circ_0001785通過miR-513a-5p/TGFBR3的ceRNA網絡軸發揮作用
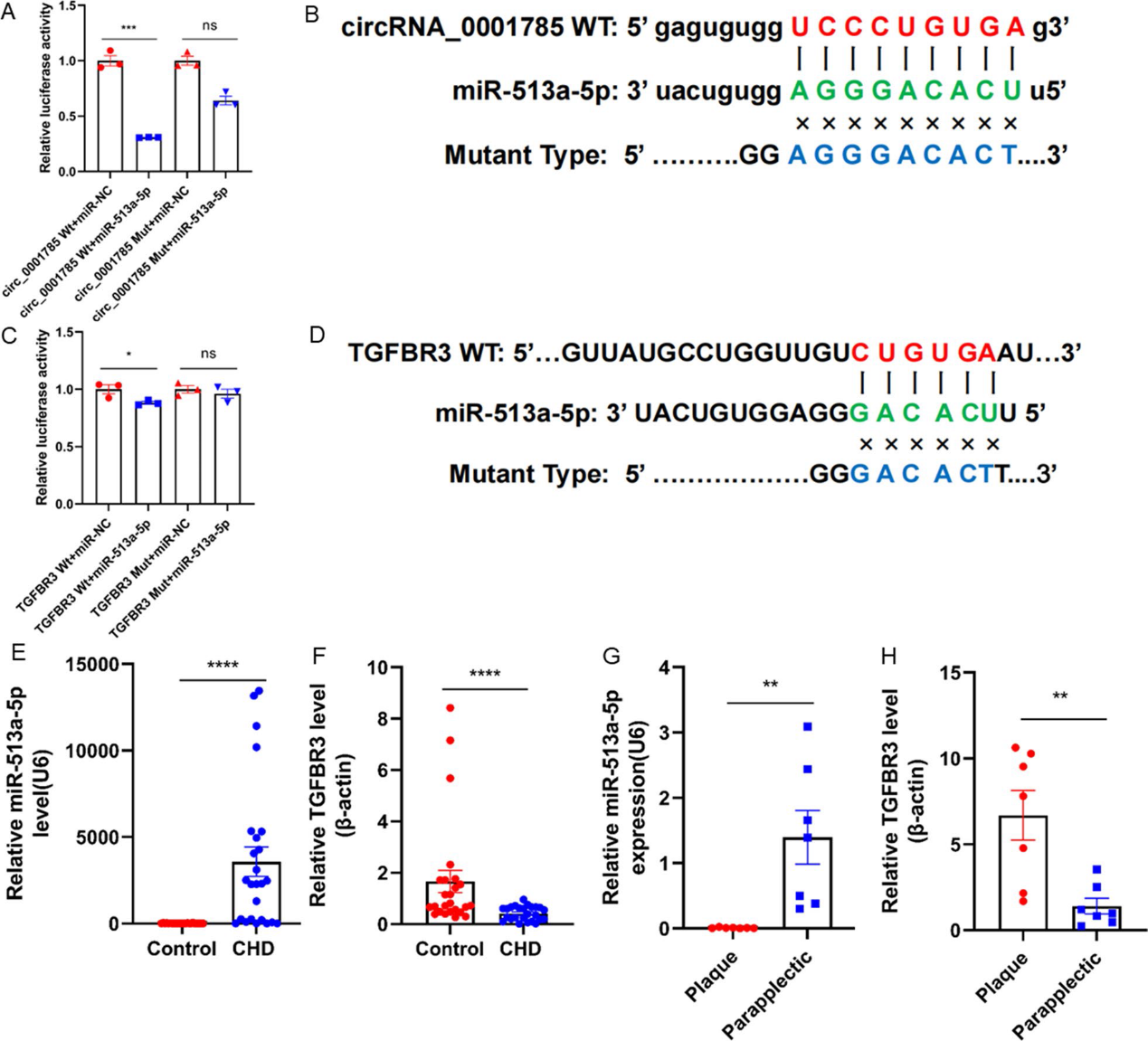
為了確定circ_0001785的下游靶基因,我們首先進行了生物信息學分析。在之前的研究中,我們確定了circ_0001785/miR-513a-5p/TGFBR3的靶向通路。為了驗證預測的靶標,基于circ_0001785和miR-513a-5p之間可能的結合位點,我們進行了雙熒光素酶報告基因實驗。結果顯示,過表達miR-513a-5p顯著降低wt型circ_0001785熒光素酶活性,而不降低mut型circ_0001785熒光素酶活性(圖4A, 4B)。上述結果也表明circ_0001785可以通過堿基互補直接與miR-513a-5p結合。同樣,我們也驗證了miR-513a-5p與TGFBR3的結合(圖4C, 4D)。為了進一步驗證miR-513a-5p和TGFBR3的表達,我們分別從冠狀動脈疾病患者和健康對照中提取RNA,對miR-513a-5p和TGFBR3進行qRT-PCR實驗,結果顯示冠狀動脈疾病患者血液中miR-513a-5p表達升高,TGFBR3表達顯著降低(圖4E, 4F)。我們檢查了下肢動脈粥樣硬化斑塊患者的斑塊組織,發現斑塊組織中miR-513a-5p的含量明顯低于斑塊旁的其他組織,而TGFBR3的含量則高于斑塊旁的其他組織(圖4G, 4H)。
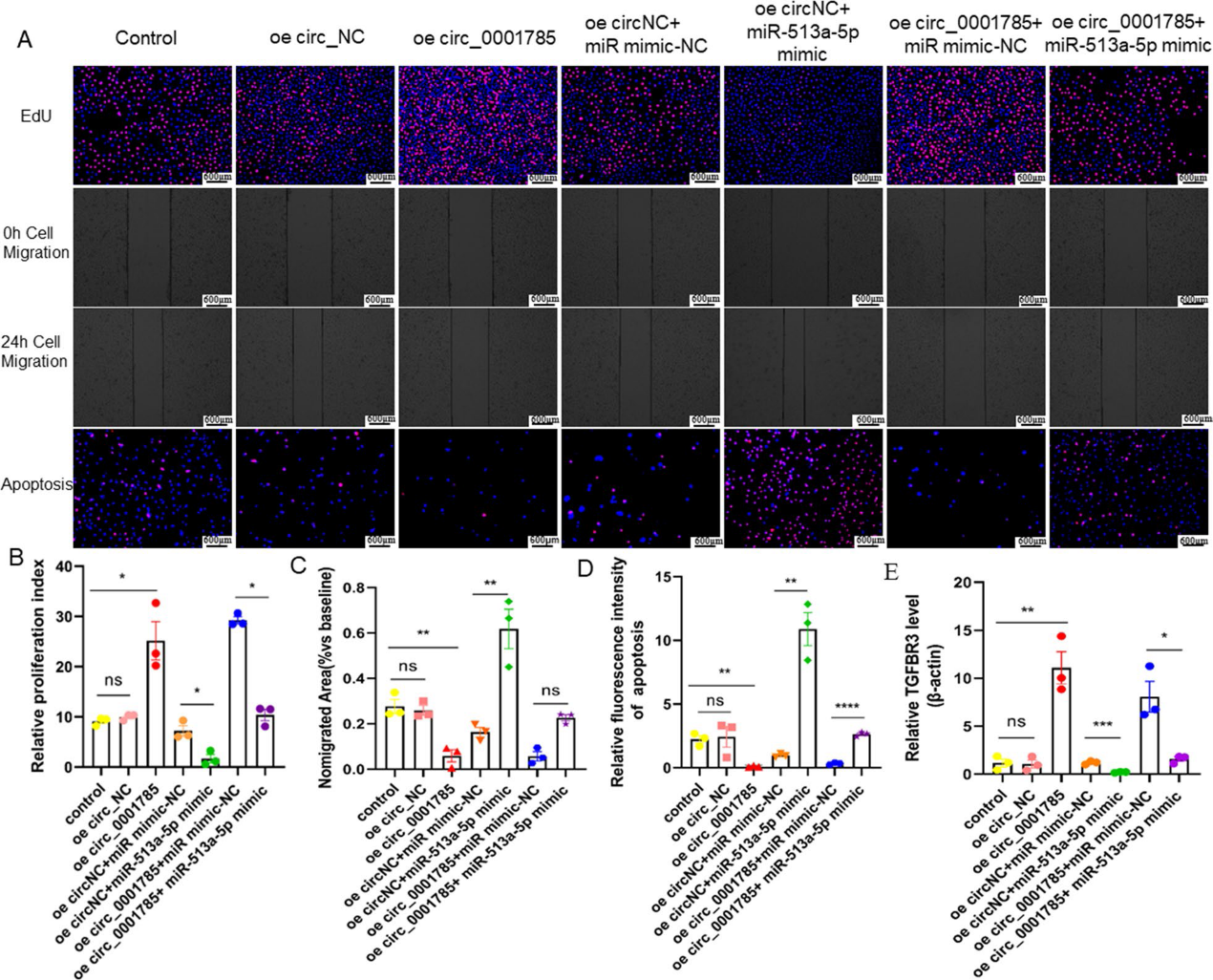
5)circ_0001785通過miR-513a-5p/ TGFBR3促進內皮細胞增殖,抑制凋亡和遷移
我們進一步探討circ_0001785是否通過miR-513a-5p/TGFBR3通路影響內皮細胞增殖、遷移和凋亡。結果顯示,過表達miR-513a-5p在一定程度上減弱了circ_0001785過表達引起的增殖促進作用(圖5A, 5B),以及對細胞凋亡的抑制作用(圖5C)和內皮細胞遷移的抑制作用(圖5D)。我們還通過qRT-PCR檢測了TGFBR3的表達水平,發現在過表達circ_0001785的內皮細胞中,TGFBR3的表達水平顯著升高,而miR-513a-5p模擬物的加入能夠拮抗這種表達的增加,導致TGFBR3的表達降低 (圖5E)。上述實驗提示circ_0001785可以通過抑制miR-513a-5p間接調節TGFBR3的表達,從而發揮其促進內皮細胞增殖的作用,抑制內皮細胞凋亡和遷移的作用。
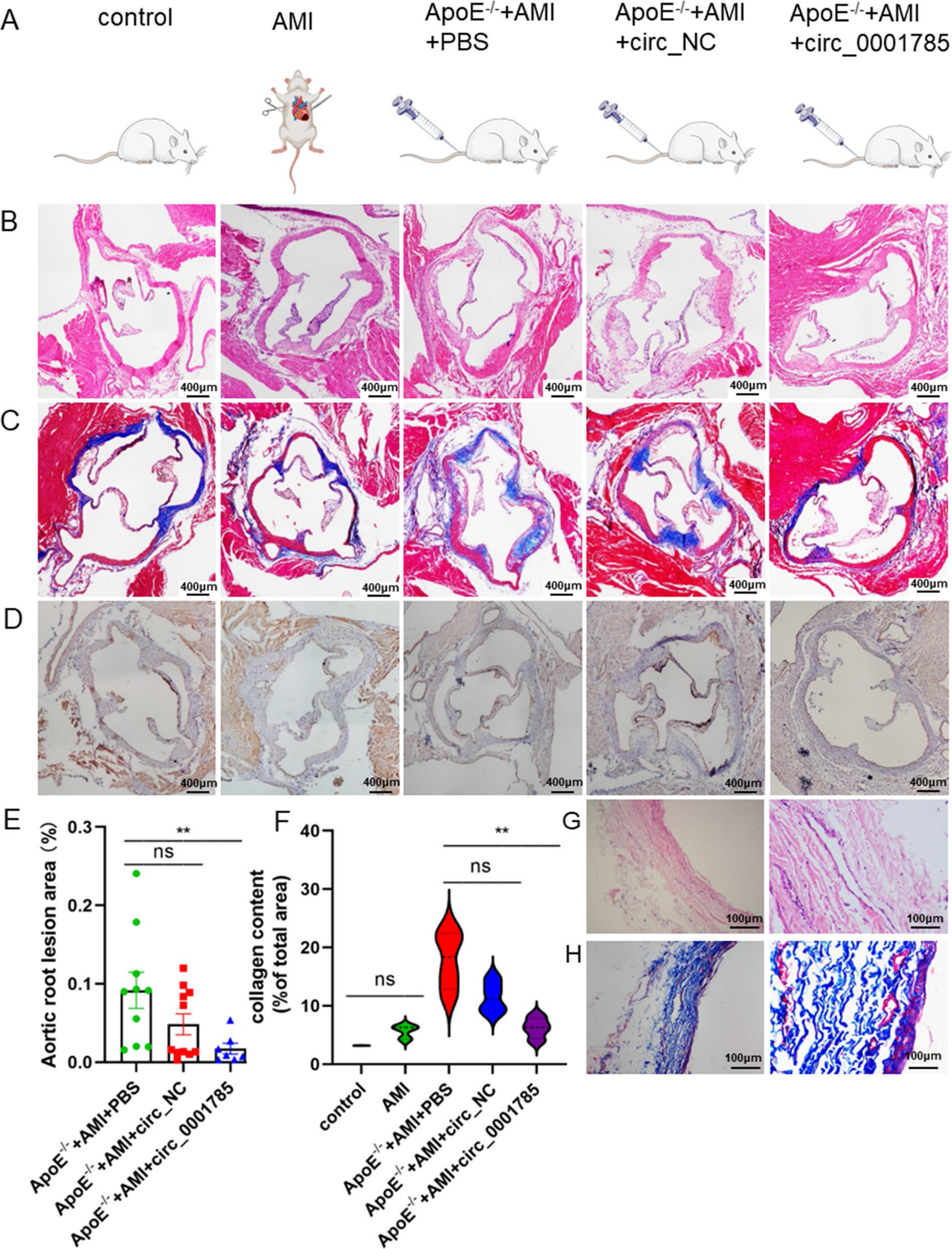
6)小鼠動脈粥樣硬化內皮損傷模型的建立
我們建立了具有動脈粥樣硬化斑塊和炎癥浸潤的小鼠模型。具體分組為:對照組、AMI、ApoE?/?+ AMI、ApoE?/?+ AMI + PBS、ApoE?/?+ AMI + LV-oe circ_0001785、ApoE?/?+ AMI + LV-oe circNC。其中,ApoE?/?小鼠在左前降支結扎前給予高脂肪喂養10周(圖6A)。與對照組和AMI組相比,ApoE?/?+ AMI小鼠更容易發生內皮細胞脫離和炎癥浸潤,斑塊擴大(圖6B、6D、6E)。同時,模型組小鼠動脈粥樣硬化增加,膠原含量增加,纖維帽變薄(圖6C、6F)。我們從臨床取出下肢動脈粥樣硬化患者的斑塊組織,進行HE和Masson染色,我們發現下肢動脈粥樣硬化患者斑塊組織中炎癥浸潤和膠原纖維均明顯增加,與小鼠模型中動脈粥樣硬化易損斑塊的病變特征一致(圖6G, 6H)。
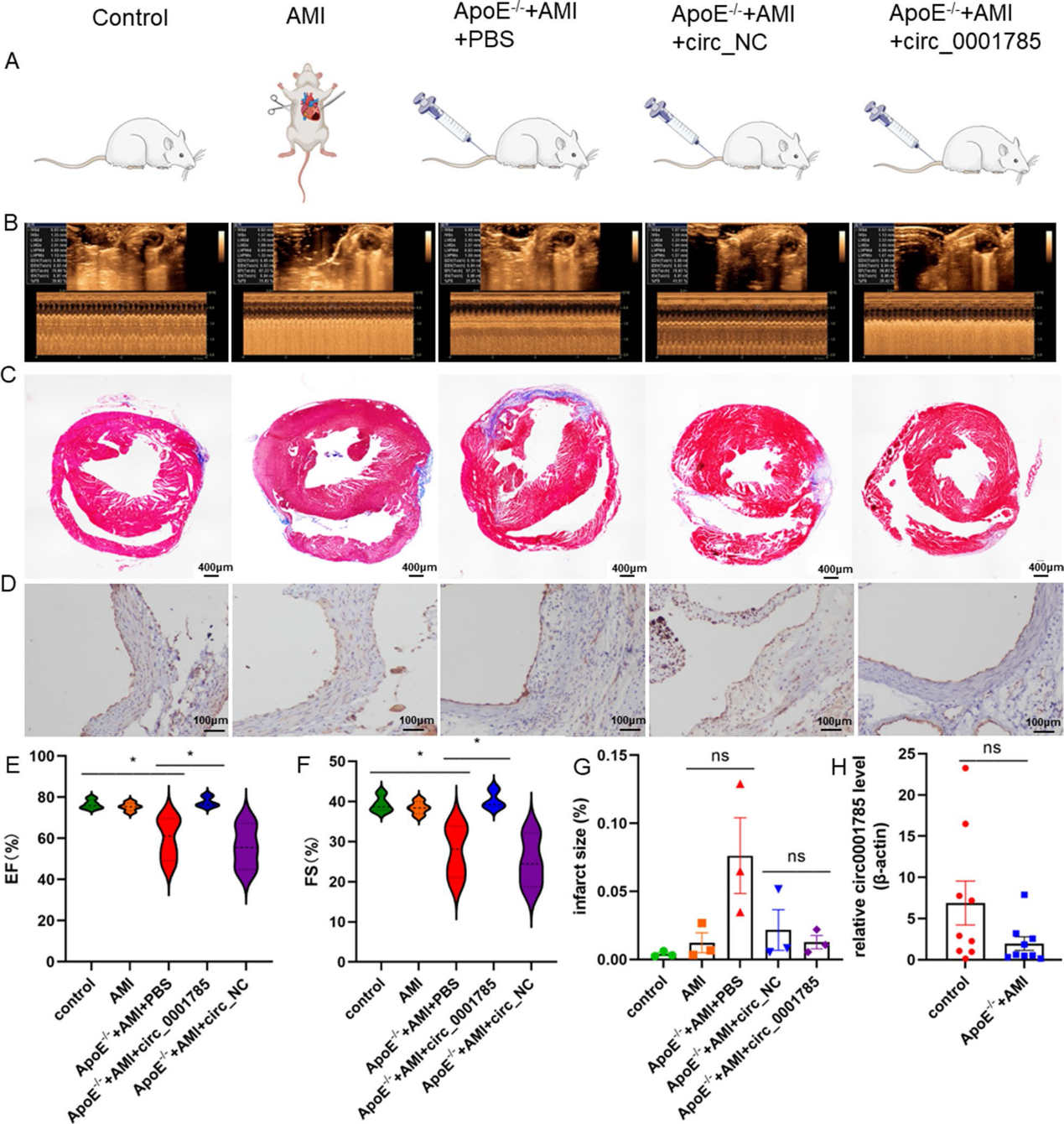
7)過表達circ_0001785導致小鼠內皮損傷減少,左心室舒張功能增強
我們通過超聲心動圖研究circ_0001785過表達對AMI后心臟功能的影響。與PBS組或circ_NC組相比,過表達circ_0001785治療后EF和FS均有改善,提示過表達circ_0001785可減緩心肌梗死后左心室功能障礙(圖7B, 7E-7F)。通過Masson染色,我們觀察到注射circ_0001785慢病毒的小鼠梗死面積顯著減少(圖7C-7G)。此外,我們在ApoE?/?+ AMI + PBS組小鼠斑塊中發現新血管 (圖7D)。我們進一步驗證circ_0001785在老鼠模型中所扮演的角色,我們發現模型組小鼠血液中circ_0001785的表達明顯降低(圖7E)。
結論
我們證明circ_0001785通過抑制miR513a-5p上調TGFBR3來保護內皮細胞免受損傷,從而減緩動脈粥樣硬化的發生,這提高了我們對動脈粥樣硬化斑塊形成內源性機制的理解。
實驗方法
動物模型、外泌體提取、外泌體追蹤、納米流式細胞術、qRT-PCR、雙熒光素酶報告實驗、傷口愈合試驗、CCK-8、EdU實驗、HE染色、Masson染色、免疫組化。
參考文獻
Tong X, Dang X, Liu D, Wang N, Li M, Han J, Zhao J, Wang Y, Huang M, Yang Y, Yang Y, Wang W, Kou Y, Kou J. Exosome-derived circ_0001785 delays atherogenesis through the ceRNA network mechanism of miR-513a-5p/TGFBR3. J Nanobiotechnology. 2023 Oct 4;21(1):362. doi: 10.1186/s12951-023-02076-x.






