新型TCF21high周細胞亞群通過重塑血管周圍基質促進結直腸癌轉移
血源性播散是結直腸癌(CRC)轉移的常見途徑。然而,作為血管的守門人,腫瘤周細胞(TPCs)在血源性轉移中的作用在很大程度上仍然未知。本文旨在研究TPCs的異質性及其對CRC轉移的影響。通過scRNA-seq鑒定21個TPC亞群。TCF的新子集TCF21high TPCs,稱為“基質-周細胞”,與結直腸癌患者的肝轉移有關。TPCs中的TCF21增加血管周圍ECM硬度,膠原重排和基底膜降解,建立血管周圍轉移微環境,從而引發結直腸癌肝轉移(CRCLM)。TPCs中的Tcf21耗竭減輕血管周圍ECM重塑和CRCLM,而TCF21high TPCs和CRC細胞的共注射顯著促進CRCLM。在機制上,整合素α5的缺失抑制FAK/PI3K/AKT/DNMT1軸以損害TCF21high TPCs中的TCF21 DNA高甲基化。本研究揭示TPC在血源性轉移中以前未確定的作用,并為CRC轉移提供潛在的診斷標志物和治療靶點。本文于2023年4月發表在《Gut.》IF:24.5期刊上。
技術路線

主要實驗結果
1、與結直腸癌轉移相關的不同TPCs亞群的鑒定
為剖析TPCs的異質性并評估其對CRC轉移的貢獻,從具有或不具有肝轉移的CRC患者的原發性腫瘤組織中分離TPCs,并使用10×chromium平臺通過scRNA-seq進行分析。從50000個細胞產生單細胞轉錄組,其在t-隨機相鄰嵌入(t-SNE)空間中并置以鑒定不同的簇(圖1A)。TPC的基因表達譜被分類為13個不同的簇(圖1B),并且使用已知的周細胞標記確定它們的起源。前10個簇特異性基因示于圖1C中。簇2中的細胞比例在具有(18.5%)和不具有(3.4%)肝轉移的CRC患者之間的所有亞組中顯示最大差異(圖1D),表明該亞組與CRCLM相關。基因本體(GO)富集分析表明,來自具有肝轉移的CRC患者的樣品中上調的基因與與ECM相關的幾個GO術語相關(圖1E),包括MATN2、CHI3L1、C0L3A1、C0L1A2、CILP、MMP2、MFAP4、FBLN1和FBLN2(圖1F)。因此,將簇2中的細胞定義為基質-周細胞。選擇僅在簇2中富集的基因之一MATN2作為基質周細胞的生物標志物,MATN2編碼蛋白質matrilin-2(MATN2)。MATN2+ TPC的比率在來源于具有肝轉移的CRC患者的腫瘤切片中比在沒有肝轉移的那些中更高(圖1G)。此外,受試者工作特征(ROC)曲線分析顯示,以高靈敏度和特異性預測CRCLM的MATN2+ TPCs的最佳截止百分比為30%(圖1H)。Kaplan-Meier生存分析顯示,在具有高(>30%)比例的MATN2+ TPCs的患者中,總生存期(OS)(圖1I)和無疾病生存期(DFS)(圖1J)較短。此外,MATN2+ TPC比值與臨床病理參數的相關性分析顯示,MATN2+ TPC比值與結直腸癌患者的TNM分期和肝轉移呈正相關。總之,這些數據表明基質周細胞與CRC轉移顯著相關。
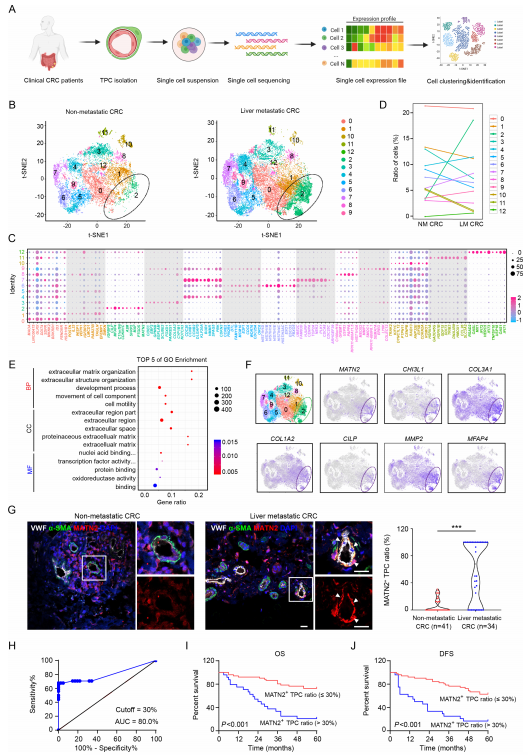
圖1 來自CRC患者的TPC中基質周細胞的轉錄組學特征
2、TPCs中的TCF21與CRC轉移有關
使用單細胞調控網絡推理和聚類(SCENIC)管道鑒定基質-周細胞的關鍵調節因子,該管道將順式調控序列信息與scRNA-seq數據連接起來。SCENIC分析表明,TCF21的調節子活性在基質-周細胞中最高(圖2A),這在所有細胞的t-SNE空間中得到證實(圖2B)。此外,TCF21high TPCs的數量與無肝轉移的患者相比,在有肝轉移的結直腸癌患者樣本中顯著增加(圖2C)。此外,肝轉移結直腸癌患者腫瘤切片中TCF21+ TPCs的比例增加(圖2D)。然而,在CRC患者肝轉移性腫瘤的TPCs中檢測不到TCF21。Pearson相關系數分析表明TCF21+ TPCs與MATN2+基質-周細胞的比例呈正相關(r=0.805,P<0.001;圖2E)。這些數據表明TCF21+ TPCs與基質-周細胞密切相關。ROC曲線分析顯示,用于預測結直腸癌患者肝轉移的TCF21+ TPCs最佳百分比為44%(圖2F)。Kaplan-Meier生存分析表明,TCF21+ TPCs比率較高(>44%)的患者的OS(圖2G)和DFS(圖2H)明顯較短。此外,TCF21+ TPCs比值與結直腸癌患者的TNM分期和肝轉移顯著相關。這些發現表明,TPCs中的TCF21可以作為CRC轉移的預測生物標志物。
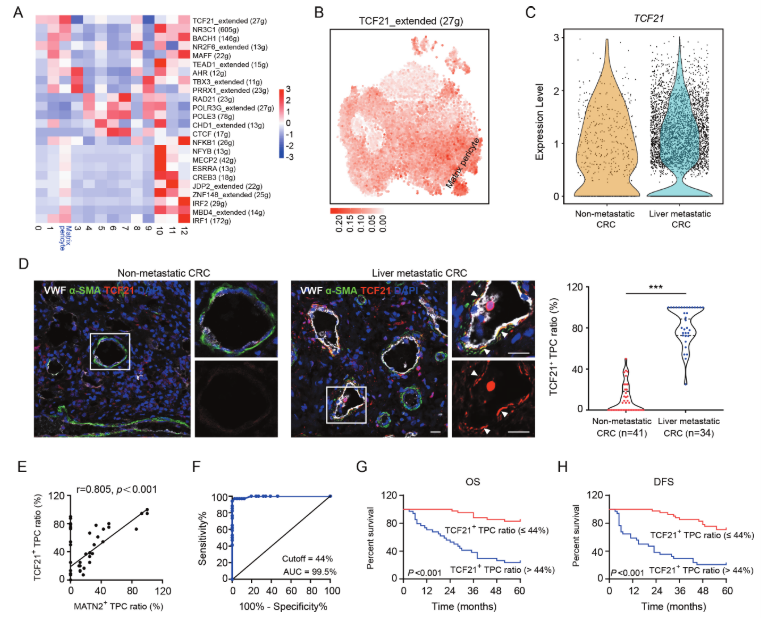
圖2 基質周細胞中的TCF21與CRC的肝轉移正相關
3、TCF21在TPCs中參與基質-周細胞表型轉變和血管周圍ECM的重塑
TPCs中的TFC21上調與CRCLM呈正相關,表明TCF21可能參與TPCs的活化,并可能促進基質-周細胞的表型轉變。TPCs中TCF21的耗竭或過表達對細胞增殖,粘附和遷移的影響可以忽略不計。基質-周細胞中9個基因的水平,包括IGFBP5,CILP,MFAP4,c11orf96,A2M,SFRP2,MAF,PTGDS和MATN2,相比TPC NM Vector,在TPCNM TCF21中顯著升高(圖3A)。相反,這些基因在轉染siTCF21的TPCLM(TPCLM siTCF21)中的水平比那些轉染陰性對照siRNA(TPCLM siNC)顯著降低。此外,MATN2+基質周細胞的百分比通過TPCNM中TCF21的過表達而增加,并且通過TPCLM中TCF21的敲低而降低(圖3B)。
RNA-seq和ChIP-seq結果的GO富集分析表明,TCF21調控的基因與“ECM組織”和“ECM”類別相關(圖3C,D),與基質-周細胞中的表達譜相似。此外,通過ChIP-seq分析檢測到的TCF21峰,通過RNA-seq檢測到的TCF21誘導基因和通過scRNA-seq檢測到的基質-周細胞基因的比較確定139個重疊基因(圖3E)。對這些重疊基因的GO分析顯示它們與“含膠原蛋白的ECM”和ECM類別相關聯(圖3F)。這些結果通過RT-qPCR和ChIP-qPCR得到證實,并且在TCF21過表達TPCNM中TCF21與基質-周細胞特異性基因啟動子的結合顯著上調(圖3G,H),通過蛋白質印跡證實(圖3I)。這些結果表明,TCF21對于基質-周細胞的產生至關重要。
ECM重塑對腫瘤轉移至關重要,表現為異常的膠原蛋白產生和交聯導致組織僵硬,從而促進腫瘤轉移。此外,蛋白酶(如基質金屬蛋白酶)對血管基底膜的降解有助于腫瘤細胞從原發性腫瘤部位逃逸。作者提出TCF21可能在血管周圍ECM重塑和CRC轉移中發揮作用。TCF21在TPCs中的過表達或敲低均未改變體外腫瘤細胞增殖,遷移,EMT或內皮細胞管形成。原子力顯微鏡(AFM)顯示TPCNM TCF21在誘導膠原蛋白的局部排列、卷曲和片狀膠原蛋白纖維重組成放射狀和成束結構以及增加粗糙度方面具有比TPCNM Vector更大的能力(圖3J)。此外,TPCNM TCF21在硬化膠原蛋白的機械性能(圖3K)和增加膠原蛋白收縮(圖3L)方面優于TPCNM Vector,從而增強ECM硬度。為進一步評估TCF21介導的血管周圍ECM重塑對CRC細胞迀移的影響,將與TPCNM Vector、TPCNM TCF21、TPCLM siNC或TPCLM siTCF21混合的PKH- 67標記的HCT116或DLD-1細胞接種到基質膠中。TPCNM TCF21在促進CRC細胞通過Matrigel包被的transwell膜侵襲方面優于TPCNM Vector(圖3M),而TPCLM siTCF21與TPCLM siNC相比,降低CRC細胞的侵襲。在器官典型培養系統上進行的實驗表明,與TPCNM Vector相比,當由膠原蛋白I和基質膠組成的基質與TPCNM TCF21預混合時,侵入的HCT 116細胞的數量顯著增加(圖3N)。總的來說,這些結果表明基質-周細胞中的TCF21誘導血管周圍ECM重塑并促進CRC細胞通過血管周圍基質侵襲。
作者進一步研究MATN2是否具有與TCF21相似的促轉移作用。鑒于TCF21high TPCs通過ECM重塑促進腫瘤轉移,在過表達或敲低MATN2的TPC中通過RT-qPCR檢查編碼ECM蛋白的基因水平,例如COL1A2,COL3A1,MMP2,CHI3L1和FBLN1。結果表明,TPCs中的MATN2對這些ECM相關基因水平的影響可以忽略不計。此外,TPCs中的MATN2對腫瘤細胞侵襲的影響可以忽略不計。這些數據表明,MATN2+ TPCs不能為腫瘤細胞提供類似于TCF21high TPCs的腫瘤細胞轉移表型,可能僅作為基質-周細胞的特征標記物。
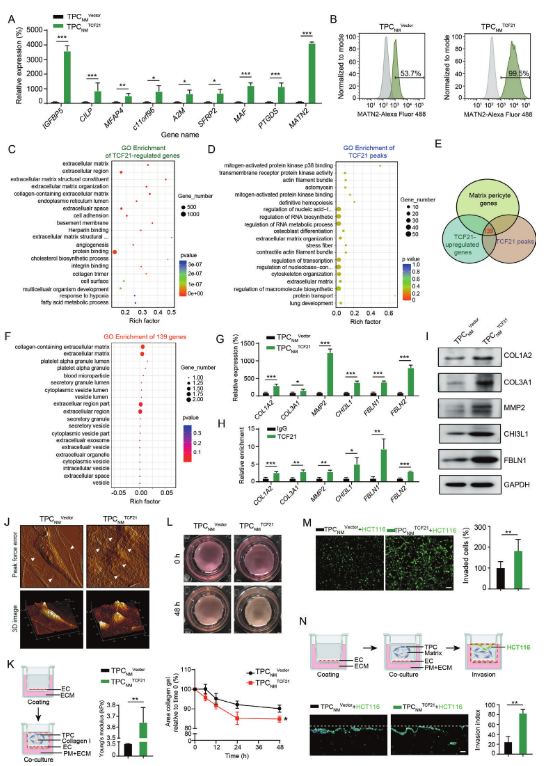
圖3 TCF21對于基質周細胞的形成至關重要,并通過ECM重塑促進CRC細胞侵襲。
4、敲除TPCs中的Tcf21抑制CRC轉移
為確定TPCs中的TCF21是否對體內CRC轉移至關重要,產生周細胞譜系追蹤小鼠(PClin)和他莫昔芬誘導型Cspg4驅動的周細胞特異性Tcf21敲除小鼠(PClin-KO)(圖4A)。向PClin和PClin-KO小鼠施用他莫昔芬導致用tdT熒光標記周細胞,以及PClin-KO小鼠中Tcf21的敲除。在體內,Tcf21的TPC特異性缺失顯著抑制肝轉移的形成(圖4B)。與PClin小鼠相比,PClin-KO小鼠中肝轉移灶的面積和數量顯著減少(圖4C)。此外,PClin-KO小鼠中EpCAM+ CD45? CTCs的數量顯著低于PClin小鼠(圖4D)。這些數據表明TPCs中的TCF21促進CRC轉移,獨立于腫瘤生長和EMT。
通過評估周細胞覆蓋率和腫瘤血管中MATN2+基質周細胞的百分比,進一步評價TPCs中TCF21對血管結構和功能的影響。免疫熒光染色顯示,TPCs中Tcf21的缺失對總周細胞覆蓋率具有可忽略的影響,而MC38-luc-LM3CRCLM異種移植物的原發性腫瘤組織中MATN2+基質周細胞的數量在PClin-KO小鼠中比在PClin小鼠中更低(圖4E)。此外,來自PClin小鼠的TPC中ECM重塑相關蛋白(包括MMP2、C0L1A2、C0L3A1和CHI3L1)的表達顯著高于來自PClin-KO小鼠(圖4F)。Masson染色顯示,與PClin小鼠相比,來自PClin-KO小鼠的腫瘤切片中纖維狀膠原組分的密度顯著降低(圖4G)。透射電子顯微鏡分析表明,在血管周圍區域的膠原束在來自PClin-KO的腫瘤切片中比在來自PClin小鼠的那些中更薄(圖4H)。組織硬度和腫瘤細胞的局部侵襲性需要膠原沉積,膠原取向的變化也有助于腫瘤轉移。通過二次諧波產生和雙光子激發熒光進一步檢查血管周圍膠原的結構。PClin-KO小鼠的血管周圍膠原纖維不規則地排列在腫瘤血管周圍,有卷曲的和不固定的輪廓,而PClin小鼠中的血管周圍膠原蛋白具有幾乎平行的取向,并且緊密地包圍在腫瘤血管周圍(圖4I)。通過AFM測定血管周圍區域的硬度,并用楊氏模量模式分析,并且作者發現PClin-KO小鼠中的血管周圍區域比PClin小鼠中的血管周圍區域顯著更軟(圖4J、K)。由于基底膜充當腫瘤細胞內滲的物理屏障,基底膜的降解可削弱其屏障功能并增加血管通透性。結果顯示,層粘連蛋白(血管基底膜中最豐富的組分)的表達在PClin-KO小鼠中顯著高于PClin小鼠(圖4L),并且與PClin小鼠相比,TPCs中Tcf21的缺失導致PClin-KO小鼠的血管通透性降低(圖4M)。總之,基質-周細胞中的TCF21可能是血管周圍ECM重塑的關鍵調節因子,其建立促進CRC細胞內滲的PMM。

圖4 Tcf21的周細胞特異性敲除抑制血管周ECM的重塑和CRC轉移
5、整合素α5缺失降低TCF21啟動子甲基化并增加TCF21在TPC中的表達
整合素,ECM組分的關鍵受體,作為機械換能器起作用以促進腫瘤轉移。研究結果顯示,在13個TPCs簇中,ITGA2、ITGA5和ITGB1在基質周細胞中顯著減少(圖5A)。功能獲得和功能喪失實驗表明,TCF21在mRNA和蛋白質水平均受到整合素α5的負調控(圖5B)。
TCF21 DNA的超甲基化抑制各種類型的腫瘤細胞中的TCF21表達,包括非小細胞肺癌、頭頸部鱗狀細胞癌和CRC。對TPCs中TCF21啟動子內CpG島的甲基化的評估顯示,TPCs中TCF21表達與其甲基化狀態負相關。此外,整合素α5正調節TCF21 DNA超甲基化,并且TPCs中整合素α5的缺失減弱TPCs中TCF21啟動子的DNA超甲基化(圖5C)。
據報道,DNMT1可調節肺癌中TCF21的DNA超甲基化。研究結果表明,整合素α5的缺失通過抑制FAK/PI3K/AKT軸降低TPCNM中DNMT1的表達,而TPCLM中整合素α5的過表達產生相反的作用,這可以被FAK抑制劑Y15逆轉(圖5D)。此外,Y15或DNMT抑制劑SGI1027降低DNMT1的表達并抑制TCF21的DNA超甲基化(圖5E),隨后TPCLM ITGA5中TCF21的表達增加(圖5D)。這些結果表明,整合素α5的缺失通過抑制TCF21的DNA超甲基化來上調TPC中的TCF21。
在原位異種移植模型中研究TPCs中整合素α5對體內CRC轉移的影響,所述原位異種移植模型通過共注射HCT116-luc-LM3或DLD1-luc-LM3細胞和整合素α5-過表達或α5-敲低的TPCs產生(圖5F)。與TPCNM shNC相比,TPCNM shITGA5增加腫瘤組織血管周圍區域的膠原密度(圖5G),促進血管周圍基底膜降解,并顯著增加肝臟中轉移灶的數量和面積(圖5H)。相反地,腫瘤細胞和TPCLM ITGA5的共同注射顯示出與使用TPCLMVector的那些相比相反的效果(圖5G、H)。這些數據表明,TPC中整合素α5的缺失促進CRC轉移。
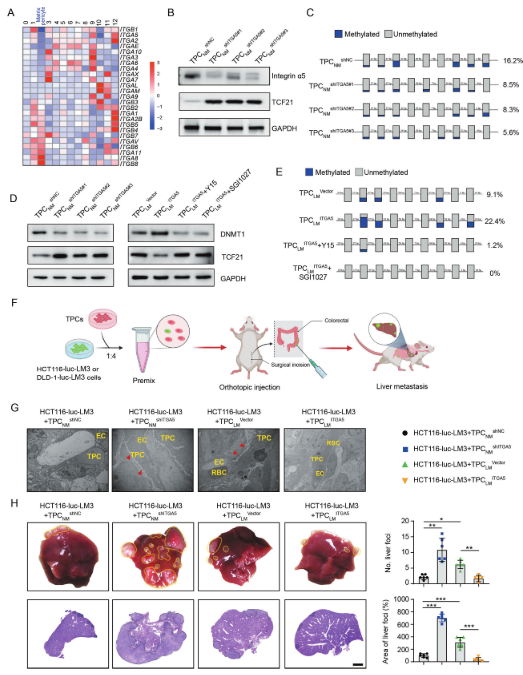
圖5 整合素α5缺失抑制TCF21啟動子的高甲基化并上調TCF21在TPC中的表達
6、TCF21high基質周細胞與結直腸癌患者血管周圍ECM重塑和肝轉移相關
為確定上述發現是否適用于CRC患者,在有和沒有肝轉移的CRC患者中評估血管周圍膠原沉積和排列。與沒有肝轉移的CRC患者相比,在具有肝轉移的CRC患者中,血管周圍膠原蛋白豐度和血管周圍膠原蛋白纖維重新定向成徑向排列更顯著(圖6A、B)。此外,與沒有肝轉移的那些相比,在來自具有肝轉移的CRC患者的腫瘤組織中,血管周圍區域的硬度顯著增強(圖6C、D)。此外,在來自具有肝轉移的CRC患者的TPC中,COL1A2、COL3A1和CHI3L1(圖6E)以及參與基底膜降解的關鍵蛋白酶MMP2(圖6F)的表達高于來自具有肝轉移的CRC患者的TPCs。相應地,整合素α5的表達在來自具有肝轉移的CRC患者的TPCs中比在沒有肝轉移的那些中更低(圖6G)。Pearson相關分析表明,TPCs中MMP2、C0L1A2、C0L3A1和CHI3L1的水平呈正相關,而TPCs中整合素α5的水平與TCF21high TPCs的比率呈負相關(圖6E-G)。這些臨床數據表明,整合素α5缺失誘導的TCF21上調是血管周圍ECM重塑和PMM建立的重要調節因子,從而促進CRC轉移。
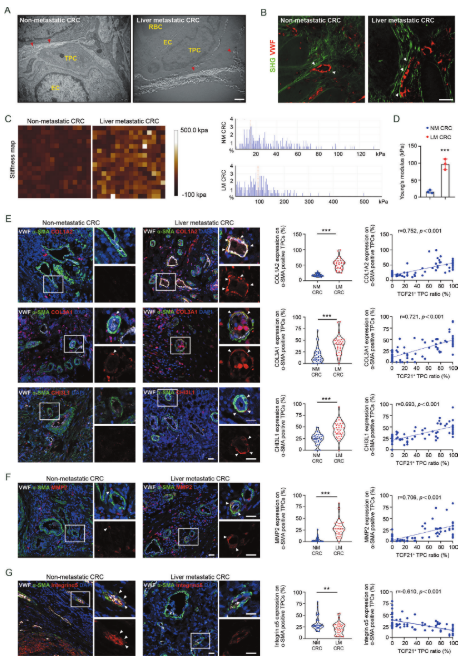
圖6 基質周細胞中的TCF21與源自CRC患者的原發性腫瘤中血管周圍ECM的重塑相關。
總之,本研究使用scRNA-seq揭示CRC患者中TPCs的異質性,并鑒定與CRCLM相關的TCF21high TPCs的新亞群。這些發現揭示TCF21high TPCs在構建PMM中的作用和機制,通過重塑血管周圍ECM促進CRC轉移,并提供潛在的血源性轉移的診斷標志物。
實驗方法
scRNA-seq,流式細胞術,血管通透性測定,染色質免疫沉淀(ChIP)和ChIP-Seq,RT-qPCR assay,細胞轉染,免疫印跡實驗,免疫熒光分析,H&E染色、免疫組織化學和Masson染色,RNA測序分析,遷移和侵襲測定,膠原凝膠收縮試驗,細胞增殖測定,粘附試驗,管形成分析,透射電鏡分析,二次諧波產生和雙光子激發熒光(SHG/TPEF),原子力顯微鏡(AFM)測量,DNA提取和亞硫酸氫鹽測序
參考文獻
Li X, Pan J, Liu T, et al. Novel TCF21high pericyte subpopulation promotes colorectal cancer metastasis by remodelling perivascular matrix. Gut. 2023;72(4):710-721. doi:10.1136/gutjnl-2022-327913






