巨噬細胞源性骨橋蛋白(SPP1)保護非酒精性脂肪性肝炎
非酒精性脂肪性肝炎(NASH)以脂肪變性、小葉炎癥、肝細胞球囊變形和纖維化為特征,所有這些增加了NASH發展為終末期肝病的風險。骨橋蛋白(OPN,SPP1)在巨噬細胞(MF)中發揮重要作用,但MF衍生的OPN是否影響NASH進展是不知道的。研究分析了來自NASH患者的公開轉錄組數據集,并使用在髓系細胞和肝臟MFs中條件性過表達或敲除SPP1的小鼠,模擬西方飲食給予它們高脂、果糖和膽固醇飲食,以誘導NASH。本研究證明高表達SPP1的MFs在非酒精性脂肪性肝病(NAFLD)患者和小鼠中富集,并表現出代謝但非促炎特性。在髓系細胞中條件性敲除SPP1(SPP1KI Mye)或在肝巨噬細胞中條件性敲除SPP1(SPP1KI LvMF)可提供保護作用,而在髓系細胞中條件性敲除SPP1(SPP1ΔMye)可加重NASH。這種保護作用是通過誘導精氨酸酶-2(ARG2),增強肝細胞中脂肪酸氧化(FAO)來介導的。ARG2的誘導源于SPP1KI Mye小鼠MFs中制瘤素- M(OSM)產量的增加。OSM激活STAT3信號,從而上調ARG2。除了肝臟作用外,SPP1KI Mye還通過性別特異性的肝外機制發揮保護作用。MF來源的OPN通過上調OSM,通過STAT3信號增加ARG2,從而保護NASH。進一步,ARG2介導的FAO增加減少了脂肪變性。因此,增強MFs和肝細胞之間的OPN - OSM - ARG2對話可能對NASH患者有益。本研究于2023年6月發表在期刊《Gastroenterology》上,IF=29.4。
技術路線

主要研究內容
1、Kupffer cells (KCs)中SPP1信使RNA表達較高的患者脂肪變性評分相對較低
轉錄組數據集GSE135251(206位NAFLD患者)揭示了SPP1 mRNA表達與NAFLD活性評分(NAS)和纖維化評分有著顯著相關性(圖1A)。轉錄組數據集GSE126848,GSE135251和GSE167523(335位NAFLD患者)顯示,45個基因均與SPP1表達相關。將這45個基因與人類scRNA seq數據集GSE136103(健康個體和肝硬化患者)進行比對,鑒定出9個在髓系細胞中表達的基因,其中3個是骨髓細胞特異性的(TREM2, MMP9, OLR1)(圖1B)。scRNA seq數據集GSE136103的細胞聚類鑒定出SPP1高表達的MF集群(SPP1High MFs),TREM2(LAM的標記物)也高表達。此外,NASH患者原發Kupffer cells(KC)的RNA-seq顯示,KCs中SPP1表達較高的患者脂肪變性評分相對較低(圖1C)。因此,盡管肝中SPP1 mRNA與NASH進程相關,是否MF源性的OPN保護或傷害了肝臟,需要進一步的調查。

圖1- KCs中SPP1 mRNA表達較高的患者脂肪變性評分相對較低
2、在NASH病人和小鼠中,OPN蛋白表達的增加
為證實NASH中OPN主要的細胞來源,研究分別對NASH患者肝臟進行活檢,對NASH小鼠組織進行免疫染色。NASH患者的OPN染色隨著纖維化分期逐漸增加,伴隨著OPN + MF簇,通過免疫組織化學鑒定OPN(或SPP1)和CD68共定位(圖1D)。對照組小鼠在膽管上皮細胞中OPN表達受限,周圍肝細胞和非實質性肝細胞中的染色很少(圖1E,top left)。NASH小鼠的肝細胞和MF中OPN表達受到誘導(圖1F,bottom left),后者進一步說明了SPP1和EMR1的共定位。這些結果證實,MF增加了人類和小鼠NASH中OPN的表達。
3、OPN mRNA表達上調的MF在NASH中顯示代謝表型
為理解OPN+MFs的功能,研究分析了NASH小鼠的一個公共的單細胞測序數據GSE129516。MF群體的亞聚類 鑒定出5個簇(KC[1], cyclin -KC, LAM[1], LAM[2],SPP1High MFs)與對照組相比,在NASH中SPP1表達增加。其中,SPP1High MFs中SPP1的表達最高,同時和LAM標記物(Trem2、Gpnmb、Cd9)的表達最高(圖1F)。差異表達(DE)分析揭示了SPP1High MFs具有相對較低水平的參與炎癥(Il1b、S100a4)和纖維化(Tgfb)的基因,但參與脂質代謝(Cd36、Lpl、Fabp5、Fabp4、Fabp7)和細胞外基質重塑(Mmp12、Mmp13)的基因水平較高(圖1F)。同樣,與其他LAMs相比,這些差異在SPP1High MFs中也被觀察到;然而,與LAM[2]相比,它們的SPP1表達水平為中等水平。Ingenuity Pathway Analysis(IPA)預測與其他MFs相比,SPP1High中參與炎癥的通路(白細胞外滲、IL6、HMGB1)受到抑制,但在脂質代謝(LXR / RXR、PPAR α / RXR α)中上調。這些結果表明,OPN在MFs中的上調賦予了NASH的代謝特性,而不是炎癥特性。
4、髓系細胞SPP1敲入小鼠(SPP1KI Mye)可預防NASH
為了解MFs中OPN的誘導如何促進NASH進展,研究準備了SPP1KI Mye小鼠。SPP1KI Mye和WT小鼠用對照或NASH誘導的飲食喂養6個月。WT小鼠(雄和雌均有)發展為NASH,表現為嚴重的脂肪變性、炎癥和肝細胞氣球樣變,分別在靠近中央和門靜脈區的微血管和大血管脂肪變性分布精細(圖2A和B)。WT雄性(NAS ? 6.4)比雌性(NAS ? 4.8)表現出更嚴重的病理改變。與WT小鼠相比,SPP1KI Mye的兩種性別小鼠的NAS、肝體比、脂滴、肝臟TGs和膽固醇(CHO)以及谷丙轉氨酶活性均顯著降低 NASH(圖2B - D)。值得注意的是,與WT小鼠相比,飼料對照組雄性和雌性SPP1KI Mye小鼠NAS和肝臟TGs水平更低(圖2B - D)。
與SPP1KI Mye相比,WT小鼠SPP1KI Mye肝臟中MoMFs(CD45 α β CD11bHighF4 / 80LowLy6G)數量減少(圖2E)。Chicken-wire纖維化存在于伴有NASH的WT小鼠中,而SPP1KI Mye小鼠無此表現(圖2F)。

圖2-SPP1KI Mye小鼠可免受NASH的侵害
5、肝臟駐留MFs中敲入SPP1的小鼠也可預防NASH
正如Lyz2 . Cre同時靶向肝內和肝外MFs(4A),過表達SPP1小鼠(SPP1KI Lv MF)僅存在于肝臟MFs中。雖然SPP1KI Mye在循環的單核細胞中有顯著的SPP1過表達,但在SPP1KI LvMF小鼠中卻沒有。喂養NASH誘導飲食6個月后,H & E染色顯示SPP1KI LvMF小鼠免于NASH,肝體比、NAS、肝臟TGs和CHO降低。然而,與SPP1KI Mye不同的是,雄性和雌性同樣受到保護。因此,肝臟駐留的MFs在SPP1KI Mye小鼠對NASH的保護作用中發揮主要作用。
6、骨髓細胞SPP1消融的小鼠(SPP1ΔMye)加速發展為NASH
為研究去除髓系細胞中的SPP1是否會加重NASH,研究構建了SPP1ΔMye小鼠,并將其飼喂對照或NASH誘導的飲食長達6個月。研究通過H & E染色、NAS、肝臟TGs和CHO發現,與WT小鼠相比,SPP1ΔMye加重了NASH,特別是在(1個月和3個月)的早期時間點,與6個月相比。在6個月時,肝臟有更多的炎癥,表現為炎癥灶增加,冠狀樣結構,以及Tnf和Mpo表達。因此,SPP1ΔMye在早期時間點加速進展為NASH,并在后期增加炎癥。
7、患有NASH的SPP1KI Mye小鼠含有較少的飽和與單不飽和脂肪酸
為了確定與WT小鼠相比,SPP1KI Mye中FA代謝的變化是否對NASH具有保護作用,研究對其肝臟進行了非靶向代謝組學和脂質組學分析。從鑒定的TGs的峰強度發現,SPP1KI Mye和WT小鼠之間的倍數變化(fold change,FC)與TGs的總碳原子數呈強正相關,與飽和狀態呈中度相關。統計分析發現,與WT小鼠相比,SPP1KI Mye合并NASH小鼠有35個TG發生了顯著變化。在主要的變化中,大多數含有飽和脂肪酸的TGs下調,而含有超長鏈多不飽和脂肪酸的TGs在SPP1KI Mye小鼠NASH中上調(圖3A)。
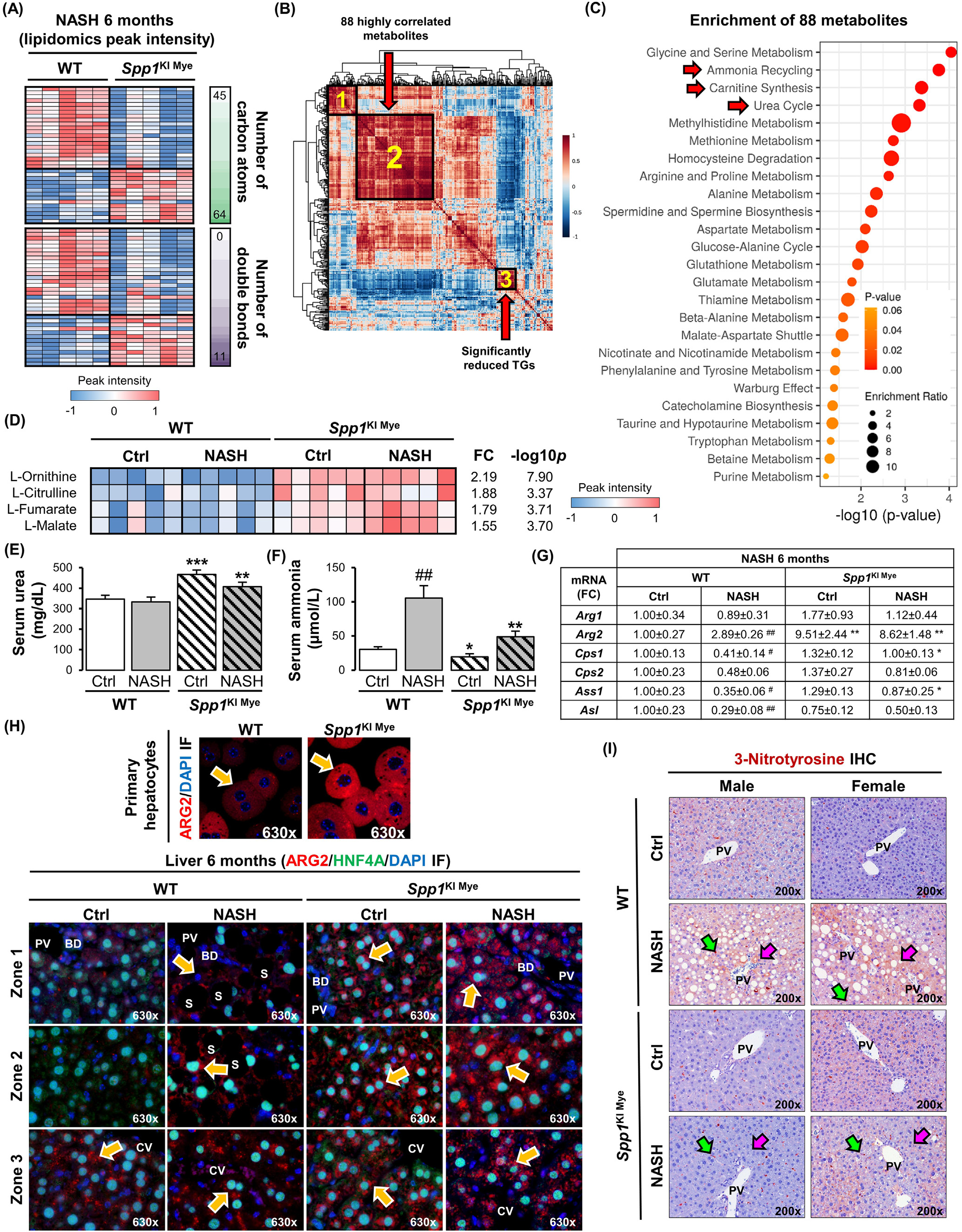
圖3-尿素循環增加和ARG2上調與SPP1KI Mye小鼠的保護作用相關
8、由于肝細胞中Arg2表達增加,TGs減少與尿素循環上調有關
接下來,相關性分析發現88個代謝物(圖3B,聚類2)與顯著降低的TGs(圖3B,聚類3)呈高度負相關(平均r > 0.7)。通過Small Molecule Pathway Database對88個代謝物進行富集,提示氨循環、肉堿合成和尿素循環的上調(圖3C)。事實上,無論飲食如何,SPP1KI Mye小鼠的肝臟中,尿素循環的代謝物(L -鳥氨酸、L -瓜氨酸、L -延胡索酸)和下游的L -蘋果酸都顯著上調(圖3D)。這被血清中增加的尿素和減少的氨所證實(圖3E和F)。qPCR結果顯示,無論飲食增加與否,Arg的線粒體亞型Arg2在SPP1KI Mye小鼠肝臟中增加,而尿素循環酶幾乎不受影響(圖3G),并且Arg2在SPP1ΔMye小鼠肝臟中的表達降低。免疫熒光分析發現SPP1KI Mye小鼠原代肝細胞中存在ARG2的誘導表達(圖3H,上)。同樣,共定位研究進一步表明,在對照飲食的WT小鼠中,ARG2主要在3區的肝細胞中表達,而在NASH中,ARG2在1區和2區的肝細胞中表達增加。值得注意的是,在SPP1KI Mye小鼠中,肝細胞中ARG2的上調是泛小葉(圖3H,底)。因此,3-硝基酪氨酸(3-NT)殘基的存在主要在肝細胞中減少(圖3I),這是一種由過量NO觸發的翻譯后修飾,由精氨酸通過NOS2轉化為瓜氨酸產生。
9、在SPP1KI Mye小鼠中上調ARG2介導FAO升高
先前的研究表明,ARG2調節線粒體動力學并保護肝臟脂肪變性。代謝組學分析顯示,肉堿穿梭體的組分在SPP1KI Mye小鼠肝臟中顯著上調(圖4A)。脂肪酸氧化(FAO)受NAD +/NADH比值的變構調節。在整個肝臟中,與WT小鼠相比,SPP1KI Mye中NAD+/NADH比值和ATP水平顯著增加(圖4B和C)。Mitotracker染色顯示,與WT肝細胞相比,SPP1KI Mye中線粒體紅色熒光較高,但結構相似(圖4D)。JC - 1染色結果顯示,與WT小鼠相比,SPP1KI Mye小鼠肝細胞JC - 1聚體/單體比例增加,提示線粒體膜電位升高(圖4E)。為檢測棕櫚酸(PA)對線粒體FAO的影響,研究監測了棕櫚酸(PA)處理的肝細胞的耗氧率(OCR)。與WT小鼠相比,來自SPP1KI Mye的肝細胞最小地增加了基礎OCR,但增加了約2倍的最大呼吸容量和約3倍的剩余呼吸容量(圖4F)。與用牛血清白蛋白和PA處理的WT小鼠相比,SPP1KI Mye的肝細胞中ATP生成輕度增加(圖4F)。值得注意的是,與使用牛血清白蛋白和PA的WT小鼠相比,來自SPP1KI Mye的肝細胞中質子泄漏顯著增加,在此過程中能量耗散而不產生ATP(圖4F)。為確定ARG2是否介導了SPP1KI Mye小鼠肝細胞中FAO的增加,研究使用小干擾RNA(siRNA)敲低Arg2,使其減少> 90 %,但不影響細胞活力。OCR檢測發現,敲低Arg2顯著抑制了最大呼吸容量、剩余呼吸容量和質子漏(圖4G)。此外,PA處理過夜的WT與SPP1KI Mye肝細胞相比,具有更多的脂滴,但用Arg2 siRNA處理后則相反。因此,在肝細胞中上調ARG2通過增加線粒體呼吸和FAO來減少脂質積累。為進一步證明ARG2在NASH中的作用,研究構建了肝細胞條件性敲除Arg2的小鼠(Arg2ΔHep),并給予NASH誘導飲食6周。兩種性別的Arg2ΔHep均表現出比WT小鼠更嚴重的NASH,這歸因于脂肪變性、炎癥和TG的增加(圖4H和I)。
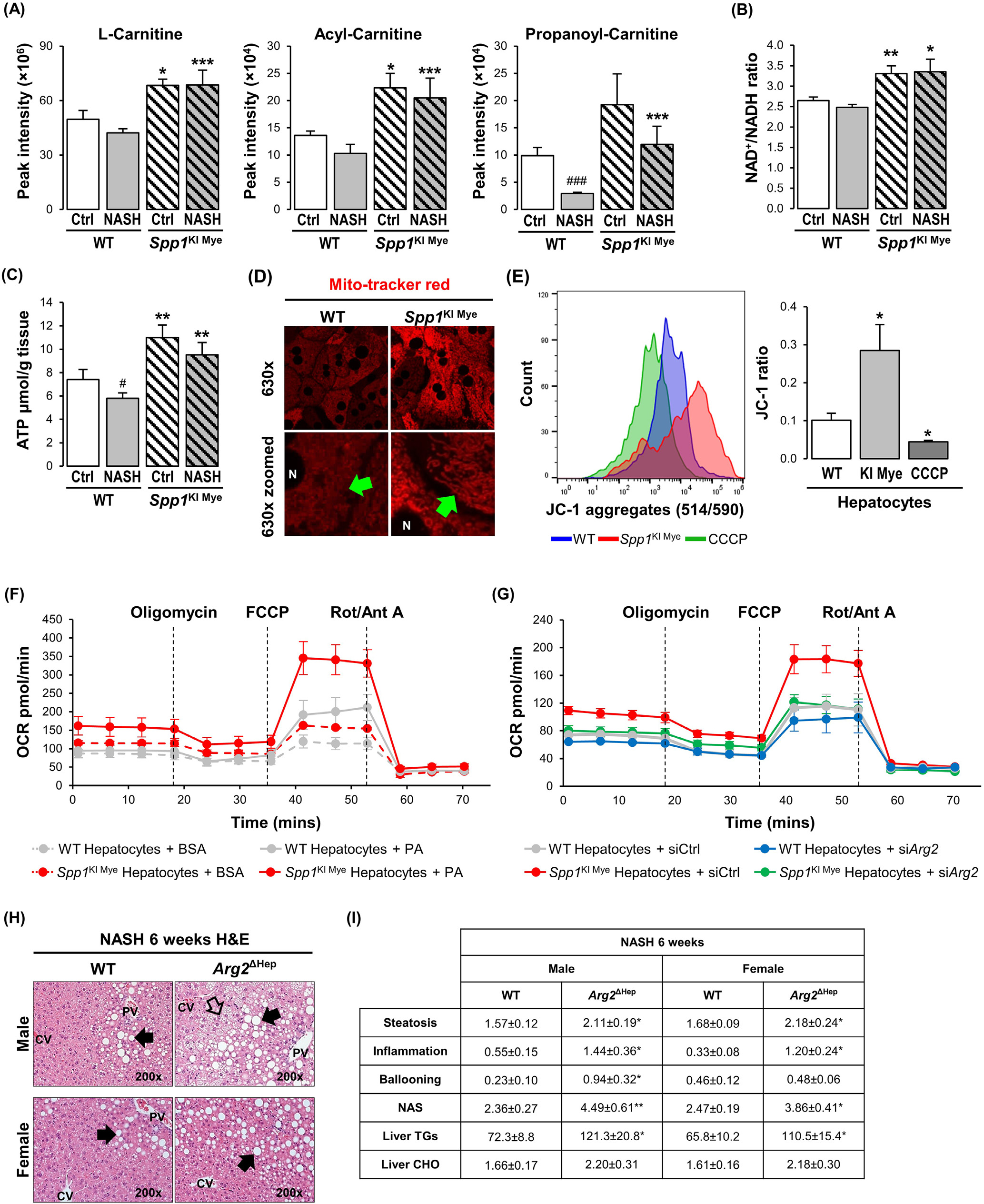
圖4 -上調ARG2介導SPP1KI Mye小鼠的FAO升高
10、SPP1KI Mye和誘導型飼料驅動了MFS中的性別特異性轉錄組
為了解SPP1KI Mye是否在肝臟源性的MFs中驅動特定的表型,從飼喂對照或NASH誘導飲食6個月的SPP1KI Mye和WT小鼠中分選出MFs,并通過RNA seq進行轉錄組分析。與對照相比,在NASH的WT小鼠中觀察到未報告的MF轉錄組性別差異。
與WT相比,飼喂對照組SPP1KI Mye雄性小鼠有362個DE基因(289個上調,73個下調),但大多數只表現出輕微的變化(FC < 2)。與WT小鼠相比,喂食NASH誘導飲食的SPP1KI Mye小鼠DE基因增加到822個(736個上調,86個下調)。然而,飼喂對照或NASH誘導飲食的小鼠之間幾乎沒有重疊的DE基因(5個上調, 1個下調)(圖5A)。Pathway分析顯示,基于正Z - score,對照飲食組的DE基因富集到參與組織重塑的通路(VEGF信號,肝纖維化,凝血酶,G6P信號)(圖5B)。一些炎癥通路上調,而IL6和TREM1信號下調(圖5B)。脂質代謝受到的影響最小(圖5B)。值得注意的是,STAT3和JAK/STAT信號通路表達上調(圖5B)。在NASH誘導的飲食組中觀察到更強烈的與組織重塑相關的變化,表現為膠原蛋白、纖維蛋白原和凝血因子的上調(圖5B和C)。在喂養NASH誘導飲食的小鼠中,SPP1KI Mye對炎癥的影響最小(圖5B)。然而,Il1rn,Il10和Tnf表達上調,而Ccl2,Il1b和Il6不受影響。此外,SPP1KI Mye有很多上調基因和通路參與脂質代謝(LXR / RXR , TG降解, FAO , PPARα / RXR α激活)和(圖5B和C)。值得注意的是,尿素循環在SPP1KI Mye MFs中上調,表現為Arg1、Cps1和Otc的表達量顯著增加,Arg2的表達量略有增加(圖5B和C)。
DE分析發現,對照組雌性組有1026個(403個上調,623個下調)基因發生改變,而NASH誘導組雌性組基因減少到553個(256個上調,297個下調)。與雄性不同的是,對照組和飼喂NASH飲食誘導組之間的DE基因具有良好的重疊(65個上調,118個下調)(圖5D)。在飼喂對照雌鼠中,組織重塑輕度下調,除TGFB信號外,大多數炎癥和脂質代謝通路均下調(圖5E)。STAT3信號與對照飲食的雄性SPP1KI Mye MFs一樣輕度上調。在NASH誘導飲食的雌鼠中,與WT小鼠(急性期反應、IL6、TNFR1信號)相比,由于細胞因子(Il1a、Il1b、Tnf、Ccl2、Ccl3、Ccl5)下調,SPP1KI Mye來源的MFs有幾個關鍵的促炎通路下調(圖5E和F)。雌性SPP1KI Mye小鼠中負責脂質代謝的基因和通路(Abcg5、Apoa1、Apoa2)下調(圖5E和F)。雖然沒有Z - score可用,但在NASH誘導飲食的小鼠SPP1KI Mye MFs中,尿素循環也受到影響(圖5E)。值得注意的是,2型糖尿病 信號在男性中不受影響,但在女性NASH患者的SPP1KI Mye MFs中下調(圖5E)。因此,SPP1KI Mye驅動性別特異性效應,其在小鼠喂食控制或NASH誘導飲食也不同的作用。
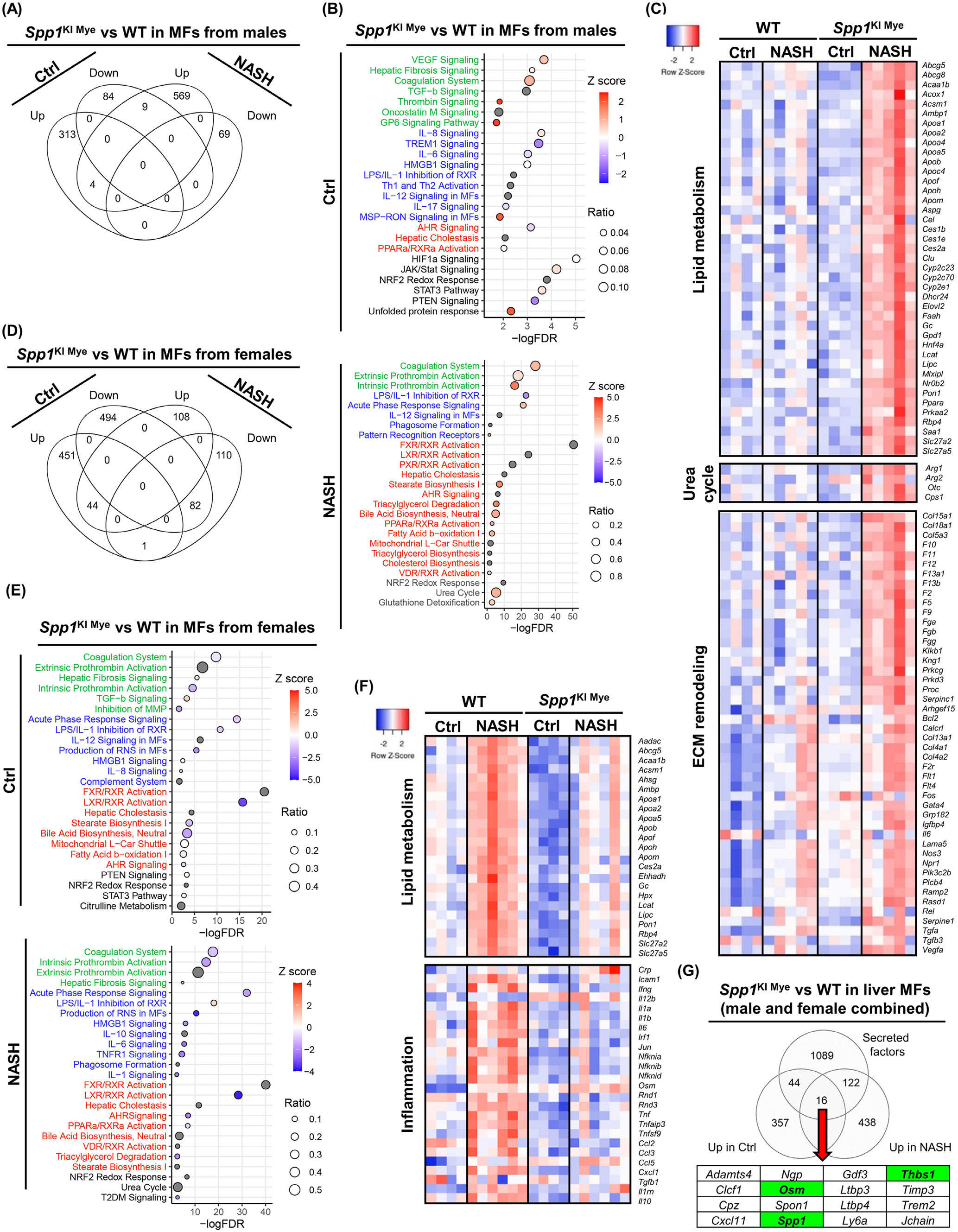
圖5- SPP1KI Mye和喂養NASH誘導飲食驅動MFs的性別特異性轉錄組
11、SPP1KI Mye驅動Oncostatin-M表達通過STAT3誘導Arg2
接下來,與WT小鼠相比,SPP1KI Mye小鼠MFs中上調的基因具有更寬的cutoff P <.05且FC>1.5(性別合并),并與已發表的小鼠分泌蛋白列表進行比較。存在16個基因(包括SPP1)編碼SPP1KI Mye驅動的分泌蛋白的mRNA(圖5G)。
然后,研究通過從IPA中提取分子相互作用,構建了從編碼分泌蛋白的16個基因到Arg2的預測調控網絡,以可視化亞細胞定位和節點連接。結果表明,6種分泌蛋白(包括OPN)可能通過53種相互作用調控Arg2的表達。制瘤素-M(OSM)、THBS1和OPN在網絡中的連接度最高(圖6A)。其中Osm具有最高的DE,并且可以通過STAT3,p38 MAPK和ERK潛在誘導Arg2(圖6A)。為檢測這種可能性,首先,研究從WT和SPP1KI Mye小鼠中分離MFs,并培養72小時。SPP1KI Mye小鼠的MF裂解液和培養基中OSM表達增加。然后,研究使用siRNA(附圖8B ,上)在原代肝細胞中敲除OSM受體(Osmr)。最后,研究用WT和SPP1KI Mye MFs的條件培養基培養WT和Osmr null肝細胞24 h。來自SPP1KI Mye MFs的條件培養基增加了WT肝細胞中ARG2的表達和STAT3的磷酸化;然而,這些效應在Osmr敲除的肝細胞中被減弱(圖6B和C)。在PA和SPP1KI Mye MFs條件培養基的存在下,WT而不是Osmr null肝細胞具有較少的脂滴(圖6C)。為進一步證實這一點,研究注射了OSM中和抗體的SPP1KI Mye小鼠,發現與注射同型對照的小鼠相比,NASH加重,表現為H & E,ARG2減少,NAS,TGs和CHO增加(圖6D和E)。因此,在肝細胞中,SPP1KI Mye驅動OSM的表達,并通過STAT3信號增加Arg2的表達。
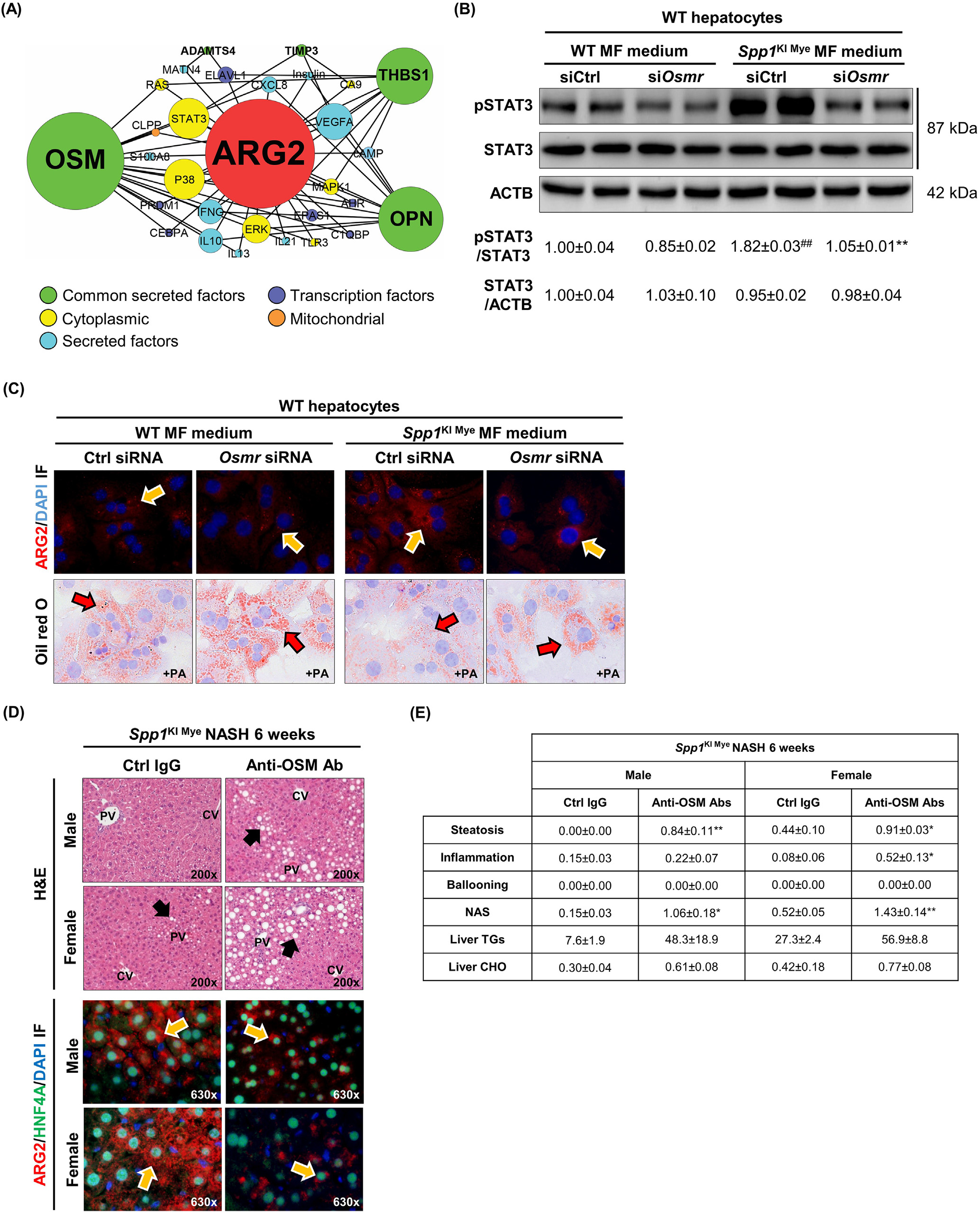
圖6- SPP1KI Mye驅動OSM的表達,OSM通過STAT3誘導Arg2
12、SPP1KI Mye以性別特異性方式影響肝外FA代謝
在肝外組織中也觀察到SPP1KI Mye的性別特異性效應。6個月后,男性SPP1KI Mye和WT小鼠在NASH飲食中有相似的體重增加和食物攝入量,內臟脂肪組織 (VAT)增加1.5倍,脂肪細胞大小更大(圖7A - D)。在VAT中,qPCR分析顯示Pnpla2下調但與WT小鼠相比,Lipe在雄性SPP1KI Mye小鼠中不下調(圖7E)。體內脂解實驗表明,注射脂解誘導劑isoprenaline后,SPP1KI Mye小鼠在血清非酯化FAs中的增加較少(圖7F)。即使在喂食NASH誘導的飲食之前也觀察到了差異,但在雄性和雌性SPP1KI LvMF小鼠中丟失了(圖7F)。
與雄性相比, NASH誘導飲食的雌性SPP1KI Mye小鼠在6個月內體重增加較少(4.3 g)(圖7A),VAT /體重比和脂肪細胞大小較WT小鼠降低(圖7C和D)。SPP1KI Mye雄性小鼠的食物攝入量相似,而SPP1KI Mye雌性小鼠在NASH誘導的飲食中從2個月到4個月減少了食物攝入量,與體重增加減少相關(圖7B)。患有NASH的雌性SPP1KI Mye小鼠具有改善的胰島素敏感性,在葡萄糖耐量試驗和胰島素耐量試驗中,隨著時間的推移,葡萄糖降低(圖7G)。在雌性SPP1KI Mye VAT小鼠中,與WT小鼠相比,Pnpla2和Lipe的表達沒有變化,而Leptin的表達增加,但AdipoQ的表達沒有變化(圖7E)。因此,雄性和雌性SPP1KI Mye小鼠也受到額外的性別特異性肝外機制的保護。

圖7- SPP1KI Mye以性別特異性的方式影響肝外FA代謝
結論
研究結果表明,MF來源的OPN對NASH具有保護作用。這種作用是通過上調MFs中的OSM,從而通過肝細胞中的STAT3信號增加ARG2來介導的。此外,ARG2介導的FAO增加減少了脂肪變性。因此,增強MFs和肝細胞之間的OPN - OSM - ARG2對話可能對NAFLD患者有益。
實驗方法
Spp1fl/fl小鼠,Spp1.Stopfl/fl小鼠,免疫組織化學,免疫熒光,轉錄組數據分析,單細胞數據分析,通路分析,相關性分析,WB,qPCR
參考文獻
Han H, Ge X, Komakula SSB, Desert R, Das S, Song Z, Chen W, Athavale D, Gaskell H, Lantvit D, Guzman G, Nieto N. Macrophage-derived Osteopontin(SPP1) Protects From Nonalcoholic Steatohepatitis. Gastroenterology. 2023 Jul;165(1):201-217. doi: 10.1053/j.gastro.2023.03.228. Epub 2023 Apr 5. PMID: 37028770.






