單細胞分析+m6A?狙擊 結直腸癌腫瘤微環境
摘要
N6甲基腺苷(m6A)RNA甲基化在各種癌癥的關鍵遺傳事件中都發揮著關鍵作用;然而,m6A如何在腫瘤微環境(TME)中發揮作用仍誘導闡明。通過非陰性機制因子分解(NMF)分析了來自33例CRC腫瘤樣本的單細胞scRNA-seq數據中的65362個單細胞,其中23個m6A RNA甲基化調節因子。使用來自公共儲存庫的CRC和免疫治療隊列來確定TME集群的預后和免疫反應。將成纖維細胞、巨噬細胞、T細胞和B細胞分別分成4-5個不同的亞簇,然后根據不同生物學的過程和不同的標記基因進行分類。此外,它揭示m6A RNA甲基化調節因子可能與CRC的臨床和生物學特征以及主要TME細胞類型的擬時間軌跡有顯著關系。批量測序分析表明,這些m6A介導的TME細胞亞群對CRC患者具有顯著的預后價值,特別是對接受ICB治療的患者具有顯著的免疫應答。
結論
總之,作者的研究首次揭曉了m6A甲基化介導腫瘤微環境的細胞間通訊在調節腫瘤生長和抗腫瘤免疫調節過程中的作用。
本研究于2022年5月發表于《Journal of Translational Medicine》上,IF=7.4。
技術路線
結果
1、m6A調節因子在CRC TME細胞中的景觀
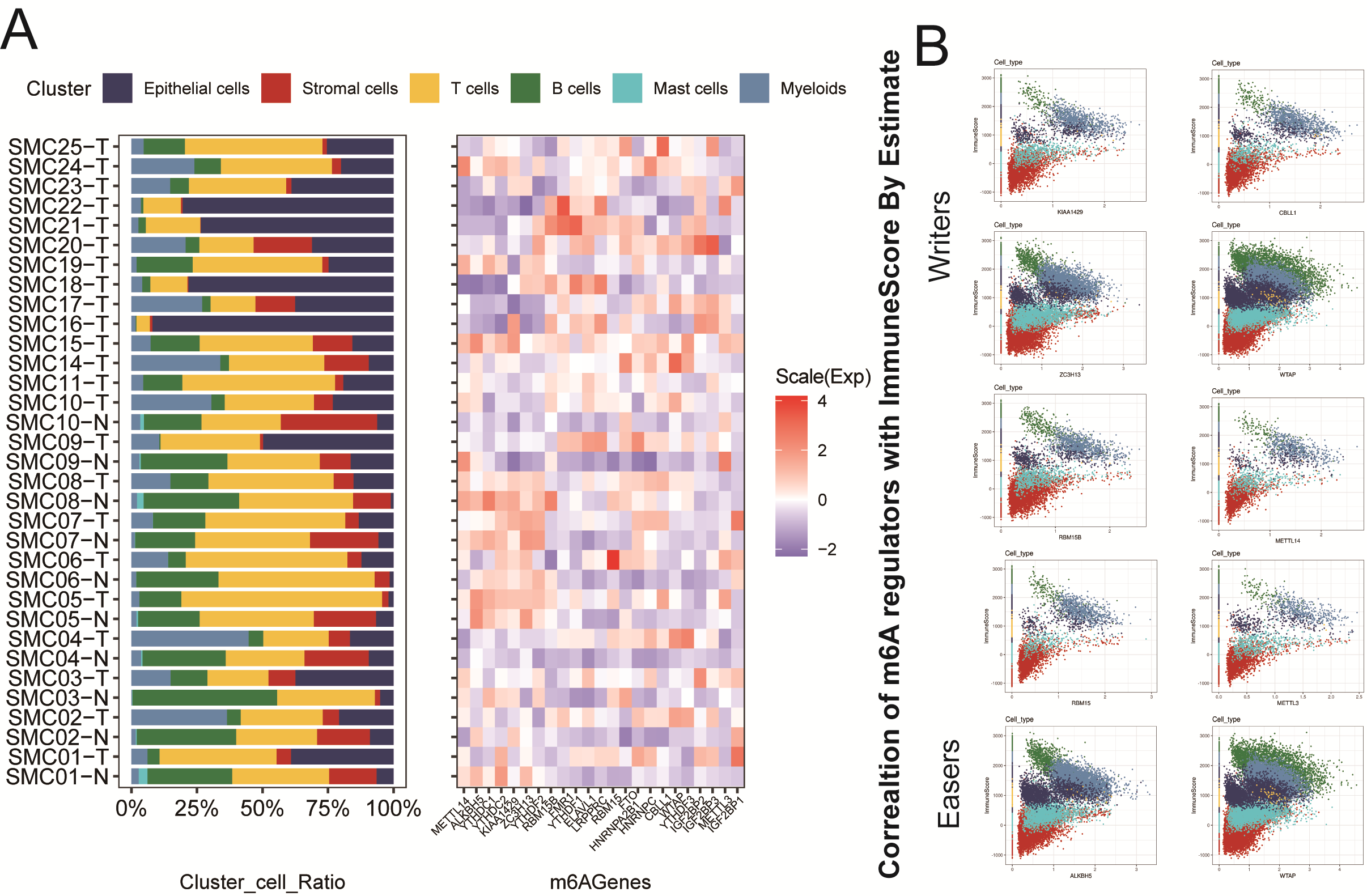
總體而言,CRC的scRNA-seq數據集,如前描述的那樣,被用于探索m6A RNA甲基化調控子景觀(圖1A)。SMC數據集包含來自23位CRC患者的33個樣本中的65362個TME細胞,其中標注了主要細胞類型,包括上皮細胞、肥大細胞、骨髓細胞、基質細胞、T細胞和B細胞(圖1B)。細胞通訊分析展示了這些細胞類型之間存在多種不同的相互作用(圖1C)。在這里,作者利用Seurat的Average Expression函數,充分評估了m6A調節因子的平均RNA表達與CRC樣本中常見變量之間的顯著差異,例如類別類型(正常vs腫瘤),MSI狀態(MSI-H vs. MSS),年齡組(Old >60 vs young <=60歲),AJCC分期(I、IIA、IIIA、IIIB、IIIC和IVA)和性別(女性)。顯然,SMC數據集中CRC的六種細胞類型中m6A調節因子的表達確實不同(圖1E)。熱圖也顯示了m6A調節因子在33個CRC樣本中主要細胞類型百分比的差異表達(圖S1A)。而且,為評估m6A調節因子與TME細胞免疫狀態的關系,作者使用“estimate”R包,評估了65362例CRC TME細胞的ImmuneScore。在6中TME細胞類型中,作者使用ImmuneScore發現寫入器和擦除器調節因子之間存在不同的強關聯(圖S1B)。
最后,圖1F分別利用scRNA數據中23個m6A調節因子的表達,顯示了感興趣的四種細胞類型(成纖維細胞、巨噬細胞、T細胞和B細胞)的m6A特殊NMF簇的比例。

圖1 m6A RNA甲基化調控因子在結直腸癌單細胞數據中的概述
圖S1
2、新型m6A介導的成纖維細胞有助于CRC的TME
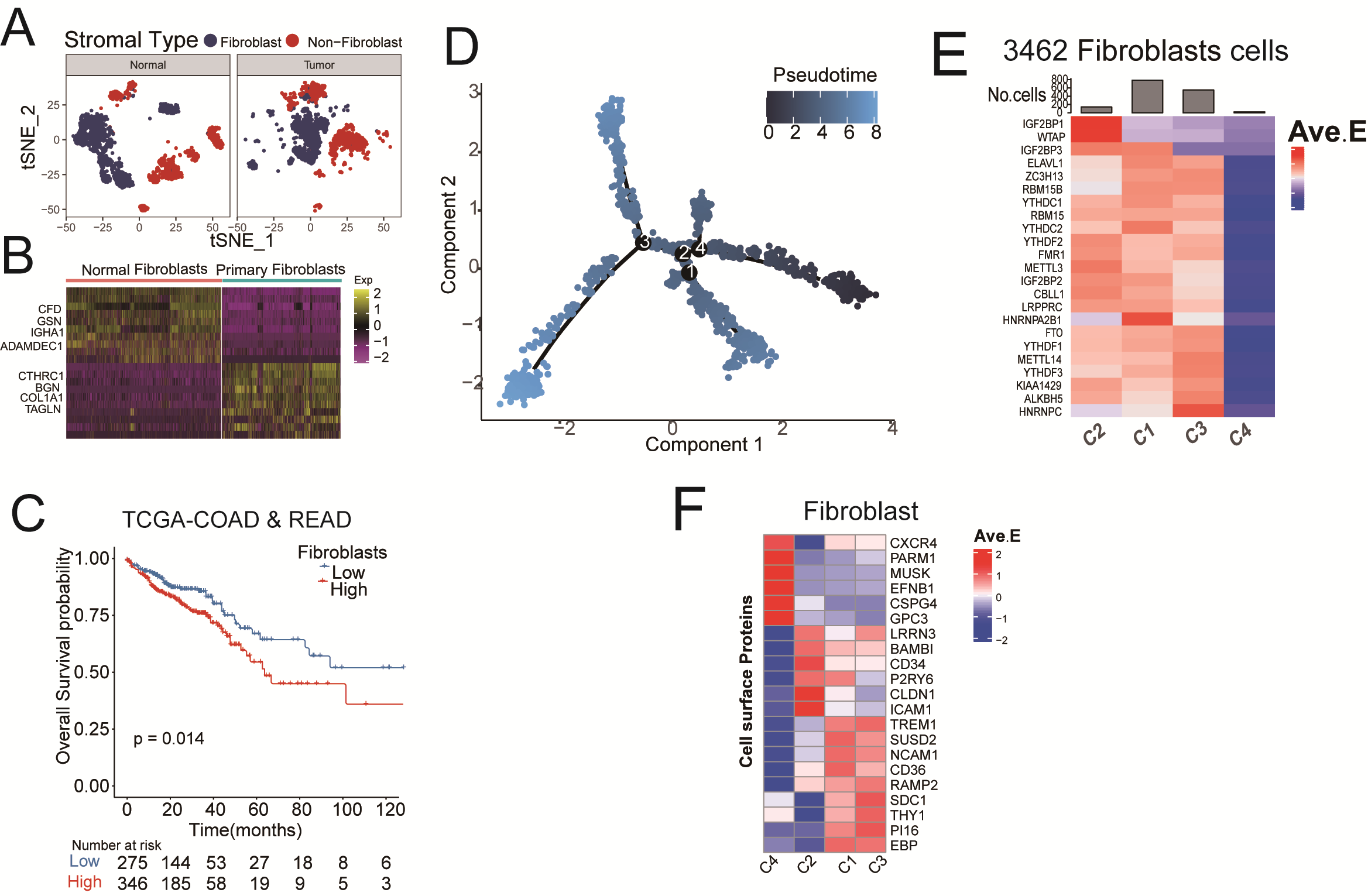
CRC數據集中的機制細胞可分為CRC腫瘤和正常組織中的成纖維細胞和非成纖維細胞(圖S2A)。作者將TCGA-COAD和TCGA-READ合并為一個數據集,使用xCell算法計算成纖維細胞的腫瘤浸潤情況,它們的高豐度表明CRC患者預后較差(圖S2C)。同樣,擬時間分析顯示,m6A RNA調節因子在TME細胞(包括成纖維細胞、NK細胞、巨噬細胞、CD4+T細胞和CD8+T細胞等)的軌跡過程中起著關鍵作用(圖2A,圖S2D, S3)。因此,通過細胞通訊分析,作者發現這些m6A相關的成纖維細胞簇(命名為核不均一核糖核蛋白A2B1+CAF-C1(n=1939)),WTAP+CAF-C2(n=245),HNRNPC+CAF-C3(n=1194)和NoneMethy-CAF-C4(n=84)與上皮細胞之間存在不同數量的配體受體鏈接(圖2B,圖S2E)。其中,WTAP+CAF-C2群體在腫瘤樣本(n=1501)中的比例高于正常樣本(n=1961 ,卡方檢驗p < 0.001)(圖2C)。KEGG富集分析顯示,WTAP+CAF-C2細胞群表現出IL-17活性、TNF信號和基于DEGs的中性粒細胞相關功能。作者還計算了來自先前研究的Pan-CAF簽名,發現WTAP+CAF-C2評分與炎性CAF(paniCAF)密切相關(圖2E)。
基因調控網絡分析顯示,26個轉錄因子(TFs)的表達在4個聚類中存在顯著差異。值得注意的屙屎,REL的TFs,CEBPB、FOSL1、POU2F2、NFKB1、IRF1和ETS1在WTAP+CAF-C2簇中上調(圖2F)。作者還比較了四種m6A介導的CAF中一些表面蛋白基因的表達,發現CD34、LRRN3、BAMB1、P2RY6、CLDN1和ICAM1在大鼠WTAP+CAF-C2組中升高(圖S2F)。從途徑熱圖可以看出,WTAP+CAFC2和NoneMethy-CAF-C4在這些途徑基因的表達上存在顯著差異。最后,富集圖譜顯示HNRNPA2B1+CAF-C1、WTAP+CAF-C2和NoneMethy-CAF-C4具有不同的REACTOME通路特征(圖2H)。
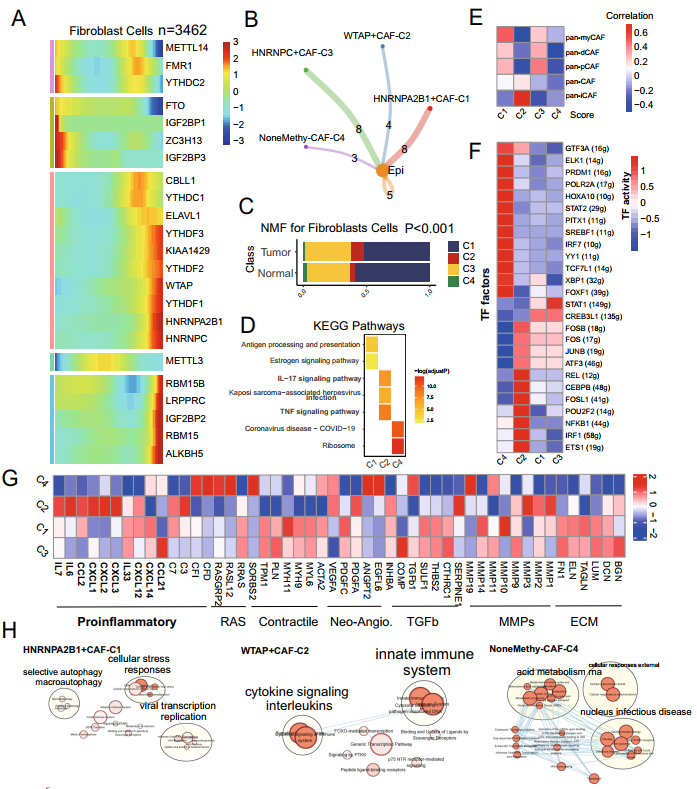
圖2 m6A調節因子改變成成纖維細胞的特征
圖S2

圖S3:偽時間軌跡分析熱圖,結直腸癌TME主要細胞類型中的TME細胞亞型包括巨噬細胞、B細胞以及四種T細胞(CD8+T、CD4+T、Treg、NK)
T細胞)。
3、m6A介導的巨噬細胞的經典特征
骨髓細胞共提取巨噬細胞5822個,分為腫瘤相關巨噬細胞(5586個)和正常巨噬細胞(236個)(圖S4A)。然后,作者獲得5個主要的m6A-mac集群(圖S4B, C),包含4個集群表達m6A調節因子(WATP+mac-C1,n=1432;HNRNPC+mac-C2,n=442)和一個不表達m6A調控因子的集群(NoneMethy-mac-C5,n=241)(圖3A)。m6A-mac NMF簇的平均數量和細胞比例在正常和腫瘤之間有顯著差異(卡方檢驗p < 0.001,圖S4D)。與成纖維細胞類似,作者也觀察到這些m6A相關巨噬細胞簇與腫瘤上皮細胞之間存在不同數量的配體受體連接。
接下來,對這些signatures使用Seurat的AddModulScore函數(圖3B,C,圖S4E, F),在TAMs中,作者發現WTAP+macC1與促炎巨噬細胞顯著相關,HNRNPA2B1+mac-C3與SPP1+和C1q+巨噬細胞顯著相關。檢查點在5個m6A-mac集群中的表達也有顯著差異(圖S4G)。此外,巨噬細胞的SCENIC分析顯示,WTAP+mac-C1和HNRNPA2B1+mac-C3簇對潛在TF的激活不同(圖3D)。
為評估作者的m6A-mac集群和特殊途徑之間的關系,作者使用GSVA,檢測到113個代謝途徑仲有1個在5個m6A-mac集群之間存在顯著差異(圖3E)。然后,50個標志通路在5個集群通路中顯示出廣泛不同的活動(圖S4H)。富集圖還顯示WTAP+mac-C1、HNRNPA2B1+mac-C3和TTHDC1 & YTHDF3+mac-C4具有不同的REACTOME通路特征(圖3F)。
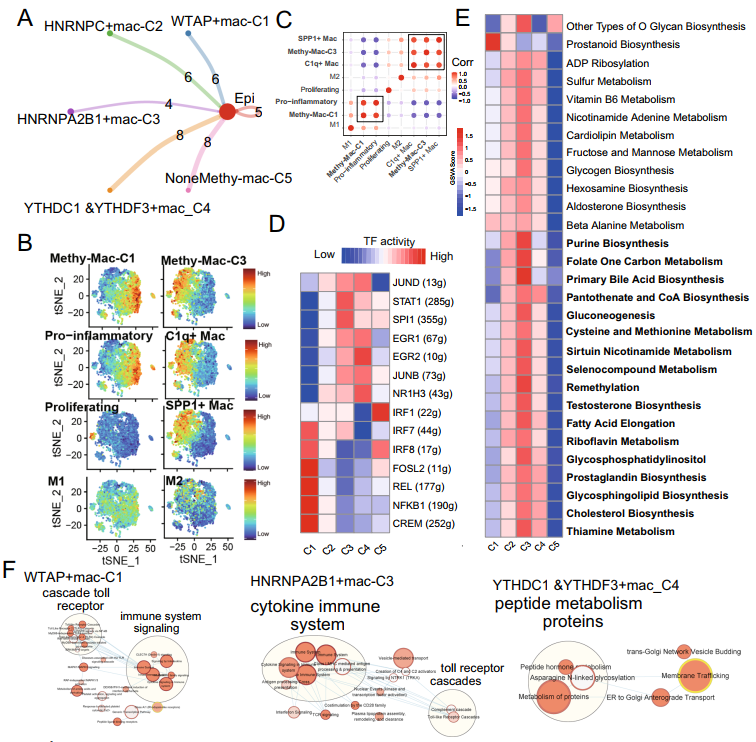
圖3 m6A調節因子有助于5822腫瘤相關巨噬細胞的產生

圖S4:CRC中m6A-mac集群的特性
4、m6A介導的T/B細胞表型強調CRC的抗腫瘤免疫應答
總共檢測到23115個T細胞,鑒定到CD4+、CD8+、Treg、NK、T helper 17、T follicular helper等8種主要細胞類型并進一步分析(圖4A)。NMF算法共識別出5個與m6A相關的細胞簇,命名為methy-T-C1至methy-T-C1(圖4B),這些m6A相關的T細胞簇與腫瘤上皮細胞之間存在不同數量的配體受體連接(圖4C)。檢查點表達分析也顯示這些m6A相關T細胞簇之間的表達有顯著差異(圖S5A)。網絡調控分析顯示,TFs在這些m6A T細胞簇中的表達存在顯著差異(圖4D)。此外,為評估T細胞中與m6A相關的T細胞簇,作者發現共刺激、共抑制免疫基因和一些功能相關標記物的平均表達存在許多差異。作者還發現CD4+T、CD8+T、Treg和NK T細胞的m6A細胞簇中特征的平均表達存在許多差異,包括T衰竭評分、T細胞毒性評分、T效應評分和T逃避評分(圖4E)。同樣,根據差異表達基因(DEGs),富集圖譜顯示CD8+T-C1、Treg-C1、CD8+T-C4和Treg-C4有更多的免疫功能相關條目(圖S5B)。對于9146個B細胞,NMF m6A簇與上皮細胞具有相似的配體受體連接。M6A相關B細胞組分別與IgG漿B細胞、IgA+漿B細胞、CD19+CD20+B細胞無顯著關系(圖4F-H)。然而,熱圖仍然顯示了m6A集群之間顯著不同的TFs(圖4I)。

圖4 T細胞和B細胞m6A甲基化調節因子的NMF簇
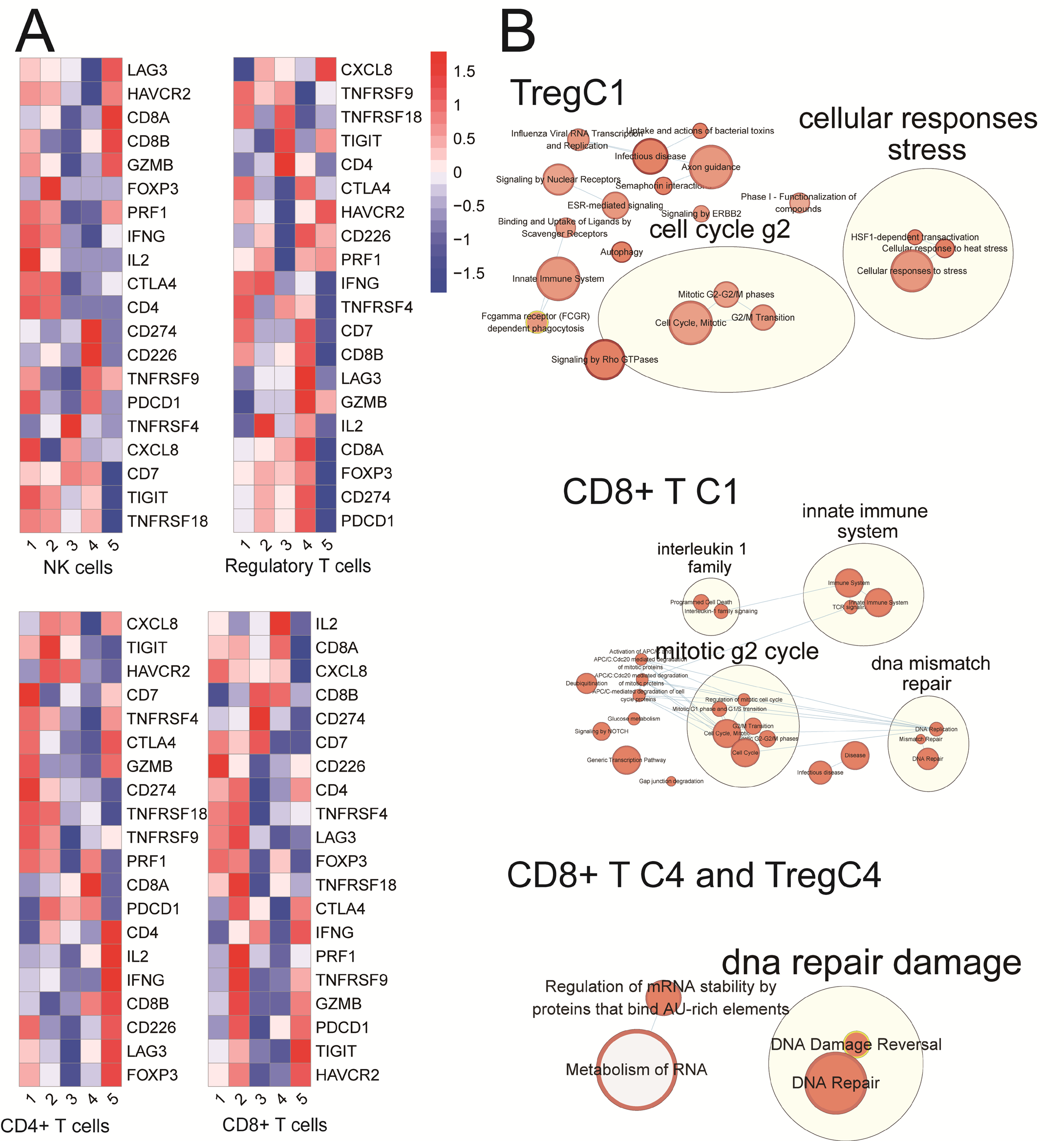
圖S5:結直腸癌中m6A-T細胞群的免疫特征及預后
5、m6A介導的TME模式有助于結直腸癌的預后和免疫治療
為獲得主要CRC TME細胞類型的特征,作者重新計算了它們在CRC scRNA數據中的DEGs,并提取了前30個作為細胞標記。然后,根據m6A介導的TME細胞的所有DEGs,作者使用GSVA計算m6A亞評分,并通過對來自8個和11個CRC隊列的1892例和2315例CRC患者的OS和RFS進行meta分析,分別探討其在CRC患者和泛癌中的預后,如圖5所示。將所有評分分為兩組進行cox回歸分析。有趣的是,隨著特殊m6A介導的亞細胞類型中主導m6A基因的變化,作者發現它們的無復發生存期(圖5A)和總生存率(圖5B)在這些亞群中有顯著差異,包括CAF、巨噬細胞、CD8+T、Treg和B細胞。此外,作者使用邏輯回歸方法觀察m6A sub TME細胞的相同有意義的現象,以預測13個公共癌癥隊列(腎透明細胞癌,非小細胞肺癌,惡性黑色素瘤,黑色素瘤,尿路上皮癌和膀胱癌)中經歷過免疫治療的病人的免疫反應(圖5C)。最后,作者考察了附加文件2:圖S6A和B中列出的泛癌癥患者中m6A亞簇的預后,發現不同的細胞亞簇貢獻了不同的癌癥,具有顯著的預后。

圖5 m6A相關細胞類型(GSVA評分)的總體預后和免疫治療反應,來源于公共隊列的大容量序列。采用survival R包計算cut-off值
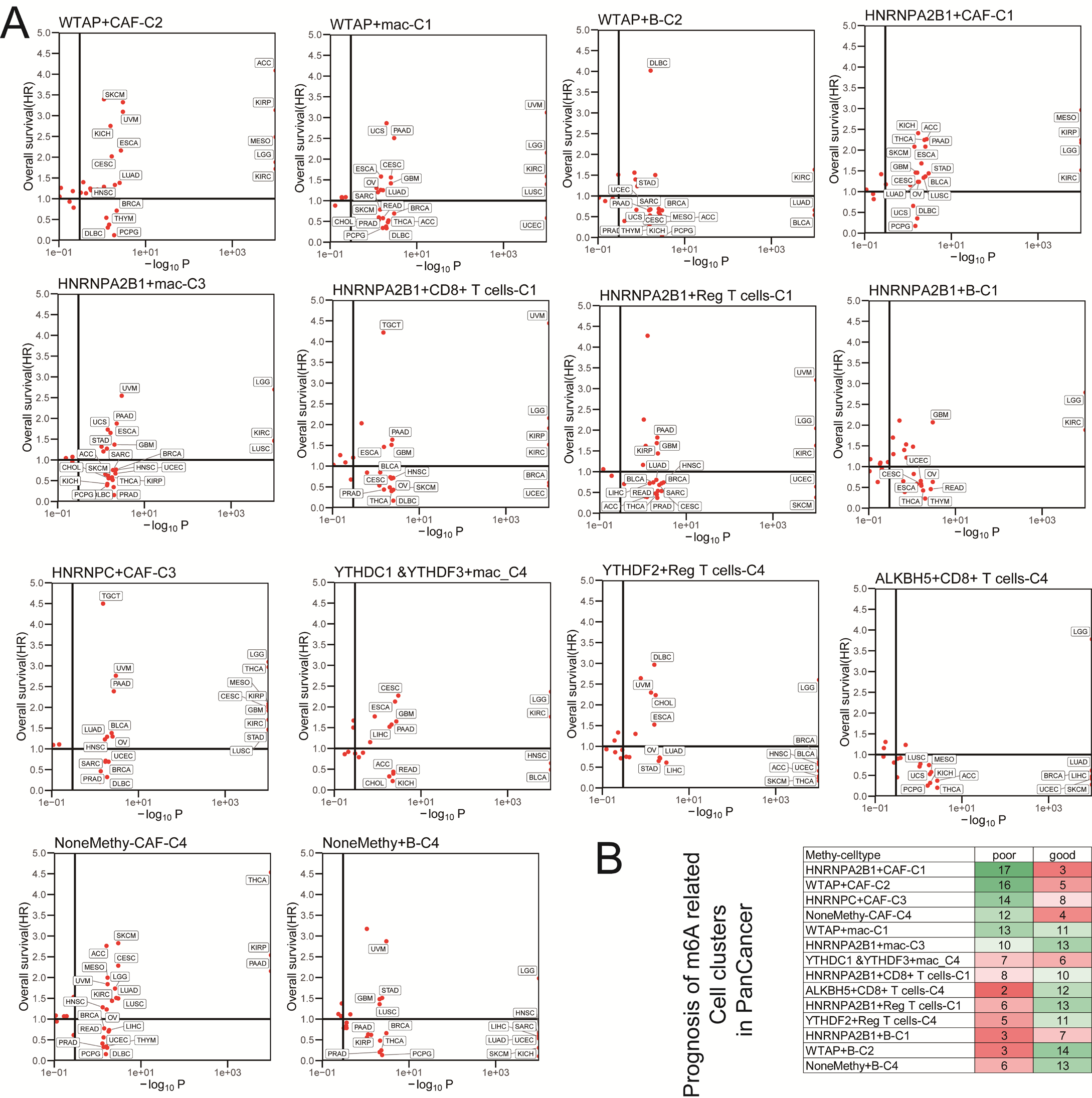
圖S6:Pan癌癥患者中m6A相關亞型TME細胞預后的動態影響
6、m6A介導的TME模式增強了細胞間通訊
通過細胞通訊分析,作者列出了細胞間通信的所有配體-受體對,包括MIF?(CD74+CXCR4)、MIF?(CD74+CD44)、MDK-NCL、LGALS9?CD45, CLEC2D?KLRB1、CLEC2C?KLRB1、CLEC2B?KLRB1、APP?CD74、CD99?CD99和ADGRE5?CD55,從m6A亞簇到腫瘤上皮細胞均存在(圖6A)。在這里,圖6B證明了兩者之間潛在機制的假設。每種m6A亞型可能與腫瘤上皮簇具有不同的強度和配體受體對,這表明m6A介導的TME細胞可能與腫瘤細胞有更多的相互作用,從而促進CRC的進展。
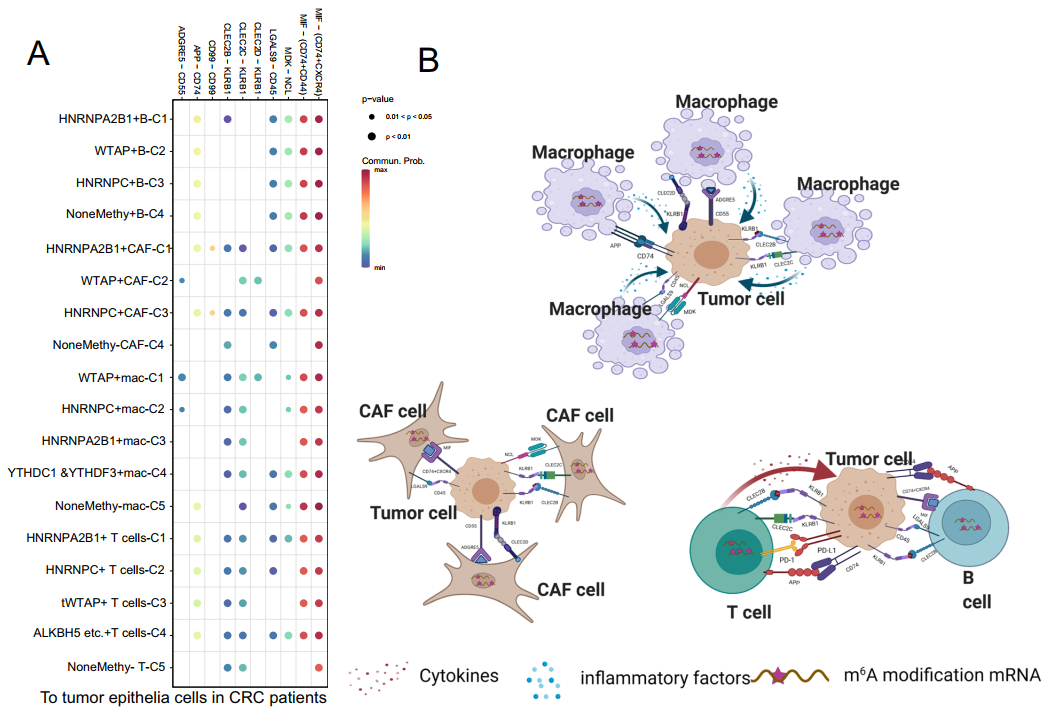
圖6 從主要的m6A相關TME細胞到上皮細胞的細胞間通訊
實驗方法
scRNA-seq,TCGA數據庫和GEO數據庫挖掘, Seurat 包可視化CRC中TME細胞類型和細胞亞型,TME細胞m6A mRNA調控因子的擬時間軌跡分析,TME細胞中m6A mRNA調控因子的非負性基質因子分解,TME細胞中m6A相關細胞亞型標記基因的鑒定,KEGG和Reactome通路分析(clusterProfiler R包),GSVA,SCENIC分析,細胞通訊分析,m6A相關特征的生存分析
參考文獻
Gao Y, Wang H, Chen S, An R, Chu Y, Li G, Wang Y, Xie X, Zhang J. Single-cell N6-methyladenosine regulator patterns guide intercellular communication of tumor microenvironment that contribute to colorectal cancer progression and immunotherapy. J Transl Med. 2022 May 4;20(1):197. doi: 10.1186/s12967-022-03395-7. PMID: 35509079; PMCID: PMC9066909.
關鍵詞
單細胞,m6A,腫瘤微環境,結直腸癌,預后,免疫治療






