STAT5通過促進組蛋白乳酰化促進PD-L1表達,以驅動急性髓系白血病的免疫抑制
隨著基因組學和免疫學的快速發展,免疫治療成為一種革命性的腫瘤治療策略,免疫檢查點抑制劑在包括血液系統惡性腫瘤在內的多種腫瘤中取得了成功。然而,急性髓性白血病(acute myeloid leukemia, AML)是一種異質性疾病,目前仍缺乏基于PD-1/PD-L1阻斷的免疫治療在AML中的應用的系統證明。因此,迫切需要識別驅動腫瘤免疫抑制的分子,并根據免疫檢查點抑制劑的獲益對患者進行分層。在這里,作者報道了STAT5在AML隊列中高表達,并激活糖酵解基因的啟動子來促進AML細胞中的糖酵解。因此,乳酸積累的增加促進了E3BP核易位和組蛋白乳酸化,最終誘導PD-L1轉錄。當免疫檢查點抑制劑與STAT5組成型激活的AML細胞共培養時,可以阻斷微環境中PD-1/PD-L1與反應性CD8+ T細胞的相互作用。臨床發現,在新診斷的AML患者中,骨髓中乳酸的積累與STAT5以及PD-L1的表達呈正相關。因此,作者揭示了STAT5-乳酸-PD-L1網絡在急性髓細胞性白血病進展中的作用,這表明STAT5誘導糖酵解和乳酸蓄積的急性髓細胞性白血病患者可能會從基于PD-1/PD-L-1的免疫療法中獲益。本文于2023年9月發表于《Nature communications》,IF=39.3。
技術路線
主要實驗結果
1.STAT5通過干擾AML患者的T細胞功能來減弱免疫狀態
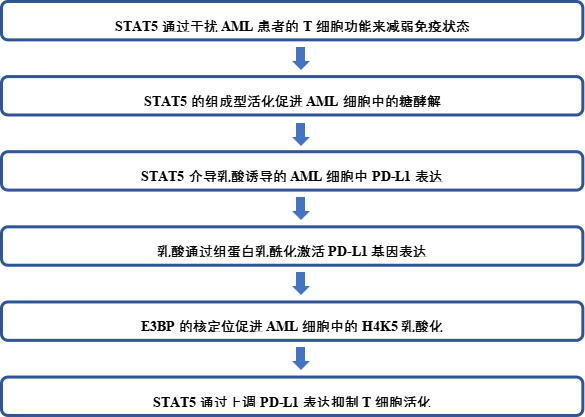
為了深入了解正常和惡性造血的免疫異質性,作者使用GSE9476數據集在健康供者和AML患者之間進行了GSEA。結果顯示,AML患者中多種免疫相關通路下調(圖1a)。通過驗證T細胞標記在AML患者和健康供者外周血單個核細胞(PBMCs)上的表達,作者觀察到AML患者CD8+T細胞中PD-1和TIM-3的表達明顯上調(圖1b)。這些結果表明,AML患者的T細胞免疫狀態嚴重失調。
作者研究了STAT5是否導致AML免疫狀態失調。STAT5在AML和健康供者中的表達通過GSE116256進行分析,結果顯示STAT5 在AML患者的惡性細胞中高表達(圖1c, d)。此外,對來自GSE12417的163名AML患者的生存分析顯示,高STAT5表達與較短的總生存期顯著相關(圖1e)。接下來,作者比較骨髓單核細胞(BMMC)和AML的PBMC之間的T細胞功能差異,但PD-1和CD69在BMMC中的表達增加(圖1f)。隨后,作者研究發現STAT5表達與BMMC的CD8 + T細胞上的PD-1呈正相關(圖1g)。因此,STAT5可能干擾患者T細胞的功能。
2.STAT5的組成型活化促進AML細胞中的糖酵解
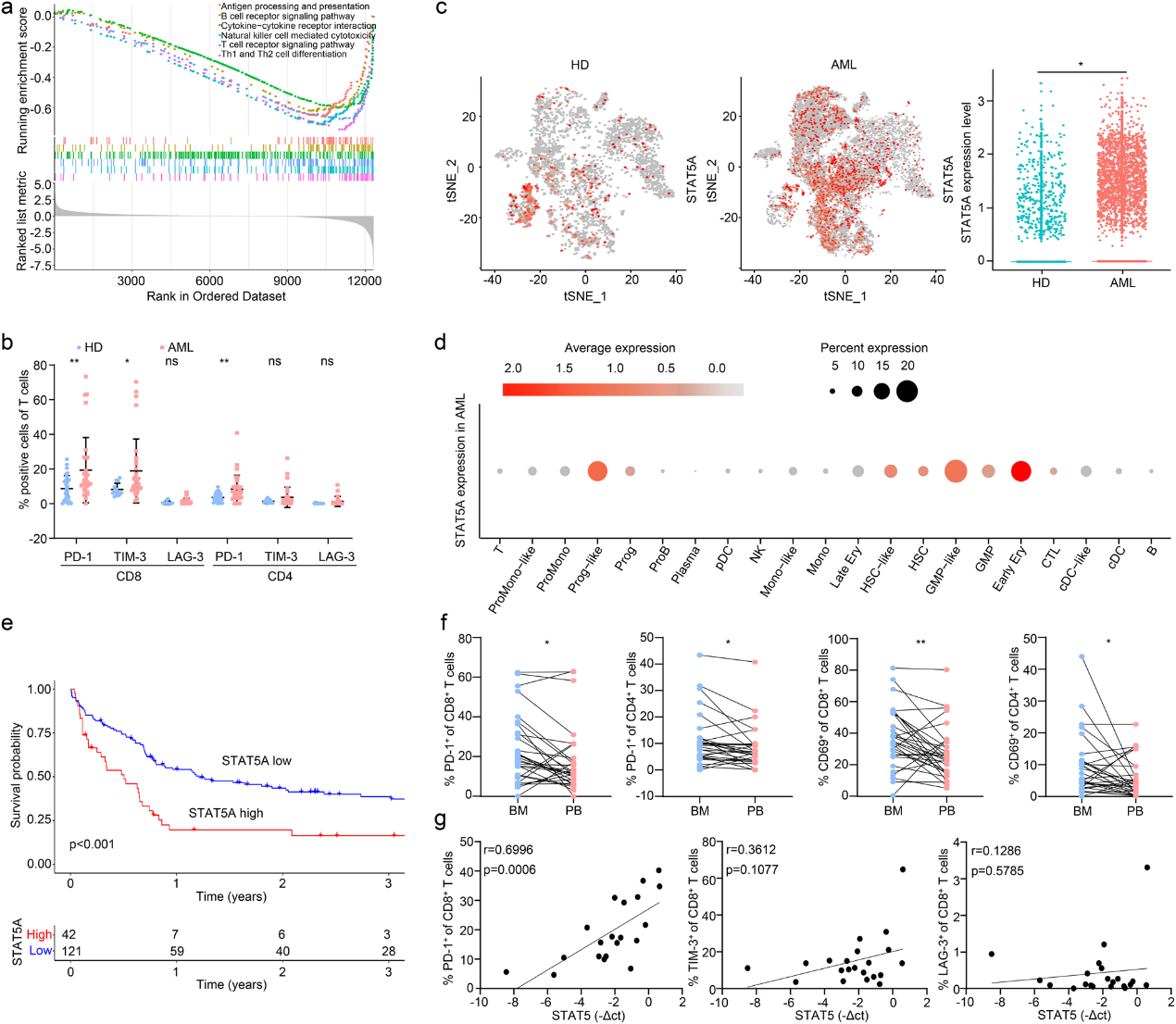
由于STAT5參與控制細胞代謝,作者通過鑒定GSE12417中的差異表達基因(DEGs)并根據STAT5的表達將其分為四分位數,繼續評估STAT5如何影響白血病糖酵解。GSEA顯示,STAT5高表達的AML患者的代謝途徑上調(圖2a)。然后,作者構建了STAT5組成激活(cS5) AML細胞,并檢測糖酵解酶的表達。STAT5促進糖酵解酶的表達,包括HK1、PFKP 和PDHA。同時,評估代謝增強的指標磷酸化AKT (p AKT)在cS5過表達的細胞中也升高(圖2b-d)。此外,糖酵解基因的熒光素酶報告基因活性被STAT5強效誘導(圖2e)。
因此,STAT5可以激活HK1、FKP 和PDHA的啟動子,促進它們的轉錄,進而上調葡萄糖代謝。作者進行了GC-MS非靶向代謝組學研究cS5過表達的AML細胞的代謝產物,發現112種代謝物發生了改變(圖2f)。如圖2g所示,通過 KEGG 富集分析,cS5過表達的AML細胞中的葡萄糖、氨基酸和核苷酸代謝等代謝途徑發生了變化。值得注意的是,糖酵解中的葡萄糖、檸檬酸、異檸檬酸、d -核糖5-磷酸和l -乳酸在cS5過表達的AML細胞中增加(圖2h)。cS5過表達的白血病細胞表現出糖酵解代謝的顯著增加,通過增強葡萄糖攝取(圖2i)、乳酸生成(圖2j)和丙酮酸含量(圖2k)來判斷。同時,糖酵解應激試驗也表明,cS5過表達的AML細胞的細胞外酸化率(ECAR)升高(圖21)。此外,STAT5的敲低(圖2m)降低了乳酸的產生和丙酮酸含量(圖2n,o)。作者進一步證實, STAT5 的表達與AML患者骨髓(BM)中的乳酸生成呈正相關(圖2p)。這些結果表明,STAT5可以上調AML中的糖酵解。通過去除培養基中的葡萄糖,這種作用得以恢復(圖2q, r)。一致地,將AML細胞暴露于2-脫氧-d-葡萄糖(2-DG)后,cS5誘導的增殖可以逆轉(圖2s),這表明STAT5主要通過增加糖酵解來促進白血病生長。
3.T5介導乳酸誘導的AML細胞中PD-L1表達
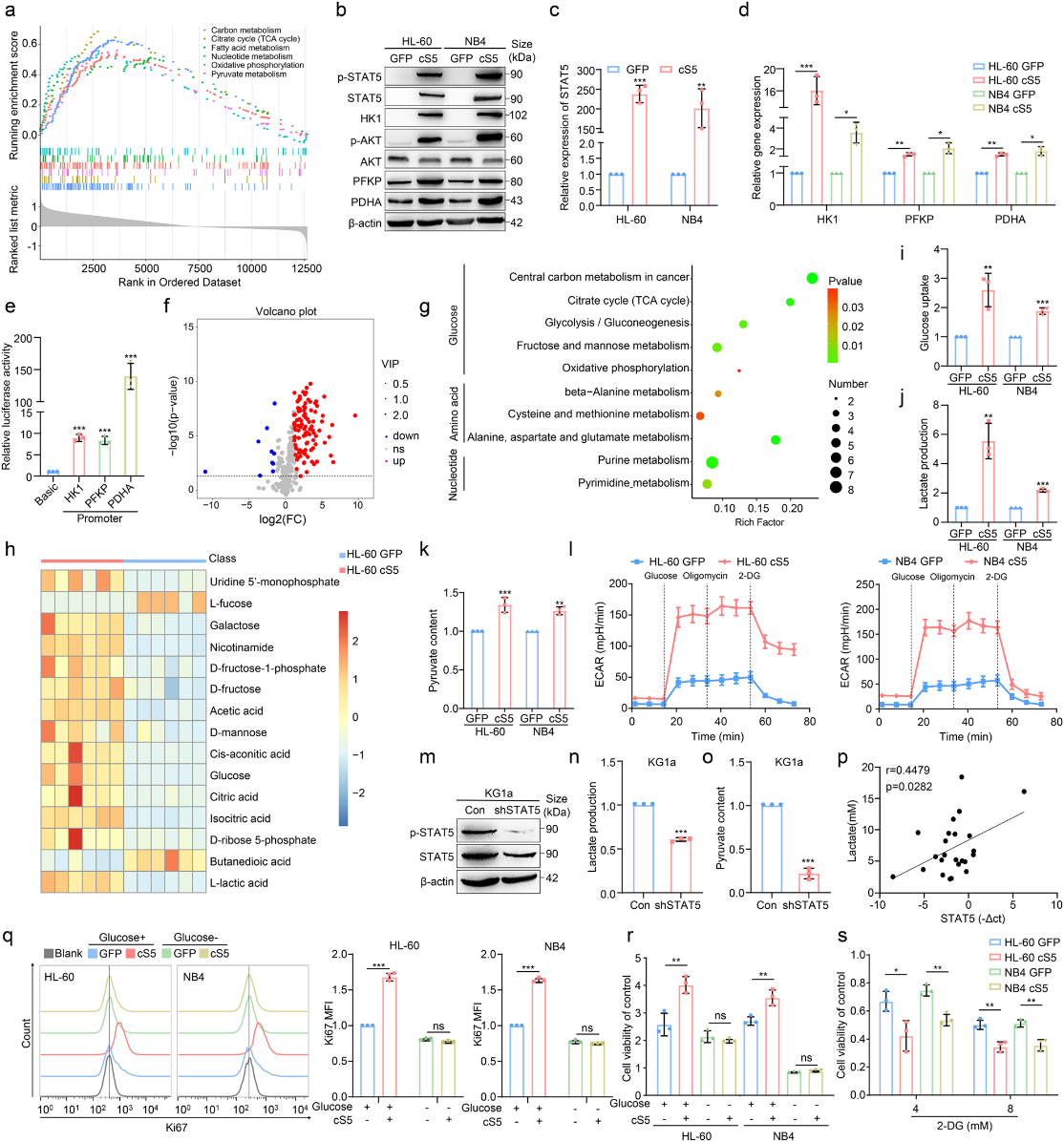
作者為了探討STAT5在調節PD-L1表達中的作用,通過流式細胞術和qPCR分析發現,cS5顯著上調了PD-L1的表達(圖 3a, b)。為了解決乳酸誘導的PD-L1在AML中表達的生物學相關性,將乳酸直接供給AML細胞,誘導PD-L1表達(圖3c)。PD-L1表達與AML患者骨髓中STAT5表達或乳酸含量呈正相關(圖3e, f)的結果支持了這一觀點。作者進一步評估了通過將細胞暴露于提供不同劑量葡萄糖的培養基中,糖酵解是否可以增強PD-L1表達,流式細胞術和qPCR顯示葡萄糖刺激的AML細胞中PD-L1表達增加(圖3g,h)。相反,當cS5過表達的AML細胞暴露于2-DG時,PD-L1表達和乳酸含量減弱(圖3i)。在STAT5敲除的AML細胞中,PD-L1的減少可以通過額外的乳酸恢復(圖3j)。此外,AML細胞暴露于不同的化合物中,這些化合物可以將氧化磷酸化轉變為糖酵解。 結果顯示,AML細胞中PD-L1表達與乳酸生成呈正相關(圖3k)。然后,作者使用熒光素酶報告測定法分析了乳酸對PD-L1啟動子活性的影響。重要的是,乳酸暴露后PD-L1啟動子活性明顯增強(圖3l)。因此,乳酸可刺激PD-L1啟動子啟動PD-L1表達。
4.乳酸通過組蛋白乳酰化激活PD-L1基因表達
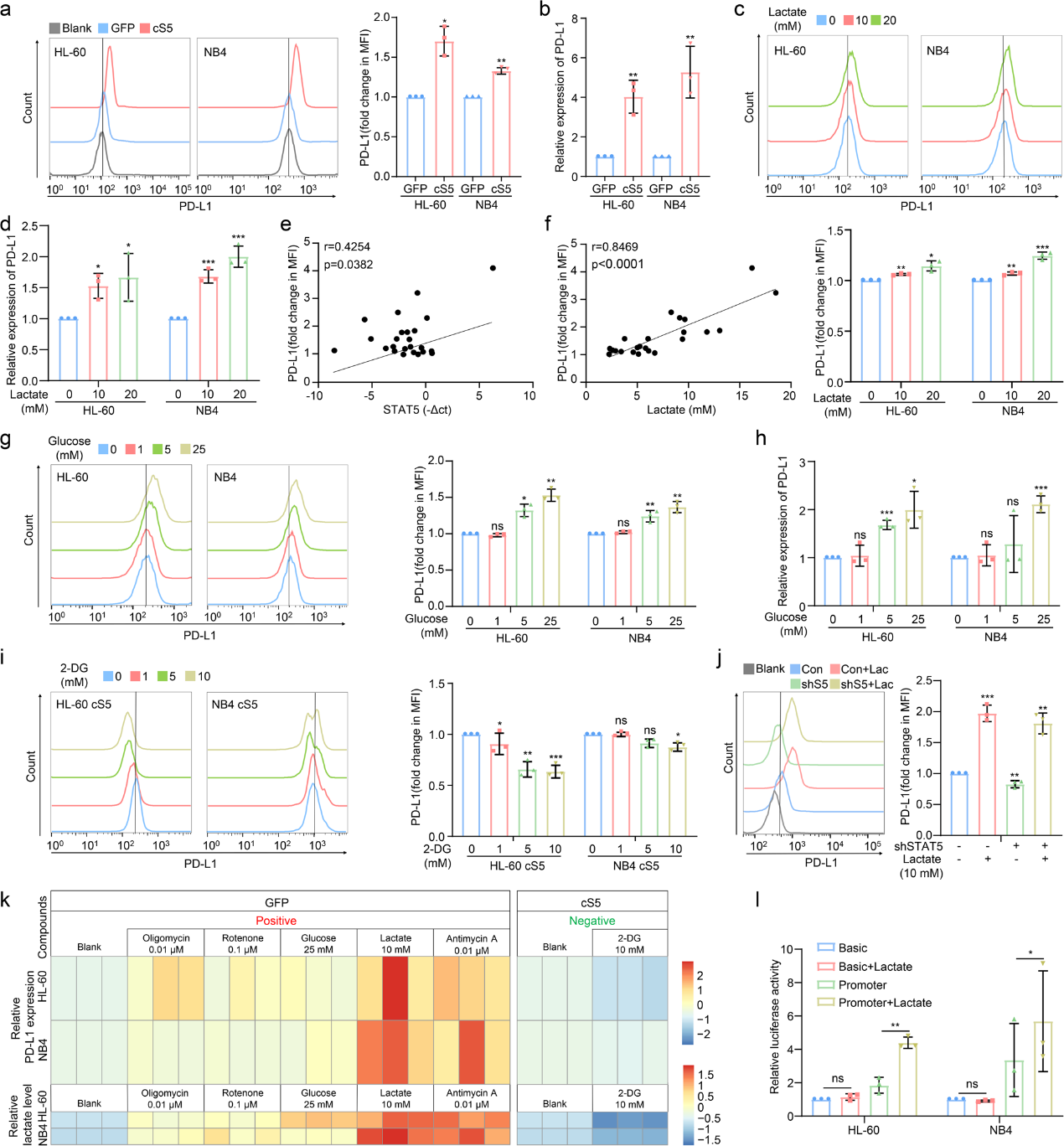
由于STAT5可以改善AML中乳酸的產生(圖2j),而乳酸化是一種由乳酸介導的新型翻譯后修飾,作者進一步研究了乳酸是否可以驅動乳酸化介導的PD-L1表達。事實上,STAT5可以增加AML細胞中組蛋白的泛乳酸化(Kla),而2-DG則相反(圖4a)。作者用額外的乳酸培養AML細胞,并注意到組蛋白Kla被顯著誘導(圖4b)。接下來,作者評估了對照組和cS5過表達的AML細胞之間組蛋白特異性殘基的乳酸化水平。STAT5誘導H3K18、H4K5、H4K8和H4K12的乳酸化水平(圖4c)。 培養液中額外的乳酸顯著誘導特定殘基的組蛋白乳糖化(圖4d)。一致地, 通過將AML細胞暴露于不同濃度的葡萄糖或2-DG來改變乳酸生成可以分別改變乳酸化(圖4e)。此外,在STAT5敲除的AML細胞中觀察到組蛋白乳酸化減弱(圖4f)。同時,免疫熒光分析也支持上述結果(圖4h)。乳酸源性H3K18的乳酸化已被證明可以直接刺激基因表達。同樣,在cS5過表達的AML細胞中,PD-L1啟動子區域中H4K5的乳酸化水平顯著富集(圖4i)。此外,通過將 AML 細胞暴露于更高濃度的葡萄糖中以誘導細胞內乳酸生成,H4K5乳酸化的富集也增加了(圖4j)。因此,乳酸激活的PD-L1 基因表達可能是通過PD-L1啟動子上的組蛋白乳酸化實現的。
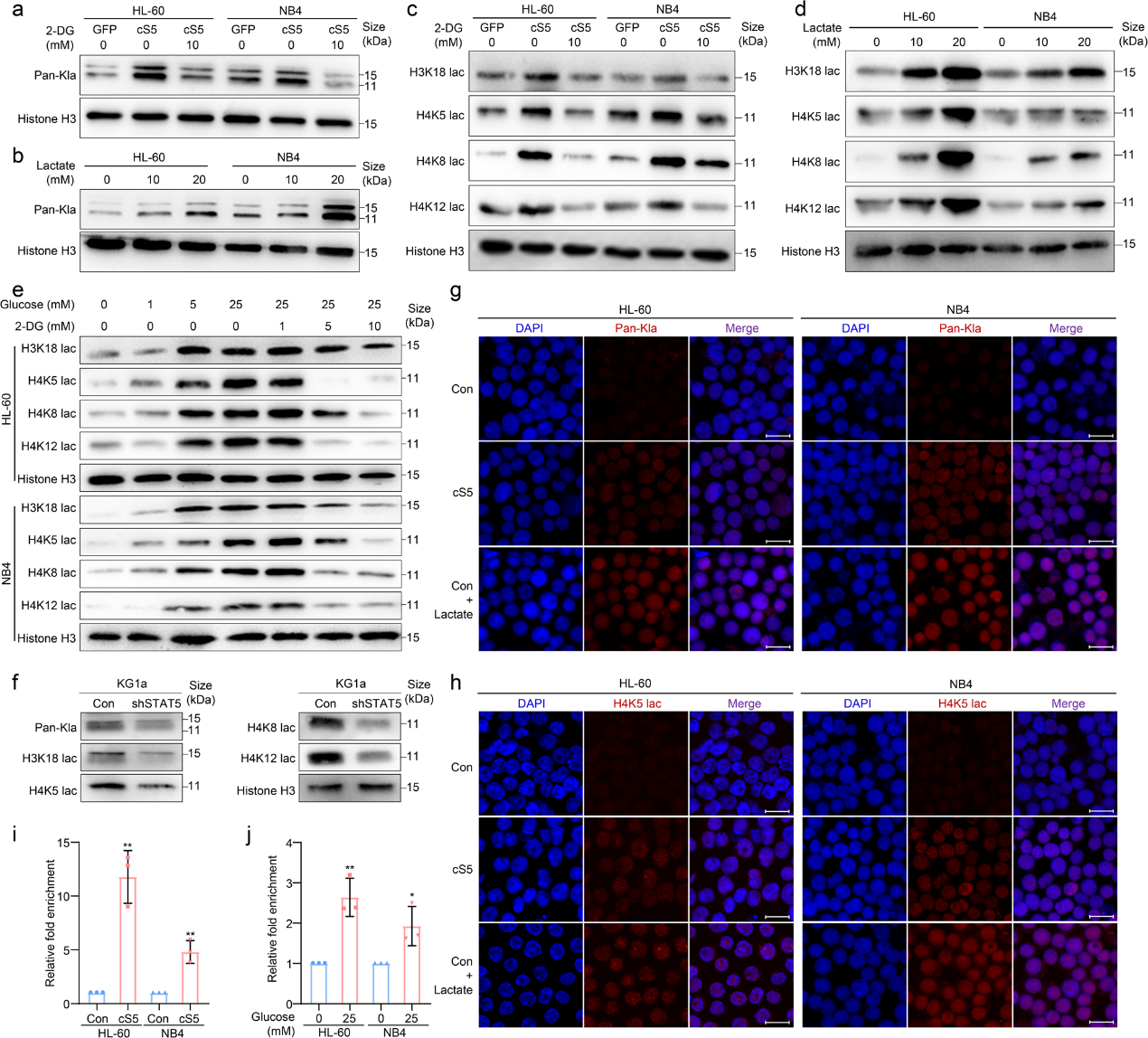
5.E3BP的核定位促進AML細胞中的H4K5乳酸化
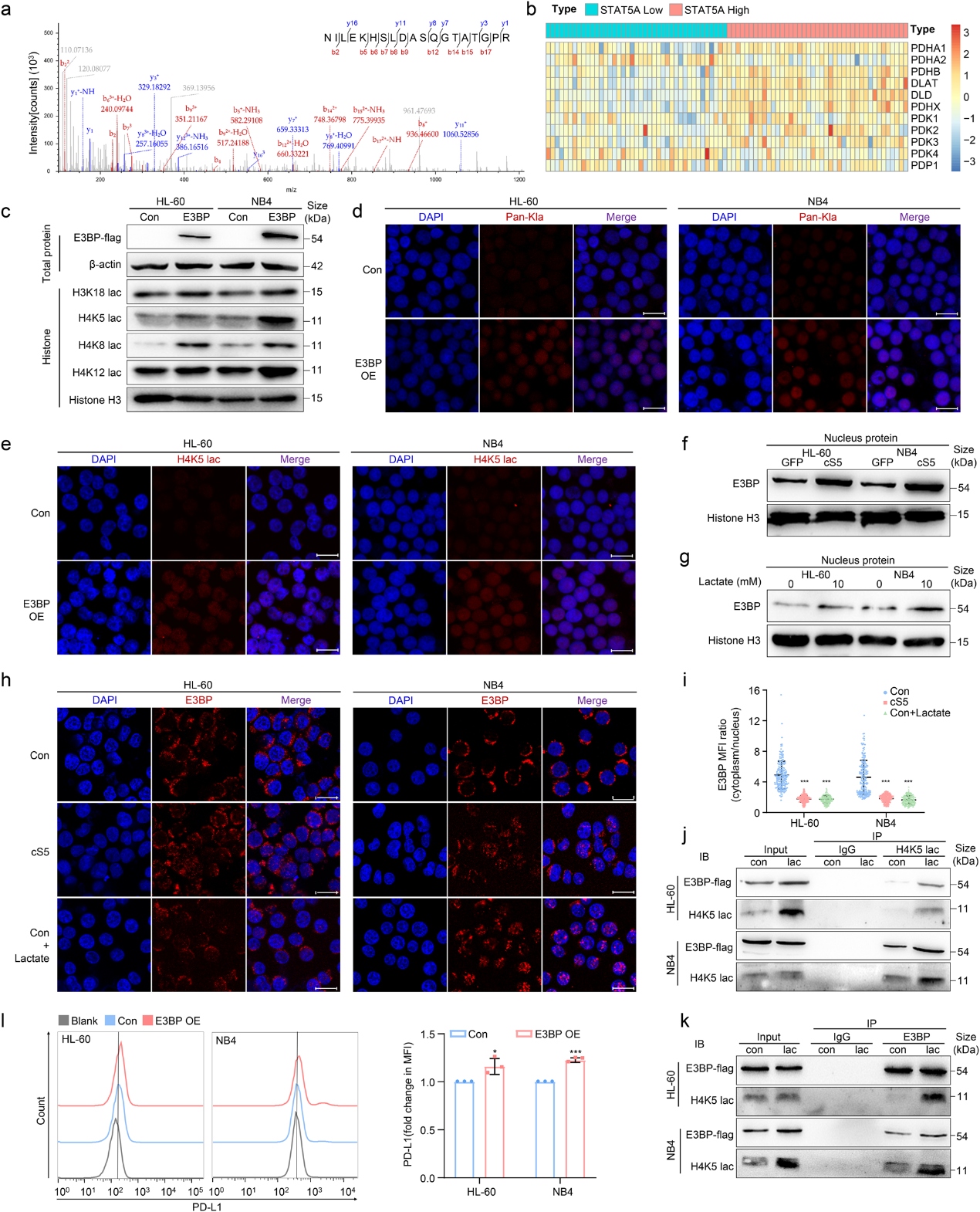
為了尋找AML細胞中調節組蛋白乳酸化的分子,作者使用LC-MS/MS驗證了乳酸化H4K5的結合蛋白。結果表明,丙酮酸脫氫酶(PDH)復合物的組成部分E3BP可以與白血病細胞中的乳酸化H4K5相互作用 (圖5a)。同時,根據STAT5的表達將源自GSE12417的AML患者分為四分位數,然后分析E3BP的表達。在STAT5高表達的AML患者中, E3BP (PDHX)基因表達升高(圖5b)。接下來,作者構建了E3BP過表達的AML細胞,然后檢測組蛋白乳酸化。結果顯示,E3BP在AML細胞中顯著誘導組蛋白乳酸化,包括H3K18、H4K5、H4K8和H4K12(圖5c)。 此外,免疫熒光還顯示,E3BP過表達后,Kla和H4K5乳酸化升高(圖5d, e)。出乎意料的是,在cS5過表達的AML細胞中,E3BP在細胞核中富集,這表明E3BP核定位受STAT5調節(圖5f)。與此一致的是, E3BP核易位在乳酸處理的AML細胞中升高(圖5g-i)。此外,Co-IP 表明,在乳酸處理后,更多的E3BP與乳酸化H4K5相互作用(圖5j, k)。一致地,AML細胞在E3BP過表達后表現出更高的PD-L1水平(圖5l)。這些結果表明,乳酸促進E3BP核易位有助于組蛋白乳酸化。
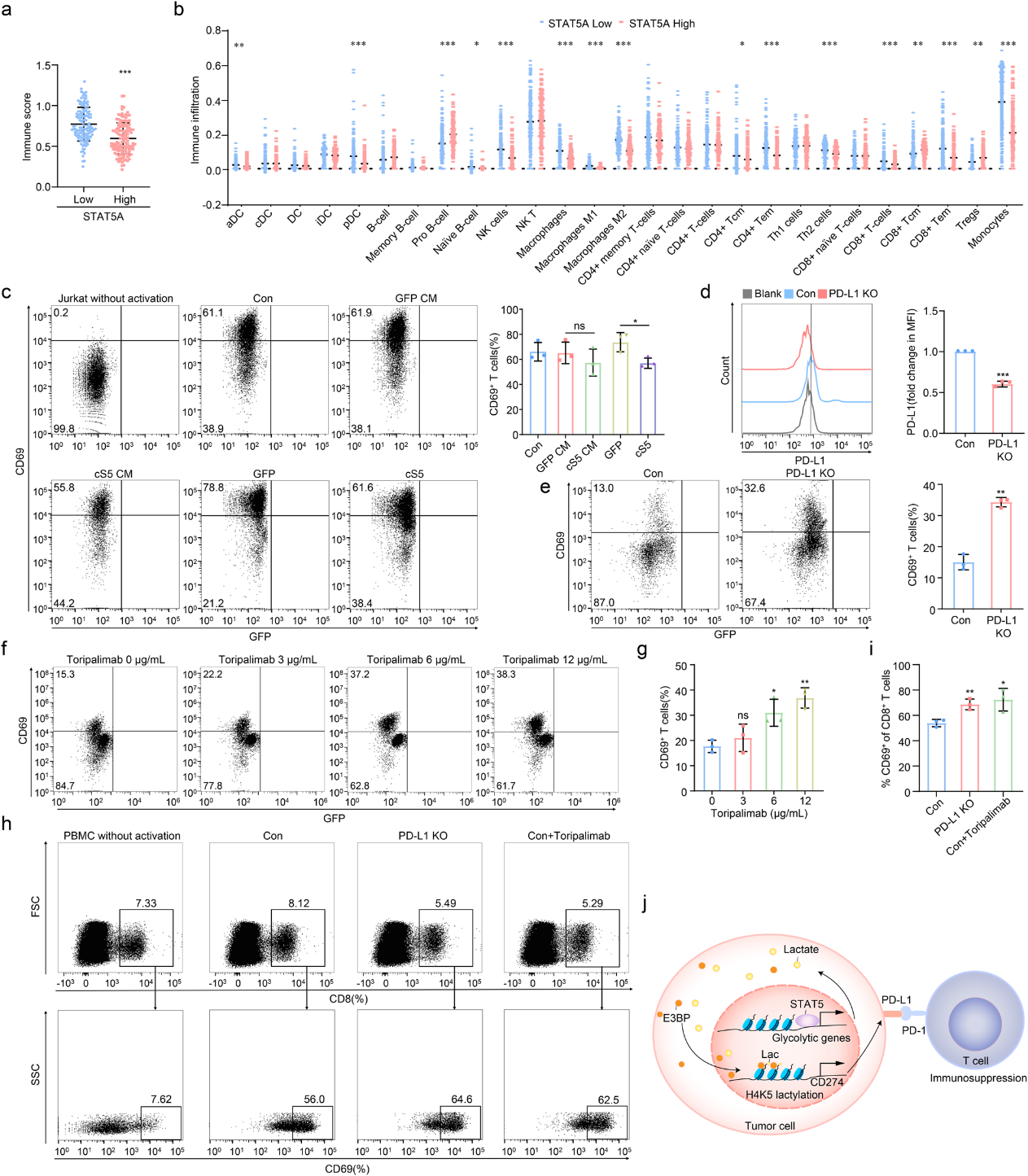
6.STAT5通過上調PD-L1表達抑制T細胞活化
基于作者發現STAT5驅動AML細胞中PD-L1的表達(圖3a),作者假設STAT5 可能抑制PD-L1介導的免疫功能。作者在GSE14468中描述了STAT5 高表達和低表達AML患者之間免疫景觀的差異。值得注意的是,在STAT5高表達的AML細胞中,免疫評分降低,CD8+T細胞含量下降(圖6a, b)。隨后,作者在AML細胞和T細胞之間進行了共培養系統。在cS5衍生的條件培養基(CM)中培養的Jurkat細胞和對照AML細胞的活化水平相當。然而,Jurkat細胞與cS5 AML細胞直接接觸顯示, Jurkat細胞中CD69的表達明顯下調(圖6c),這表明STAT5 可能通過誘導PD-L1表達來抑制 Jurkat 細胞的活化。作者進一步生成 PD-L1 敲除(KO) HL-60 cS5 細胞(圖 6d),然后與Jurkat細胞共培養。正如預期的那樣,Jurkat細胞通過PD-L1敲除被重新激活(圖6e)。通過使用PD-1中和抗體托利單抗治療Jurkat細胞,阻斷PD-1/PD-L1 相互作用,也恢復了Jurkat細胞的活化(圖6f, g)。PBMCs的 CD8+ T 細胞在與PD-L1- ko HL-60 cS5 細胞共培養或暴露于特瑞普利單抗后被重新激活(圖6h, i),支持AML中PD-L1抑制可能恢復被STAT5抑制的CD8+ T 細胞激活。
結論
綜上所述, 由STAT5驅動的乳酸累積促進了PD-L1啟動子上組蛋白的乳酸化,并最終誘導 PD-L1 的表達。免疫檢查點抑制劑可以阻斷STAT5 高表達AML中PD-1/PD-L1的相互作用,并重新激活CD8+T細胞。因此,作者的研究證明了新陳代謝-表觀遺傳學-免疫網絡在急性髓細胞性白血病進展中的作用,STAT5誘導的乳酸可作為抗PD- (L)1免疫療法應用于AML的預測性生物標志物。
參考文獻
Huang, ZW., Zhang, XN., Zhang, L. et al. STAT5 promotes PD-L1 expression by facilitating histone lactylation to drive immunosuppression in acute myeloid leukemia. Sig Transduct Target Ther 8, 391 (2023).
生信分析:生物信息學分析
常規分子實驗:質粒構建、qPCR檢測、免疫印跡檢測、組蛋白提取、免疫熒光染色、免疫共沉淀、熒光素酶報告基因檢測、
細胞實驗:慢病毒感染 、糖代謝指數的測量、流式細胞術、AML細胞和T細胞共培養測定、細胞糖酵解應激試驗測定






