CircXRN2通過激活Hippo通路抑制由組蛋白乳酸化驅動的人膀胱癌腫瘤進展
膀胱癌(BCa)是世界上第四大最常見的預后不良的惡性腫瘤。需要進一步的探索和研究來揭示circRNA的潛在作用和分子機制。在目前的研究中,我們的研究結果表明,circXRN2通過激活人類膀胱癌中的Hippo通路,抑制由組蛋白乳酸化驅動的腫瘤進展。在本研究中,CircXRN2在膀胱癌組織和細胞系中異常下調。CircXRN2在體內和體外均能抑制腫瘤細胞的增殖和遷移。此外,circXRN2作為糖酵解和乳酸生成的負調節因子。從機制上講,circXRN2通過與SPOP降解因子結合,阻止LATS1進行SPOP介導的降解,進而激活Hippo信號通路,發揮多種生物學功能。circXRN2-Hippo通路調節軸通過抑制H3K18乳酸化和LCN2的表達進一步調節腫瘤進展。我們的研究結果為人類膀胱癌的臨床干預提供了新的治療靶點和有希望的策略。本文于2023年9月發表于“Molecular Cancer”(IF=37.3)上。
技術路線

結果
1)LATS1在膀胱癌中下調,并與circXRN2相互作用
LATS1是Hippo信號通路中重要的促進分子,在多種惡性腫瘤中發揮重要作用。如圖1a所示,組織芯片和臨床樣本顯示,與鄰近正常組織相比,膀胱癌組織中LATS1異常下調。通過RNA免疫沉淀(RIP)和高通量測序,我們獲得了一個可能與LATS1蛋白相互作用的circRNAs數據庫(圖1b)。為了進一步發現可能參與腫瘤發生和進展的特異性circRNAs,我們驗證了數據庫中circRNAs在永生化人正常尿道上皮細胞(SV-HUC-1)和膀胱癌細胞系(5637、T24、EJ、TCCSUP和UM-UC-3)中的表達水平。結果,我們在膀胱癌細胞系中鑒定出14種表達水平非常低的circRNA(圖1c)。此外,我們使用RIP實驗驗證了LATS1與上述circRNAs之間的親和力,其中circXRN2 (hsa_circ_0001134)對LATS1蛋白的結合效率和親和力最高(圖1d)。此外,我們通過qRT-PCR驗證了circXRN2在臨床腫瘤組織中的失調(圖1e)。值得注意的是,腫瘤細胞系中circXRN2的表達水平在一定程度上與Hippo通路關鍵分子TAZ和YAP的激活相關(圖1f和g)。這些發現表明,circXRN2可能參與了LATS1和Hippo信號通路的調節。
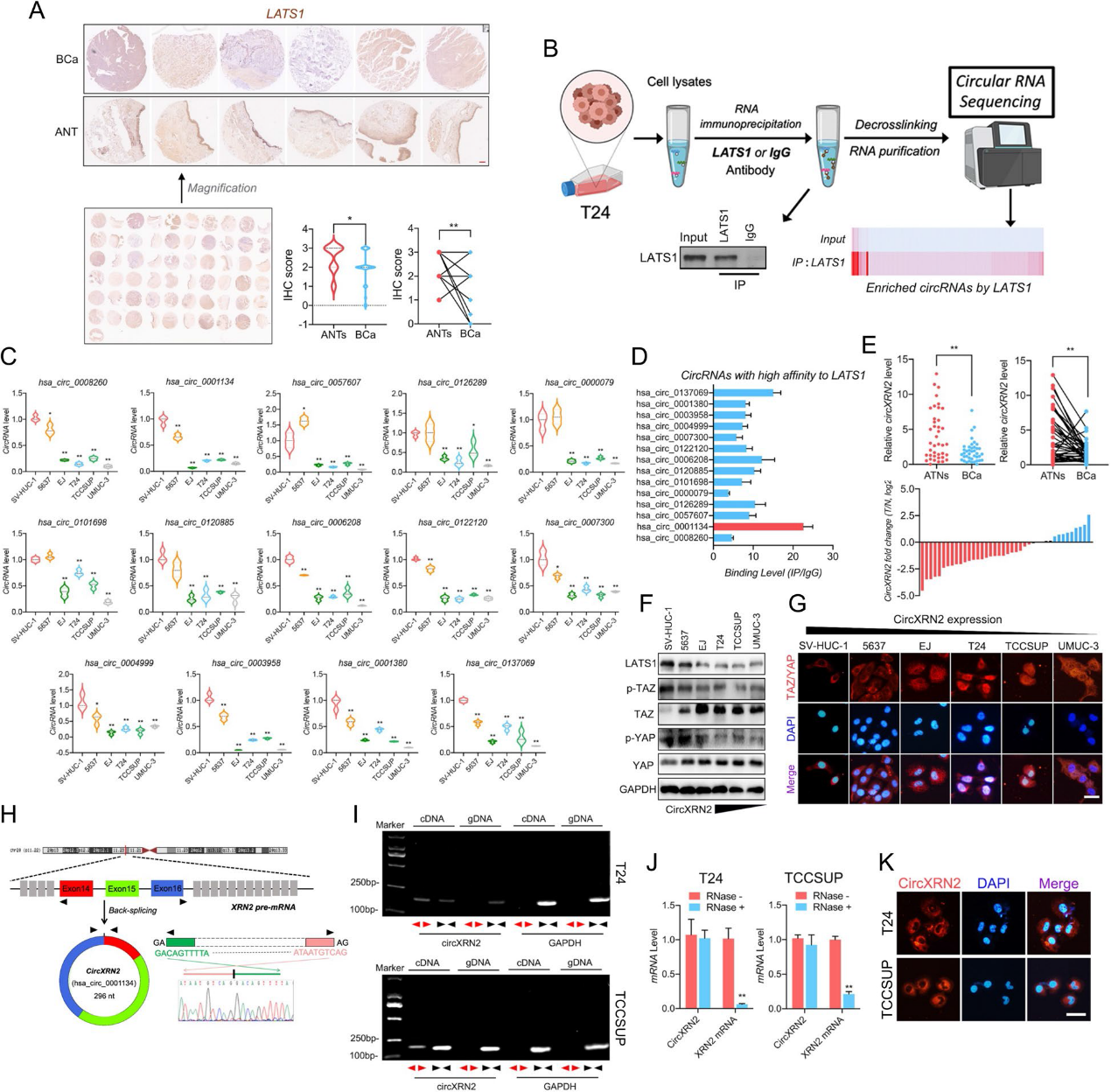
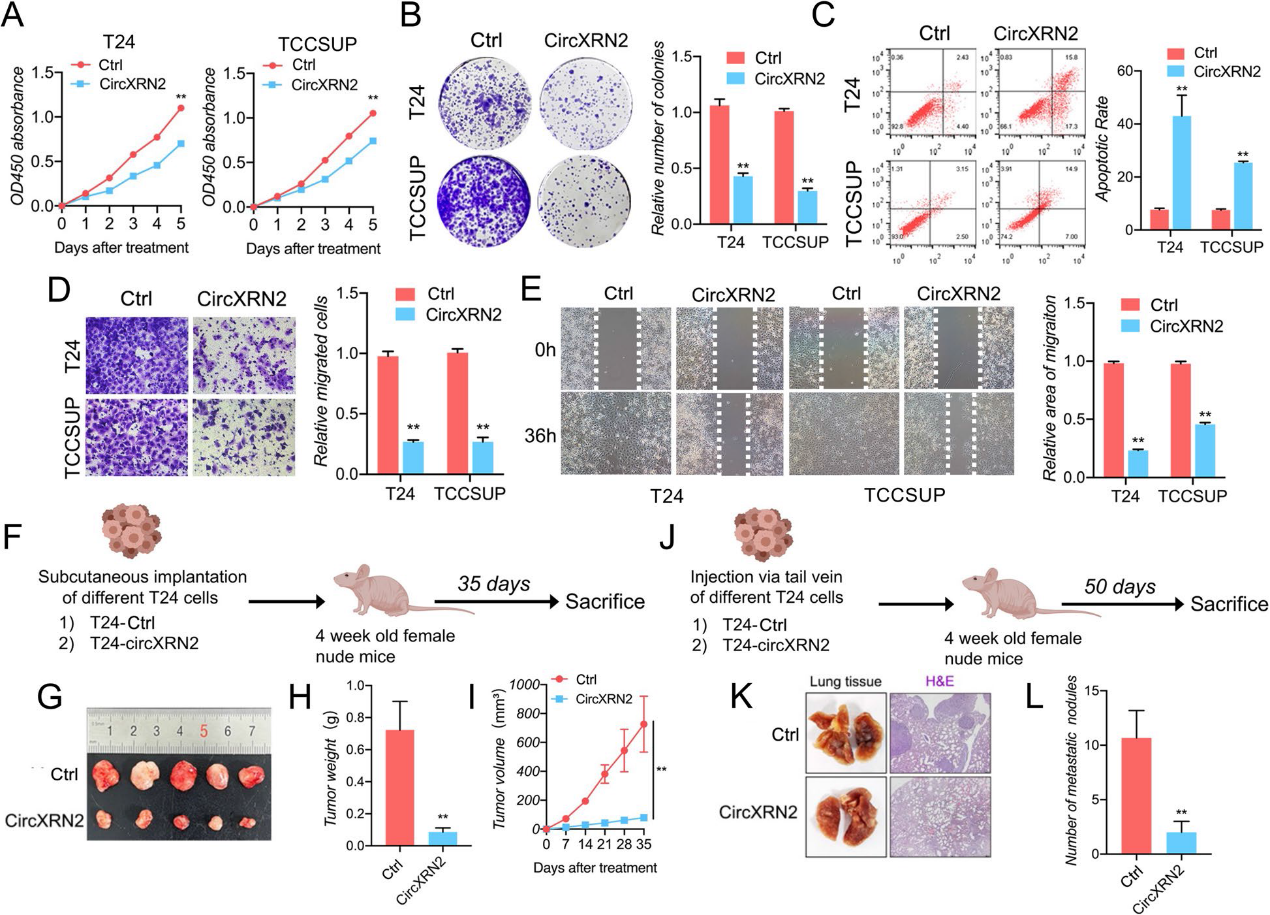
2)CircXRN2在體外和體內抑制膀胱癌細胞的增殖和遷移
根據Sanger測序,我們確定了circXRN2的連接位點序列(圖1)。然后,我們使用發散引物和收斂引物進行qRT-PCR。圖1i的結果表明,circXRN2只能被cDNA中的發散引物擴增,這證實了circXRN2的環狀結構,而不是線性結構。與線性RNA相比,circRNA在內源性環境中更加穩定,因此不易降解。由于這一特性,我們用RNase R處理樣品,發現circXRN2可以耐受RNase R的消化,而線性XRN2 mRNA幾乎完全被降解(圖1j)。最后,RNA FISH顯示circXRN2主要定位于膀胱癌細胞的細胞質中(圖1k)。在體外實驗中,我們進行了CCK8測定來評估細胞活力,結果證明了circXRN2的抑制作用(圖2a)。同樣,我們通過集落形成實驗來測試circXRN2在細胞增殖中的生物學功能,結果與之前的實驗結果一致(圖2b)。此外,circXRN2的過表達也會引發細胞凋亡(圖2c)。在細胞遷移能力方面,如圖2d和e所示,circXRN2也降低了細胞遷移能力。在體內實驗中,我們建立了裸鼠皮下移植瘤發生模型和尾靜脈肺轉移模型。結果表明,circXRN2可以降低皮下腫瘤的生長速度和重量(圖2f-i)。同樣,circXRN2過表達組的轉移淋巴結數量遠低于陰性對照組(圖2j-l)。綜上所述,我們的研究結果表明circXRN2在體外和體內抑制膀胱癌細胞的增殖和遷移。
3)CircXRN2阻止SPOP介導的LATS1降解
為了揭示circXRN2和LATS1之間的相互作用,我們構建了表達LATS1不同片段的質粒,并將其轉染到293T細胞中(圖3a)。RIP實驗顯示,在293T細胞和BCa細胞中,LATS1蛋白的片段2 (279 aa-525 aa)可與circXRN2相互作用(圖3b)。接下來,我們發現過表達circXRN2上調LATS1蛋白水平(圖3c和d)。根據上述結果,我們假設circXRN2可能通過翻譯后修飾調節LATS1蛋白水平。為了證實這一猜想,我們用環己亞胺處理陰性對照和過表達circXRN2的細胞,結果表明circXRN2可以延長LATS1蛋白的半衰期(圖3e)。此外,硼替佐米(一種蛋白酶體抑制劑)恢復了circXRN2缺乏腫瘤細胞中LATS1蛋白的表達水平(圖3f)。接下來,我們通過IP檢測不同細胞中LATS1蛋白的泛素化。如圖3g所示,在硼替佐米和N-乙基馬來酰亞胺治療下,在circXRN2過表達的細胞中,較少的LATS1蛋白泛素化。綜上所述,這些結果證實了circXRN2通過調節轉錄后泛素化調節膀胱癌細胞中的LATS1蛋白水平。
最近的一項研究報道,LATS1是斑點型POZ (SPOP)的潛在底物,SPOP促進LATS1的泛素化和降解。如圖3h所示,在膀胱癌細胞中,LATS1與SPOP蛋白相互作用。接下來,我們將不同濃度的HA標記的SPOP轉染到膀胱癌細胞中。結果顯示,SPOP以劑量依賴的方式下調LATS1蛋白(圖3i)。有趣的是,SPOP敲除顯著消除了circXRN2缺乏誘導的LATS1蛋白下調(圖3j)。此外,IP分析顯示,SPOP敲低顯著降低了LATS1蛋白的泛素化(圖3k)。如圖31所示,在LATS1蛋白的N端存在兩個推測的SPOP結合基序或“degrons”(SBC1: 327- MQSSS- 341;Sbc2: 429- pqsss - 443)。在我們之前的結果中,circXRN2與LATS1的片段2 (279 aa-525 aa)相互作用,其中包含SBC1和SBC2。因此,我們推測circXRN2和SPOP可能競爭性地與LATS1蛋白相互作用以調節其降解。為了進一步驗證,我們將野生型或突變型LATS1質粒轉染到293T或膀胱癌細胞中,證實了SBC1突變導致SPOP介導的LATS1降解被顯著阻斷,而SBC2的耗盡幾乎沒有影響(圖3m)。同時,co-IP結果顯示,野生型LATS1可以結合SPOP,但SBC1突變體LATS1與SPOP的相互作用幾乎完全減弱(圖3n)。最后,如圖3o所示,我們發現circXRN2的敲低促進了膀胱癌細胞中SPOP和LATS1的相互作用。綜上所述,我們的研究結果表明circXRN2阻止了LATS1由SPOP介導的降解。

4)CircXRN2在膀胱癌中作為糖酵解和乳酸生成的抑制因子
許多研究報道了Hippo通路在細胞糖酵解代謝中的調節作用。鑒于circXRN2、LATS1和Hippo通路之間的密切關系,我們假設circXRN2在膀胱癌細胞的糖酵解中起關鍵作用。為了驗證這一推測,我們過表達circXRN2,并進行了2-NBDG攝取檢測、葡萄糖攝取試驗和乳酸生成測定。上述實驗證明,circXRN2降低了T24和TCCSUP細胞的葡萄糖攝取和乳酸生成(圖4a-c)。海馬糖酵解率分析結果顯示,過表達circXRN2的膀胱癌細胞中glycoPER、基礎糖酵解和代償性糖酵解均低于正常腫瘤細胞(圖4d)。綜上所述,circXRN2在T24和TCCSUP細胞的糖酵解和乳酸代謝中起負作用。

5)CircXRN2通過穩定LATS1激活Hippo通路,調節膀胱癌進展、糖酵解和乳酸生成
為了證實circXRN2/LATS1軸調控膀胱腫瘤細胞的多種生物學功能和葡萄糖代謝,我們在過表達circXRN2的細胞中敲低了LATS1蛋白。免疫印跡分析顯示了LATS1、TAZ和YAP的蛋白水平(圖5a),免疫熒光證實了TAZ/YAP在細胞內的位置(圖5b)。CCK-8實驗和集落形成實驗的結果顯示,LATS1的缺失逆轉了circXRN2誘導的對細胞活力和增殖的抑制作用(圖5c和d)。同時,通過Transwell實驗和傷口愈合實驗確定了細胞遷移。與circXRN2過表達的細胞相比,轉染shLATS1的細胞遷移能力更強(圖5e和f)。此外,通過2-NBDG攝取測定、葡萄糖攝取測定和乳酸生成檢測,分別測定對照組、circXRN2過表達組和circXRN2 + shLATS1組的葡萄糖攝取能力和乳酸生成。圖5g-i顯示shLATS1減輕了circXRN2對糖酵解代謝的抑制。隨后,通過海馬代謝分析儀對不同細胞的glycoPER、基礎糖酵解率和代償糖酵解率進行分析計算,結果也支持上述結論(圖5j)。

6)circXRN2調控組蛋白乳酸化促進膀胱癌的發生
我們利用2-脫氧-D-葡萄糖(2-DG,一種糖酵解抑制劑)和草氨酸鹽(一種乳酸脫氫酶抑制劑)來證實膀胱癌細胞中糖酵解、整體乳酸化和組蛋白乳酸化之間的關系。如圖6b-d所示,2-DG和草氨酸鹽以劑量依賴的方式降低了全局乳酸化修飾和H3K18乳酸化修飾,并被LDH耗盡完全抑制。考慮到circXRN2對糖酵解和乳酸生成的影響,我們假設circXRN2可能參與了膀胱癌中組蛋白的乳酸化。正如我們假設的那樣,圖6e中的結果顯示circXRN2顯著降低了全局乳酸化和H3K18乳酸化水平。值得注意的是,在膀胱癌細胞系中,全局乳酸化和H3K18乳酸化是異常的,這表明它們在腫瘤發生中的潛在作用(圖6f)。此外,為了驗證組蛋白乳酸化在膀胱癌中的生物學功能,我們消除了內源性LDHA和LDHB,以降低整體乳酸化和H3K18乳酸化水平,并補充乳酸鈉進行拯救實驗。CCK-8和集落形成實驗表明,組蛋白乳酸化在細胞增殖和集落形成能力中起著至關重要的作用(圖6g和h)。此外,同時消除LDHA和LDHB也會損害T24和TCCSUP細胞的細胞遷移能力(圖6i和j)。乳酸鈉可以減弱LDHA/B缺乏誘導的腫瘤細胞增殖(圖6g和h)和遷移(圖6i和j)的抑制。綜上所述,這些結果表明組蛋白H3K18乳酸化是由circXRN2調節的,并參與了膀胱癌的腫瘤發生。

7)LCN2是H3K18乳酸化的靶點,是膀胱癌的致癌基因
為了揭示H3K18乳酸化的調控機制,我們在T24細胞中使用ChIP級H3K18la抗體和IgG進行了CUT&Tag。如圖7a所示,H3K18la可以在許多基因的啟動子區域富集。同時,KEGG數據庫分析顯示,在我們的CUT&Tag測序中,H3K18la相關基因在調節腫瘤發生的多種信號通路中富集(圖7b),表明H3K18la在人類膀胱癌進展中起著關鍵作用。然后,我們對circXRN2過表達或不過表達的T24和TCCSUP細胞進行轉錄組測序,并將這些結果與CUT&Tag數據和PubMed數據庫相結合,選擇LCN2、NARP和KRT80作為候選基因(圖7c和d)。LCN2、NARP和KRT80啟動子區域富集H3K18la或IgG的信號如圖7e所示。接下來,我們在circXRN2過表達的細胞中驗證了上述靶點在mRNA水平上的表達,結果表明,circXRN2可以顯著調節LCN2。然后,在過表達circXRN2的T24和TCCSUP細胞中驗證LCN2 mRNA和LCN2蛋白的表達水平。結果顯示,LCN2被circXRN2顯著下調(圖7f)。此外,糖酵解抑制劑也在蛋白水平上調節LCN2的表達(圖7g)。我們在TCGA數據庫和Kaplan-Meier Plotter數據庫中發現,與正常組織相比,LCN2在膀胱癌組織中表達上調,且與膀胱癌進展密切相關(圖7h)。基于以上證據,我們選擇LCN2進行下面的研究。根據我們之前的CUT&Tag測序,我們設計了針對LCN2啟動子不同區域的特異性引物,ChIP實驗顯示H3K18la富集在LCN2啟動子中。值得注意的是,H3K18la與LCN2啟動子之間的相互作用可以被糖酵解抑制劑和circXRN2減少,進一步表明H3K18la在LCN2轉錄中的關鍵作用(圖7i, j)。最后,我們探討了LCN2在LCN2缺失的T24和TCCSUP細胞中的生物學功能。如圖7k-n所示,LCN2的缺失顯著降低了腫瘤細胞的增殖、集落形成和遷移。綜上所述,我們的研究結果表明LCN2直接受H3K18乳酸化調控,并在人類膀胱癌中發揮致癌基因的作用。

8)circXRN2?LATS1軸在體內抑制膀胱癌細胞的腫瘤生長和轉移
為了驗證circXRN2-LATS1軸是否在體內抑制膀胱癌細胞的腫瘤生長和轉移,我們將不同處理(對照、circXRN2過表達、circXRN2 + shLATS1)的細胞皮下注射到裸鼠體內。與體外細胞實驗類似,過表達circXRN2可顯著降低腫瘤生長速率,敲低LATS1顯著減弱了circXRN2引起的抑制作用(圖8a-d)。我們還通過向裸鼠尾靜脈注射不同的T24細胞,建立裸鼠肺轉移模型,評估細胞在體內的轉移能力。如圖8eg所示,與正常對照組相比,過表達circXRN2顯著減少了肺轉移結節,而在circXRN2過表達并敲低LATS1的細胞中,腫瘤結節顯著增加。此外,我們通過免疫組織化學和western blotting檢測不同治療組腫瘤中LATS1、TAZ/YAP、LCN2和H3K18la的表達水平,結果與之前的實驗結果一致(圖8h-i)。同時,我們評估了LCN2 mRNA在不同腫瘤中的表達水平(圖8j)。總之,我們的研究結果表明,circXRN2通過激活Hippo信號通路抑制人類膀胱癌中由H3K18乳酸化介導的腫瘤進展。
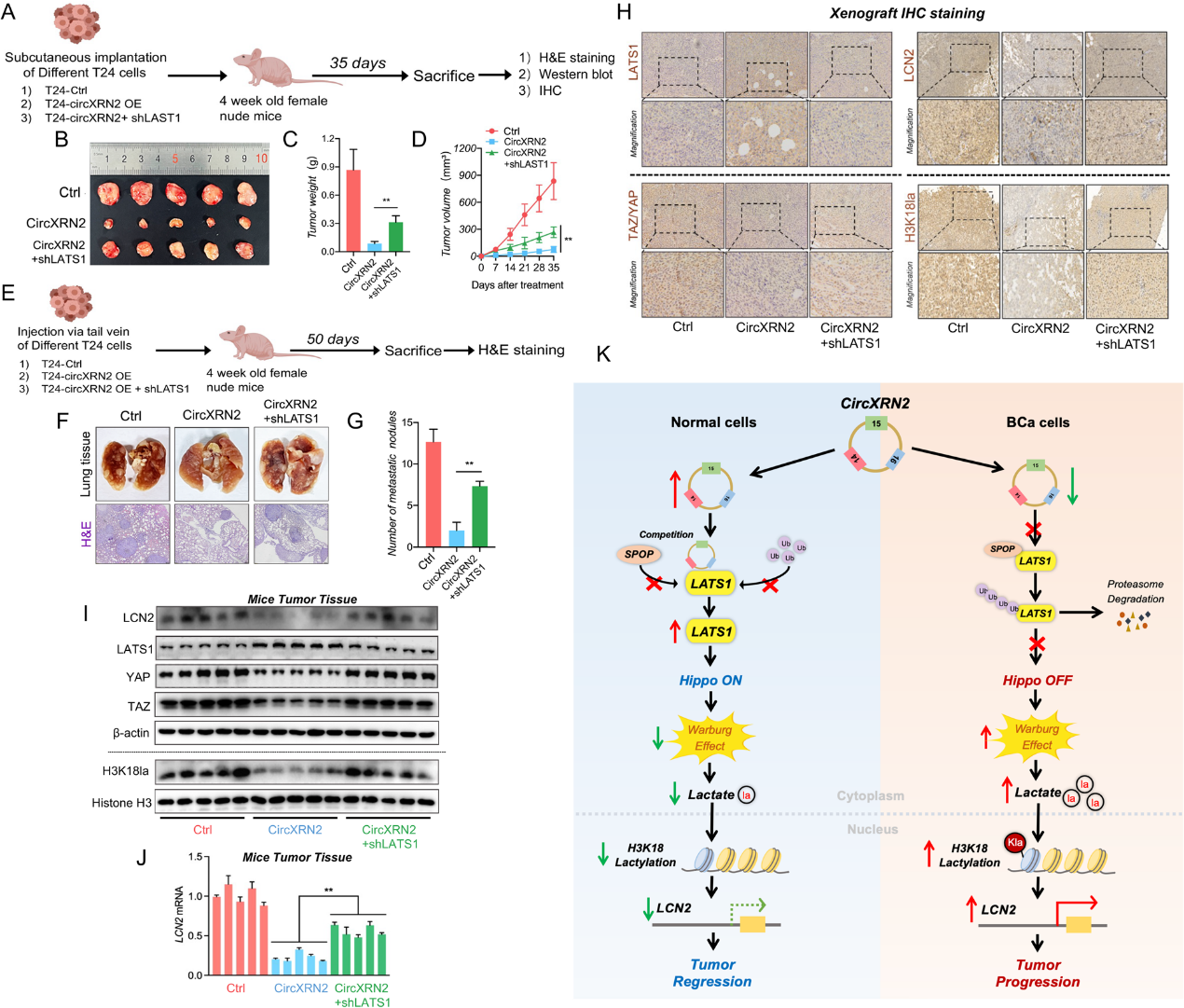
結論
我們證實circXRN2通過調節H3K18乳酸化抑制膀胱癌的進展。從機制上講,circXRN2與LAST1蛋白結合,保護其免受SPOP介導的泛素化和降解,從而激活Hippo信號通路,抑制H3K18的乳酸化。我們的發現將有助于發現新的分子靶點和治療人類膀胱癌的策略。
實驗方法
RIP,CUT&Tag,FISH,糖酵解率測定,qRT-PCR,ChIP,IP,CCK-8,克隆形成實驗,transwell,傷口愈合試驗,流式,WB,免疫熒光。
參考文獻
Xie B, Lin J, Chen X, Zhou X, Zhang Y, Fan M, Xiang J, He N, Hu Z, Wang F. CircXRN2 suppresses tumor progression driven by histone lactylation through activating the Hippo pathway in human bladder cancer. Mol Cancer. 2023 Sep 8;22(1):151. doi: 10.1186/s12943-023-01856-1.






