單細胞和空間轉錄組分析揭示結直腸癌肝轉移的細胞異質性

結直腸癌(CRC)是全球第三大最常見的惡性腫瘤,14.5 - 17.5%的患者發生肝轉移。癌細胞和基質細胞之間通過分泌細胞因子、生長因子和蛋白酶來重塑腫瘤微環境(TME),從而促進轉移擴散。單細胞RNA測序(scRNA-seq)描述了原發性CRC的免疫環境,但CRC肝轉移的總體細胞格局以及原發性和轉移性CRC之間的相互作用網絡差異很少有報道。在本研究中,作者使用單細胞和空間轉錄組RNA測序全面繪制了CRC和匹配的CRC肝轉移的細胞圖譜。在CRC原發腫瘤和肝轉移之間,觀察到CAF、CD8+ T細胞和腫瘤相關巨噬細胞等主要細胞類型的不同表型特征和高度變化的頻率,表明TME內部的分子異質性,為未來的CRC肝轉移的治療提供潛在的靶點。該研究于2023年6月發表在《Science Advances》,IF:13.6。
技術路線
主要研究結果
1. CRC原發腫瘤和CRC肝轉移瘤的單細胞轉錄組圖譜
從6例CRC患者的原發結直腸癌(CC)、鄰近正常結直腸黏膜(CN)、肝轉移(LM)、鄰近正常肝組織(LN)和外周血(PB)收集了CD45?非免疫細胞和CD45+免疫細胞,用于單細胞轉錄組分析(圖1A)。在主要的非免疫細胞群中,進一步的無監督聚類產生11個腫瘤細胞簇、8個成纖維細胞簇和6個內皮細胞簇(圖1B)。LM中CA2和F2_MCAM富集,F4_F3和F5_CCL11在CC中顯著富集(圖1C)。根據已知marker的表達情況,將免疫細胞分為41個群體。雖然LN中單核細胞、NK細胞和黏膜相關不變T (MAIT)細胞占主導地位,但TIME被轉移性腫瘤細胞重塑,Tregs和巨噬細胞顯著上調(圖1E)。這些結果表明,在CRCLM的不同組織中具有不同分布模式的多個細胞群。

圖1. 結直腸癌肝轉移的整體細胞景觀
2. CRC原發腫瘤及CRC肝轉移瘤的空間分布特征
收集6例患者的6個組織標本,包括4例結直腸癌原發灶(C1 ~ C4)和2例肝轉移灶(L1和L2)。通過hematoxylin-eosin staining和每個樣本的基因表達特征確定腫瘤區域(T)和癌旁區域(PT)(圖2A)。與癌旁組織相比,腫瘤組織富集細胞周期相關通路,如G2-M檢查點、E2F靶點和有絲分裂紡錘體(圖2B)。根據基因表達譜將腫瘤組織和癌旁組織劃分為不同區域(圖2A)。與C1、C3、C4的瘤旁組織相比,腫瘤組織中的漿細胞比例降低(圖2C、D)。
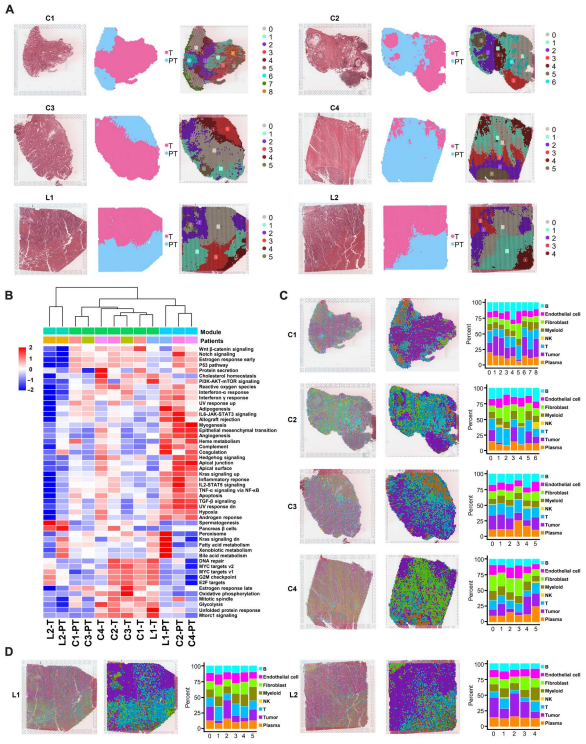
圖2. 空間轉錄組樣本的細胞鑒定
3. TME重塑骨髓細胞的組成
使用subclustering分析確定八個集群的單核細胞/巨噬細胞和三個集群的常規DCs (cDCs)(圖3A)。髓樣細胞在各部位有明顯的分布規律(圖3 B),展示出器官特異性表征。與癌旁組織相比,Mac_SPP1亞群在腫瘤組織中富集,且大部分Mac_SPP1亞群細胞來自原發腫瘤。此外,在CXCL9高表達的LM中,Mac_CXCL9的比例顯著升高(圖3C),提示該亞群可以募集CXCR3陽性的效應性T細胞進入腫瘤。參與募集髓系細胞(尤其是粒細胞)的基因(如CXCL3)在Mac_SPP1亞群中富集(圖3D)。GSVA分析表明Mac_SPP1亞群參與炎癥反應相關通路。然而,Mac_CXCL9亞群在干擾素-γ (IFN-γ)應答和T細胞活化通路中富集(圖3E)。軌跡分析顯示Mac_CXCL9和Mac_SPP1亞群均出現終末分化,表明它們是腫瘤激活的亞群(圖3F)。
在CC和LM中均發現cDC1 (cDC_CPNE3)和cDC2 (cDC_CD1c)(圖3A)。此外,cDC_LAMP3在LM中被鑒定并富集(圖3C)。cDC_LAMP3高表達CCR7(圖3G), CCR7是CCL19和CCL21的受體,表明其具有向淋巴結遷移的能力。此外,cDC_LAMP3亞群高表達共刺激分子CD40、CD80和CD86,這些分子是DC成熟的標志(圖3H)。在LM中cDC_LAMP3亞群的比例顯著增加,表明腫瘤細胞在TIME上被馴化。

圖3. 骨髓細胞的免疫景觀
4. CXCL13+ T細胞在肝轉移瘤中富集
CD8+ T細胞和CD4+ T細胞中都有一簇表達CXCL13, CXCR5的趨化因子(圖4A、B)。與LN相比,LM中CD8_CXCL13細胞的百分比顯著增加。然而,這個亞群很少在CN、LN和PB中檢測到 (圖4C、D)。在結腸的穩定狀態下約3 - 12%的CD4細胞呈CXCL13陽性。在CC中,CD4_CXCL13的百分比減少,但與LN相比,LM中該亞群的百分比增加(圖4E)。
為進一步研究CXCL13+ T細胞亞群的特征,作者分析了各亞群中上調的通路。GSVA分析顯示CD8_CXCL13亞群富集T細胞增殖通路,CD4_CXCL13亞群富集G2-M檢查點通路,顯示出這兩個亞群的增殖特性(圖4F、G)。CC和LM的CD69+ CD103+ CD8+ T細胞的Ki67表達水平均高于其他CD8+ T細胞。然而,CN和LN中不同CD8+ T細胞亞群的增殖特性幾乎相同(圖4H)。綜上所述,這些結果表明CD8_CXCL13和CD4_CXCL13細胞在結直腸癌LM中表達上調,因為它們具有較高的增殖能力。

圖4. 腫瘤浸潤T細胞的轉錄重編程。
5. CXCL13+ T細胞與結直腸癌患者的良好預后相關
在上述結果中,作者發現與CD4_CXCL13亞群相比,CD8_CXCL13在CC和LM中富集(圖4D、E),表明CD8_CXCL13細胞可能是一個腫瘤激活亞群。因此,進一步研究CD8_CXCL13亞群的特征。與其他亞群相比,在CD8_CXCL13亞群中觀察到高水平的耗竭標志物,如PDCD1、HAVCR2、LAG3、CTLA4和TIGIT(圖5A、B)。軌跡分析顯示CD8_CXCL13細胞處于終末分化狀態(圖5C)。此外,CD8_CXCL13亞群還表達高水平的效應分子,如GZMB(圖5A、B),這表明該亞群可能保留部分抗腫瘤功能。由于在組織中很難檢測到CXCL13,用CD69和CD103標記CXCL13+ 細胞,IHC結果顯示CD69+ CD103 + CD8+ T細胞比其他腫瘤組織中的CD8+ T細胞更接近CK19+腫瘤細胞(圖5D、E),促進其腫瘤殺傷功能。值得注意的是,CD103+ CD8+ T細胞存在于結直腸癌組織的三級淋巴結構(TLSs)中,且TLS評分越高的患者,其CD8_CXCL13評分越高,這表明該亞群可能參與TLS的形成(圖5F、G)。將基因表達綜合(GEO)隊列中的CRC患者分為CXCL13高表達和CXCL13低表達組,發現CC中CXCL13的高表達預示著較好的總生存期(圖5H)。綜上所述,在TME中富集的CXCL13+ T細胞是腫瘤反應性的亞群,有助于改善CRC患者的預后。

圖5. CXCL13+ T細胞的特性及預后影響
6. 結直腸癌的原發灶和肝轉移灶中存在不同的成纖維細胞亞群
在結直腸癌的TME中,發現8個具有不同基因表達模式的成纖維細胞簇,分別為F1_PRELP、F2_MCAM、F3_HAS1、F4_F3、F5_CCL11、F6_IGFL2、F7_COCH和F8_MKI67 (圖6A)。與CC相比,LM中F2_MCAM簇的百分比較高。F4_F3和F5_CCL11亞群主要包含來自CC的細胞(圖6B)。根據批量RNA測序數據,F4_F3在CC中的浸潤較CN中增加。然而,在CC中F5_CCL11亞群的百分比下降,基于軌跡分析,可能會轉變為F4_F3亞群(圖6C)。軌跡分析還預測F2_MCAM和F4_F3是兩個不同的終末分化簇(圖6C)。IHC分析證實F2_MCAM存在于CC和LM中(圖6D)。然而,與單細胞分析一致,F4_F3亞群只在CC中存在,而在LM中不存在,這種現象可能是由于LN中不存在F4_F3而CN中存在(圖6E、F)。ST分析也證實,CC中F4_F3亞群的浸潤比LM中更多(圖6G、H)。CN和CC中F4_F3亞群緊密地圍繞在上皮細胞周圍,促進其與上皮細胞的相互作用(圖6I)。此外,F4_F3在CC中的浸潤增加可能導致預后惡化(圖6J)。綜上所述,在結直腸癌的原發腫瘤和肝轉移腫瘤中,觀察到不同的表型特征和高度可變的成纖維細胞頻率,這表明在不同的癌癥環境中TME內的細胞異質性。

圖6. 原發性和轉移性腫瘤中成纖維細胞的轉錄組特征和異質性
7. 表達F3的成纖維細胞亞群在結直腸癌原發腫瘤中富集并分泌腫瘤因子,與結直腸癌患者的不良預后相關
進一步分析CC和LM的特征,F4_F3富集C3和CXCL1,表明該亞群參與補體和炎癥反應通路(圖7A、B)。F4_F3也表達高水平的MMP2和MMP3,這可能有助于細胞外基質的組織(圖7A )。此外,參與血管生成和腫瘤侵襲的腫瘤因子,如VEGFA、NRG1、HGF、GDF15、AREG和BMP2,在F4_F3中富集(圖7C)。F4_F3與腫瘤細胞的相互作用分析進一步揭示它們通過NRG1和Erb-B2受體酪氨酸激酶3 (ERBB3)通路進行交叉對話,ERBB3在腫瘤細胞中富集,并能與ERBB2形成異二聚體,促進腫瘤細胞增殖和CRC患者對西妥昔單抗的耐藥(圖7D)。ST分析也表明F3與NRG1共定位,包圍ERBB3+腫瘤細胞(圖6G和圖7E-I)。Transwell遷移實驗顯示,重組人NRG1 (rNRG1)可以促進RKO和SW620細胞的遷移(圖7J)。F3和NRG1高表達的CRC患者總生存期較差(圖7K)。這些結果表明,CC富集的成纖維細胞F4_F3可能通過分泌腫瘤因子導致CRC患者的不良預后。
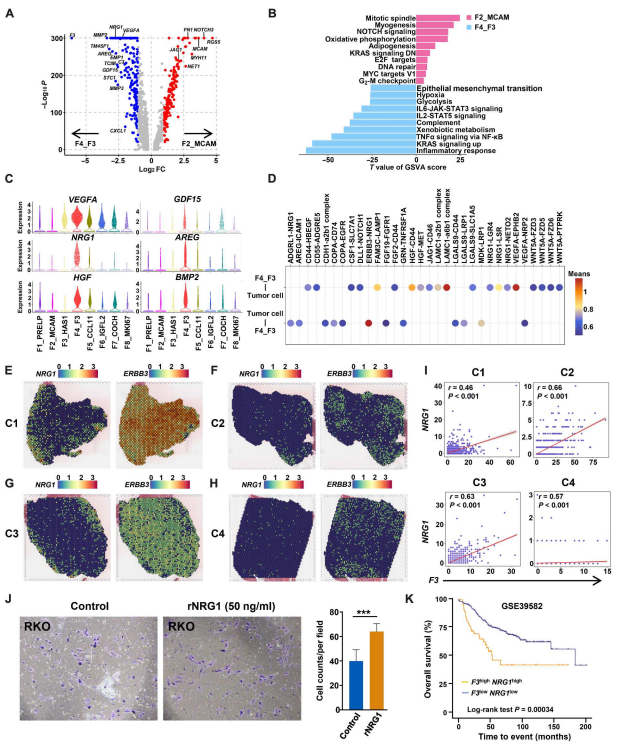
圖7. F3+成纖維細胞的特性及預后影響
8. LM TME中表達MCAM的成纖維細胞通過Notch信號通路調控CD8_CXCL13細胞的生成
Notch信號傳導因子RBPJ優先表達于CD8_CXCL13和CD4_CXCL13亞群(圖5A)。LM中的RBPJ表達與CXCL13和ITGAE呈正相關,而在CC中未觀察到這一情況(圖8A)。CD8_CXCL13和CD4_CXCL13亞群主要表達NOTCH1受體(圖8B)。F2_MCAM亞群富集JAG1, F5_COCH亞群富集DLL1,而E2_DLL4子集富集DLL4、JAG1和JAG2(圖8C)。使用CellPhone DB對Notch及其配體的相互作用分析顯示,在內皮細胞中,E2_DLL4亞群與CXCL13+ T細胞的相互作用最強,而在成纖維細胞中,F2_MCAM亞群通過JAG1-NOTCH1與CD8_CXCL13和CD4_CXCL13亞群的相互作用最強(圖8D)。
接下來,根據LM中F2_MCAM的比例將患者分為兩組,發現F2_MCAM-high組患者的LM中CD8_CXCL13亞群比例更高(圖8E)。GEO數據集分析顯示,F2_MCAM浸潤評分較高的患者在LM中有較高的CD8_CXCL13亞群浸潤評分,而在CC中CD4_CXCL13亞群無此情況(圖8F)。此外,通過ST檢測F2_MCAM和CD8_CXCL13在LM中的位置。與單細胞結果一致,在ST樣本中,F2_MCAM浸潤評分較高的區域CD8_CXCL13浸潤評分較高(圖8G、H)。
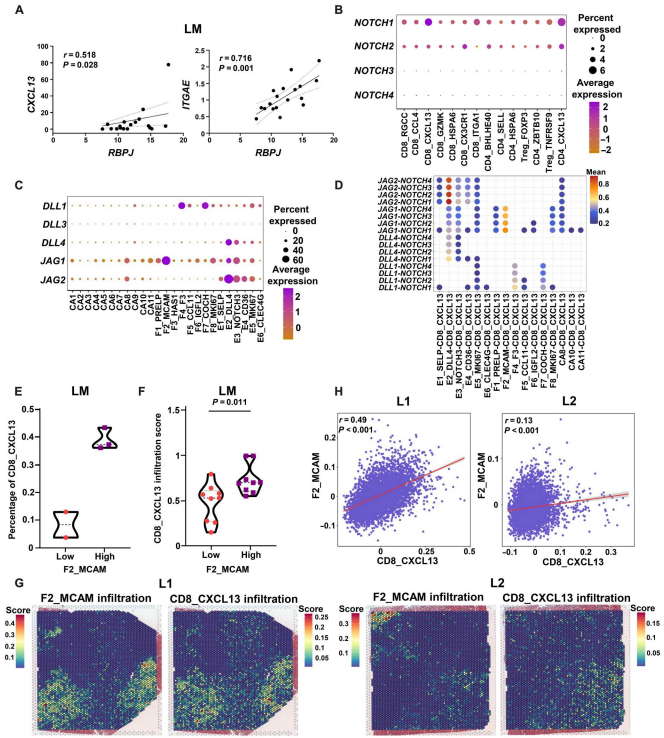
圖8. TME中NOTCH信號調節CD8_CXCL13細胞的生成
9. ST組織的細胞間相互作用網絡
作者還研究了原發腫瘤和肝轉移腫瘤ST中不同簇之間的細胞相互作用。結果表明,VEGFA-NRP1和VEGFA-NRP2配體-受體對在原發性和肝轉移瘤中均有富集。還發現CC和LM之間存在多種不同的富集的配體-受體對。ERBB3-NRG1對在C1和C3豐富,但在L1和L2中均缺失(圖9A),表明ERBB3-NRG1相互作用在原發腫瘤的發展和轉移中具有潛在作用。綜上所述,作者發現在結直腸癌原發腫瘤中富集的F3+成纖維細胞可以通過產生各種腫瘤因子(包括NRG1)來調節腫瘤的發展和遷移,NRG1與腫瘤細胞上表達的ERBB3相互作用來發揮其腫瘤功能。然而,與CC中的腫瘤亞群F3+成纖維細胞不同,LM中富集的MCAM+成纖維細胞可以通過Notch信號通路調節CD8_CXCL13細胞的生成,表明不同腫瘤環境中基質細胞的細胞異質性(圖9B)。
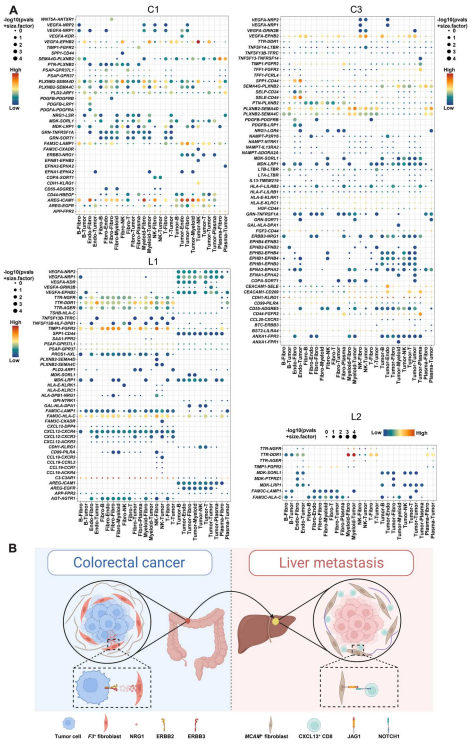
圖9. ST組織中細胞配體和受體的相互作用
結論
綜上所述,本研究使用單細胞和空間轉錄組RNA測序全面繪制了結直腸癌和匹配的肝轉移CRC的細胞圖譜。結直腸癌原發灶和肝轉移灶的不同表型和主要細胞類型,如CAF、CD8+ T細胞和腫瘤相關巨噬細胞的頻率高度變化,提示TME內的分子異質性,并為未來的腫瘤治療提供了潛在的靶點。
實驗方法
單細胞RNA文庫制備及測序,scRNA-seq數據質量控制與預處理,無監督細胞聚類和注釋,單樣品基因集富集分析,基因集變異分析,SCENIC分析,細胞分化軌跡推理,流式細胞術,分子相互作用網絡分析,免疫組化染色,結直腸癌患者生存分析,基因表達相關性分析,ST組織處理、數據處理和細胞類型浸潤評分計算,細胞培養,細胞遷移實驗
參考文獻
Wang F, Long J, Li L, Wu ZX, Da TT, Wang XQ, Huang C, Jiang YH, Yao XQ, Ma HQ, Lian ZX, Zhao ZB, Cao J. Single-cell and spatial transcriptome analysis reveals the cellular heterogeneity of liver metastatic colorectal cancer. Sci Adv. 2023 Jun 16;9(24):eadf5464. doi: 10.1126/sciadv.adf5464. Epub 2023 Jun 16. PMID: 37327339; PMCID: PMC10275599.






