LncRNA通過調控Hippo-YAP信號重編程鐵代謝

鐵代謝失調與癌癥的發展密切相關。長鏈非編碼RNA(lncRNA)通過整合信號通路參與各種代謝過程。在本研究中,作者揭示LncRIM能有效將Hippo通路與鐵代謝聯系起來。LncRIM與 NF2結合抑制NF2-LATS1相互作用,從而激活YAP并通過DMT1和TFR1增加胞內鐵水平。另外,LncRIM-NF2軸介導依賴于Hippo通路的細胞鐵代謝。臨床上,LncRIM高表達與患者低生存率相關,表明其作為生物標志物和治療靶點的潛在用途。該研究于2023年4月發表在《Nature Communications》,IF:16.6。
技術路線











主要研究結果
1. LncRIM調節鐵代謝和乳腺癌進展
本研究結果表明,細胞鐵水平降低導致YAP失活(圖1a)。為證實這一結果,使用Calcein-AM評估用空載體、YAP、活性YAP突變體(YAP-5SA)或無活性YAP突變體(YAPS94A)穩定轉染MCF-7細胞中的細胞鐵水平。結果表明,YAP和YAP-5SA過表達顯著增加鐵水平,而YAP-S94A沒有發揮這種作用(圖1b,c)。此外,如圖1d,e所示,YAP激活與癌癥鐵水平呈正相關,表明Hippo通路在細胞鐵代謝中的潛在作用。
作者根據相關數據庫確定了YAP1依賴性轉錄可能需要的40個lncRNA。然后用鐵螯合劑去鐵胺(DFO)處理MCF-7細胞以降低細胞內鐵水平,或用檸檬酸鐵銨(FAC)增加胞內鐵含量(圖1f)。如圖1g所示,FAC處理促進幾種lncRNA表達,而DFO處理顯著降低幾種lncRNA水平,這表明響應FAC和DFO刺激的lncRNA可能參與癌細胞鐵代謝穩態。作者發現,敲低LncRIM(一種與鐵代謝相關的lncRNA)可顯著降低細胞鐵水平(圖1h)。鑒于LncRIM與腫瘤抑制Hippo信號通路相關性,作者接下來研究LncRIM和癌癥發展之間的功能關系。結果與對照組相比,LncRIM在腫瘤組織中高度表達(圖1i)。此外,在獨立隊列中,LncRIM高表達與癌癥患者低生存率相關(圖1j)。這些數據表明LncRIM在癌癥發展中起重要作用。
作者檢測LncRIM是否協調細胞鐵代謝以誘導乳腺癌進展。構建LncRIM過表達或敲低的MCF-7和MDA-MB-468細胞系。如圖1k、l所示,敲低LncRIM可顯著降低細胞鐵水平,而過表達LncRIM則可增加細胞鐵水平。如圖1m所示,FAC刺激部分逆轉LncRIM沉默的MCF-7和MDA-MB-468細胞中減弱的細胞增殖和細胞周期停滯。LncRIM過表達部分降低DFO對細胞增殖的抑制作用(圖1n)。這些數據表明,鐵穩態對LncRIM調節細胞增殖和存活很重要。
細胞鐵代謝受與鐵吸收、儲存和排泄相關基因調節(圖1o)。通過RT-qPCR評估LncRIM敲低或過表達后這些基因的表達變化,結果顯示,LncRIM敲低細胞系中,TFR1和DMT1表達顯著降低,而LncRIM過表達增加這些基因的表達(圖1p)。此外,LncRIM主要定位于細胞質(圖1q)。這些數據揭示了新發現的胞質lncRNA—LncRIM,它在細胞鐵代謝和乳腺癌發展中起關鍵作用。

圖1:LncRIM調控鐵代謝與乳腺癌進展
2. LncRIM與NF2互作使LATS1激酶失活
作者使用MCF-7細胞裂解物進行RNA pull-down,檢測Hippo通路中可能參與LncRIM相關鐵代謝過程的潛在蛋白。他們發現有義LncRIM與NF2結合,NF2是Hippo-YAP信號通路上游重要的膜-細胞骨架支架(圖2a)。此外,用重組NF2進行RNA-蛋白質結合測定驗證了LncRIM和NF2之間直接的相互作用(圖2b,c)。用表達SFB-NF2的MCF-7細胞進行RNA免疫沉淀(RIP),結果顯示LncRIM與NF2直接互作(圖2d)。這些數據表明LncRIM可能通過NF2相關機制調節細胞鐵代謝。
如RNA熒光原位雜交(FISH)所示(圖2e,f),LncRIM和NF2共定位于細胞膜。作為腫瘤抑制因子,NF2與激酶LATS1互作并將其募集到質膜,導致LATS1磷酸化和胞質內YAP滯留。接下來,作者評估LncRIM對NF2和LATS1互作以及LATS1向質膜募集的影響。如圖2g、h所示,LncRIM過表達顯著減少NF2和LATS1之間的互作,而LncRIM敲低顯著增加NF2-LATS1的相互作用。免疫熒光(IF)和亞細胞分級證實LncRIM降低NF2誘導的LATS1膜易位(圖2i-k)。此外,作者構建了兩個NF2缺失突變體并進行蛋白純化(圖2l)。co-IP結果顯示,C-末端結構域(CTD)-缺失的NF2突變體與野生型NF2同樣有效結合LncRIM,而FERM結構域缺失的NF2突變株與LncRIM沒有發生結合(圖2m)。通過構建具有三個不同截短環的LncRIM突變體(S1突變體由1-580堿基組成,S2突變體由581-893堿基組成,S3突變體由894-1113堿基組成),發現LncRIM S1截短對LncRIM-NF2相互作用至關重要(圖2n)。此外,S1結構域環恢復顯著抑制LncRIM沉默的細胞中LATS1和NF2之間的結合,顯示與全長LncRIM作用相似結果(圖2o)。
然后作者評估LncRIM-NF2軸在細胞鐵代謝中的功能。他們發現全長LncRIM或S1截短環過表達充分恢復LncRIM沉默細胞中的細胞鐵水平(圖2p)。此外,在LncRIM缺失細胞中敲低NF2部分恢復YAP激活、DMT1和TFR1表達以及細胞鐵水平(圖2q,r)。這些數據闡明了一種新機制,通過該機制,LncRIM與NF2直接結合來抑制NF2-LATS1相互作用并調節細胞鐵代謝(圖2s)。
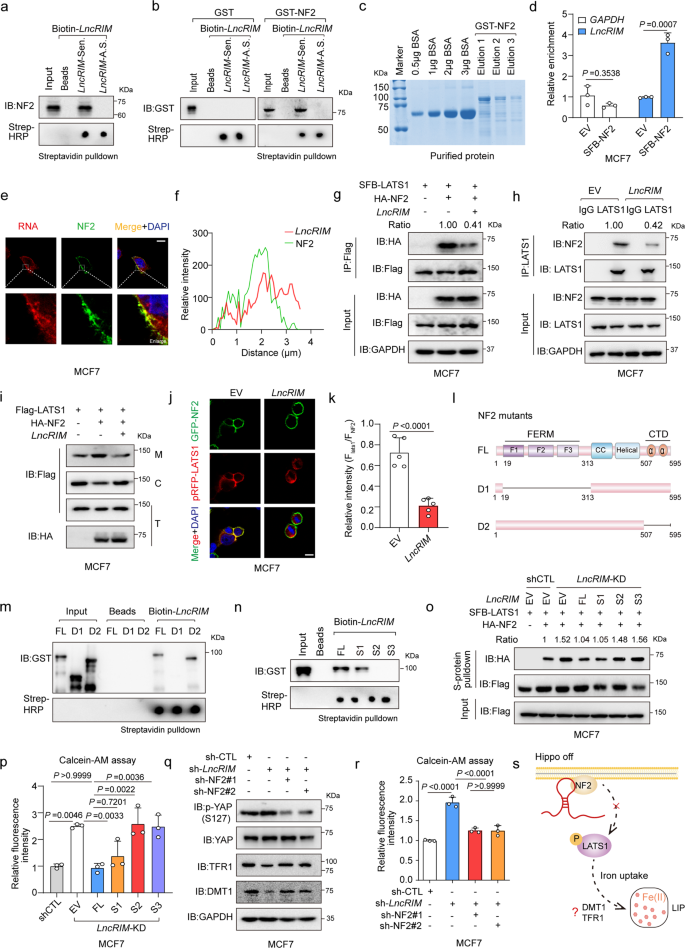
圖2:LncRIM與NF2互作抑制LATS1激酶
3. LncRIM依賴Hippo-YAP通路調節鐵代謝
接下來,作者研究LncRIM-NF2軸介導的細胞鐵代謝與Hippo-YAP通路之間的聯系。作者發現當LncRIM過表達,LATS1在Ser909和Thr1079以及YAP在Ser127磷酸化降低,DMT1和TFR1表達增加;相反,LncRIM敲低則觀察到相反的結果(圖3a,b)。與對照細胞結果相反,YAP沉默的MCF-7細胞中LncRIM過表達沒有促進DMT1和TFR1表達或是增加鐵水平(圖3c-f)。而YAP的再表達顯著恢復DMT1和TFR1以及YAP靶基因的表達,且表達水平與LncRIM過表達誘導結果相似,細胞鐵水平同樣得到恢復(圖3g,h)。這些發現表明Hippo通路在LncRIM-NF2軸介導的細胞鐵代謝調節中發揮重要作用。
先前有研究報道,TFR1是YAP的下游靶標。為確定YAP是否直接調節DMT1轉錄,使用GEO數據庫(GSE107013)分析DMT1啟動子,并鑒定一個YAP/TEAD4結合位點(圖3i)。熒光素酶報告基因和染色質免疫沉淀(ChIP-PCR)結果顯示YAP直接與DMT1啟動子結合(圖3j)。此外,DMT1啟動子中YAP/TEAD結合位點(CATTCT)的缺失顯著減弱YAP-5SA誘導的DMT1啟動子螢光素酶活性(圖3k)。這些結果表明DMT1是YAP的直接轉錄靶點。
DMT1 mRNA編碼四種不同的亞型。在所有亞型中,DMT1亞型1(含鐵應答元件(IRE)的變異體)在MCF-7和MDA-MB-468細胞中高度表達。先前研究報道,細胞鐵穩態在很大程度上由鐵調節蛋白(IRP)/ IRE系統控制。IRP2已被證明可調節乳腺癌中的鐵穩態。因此,作者在先前報道的IRP2系統基礎上比較細胞鐵代謝中LncRIM-NF2軸的激活。如圖3l,m所示,敲低IRP2顯著降低DMT1和TFR1表達,然而,LncRIM和YAP過表達仍然部分挽救DMT1和TFR1表達以及IRP2敲低后的細胞鐵水平。上述數據共同表明,LncRIM-NF2軸在細胞鐵代謝中發揮重要作用,其方式可能與經典的IRP/IRE系統不同。
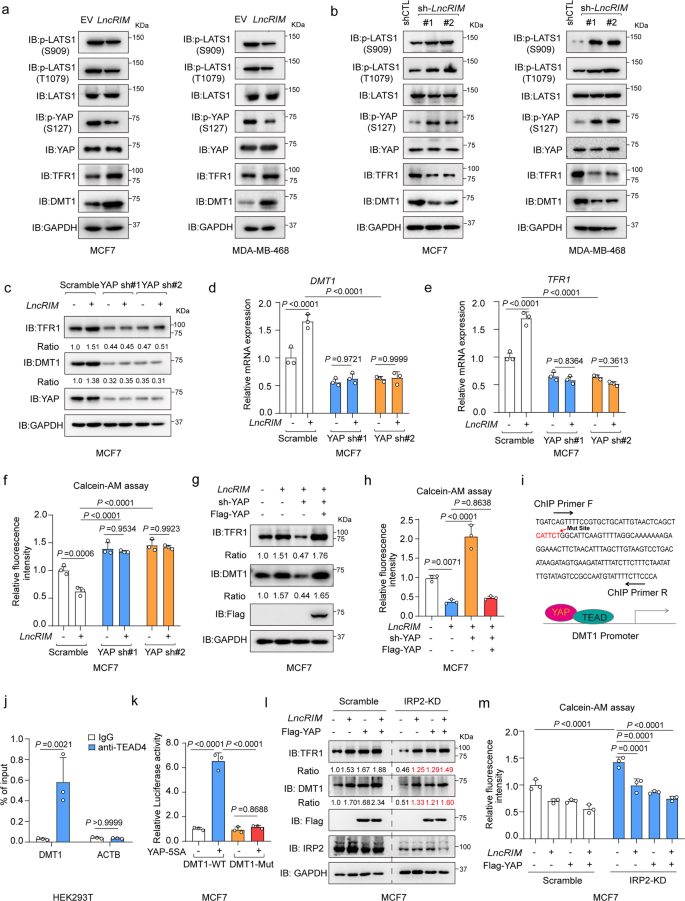
圖3:LncRIM以Hippo-YAP通路依賴方式調控鐵代謝
4. 鐵觸發的LncRIM-NF2反饋回路過度激活YAP
在本研究中,LncRIM被證明對鐵刺激有反應,并調節Hippo信號通路(圖1g和3a,b)。為進一步探索細胞鐵水平對Hippo通路的潛在影響,作者用FAC或DFO刺激MCF-7細胞和MDA-MB-468細胞一定時間。FAC刺激后,YAP和LATS1磷酸化顯著降低,而DFO刺激增加LATS1和YAP磷酸化水平(圖4a)。如圖4b所示,較低濃度的FAC顯著降低YAP和LATS1磷酸化,而較高濃度的鐵則恢復這些蛋白的磷酸化水平。作者還發現FAC或DFO刺激后,LncRIM表達與YAP激活變化一致(圖4c,d)。熒光素酶報告基因和ChIP-PCR檢測結果顯示(4e,f),YAP/TEAD顯著提高LncRIM啟動子螢光素酶活性,并直接與LncRIM啟動子結合。提示LncRIM Hippo在細胞鐵代謝中潛在的反饋回路。
此外,作者發現FAC處理顯著增強LncRIM和NF2的相互作用,并減少NF2與LATS1結合(圖4g,h),這表明鐵觸發的LncRIM在鐵誘導Hippo-YAP信號通路激活的調節中起關鍵作用。考慮LncRIM-NF2軸對鐵激活的反饋回路,作者用FAC處理對照、LncRIM敲低和LncRIM過表達的MCF-7和MDA-MB-468乳腺癌細胞。結果顯示,FAC處理部分恢復LncRIM沉默誘導的YAP和LATS1磷酸化,進一步增強LncRIM過表達時YAP的激活(圖4i,j)。此外,IF結果顯示,敲低LncRIM導致YAP在細胞質中發生隔離,而FAC刺激在很大程度上改善YAP向細胞核的遷移(圖4k,l)。總之,這些數據證實鐵觸發的LncRIM-NF2反饋回路過度激活YAP以促進細胞增殖。
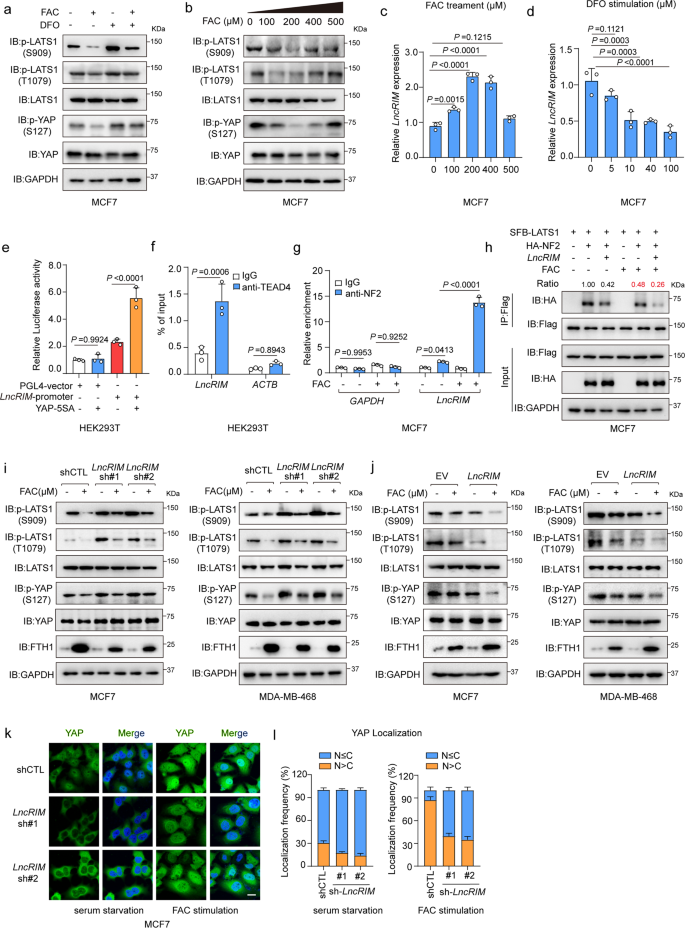
圖4:鐵觸發的LncRIM-NF2反饋回路過度激活YAP
5. LncRIM-YAP軸介導的鐵代謝促進腫瘤進展
接下來,作者研究LncRIM-YAP鐵代謝軸在體內腫瘤發生中的作用。LncRIM敲低抑制了異種移植物腫瘤的大小和重量(圖5a-c),并顯著降低細胞增殖,如Ki67和YAP表達降低(圖5d)。此外,敲低LncRIM損害血管生成,如CD31(一種內皮細胞標記物)染色強度降低,以及降低細胞鐵含量,如增強的DAB鐵染色(圖5d,e)。此外,免疫印跡和免疫組織化學(IHC)染色結果顯示,在LncRIM沉默的腫瘤中,DMT1和TFR1表達均降低,LATS1和YAP磷酸化水平升高,YAP下游靶標表達降低(圖5f,g)。這些結果表明LncRIM介導的腫瘤進展與細胞鐵代謝呈正相關。
為進一步驗證LncRIM介導的細胞鐵代謝與腫瘤生長之間的相關性,作者構建LncRIM過表達和LncRIM過表達的DMT1和TFR1雙敲低細胞系,隨后將每個細胞系直接注射裸鼠。如圖5h–k所示,敲低DMT1和TFR1導致LncRIM介導的異種移植腫瘤生長顯著降低,且這種降低伴隨著細胞鐵水平以及Ki67和YAP表達降低(圖5j,k)。這些結果在一定程度上證明LncRIM-NF2軸通過上調細胞鐵代謝促進細胞增殖和乳腺癌生長。
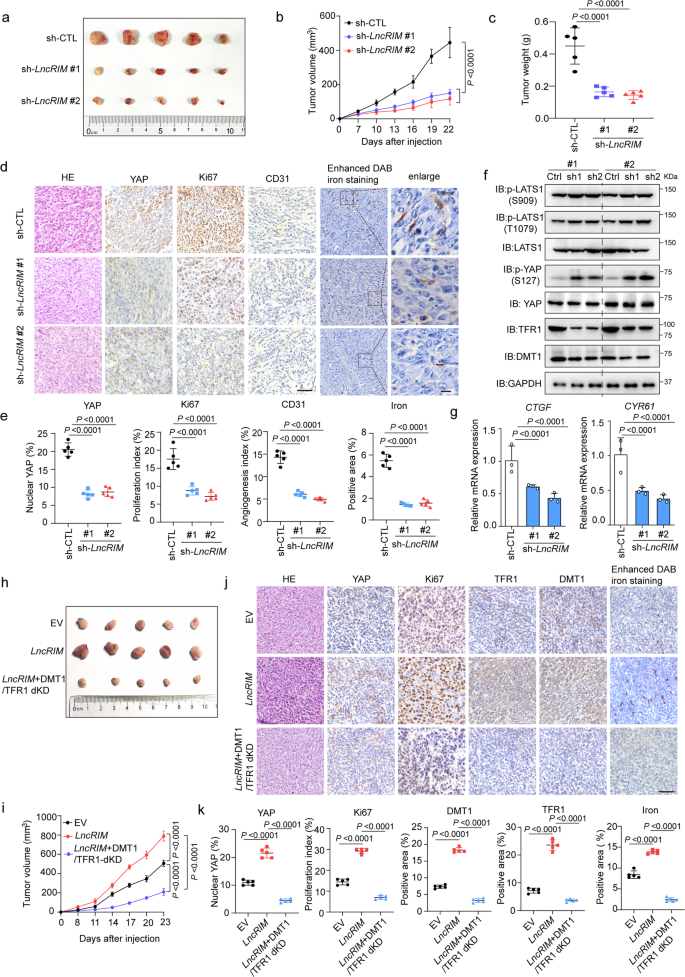
圖5:LncRIM-YAP軸介導的鐵代謝促進腫瘤進展
6. LncRIM高表達與癌癥患者臨床結果不良相關
LncRIM與YAP密切相關,可促進鐵代謝重編程和腫瘤生長,因此也可能在病理上參與了乳腺癌發展。為驗證這一假設,作者使用RT-qPCR檢測LncRIM在癌組織隊列中的表達,將這些數據分為LncRIM-低組和LncRIR-高組,并通過IHC進一步檢測其與增殖、血管生成和鐵代謝的相關性。如圖6a,b所示,LncRIM高表達與Ki67和CD31呈正相關,它們分別是增殖和血管生成的標志物。在癌癥中,LncRIM高表達與YAP、DMT1和TFR1表達以及細胞鐵水平增加呈正相關(圖6a)。用Perl藍對鐵和免疫細胞標記物CD45進行雙重染色,結果顯示LncRIM介導的鐵水平變化主要位于乳腺癌細胞(圖6a)。
此外,在乳腺癌患者樣本中,LncRIM表達與YAP靶基因(包括CTGF、CYR61、DMT1和TFR1)呈正相關(圖6c,d)。DMT1和TFR1在乳腺癌組織中的表達顯著高于對照組(圖6e,f),且獨立隊列中DMT1和TFR1高表達與乳腺癌患者低生存率相關(圖6g,h)。這些數據表明LncRIM-NF2-DMT1/TFR1軸可能成為癌癥臨床治療靶點(圖6i)。
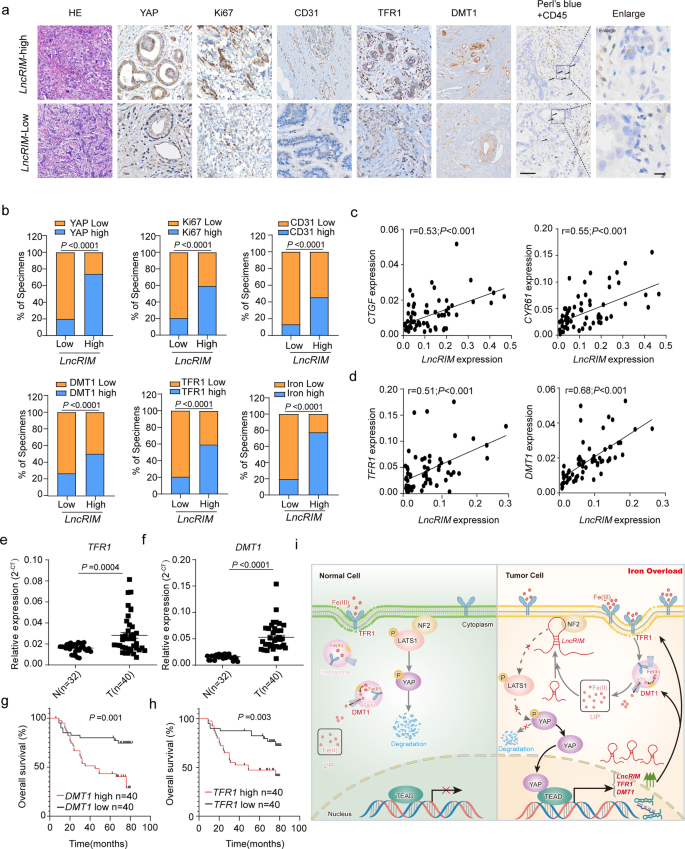
圖6:LncRIM高表達與乳腺癌患者臨床結果不良相關
結論
本研究揭示了一種新的鐵代謝相關機制,其中LncRIM直接結合NF2觸發YAP激活,然后促進DMT1和TFR1表達,最終提高細胞鐵水平并促進癌細胞增殖。此外,作者證明LncRIM-Hippo軸以獨立于IRP2的方式發揮作用,并引起與IRP2類似的生物學效應,包括增加DMT1和TFR1表達以及細胞鐵水平。作者還驗證了鐵觸發的LncRIM-NF2反饋回路,該回路反過來過度激活YAP。
實驗方法
RNA pull-down,RT-qPCR,敲低細胞系和過表達細胞系構建,RIP,免疫熒光,ChIP-PCR,WB,IHC,免疫熒光染色,重組蛋白表達及純化,熒光素酶報告基因系統構建
參考文獻
He XY, Fan X, Qu L, Wang X, Jiang L, Sang LJ, Shi CY, Lin S, Yang JC, Yang ZZ, Lei K, Li JH, Ju HQ, Yan Q, Liu J, Wang F, Shao J, Xiong Y, Wang W, Lin A. LncRNA modulates Hippo-YAP signaling to reprogram iron metabolism. Nat Commun. 2023 Apr 20;14(1):2253. doi: 10.1038/s41467-023-37871-5. PMID: 37080959; PMCID: PMC10119135.






