“中性粒細胞胞外陷阱”+“心肌細胞”助力房顫研究
心房顫動(房顫)是一種常見的心律失常,與心血管疾病的發病率和死亡率有關。中性粒細胞胞外誘捕網(NETs)是中性粒細胞釋放的具有胞漿蛋白的DNA片段,參與多種心血管疾病。為了闡明NETs在AF中的作用,作者研究了NETs對AF進展的影響以及NETs在AF中的分泌情況。結果表明:NETs誘導了心肌細胞的自噬凋亡,NETs還通過促進線粒體去極化和ROS產生導致線粒體損傷。持續的快速起搏導致心肌細胞結構喪失,并提供強有力的刺激誘導中性粒細胞分泌NETs。同時,AF中增加的AngⅡ通過上調AKT磷酸化促進NETs形成,但由于未誘導自噬,AngⅡ不能直接啟動NETosis。在體內實驗中,脫氧核糖核酸酶I被用來抑制NETs的形成,AF相關的纖維化也得到了預期的改善。相應地,誘發AF的持續時間減少。作者的研究闡明了NETs在AF中的形成機制,并證明了NETs通過誘導線粒體損傷和自噬性細胞死亡對心肌細胞的致死作用,這全面描述了NETs和心肌細胞分泌的刺激組成的正反饋維持AF和AF相關纖維化的進展。本研究于2023年7月發表于雜志《Signal Transduction and Targeted Therapy》上,IF:39.3。
技術路線
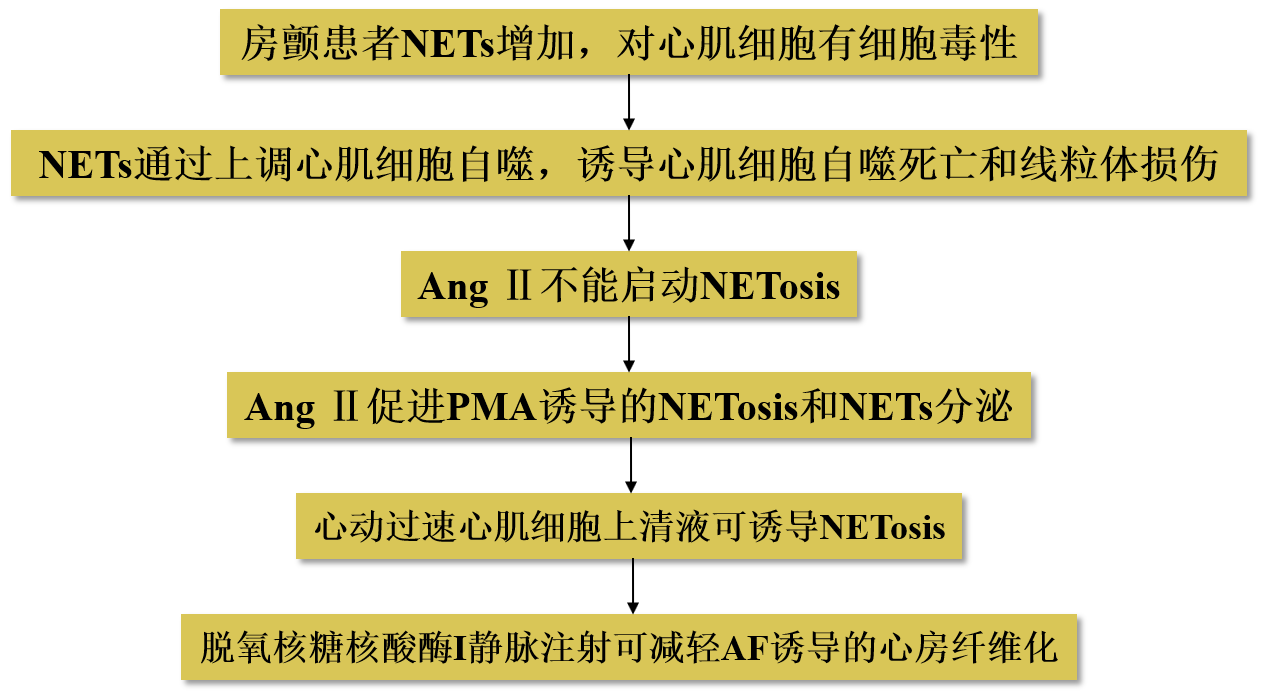
主要研究內容
1、NETs與房顫有關
為探討NETs與AF的可能關系,作者首先收集了AF或竇性心律(SR)患者的外周血。采用抗髓過氧化物酶(MPO)捕獲抗體和抗dsDNA檢測抗體的復合酶聯免疫吸附試驗(ELISA)測定NETs的相對濃度。如預期的那樣,AF患者外周血NETs水平顯著高于SR患者(圖1a)。同時比較左心耳組織勻漿中NETs濃度,也觀察到類似的趨勢(圖1b)。在AF患者冠狀靜脈竇口處采集冠狀動脈血液,并與外周血中NETs濃度進行比較。有趣的是,血液通過冠狀動脈循環后NETs水平降低(圖1a)。因此,作者推測NETs可能在冠狀動脈血管中充血,這與心肌梗死(MI)的情況類似。為驗證這一假設,在左心耳切面進行了免疫熒光染色,以識別和定位NETs,表明AF患者左心耳和冠狀動脈血管中NETs的形成(圖1c)。然而,與MI后NETs主要集中在冠狀動脈血管不同,AF中的NETs也分布于冠狀動脈血管外(圖1d)。
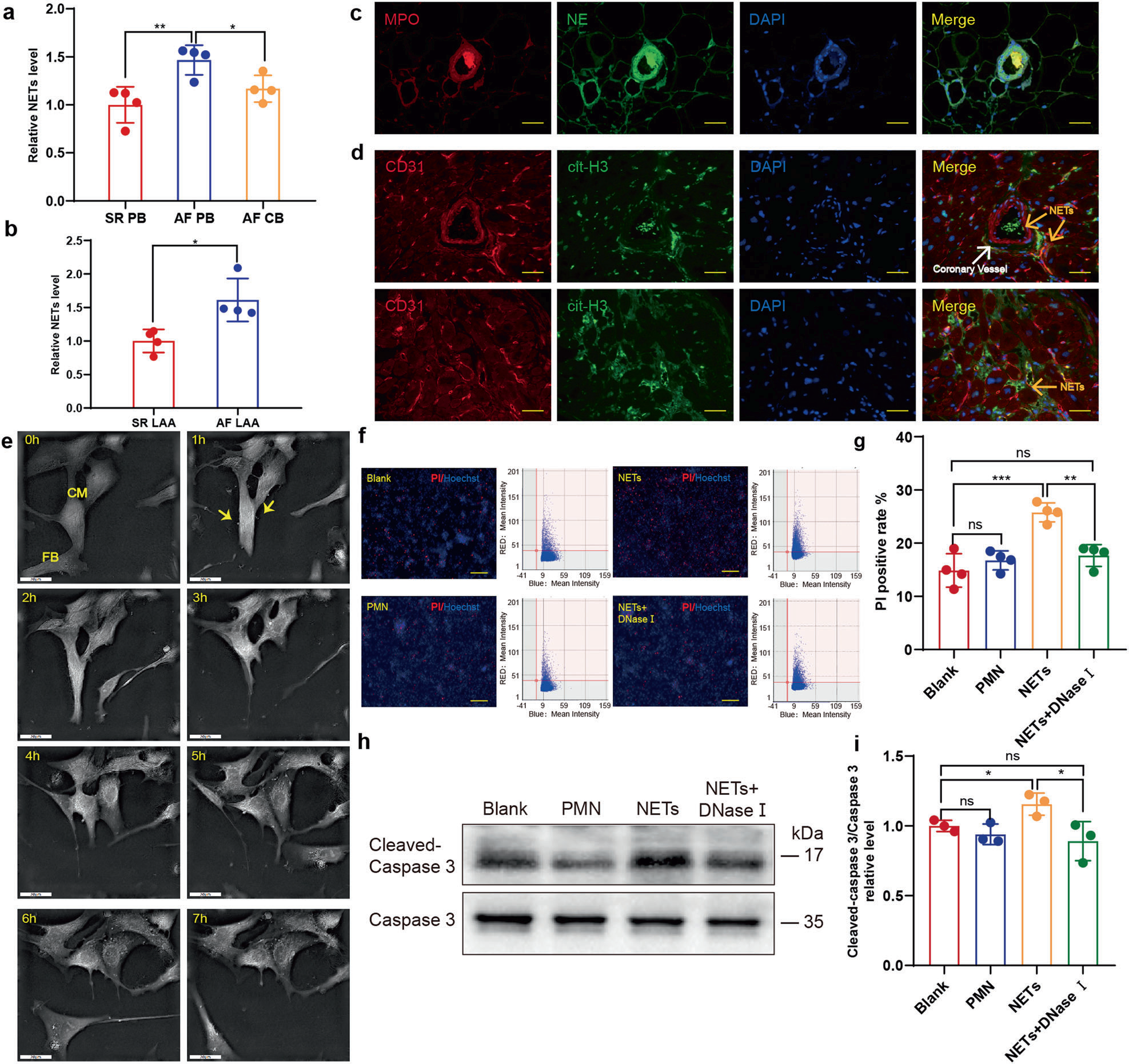
圖1 房顫患者NETs增加,對心肌細胞有細胞毒性
2、NETs通過促進自噬導致心肌細胞凋亡
作者之前報道,NETs單獨激活Smad和MAPK信號通路,進一步誘導成纖維細胞向肌成纖維細胞分化。考慮到心臟重塑所必需的心肌細胞的丟失以及NETs含有豐富的細胞毒性蛋白酶,作者進一步研究了NETs對心肌細胞是否具有毒性。在Nanolive 3D-全息顯微鏡下,作者連續監測了與NETs孵育的心肌細胞,在心肌細胞中觀察到萎縮和核周顆粒增加(圖1e)。由于一些原代心肌細胞可能無法粘附在板上并發生凋亡,因此細胞殘留經常被發現粘附在正常的細胞上。而在流式細胞術中,附著的殘留物可能導致貼壁細胞的誤判。為更精確地識別死亡的心肌細胞,通過Celigo全視野分析代替碘化丙啶(PI)和Hoechst染色的聯合染色。正如預期的那樣,在NETs孵育的孔中PI陽性率升高(圖1f,g),WB檢測發現cleaved caspase3 / caspase 3的類似趨勢,進一步得到支持(圖1h,i)。這些結果表明NETs對心肌細胞的細胞毒性作用。
NETs孵育后,心肌細胞核周顆粒明顯增多。由于在自噬過程中增加的溶酶體也會遷移到核周區域,作者進一步研究了自噬是否可能參與了NETs誘導的細胞死亡。19免疫熒光染色顯示,與NETs孵育后,自噬水平上調(圖2a)。相應地,p62和Beclin-1的蛋白水平也增加了(圖2b , c)。為了進一步研究NETs是否誘導心肌細胞自噬性死亡,使用3甲基腺嘌呤(3-MA)阻斷自噬。如預期的那樣,3-MA部分削弱了增加的cleaved caspase3(圖2d , e)。通過PI染色和Celigo分析(圖2f , g)也驗證了3-MA對NETs誘導的心肌細胞凋亡的保護作用。

圖2 NETs通過上調心肌細胞自噬,誘導心肌細胞自噬死亡和線粒體損傷
3、NETs通過促進線粒體去極化和活性氧的產生而導致線粒體損傷
由于線粒體是心肌細胞收縮所必需的能量供應,而功能失調的線粒體產生過量的活性氧(ROS)可以促進死亡,因此分析了NETs對心肌細胞線粒體的影響。心肌細胞中腫脹的線粒體與NETs孵育后顯著增加(圖2h)。為進一步闡明NETs對線粒體的損傷作用,分別使用JC-1和MitoSOX比較線粒體膜電位和線粒體ROS(mtROS)的產生。正如預期的那樣,NETs導致線粒體膜電位去極化(圖2i,j)。心肌細胞經NETs孵育后,線粒體ROS生成也增加(圖2k,l)。
4、僅Ang II不能直接啟動NETosis
炎癥可以促進AF的進展,反過來,AF又可以促進炎癥。然而,與MI相比,AF相關的炎癥反應較弱,其中豐富的促炎細胞因子和氧化劑誘導NETosis。除了炎癥相關的刺激外,其他分子也普遍存在誘導NETosis的能力。Akt是NOX依賴的NETosis所必需的,在NETosis過程中,Akt的磷酸化水平上調。既往研究表明,AF中AngⅡ升高可誘導心臟重構,而Akt的磷酸化可被AngⅡ1型(AT1)/受體信號通路激活而上調。與之前的報道類似,作者發現在AF患者的外周血中Ang II升高(圖3a)。Chrysanthopoulou等報道0.1 nM AngⅡ以ROS /自噬依賴的方式顯著誘導NETosis。然而,作者的結果表明AngⅡ誘導細胞凋亡而不是NETosis。作者首先通過SYTOX Green染色和Celigo全視野分析比較了中性粒細胞與Ang II共孵育后NETs的分泌情況,發現中性粒細胞與Ang II共孵育后細胞游離DNA(cell-free DNA,cfDNA)增加(圖3b,c)。然而,在相應的Celigo IF圖片中,缺乏典型的NETs結構(圖3b)。
考慮到死亡細胞的細胞核也可以被SYTOX Green染色,作者進一步測定了cleaved caspase 3的蛋白水平,發現Ang II誘導的中性粒細胞凋亡呈劑量依賴性(圖3d,e)。此外,作者發現AngⅡ也不上調中性粒細胞的自噬(圖3f-h)。
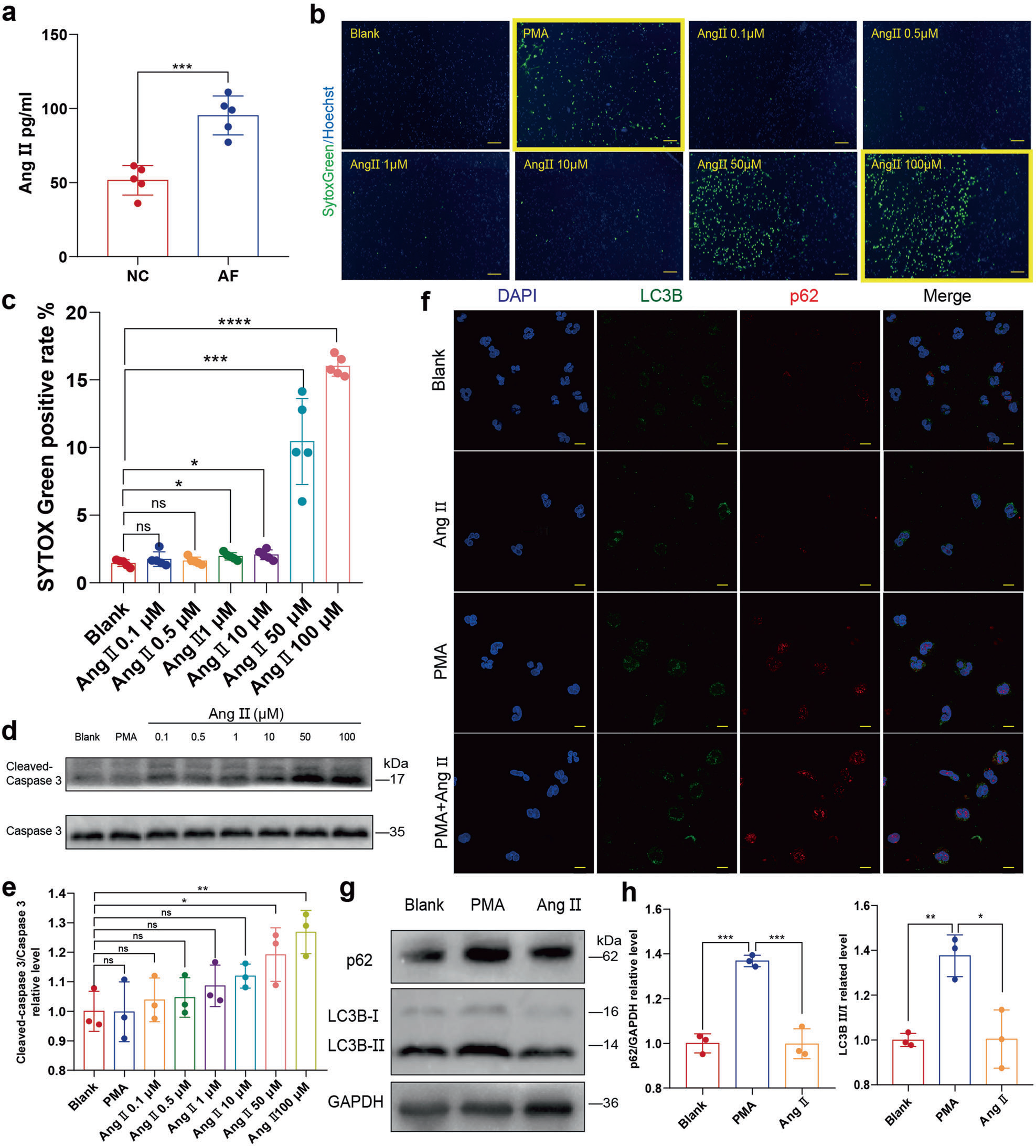
圖3 AngⅡ不能啟動NETosis
5、Ang II促進PMA誘導NETosis
醋酸豆蔻酸鹽二萜醇(PMA),一種常見的佛波酯,強烈誘導中性粒細胞的活化。由于AngⅡ不能直接啟動NETosis,作者接下來研究了AngⅡ對PMA誘導的NETosis的影響。與Ang II立即誘導中性粒細胞凋亡不同,在PMA和Ang II(濃度小于10 μM)孵育的大鼠中性粒細胞中沒有觀察到cleaved caspase 3的增加(圖4a、b)。當PMA和AngⅡ共同孵育時,Akt的磷酸化進一步上調,但與單獨AngⅡ孵育相比,磷酸化Akt的增加并不顯著。在自噬方面,作者發現當中性粒細胞與10 nM PMA和10 μM Ang II共孵育時,LC3BII/I比值上調,然而,較高的Ang II濃度(100 μM)似乎可以逆轉PMA和Ang II單獨孵育的促自噬作用,并以劑量依賴的方式降低LC3BII/I比值。此外,共孵育導致中性粒細胞中更高的ROS產生(圖4c)。似乎當PMA等強刺激超過其抗自噬作用時,AngⅡ可能發揮促NETosis作用。因此,作者推測AngⅡ可能通過間接協同刺激如PMA來促進NETosis,而不是直接啟動這種特殊的細胞死亡。
分離供者外周血中性粒細胞,分別與PMA或PMA +AngⅡ孵育。由于10 μM的AngⅡ沒有誘導明顯的細胞凋亡,因此在后續的實驗中大多采用這一濃度。PMA與AngⅡ共孵育顯著增加SYTOX Green陽性率,比AngⅡ或PMA單獨作用產生的SYTOX Green陽性率增加更顯著(圖4d,e)。通過IF染色進一步研究NETs分泌情況。用PMA刺激中性粒細胞30 min后,細胞核的去濃縮過程正在進行,這在有或沒有Ang II存在的中性粒細胞中都沒有觀察到。同樣,當血管緊張素濃度達到100 μM時,NETs結構也消失,大量分葉狀細胞核(仍為濃縮狀)被染色。此外,單獨加入PMA和單獨加入10 μM Ang II的SYTOX Green計數的平均值遠低于共孵育的SYTOX Green計數,說明Ang II具有促進因子的作用(圖4f,g)。在組蛋白3瓜氨酸化中也觀察到類似的趨勢(圖4h,I)。總體而言,AngⅡ可以促進NETosis,而不是直接啟動NETosis。

圖4 Ang Ⅱ促進PMA誘導的NETosis和NETs分泌
6、速搏新生大鼠心肌細胞上清液可誘導NETosis,其表現為線粒體DNA增加和高流動性組盒1分泌增多
由于單獨升高的AngⅡ并不能誘導NETosis的發生,因此AF中必須存在其他可能的刺激源才能誘導NETosis的發生。Mallavia等報道NETs形成可由線粒體DNA(mitochondrial DNA,mtDNA)觸發,Wiersma等證明心肌細胞在快速起搏后發生線粒體功能障礙。因此,作者推測快節奏的心肌細胞可能通過釋放mtDNA來誘導NETosis。為證明這一假設,作者在乳鼠心肌細胞上進行了如前所述的快速起搏(6 Hz,40 V,10 ms脈沖)作為實驗性AF或正常起搏作為陰性對照(1HZ,40 V,10 ms脈沖),并收集上清。在顯微鏡下連續監測起搏過程,作者發現在電刺激1 h后觀察到結構損傷,心肌細胞沒有從持續的快速起搏中存活(圖5a)。作者首先比較了兩組細胞的cfDNA和mtDNA水平,發現在快速起搏3 h后,細胞上清中的cfDNA和mtDNA水平均升高(圖5b,c)。此外,作為cfDNA一部分的mtDNA比cfDNA增加的幅度更大。除了升高的mtDNA外,作者發現高遷移率族蛋白B1(high mobility group box 1,HMGB1)從細胞核轉位到細胞質也可以被快節奏誘導,這可能是誘發NETosis的潛在能力(圖5d)。
接下來,將分離的大鼠中性粒細胞與佛波酯(PMA)、正常起搏心肌細胞上清液、快節奏心肌細胞上清液、快節奏心肌細胞上清液+ AngⅡ共孵育。大鼠中性粒細胞易分泌云霧狀而非尖刺狀的NETs,且交聯較弱,形成較大的網狀結構,難以通過IF顯微鏡進行識別和定量。因此,本研究采用Celigo全視野分析法,通過SYTOX Green染色胞外DNA來分析NETs分泌情況。如預期的那樣,與快節奏的心肌細胞上清液孵育后,SYTOX Green計數增加,并且在額外給予Ang II的情況下,SYTOX Green計數增加更顯著,這與PMA相似(圖5e,f)。值得注意的是,正常節律的心肌細胞上清降低了NETosis,這表明正常心肌細胞可能分泌某種細胞因子來保護中性粒細胞免受NETosis。

圖5 心動過速心肌細胞上清液可誘導NETosis
7、靜脈注射DNase I可下調NETs形成,改善房顫相關纖維化,縮短房顫持續時間
NETs是以dsDNA為骨架的網狀結構,可被脫氧核糖核酸酶I降解,因此作者研究脫氧核糖核酸酶I是否具有保護作用,是否可以減少AF相關的纖維化和AF持續時間。通過靜脈注射氯化鈣和乙酰膽堿的混合溶液誘導大鼠AF,并記錄心電圖(ECG)以確保誘導成功。每隔一天注射一次,連續注射兩周,同時額外注射脫氧核糖核酸酶I溶液或相同體積的生理鹽水。Western blot檢測大鼠左心房(LA)中的瓜氨酸化組蛋白3(cit-H3),比較大鼠NETs的形成(圖6a、b)。Masson三色染色顯示誘導的AF導致LA中膠原沉積增加,而額外給予脫氧核糖核酸酶I可以緩解這種情況(圖6c,d)。在膠原蛋白I(Col I)、磷酸化Smad2(p-smad2)和磷酸化p38(pp38)的蛋白水平也觀察到類似的趨勢(圖6e,f)。此外,脫氧核糖核酸酶I有效地改善了誘發AF的成功率和持續時間(圖6g)。
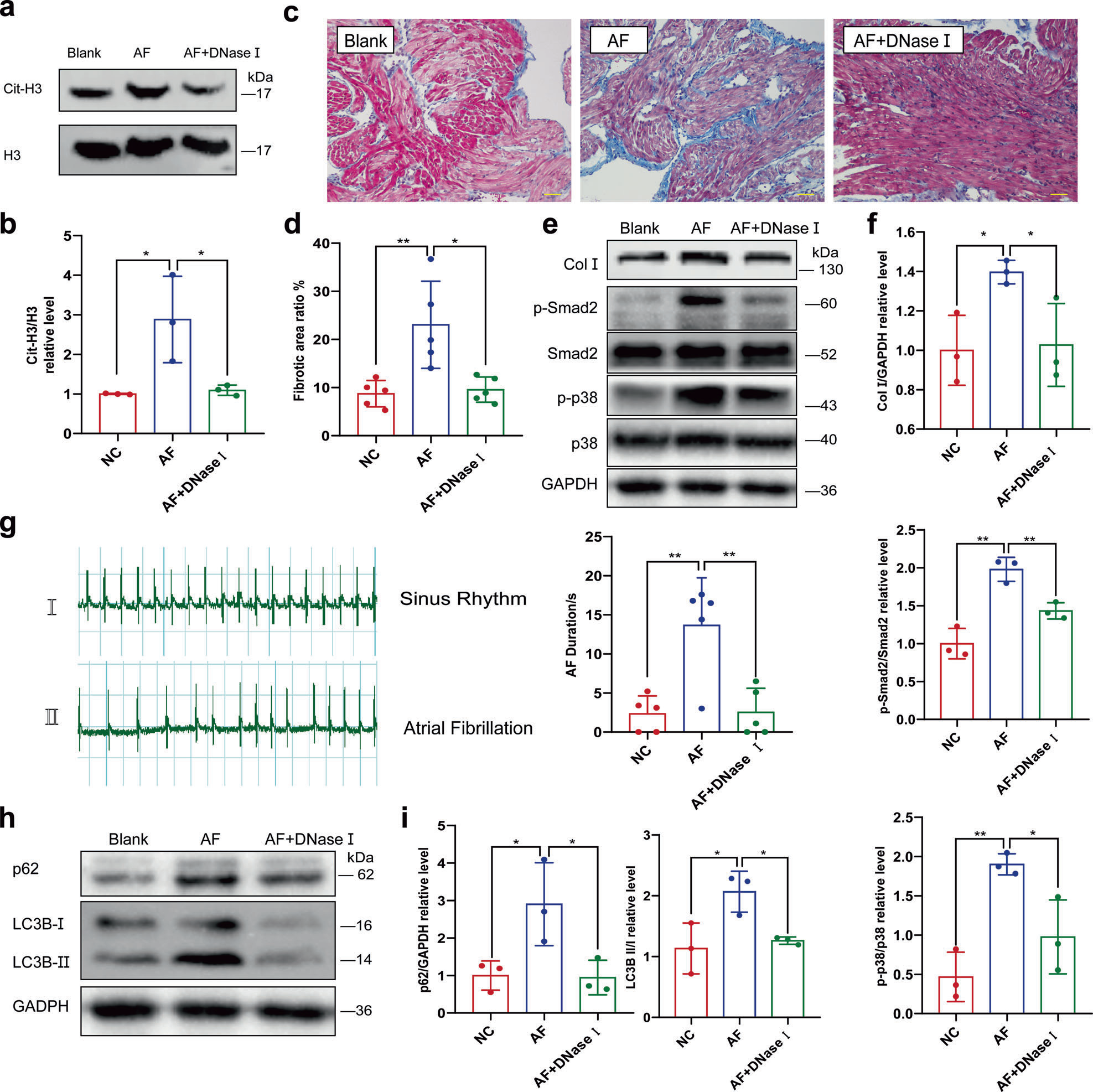
圖6 脫氧核糖核酸酶I靜脈注射可減輕AF誘導的心房纖維化
實驗方法
Specific-pathogen-free(SPF)Sprague-Dawley(SD)大鼠,心肌細胞的分離與培養,大鼠骨髓中性粒細胞的分離,大鼠NETs獲取,人中性粒細胞的分離、培養和處理,活細胞三維全息顯微鏡,Celigo血細胞計數,透射電鏡,線粒體膜電位測定,Western-blot,乙酰-CaCl2致AF大鼠模型
參考文獻
He L, Liu R, Yue H, Zhang X, Pan X, Sun Y, Shi J, Zhu G, Qin C, Guo Y. Interaction between neutrophil extracellular traps and cardiomyocytes contributes to atrial fibrillation progression. Signal Transduct Target Ther. 2023 Jul 26;8(1):279. doi: 10.1038/s41392-023-01497-2. PMID: 37491321; PMCID: PMC10368710.






