NUMA1通過調控ASK1-JNK信號通路調控食管鱗癌細胞凋亡
食管鱗狀細胞癌(ESCC)是世界范圍內常見的惡性腫瘤,由于缺乏治療靶點,其生存率較低。本研究結果表明,NUMA1轉錄物和蛋白水平在ESCC患者樣本中顯著上調,其高表達預示著不良預后。敲低NUMA1可促進細胞凋亡,抑制細胞增殖和集落形成。通過使用細胞源性異種移植(CDX)和患者源性異種移植(PDX)小鼠模型,我們發現沉默NUMA1表達可抑制腫瘤進展。此外,有條件敲除NUMA1可減少4NQO誘導的小鼠食管癌變,進一步證實了NUMA1在ESCC中的致癌作用。機制上,我們通過免疫沉淀實驗發現NUMA1與GSTP1和TRAF2相互作用,促進TRAF2與GSTP1的關聯,抑制TRAF2與ASK1的相互作用,從而調節JNK的持續激活。綜上所述,我們的研究結果表明,NUMA1在ESCC進展過程中發揮重要作用,它通過調節ASK1-MKK4-SAPK/JNK信號通路發揮作用。本文于2023年7月發表于“Cellular and Molecular Life Sciences”(IF=8)上。
技術路線

結果
1)NUMA1在人類ESCC中過表達,并與患者生存能力相關
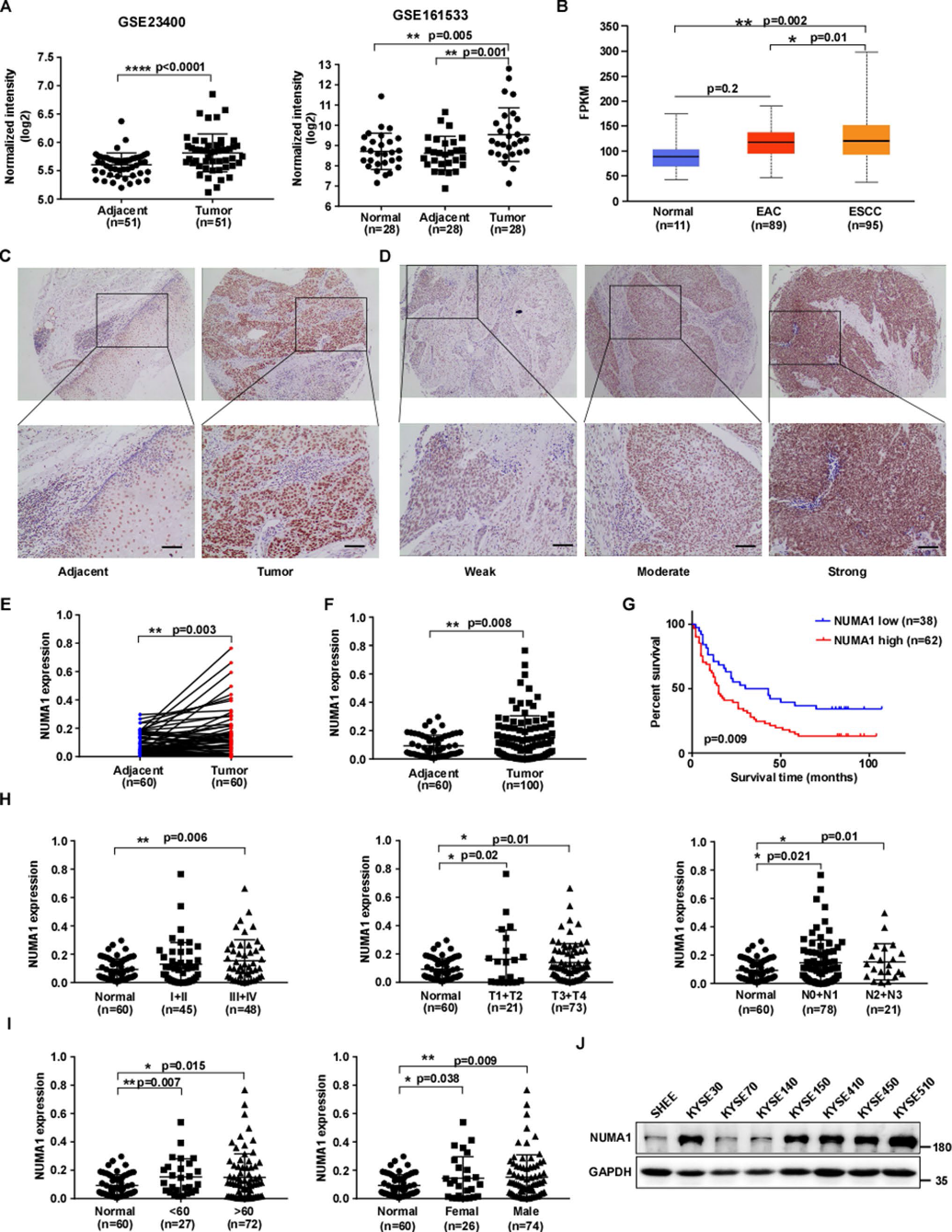
為了探索ESCC的潛在治療靶點,我們利用兩個ESCC微陣列數據集(GSE23400, GSE161533)分析了ESCC中高水平的基因表達。從數據集中,我們發現患者源性ESCC腫瘤組織中NUMA1的mRNA水平顯著上調(圖1A)。接下來,我們使用UALCAN評估TCGA數據庫中的NUMA1表達信息,生物信息學分析結果顯示,NUMA1 mRNA水平在ESCC中顯著上調(圖1B)。為了進一步探討NUMA1在ESCC中的臨床意義,我們通過免疫組織化學染色測量了ESCC組織微陣列中NUMA1的表達。與配對(圖1C-E)和未配對(圖1F)的鄰近組織相比,腫瘤組織中NUMA1的表達明顯升高。生存分析顯示,NUMA1高表達患者總生存期較差,預后不良(圖1G)。臨床關聯分析結果顯示,NUMA1表達與臨床分期、淋巴結轉移、年齡、性別無顯著相關性(圖1H、圖1I)。此外,我們還檢測了NUMA1在不同ESCC細胞系和正常人永生化食管上皮細胞系中的表達。結果顯示,與正常SHEE細胞相比,NUMA1在ESCC細胞系中的表達增加(圖1J)。這些結果表明,NUMA1在ESCC組織中表達上調,預示著ESCC患者預后不良。
2)NUMA1的沉默降低了體外細胞的增殖,延緩了體內腫瘤的生長
為了研究NUMA1在ESCC細胞中的作用,我們構建了針對NUMA1和scramble control的慢病毒shRNA,并感染ESCC細胞。Western blot結果顯示,NUMA1表達明顯降低(圖2A)。在KYSE450、KYSE510和KYSE150細胞中敲除NUMA1后,細胞增殖和集落形成明顯受到抑制(圖2B-D)。此外,我們通過轉染flag-NUMA1質粒,在KYSE30、KYSE150和KYSE410細胞系中過表達NUMA1,并通過Western blot和qPCR證實了其表達(圖2E)。過表達NUMA1顯著增加細胞增殖和集落形成(圖2F-H)。為了進一步探討NUMA1在體內是否能促進腫瘤生長,我們將沉默NUMA1表達或scramble對照的KYSE450細胞皮下注射到裸鼠體內。結果顯示,沉默NUMA1表達可顯著抑制腫瘤在體內的生長(圖2I-K)。與scramble對照組相比,腫瘤生長速度、腫瘤體積和腫瘤重量均明顯降低,但體重無顯著差異(圖2I-K)。此外,在shNUMA1組中,NUMA1的表達顯著降低,SAPK/JNK (Thr183/Tyr185)的磷酸化水平上調(圖2L)。CDX小鼠切除腫瘤的免疫組化染色結果也顯示,NUMA1敲低組的Ki67和NUMA1表達降低,而NUMA1沉默組的SAPK/JNK和c-Jun的磷酸化水平顯著上調(圖2M-N)。總之,這些結果表明,NUMA在ESCC的進展過程中起著至關重要的作用,并與SAPK/JNK (Thr183/Tyr185)的激活有關。

3)沉默NUMA1表達可促進ESCC細胞凋亡和細胞周期阻滯
為了評估NUMA1對細胞凋亡的貢獻,在沉默NUMA1表達后,我們通過TUNEL實驗和膜聯蛋白-V染色檢測細胞凋亡。TUNEL實驗結果顯示,敲除NUMA1表達后,細胞凋亡明顯被誘導(圖3A)。此外,流式細胞術分析結果也顯示,NUMA1敲除細胞組凋亡細胞數量增加(圖3B)。然后,我們通過Western blot檢測促凋亡和抗凋亡標志物的表達。敲低NUMA1可上調cleaved-PARP、cleaved caspase-3和Bim短異構體的表達,下調Bcl-2的表達(圖3C)。接下來,我們在KYSE450和KYSE510細胞中檢測了敲除NUMA1后的細胞周期分布,流式細胞術分析結果顯示顯著誘導G1期阻滯(圖3D)。此外,我們檢測了與細胞周期G1期相關的蛋白的表達,與scramble對照組相比,NUMA1沉默降低了cyclin D1和cyclin D3的表達(圖3E)。這些結果表明,在ESCC中缺乏NUMA1可通過相關生物標志物的調控誘導細胞凋亡和G1細胞周期阻滯。

4)NUMA1條件敲除抑制4NQO誘導的小鼠食管癌變
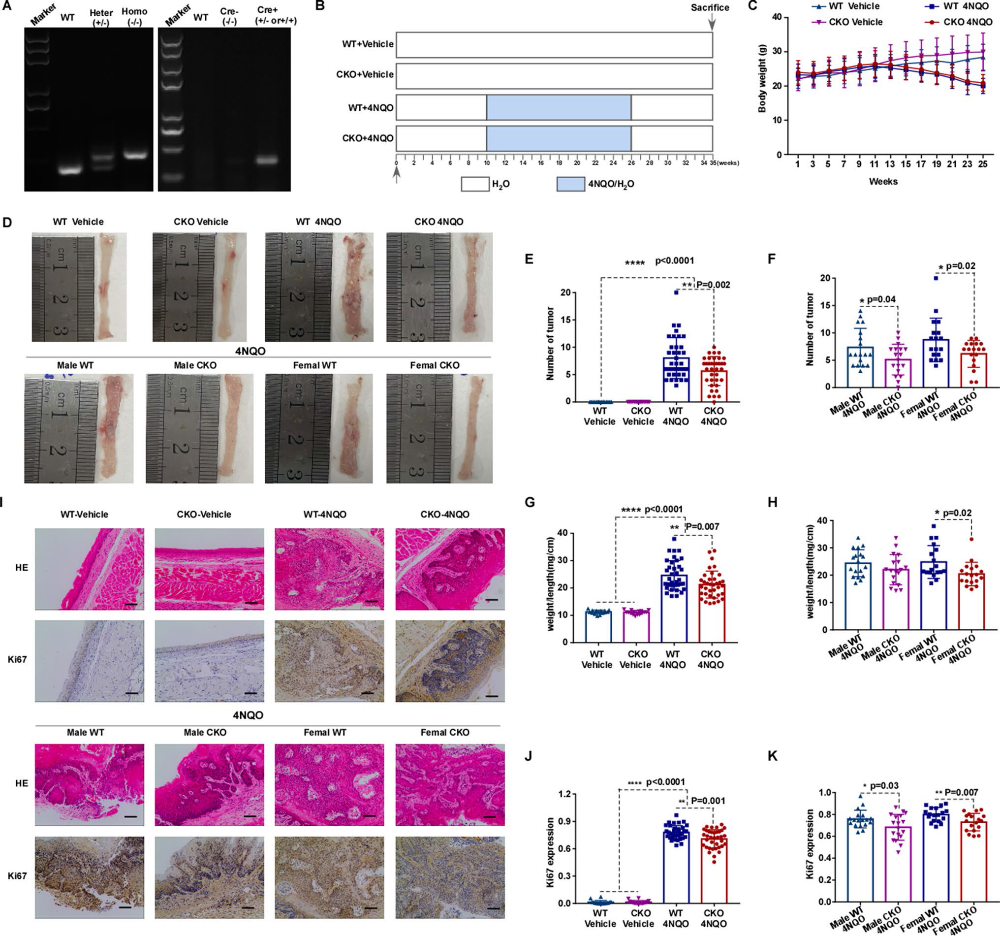
在4NQO誘導的食管癌模型中,我們制備了野生型(WT、flox純合、Cre基因陰性)和NUMA1條件敲除型(CKO、flox純合、Cre基因陽性)小鼠,以確定NUMA1缺失是否能延緩食管癌的發生或腫瘤的進展。首先對NUMA1 flox雜合子(Heter)、flox純合子(Homo)、Cre基因陽性(Cre +)、Cre基因陰性(Cre?)進行PCR基因分型(圖4A)。然后根據原理圖(圖4B)對小鼠進行分組處理。與Vehicle組相比,4NQO處理的小鼠體重明顯減輕(圖4C)。此外,與WT對照組相比,NUMA1 CKO小鼠的腫瘤發生更低(圖4D-F)。WT組的體重與長度之比顯著高于NUMA1 CKO組,尤其是雌性NUMA1 CKO組(圖4G-H)。經4NQO治療后,我們發現WT小鼠食管切片發育不良較CKO組更為嚴重,部分小鼠已發生原位癌和浸潤性癌。與此一致的是,Ki67水平在腫瘤負荷較高的食管組織中高表達(圖4I-K)。這些數據表明,NUMA1作為癌基因,加速ESCC的癌變,促進4NQO誘導的腫瘤發展。
5)NUMA1與GSTP1相互作用,促進GSTP1與TRAF2相互作用
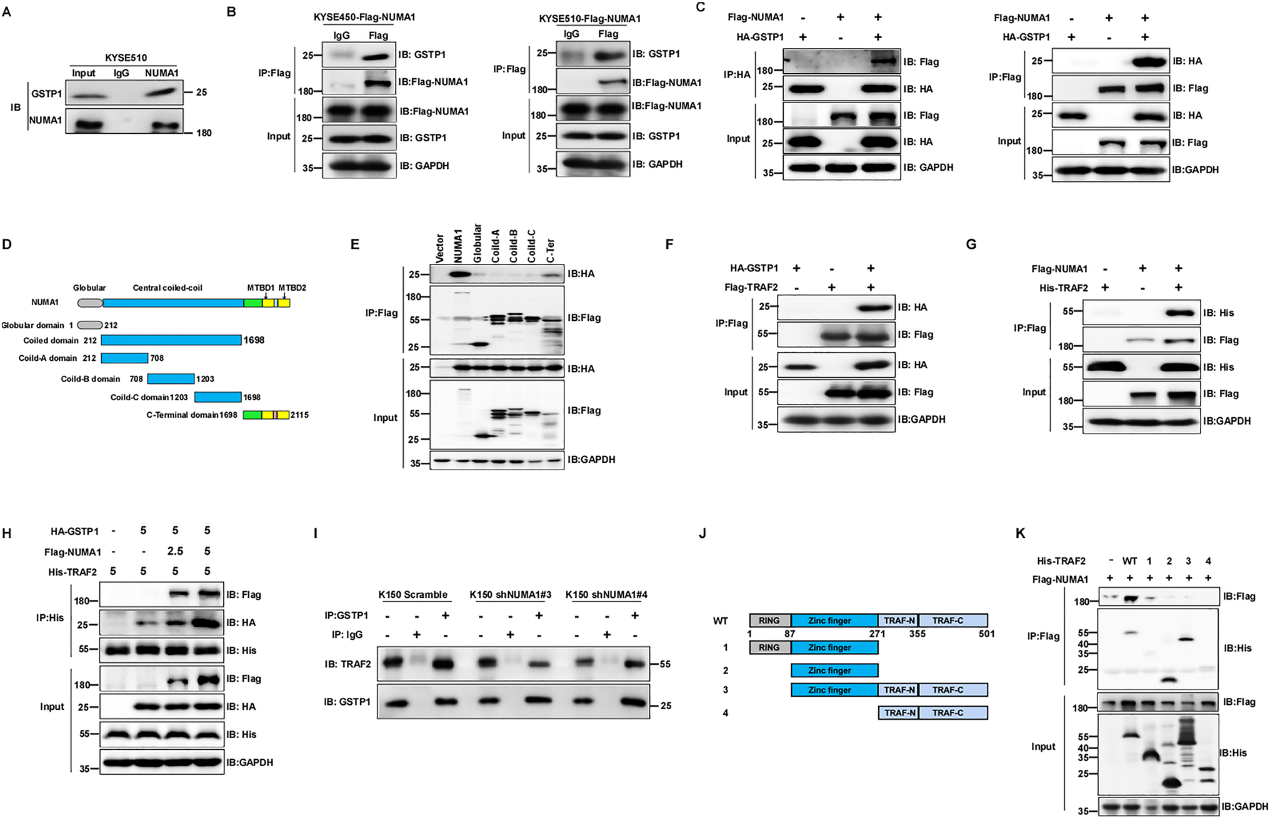
為了確定NUMA1的潛在致癌作用及其分子機制,我們繼續使用co-IP(共免疫沉淀)試驗和LC-MS /MS分析來探索NUMA1在ESCC中的潛在底物。我們發現GSTP1是MS評分最高的蛋白。我們進一步進行了co-IP分析,以確認GSTP1是否與NUMA1相互作用。結果顯示,內源性NUMA1可以在KYSE510細胞中沉淀內源性GSTP1(圖5A)。此外,我們在KYSE450和KYSE510細胞中異位表達NUMA1,co-IP結果顯示Flag-NUMA1可以沉淀內源性GSTP1(圖5B)。我們還在KYSE150細胞中異位表達NUMA1和GSTP1進行了co-IP實驗,發現Flag-NUMA1可以沉淀HA-GSTP,反之亦然(圖5C)。為了鑒定與GSTP1相關的NUMA1結構域,我們構建了一系列Flag標記的NUMA1結構域缺失突變體,如圖5D所示。使用Flag磁性瓊脂糖的co-IP分析結果顯示,NUMA1的c端結構域負責與GSTP1的相互作用(圖5E)。我們通過外源性免疫沉淀證實了GSTP1與TRAF2的相互作用,GSTP1確實與TRAF2相互作用(圖5F)。然后,我們通過外源性免疫沉淀研究了NUMA1是否可以與TRAF2結合。結果顯示,NUMA1與TRAF2相互作用(圖5G)。此外,我們探索了NUMA1與GSTP1結合是否會影響GSTP1與TRAF2的關聯。結果顯示,NUMA1表達的增加促進了TRAF2和GSTP1之間的相互作用(圖5H)。相反,減少NUMA1的表達減少了GSTP1和TARF2之間的內源性聯系(圖5I)。我們進一步研究了TRAF2的哪個結構域可以與NUMA1結合,構建了一系列帶有His標記的TRAF2結構域缺失突變體,如圖5J所示。結果顯示,TRAF2的鋅指基元直接與NUMA1結合(圖5K)。這些發現表明,NUMA1與GSTP1和TRAF2相互作用,并促進TRAF2與GSTP1相互作用。
6)NUMA1通過與TRAF2和GSTP1結合調控ASK1?MKK4?SAPK/JNK信號
以上結果促使我們進一步研究NUMA1對ASK1-MKK4-SAPK/JNK信號通路的調控作用。我們研究了NUMA1的哪個結構域負責與TRAF2結合。Co-IP結果顯示,球狀結構域、c端結構域和部分卷曲結構域與TRAF2相互作用(圖6A)。接下來,我們研究了TRAF2中負責與GSTP1相互作用的結構域。結果顯示,TRAF2的RING finger motif和TRAF結構域都與GSTP1相互作用(圖6B)。我們進一步發現,NUMA1可以顯著下調ASK1免疫沉淀TRAF2的量(圖6C)。而且,NUMA1表達的增加更顯著地降低了TRAF2與ASK1之間的關聯(圖6D)。綜上所述,NUMA1可以促進TRAF2與GSTP1的相互作用,抑制TRAF2與ASK1的相互作用。為了進一步確定NUMA1對ASK1-MKK4-SAPK/JNK信號傳導的影響,我們測量了敲除或過表達NUMA1后ESCC細胞中MKK4和JNK的磷酸化狀態。敲除NUMA1后,MKK4、JNK和c-Jun的磷酸化水平升高,而GSTP1和TRAF2的表達水平沒有變化(圖6E)。相反,KYSE150細胞中過表達NUMA1抑制SAPK/JNK和c-Jun的磷酸化(圖6F)。此外,我們發現MKK4和JNK磷酸化水平顯著下調(圖6G)。NUMA1與TRAF2和GSTP1過表達顯著抑制MKK4和JNK的激活(圖6H)。這些結果表明,NUMA1通過調節TRAF2和GSTP1的相互作用來調節ASK1-MKK4SAPK/JNK信號通路。

7)GSTP1介導NUMA1在ESCC中的致癌作用
為了進一步驗證GSTP1在人ESCC中的功能,我們生成了GSTP1敲除細胞(圖7A),并評估了細胞增殖和集落形成。沉默GSTP1表達可顯著抑制ESCC細胞增殖和集落形成(圖7B-D)。此外,我們檢測了GSTP1敲除后的信號級聯,發現MKK4和JNK磷酸化水平上調(圖7E)。為了研究GSTP1是否介導了NUMA1在ESCC中的致癌作用,我們進行了拯救實驗。轉染載體或flag標記的NUMA1的KYSE30和KYSE150細胞分別被scramble和shGSTP1慢病毒感染(圖7F)。與對照細胞相比,過表達NUMA1顯著增加了細胞的增殖和集落形成,而GSTP1的敲除部分地挽救了這一現象(圖7G, H)。此外,沉默NUMA1表達后細胞增殖和集落形成明顯受到抑制,而GSTP1過表達部分挽救了這種表型(圖7I-K)。綜上所述,這些結果表明GSTP1介導了ESCC細胞中NUMA1的致癌功能。

8)在ESCC患者來源的異種移植小鼠模型中,沉默NUMA1表達延遲腫瘤生長
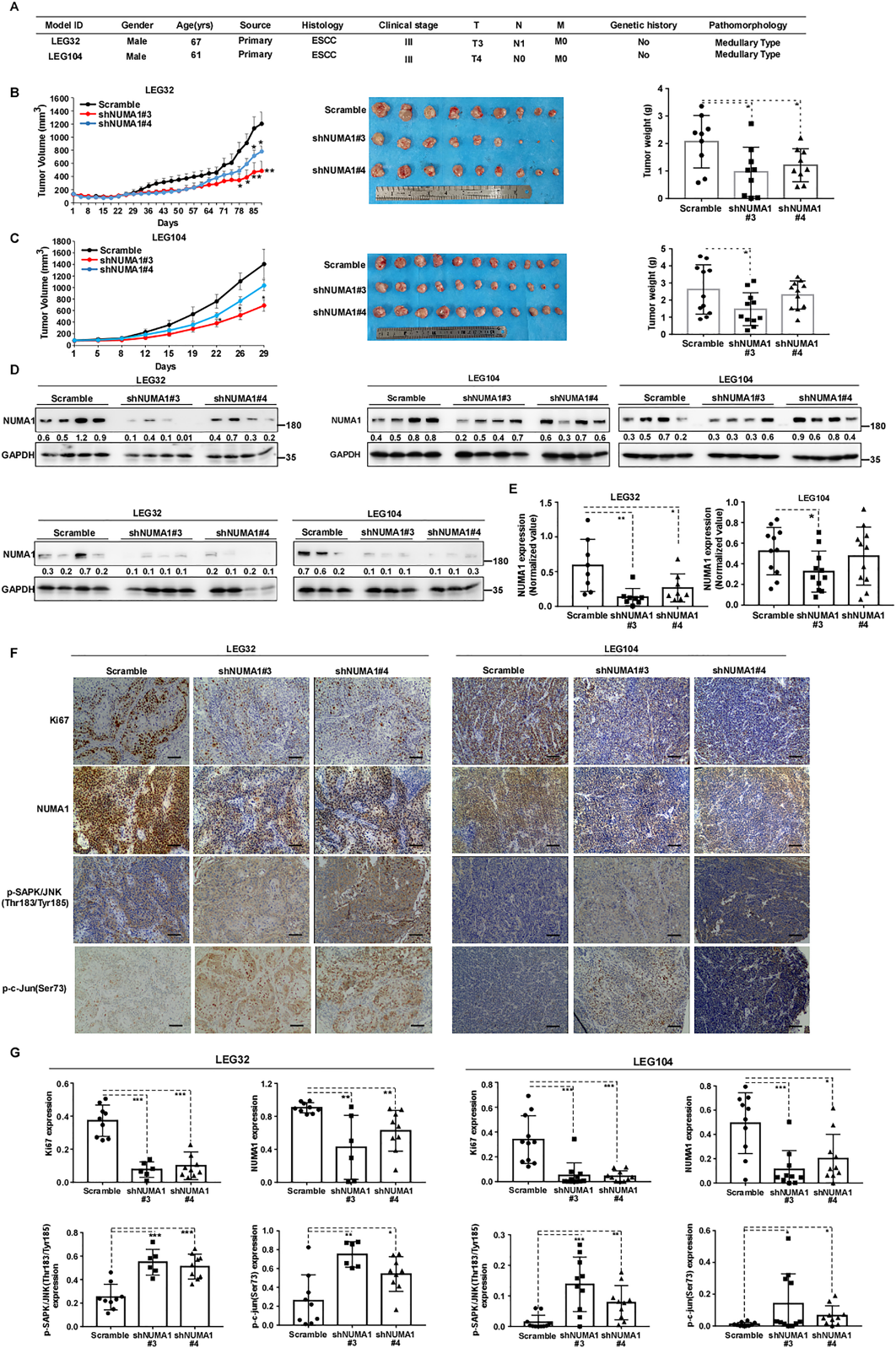
為了進一步評估NUMA1對ESCC體內進展的影響,我們建立了PDX小鼠模型,并進行了慢病毒介導的NUMA1敲除。圖8A結果顯示了LEG32和LEG104的患者特征。敲低NUMA1顯著延緩了腫瘤生長,腫瘤體積和腫瘤重量較對照組顯著下調(圖8B, C)。此外,與scrambled對照組相比,NUMA1的表達明顯下調(圖8D, E)。免疫組化分析結果顯示,NUMA1和Ki67的表達降低,p-SAPK/ JNK (Thr183/Tyr185)和p-c-Jun (Ser73)的表達顯著誘導(圖8F, G)。這些發現表明,抑制NUMA1的表達可延緩ESCC PDX腫瘤的體內生長。
結論
NUMA1通過調節GSTP1、TRAF2和ASK1復合物促進ESCC進展。它可能被認為是ESCC治療的潛在靶點。
實驗方法
MTT試驗,WB,免疫共沉淀,LC–MS/MS,細胞周期分析,凋亡分析,免疫組化,CDX小鼠模型構建,PDX小鼠模型構建。
參考文獻
Yin S, Zhao S, Li J, Liu K, Ma X, Zhang Z, Wang R, Tian J, Liu F, Song Y, Song M, Zhao R, Yang R, Lee MH, Dong Z. NUMA1 modulates apoptosis of esophageal squamous cell carcinoma cells through regulating ASK1-JNK signaling pathway. Cell Mol Life Sci. 2023 Jul 18;80(8):211. doi: 10.1007/s00018-023-04854-0.






