靶向m7G-SLUG/SNAIL軸——在射頻消融不足后阻斷肝細(xì)胞癌轉(zhuǎn)移

射頻熱消融是治療肝細(xì)胞癌(HCC)的理想根治方法。然而,不充分的射頻消融(IRFA)可能會導(dǎo)致肝癌的高復(fù)發(fā)率。在哺乳動物和酵母中,tRNA上的N7 -甲基鳥苷(m7G)是一種進(jìn)化上保守的修飾,可調(diào)節(jié)熱應(yīng)激反應(yīng)和腫瘤進(jìn)展,但它在IRFA后HCC復(fù)發(fā)中的功能仍不清楚。本研究中,作者發(fā)現(xiàn)METTL1 介導(dǎo)的 m7G tRNA修飾在體外和體內(nèi)亞致死熱應(yīng)激下促進(jìn)HCC轉(zhuǎn)移。機(jī)制上,METTL1介導(dǎo)的m7G tRNA修飾以依賴于密碼子頻率的方式選擇性調(diào)控上皮-間充質(zhì)轉(zhuǎn)化(EMT)過程中關(guān)鍵基因SLUG/SNAIL的翻譯。該研究于2023年6月發(fā)表在《Molecular Therapy》,IF:12.4。
技術(shù)路線

主要研究結(jié)果
1. HCC中亞致死熱應(yīng)激促進(jìn)METTL1表達(dá)和m7 G修飾
建立IRFA或HCC患者異種移植(PDX)小鼠模型,以高精度模擬臨床HCC 消融。使用紅外成像儀監(jiān)測腫瘤過渡區(qū)(TZ)在41℃-50℃范圍內(nèi)遭受亞致死性熱應(yīng)激時的溫度(圖1A)。結(jié)果發(fā)現(xiàn),IRFA 顯著上調(diào)了TZ中m7G tRNA 修飾水平以及METTL1和WDR4的表達(dá)(圖1B-1D)。METTL1 和 WDR4 在非腫瘤組織中的水平較低,但在RFA治療后復(fù)發(fā)的HCC組織中的水平顯著升高(圖1E和1F)。亞致死性熱處理可顯著上調(diào)HCC患者衍生的類器官組織中METTL1 和WDR4的表達(dá)(圖1G和1H)。在亞致死熱應(yīng)激HCC細(xì)胞模型中驗(yàn)證亞致死熱處理會增加HCC細(xì)胞中m7G tRNA的修飾及METTL1/WDR4 的水平(圖1I和1J)。這些數(shù)據(jù)表明,IRFA誘導(dǎo)的m7G tRNA 修飾上調(diào)可能與HCC在RFA 期間的耐熱性有關(guān)。

圖1. 暴露于亞致死熱應(yīng)激下的HCC中m7G tRNA修飾和METTL1/WDR4水平升高
2. 敲降METTL1抑制亞致死熱應(yīng)激下HCC細(xì)胞的惡性行為
鑒于亞致死熱應(yīng)激會增加m7G tRNA的修飾和METTL1/WDR4的表達(dá),作者推測METTL1 可能在亞致死熱應(yīng)激下發(fā)揮重要的致癌功能。northwestern blot(圖2A)證明METTL1 基因敲低降低tRNA的m7G修飾。亞致死熱應(yīng)激顯著抑制HCC細(xì)胞的生長(圖2B)、克隆形成能力(圖2C、2D)和細(xì)胞周期進(jìn)展(圖2E),而 METTL1 的缺失進(jìn)一步抑制亞致死熱處理下HCC細(xì)胞的生長和克隆形成。另一方面,亞致死熱應(yīng)激會誘導(dǎo)HCC細(xì)胞凋亡,當(dāng) METTL1 被沉默時,這一趨勢更加明顯(圖2F)。此外,亞致死熱處理顯著促進(jìn)三種HCC細(xì)胞的遷移和侵襲能力,但METTL1沉默會顯著削弱這一趨勢(圖2G-2J)。這些數(shù)據(jù)表明,METTL1 在亞致死熱應(yīng)激下對HCC的惡性特征起著重要作用。
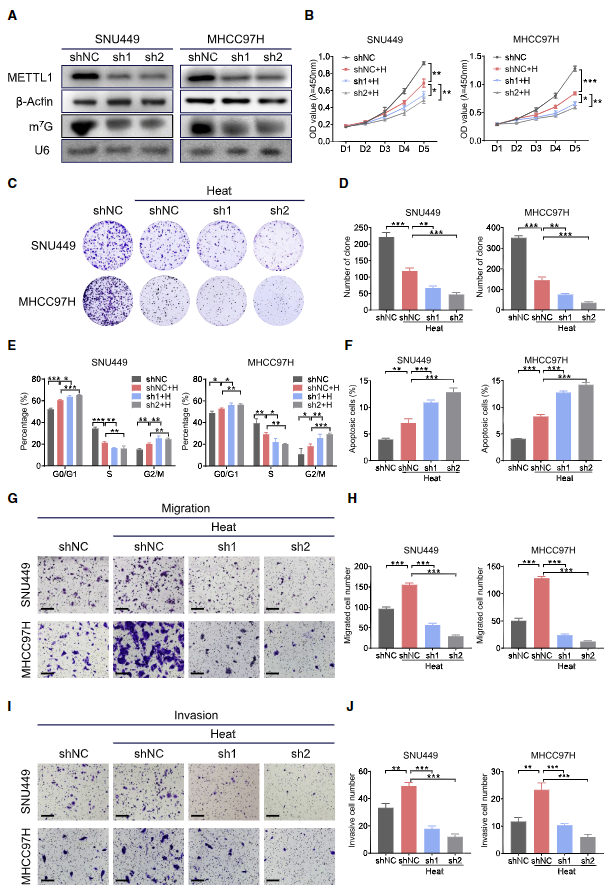
圖2. 敲低METTL1抑制亞致死熱應(yīng)激下HCC細(xì)胞的惡性行為
3. 過表達(dá)METTL1以m7G tRNA 修飾依賴的方式促進(jìn)HCC細(xì)胞在亞致死熱應(yīng)激后的惡性能力
在HCC細(xì)胞中過表達(dá)野生型(oeWT)及其無催化活性突變體(oeMUT)METTL1。與oeNC 相比,在含有oeWT METTL1 而非oeMUT METTL1的HCC 細(xì)胞中觀察到tRNA 中m7G修飾水平增加(圖3A)。在正常培養(yǎng)條件下,oeWT METTL1 顯著促進(jìn)HCC細(xì)胞生長(圖3B)、克隆形成(圖3C、3D)、遷移(圖3E、3F)和侵襲(圖3G、3H)。然而,過表達(dá)無催化活性突變體METTL1 對HCC的進(jìn)展影響甚微(圖3B-3H)。同樣,在亞致死熱處理?xiàng)l件下,過表達(dá) WT METTL1 而非突變體METTL1顯著促進(jìn)HCC細(xì)胞的惡性發(fā)展(圖3B-3H)。這些數(shù)據(jù)表明,在亞致死性熱應(yīng)激下,METTL1以m7G tRNA甲基轉(zhuǎn)移酶活性依賴的方式對HCC細(xì)胞惡性化至關(guān)重要。
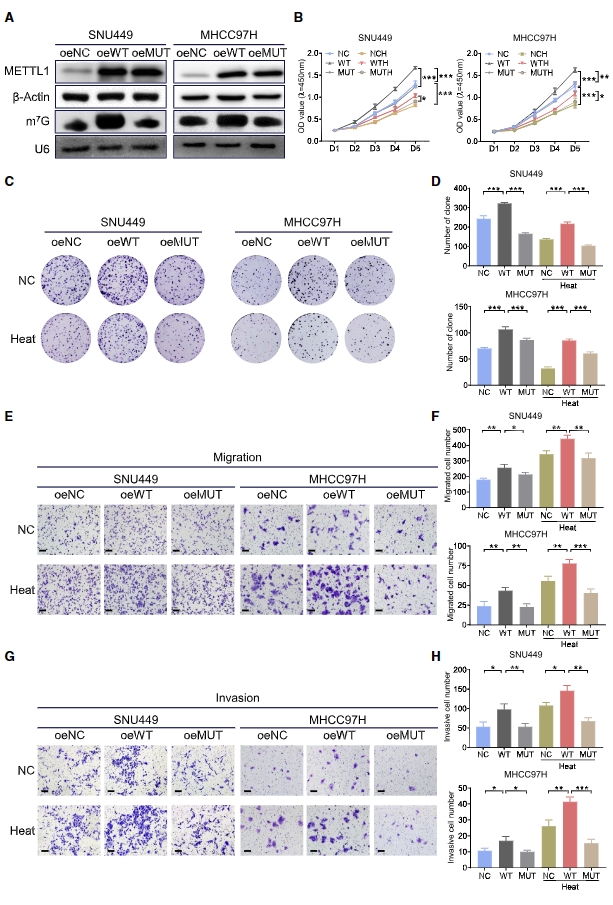
圖3. 過表達(dá)METTL1以m7G tRNA 修飾依賴的方式促進(jìn)HCC細(xì)胞在亞致死熱應(yīng)激后的惡性能力
4. 亞致死熱應(yīng)激通過METTL1-m7G 介導(dǎo)的翻譯控制機(jī)制提高HCC細(xì)胞的惡性潛能
TRAC-seq結(jié)果顯示,亞致死熱處理后,HCC細(xì)胞中的tRNA m7G修飾顯著上調(diào)(圖4A、4B)。此外,大多數(shù)經(jīng)m7G修飾的tRNA的表達(dá)水平在亞致死熱處理后也有所提高,尤其是ThrTGT和LysCTT tRNA(圖4C)。翻譯預(yù)測進(jìn)一步發(fā)現(xiàn),亞致死熱應(yīng)激后,關(guān)鍵EMT 基因SLUG和SNAIL的翻譯效率顯著增加,而敲除METTL1會減少熱處理HCC細(xì)胞中這兩個基因的mRNA翻譯(圖4D 和4E)。消耗METTL1會顯著降低SLUG 和SNAIL 的蛋白水平和mRNA 翻譯效率,這表明METTL1 促進(jìn)熱處理HCC細(xì)胞中SLUG和SNAIL mRNA的翻譯(圖4F、4G)。此外,tRNA LysCTT在熱處理后顯著增加(圖4C)。這些數(shù)據(jù)表明,m7G tRNA,特別是tRNA LysCTT,以依賴于密碼子頻率的方式調(diào)節(jié)SLUG 和SNAIL的翻譯。因此,作者進(jìn)行LysCTT挽救實(shí)驗(yàn),發(fā)現(xiàn)在缺失METTL1 的細(xì)胞中過表達(dá)LysCTT可在熱致死性應(yīng)激后挽救SLUG 和SNAIL 的蛋白水平(圖4H),從而加強(qiáng)METTL1介導(dǎo)的tRNA m7G修飾與SLUG和SNAIL mRNA 翻譯之間的功能聯(lián)系。
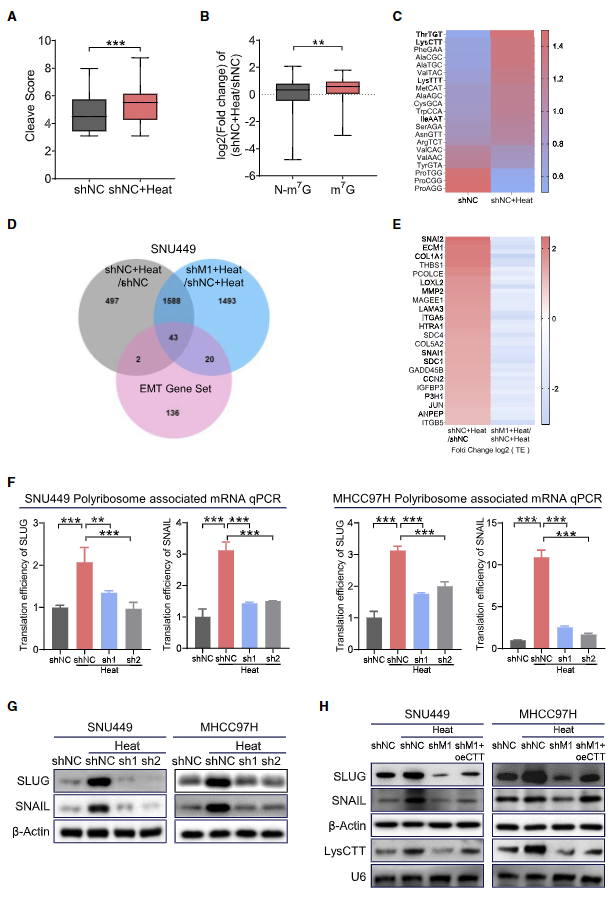
圖4. 亞致死熱應(yīng)激以m7G tRNA密碼子頻率依賴的方式提高SLUG/SNAIL的翻譯效率
5. SLUG/SNAIL異位表達(dá)挽救亞致死性熱應(yīng)激下METTL1 敲低的 HCC 細(xì)胞的惡性能力
在METTL1穩(wěn)定敲除的HCC細(xì)胞中過表達(dá)SLUG/SNAIL進(jìn)行挽救試驗(yàn)(圖5A)。數(shù)據(jù)顯示,在亞致死性熱應(yīng)激下,過表達(dá)SLUG或SNAIL能顯著促進(jìn)METTL1敲除HCC細(xì)胞的生長和菌落形成(圖5B-5D)。此外,在過表達(dá)SLUG/SNAIL后,METTL1敲除的HCC細(xì)胞的遷移和侵襲能力得到恢復(fù)(圖5E-5H)。因此,SLUG/SNAIL是METTL1的重要下游靶標(biāo),在亞致死性熱應(yīng)激下提高HCC細(xì)胞的惡性潛能。

圖5. SLUG/SNAIL異位表達(dá)挽救亞致死性熱應(yīng)激下METTL1敲低的HCC細(xì)胞的惡性能力
6. METTL1 加速體內(nèi)熱處理后HCC的轉(zhuǎn)移
利用體內(nèi)HCC轉(zhuǎn)移模型進(jìn)一步研究METTL1在IRFA后HCC復(fù)發(fā)中的致癌功能。在脾內(nèi)注射模型中,將經(jīng)過熱處理的METTL1敲除的MHCC97H細(xì)胞和對照細(xì)胞注入NCG小鼠脾臟,以評估肝轉(zhuǎn)移情況(圖6A)。數(shù)據(jù)顯示,經(jīng)熱處理的對照組細(xì)胞形成了更多的肝轉(zhuǎn)移瘤(7/7),而 METTL1 敲除組則顯著減少HCC腫瘤(分別為3/7和2/7)(圖 6B-6F)。此外,腫瘤組織中METTL1、WDR4、Ki-67、SLUG和SNAIL 的表達(dá)水平以及m7G tRNA的修飾水平在熱處理對照組中均有所上升,而在METTL1敲除組中則有所下降(圖6G-6M)。進(jìn)一步用敲除METTL1的MHCC97H細(xì)胞建立尾靜脈注射模型(圖7A),以評估 METTL1在熱處理后調(diào)控肺轉(zhuǎn)移的功能。結(jié)果發(fā)現(xiàn),正如預(yù)期的那樣,熱處理后對照細(xì)胞組出現(xiàn)更多的肺轉(zhuǎn)移(圖7B、7D和7E)。肺重量與體重的比值也顯示亞致死性熱應(yīng)激誘導(dǎo)的肺轉(zhuǎn)移負(fù)擔(dān)更高(圖7C)。重要的是,消耗METTL1顯著抑制HCC 細(xì)胞的肺轉(zhuǎn)移和增殖活性,這一點(diǎn)從尾靜脈注射模型中腫瘤負(fù)荷的減少和Ki-67水平的降低可以看出(圖7F-7I)。因此,這些數(shù)據(jù)揭示METTL1 在熱處理后對體內(nèi)轉(zhuǎn)移的促進(jìn)具有重要作用。

圖6. METTL1缺失在體內(nèi)顯著抑制亞致死性熱應(yīng)激下HCC細(xì)胞的肝內(nèi)轉(zhuǎn)移
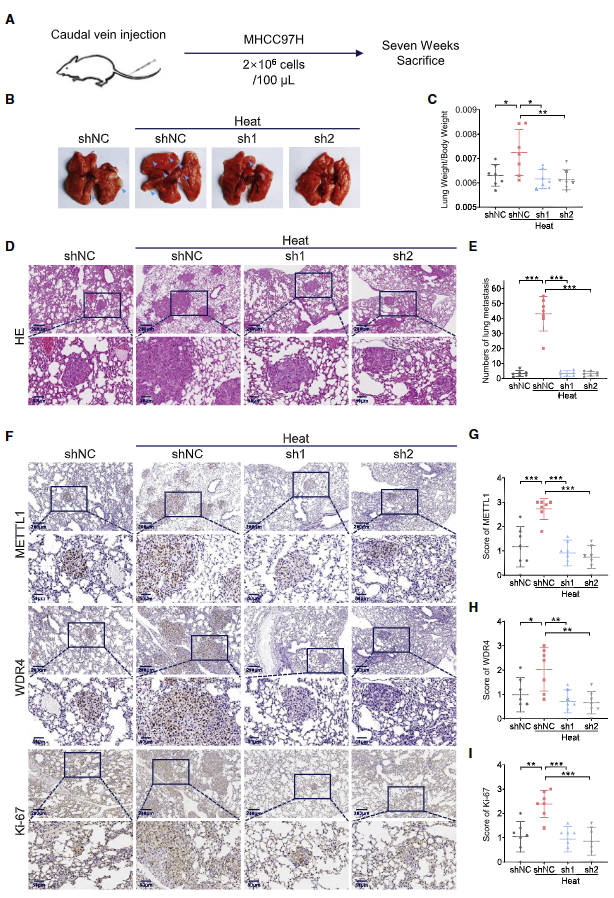
圖7. METTL1缺失在體內(nèi)顯著抑制亞致死性熱應(yīng)激下HCC細(xì)胞的肺轉(zhuǎn)移
7. METTL1在體內(nèi)促進(jìn)IRFA后的HCC轉(zhuǎn)移
在原位異種移植HCC模型中進(jìn)行IRFA。8周后對小鼠進(jìn)行解剖以評估不同器官(包括肝臟和肺臟)的轉(zhuǎn)移情況(圖8A)。對所有組織進(jìn)行HE染色定量后,發(fā)現(xiàn)shNC + IRFA 組(7/7)肝內(nèi)轉(zhuǎn)移較多(圖8B、8C、8E 和8F)。值得注意的是,在shNC + IRFA 組發(fā)現(xiàn)了肝外轉(zhuǎn)移,包括肺、腹壁、脾、腎、膈、腸和腸系膜(圖8D、8G、8H)。正如預(yù)期的那樣,METTL1基因敲除顯著抑制IRFA 誘導(dǎo)的肝轉(zhuǎn)移和其他器官轉(zhuǎn)移,尤其是肺轉(zhuǎn)移的趨勢。這些數(shù)據(jù)證明METTL1在IRFA后促進(jìn)HCC轉(zhuǎn)移的關(guān)鍵生理功能。
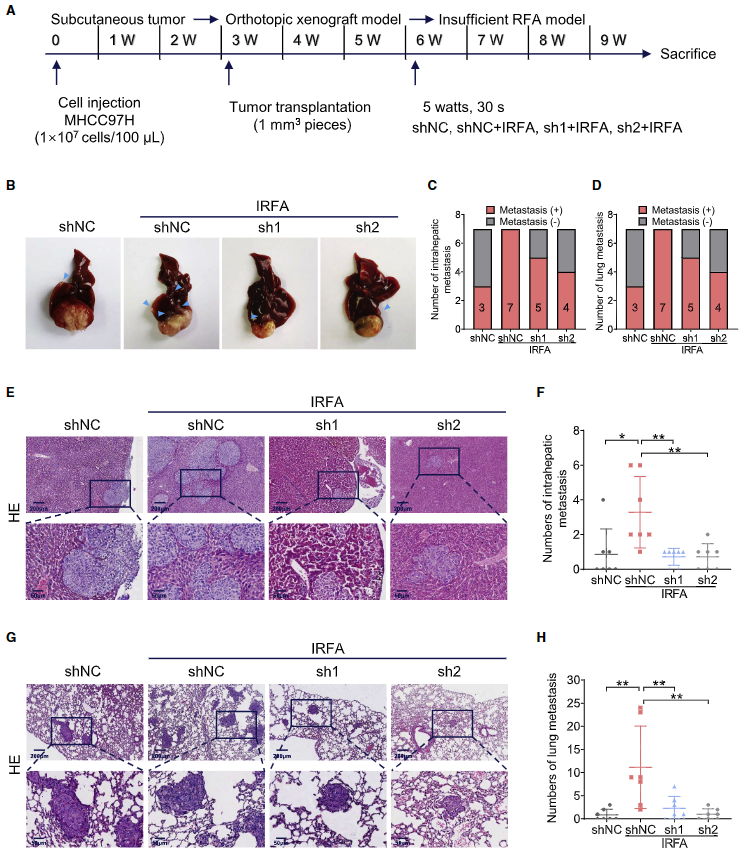
圖8. METTL1在體內(nèi)促進(jìn)IRFA后的HCC轉(zhuǎn)移
結(jié)論
綜上所述,本研究提供了證據(jù),證明在亞致死熱應(yīng)激下,METTL1通過促進(jìn)SLUG/SNAIL mRNA翻譯,以m7G tRNA修飾依賴的方式促進(jìn)HCC轉(zhuǎn)移,為防止射頻熱消融治療后HCC轉(zhuǎn)移提供了分子基礎(chǔ)。
實(shí)驗(yàn)方法
細(xì)胞培養(yǎng),動物實(shí)驗(yàn),細(xì)胞活力和克隆形成檢測,細(xì)胞周期和細(xì)胞凋亡檢測,遷移和侵襲實(shí)驗(yàn),RNA提取和RT-qPCR,northern blot,northwestern blot,western blot,HE染色,免疫組化分析,多聚核糖體結(jié)合mRNA測序, m7G tRNA還原和斷裂測序(TRAC-seq),質(zhì)粒構(gòu)建和慢病毒轉(zhuǎn)導(dǎo),體外亞致死熱處理模型構(gòu)建,體內(nèi)射頻消融不充分(IRFA)實(shí)驗(yàn),IRFA動物模型構(gòu)建,轉(zhuǎn)移動物模型構(gòu)建
參考文獻(xiàn)
Zhu S, Wu Y, Zhang X, Peng S, Xiao H, Chen S, Xu L, Su T, Kuang M. Targeting N7-methylguanosine tRNA modification blocks hepatocellular carcinoma metastasis after insufficient radiofrequency ablation. Mol Ther. 2023 Jun 7;31(6):1596-1614. doi: 10.1016/j.ymthe.2022.08.004. Epub 2022 Aug 13. PMID: 35965412; PMCID: PMC10278047.






