多維單細胞蛋白和RNA分析 剖析胸腺上皮細胞的細胞和功能異質性
胸腺間質細胞網絡提供了控制T細胞發育和選擇的必要環境,并提供獨特的分子信號。最近的單細胞RNA測序研究揭示了胸腺上皮細胞(TEC)之間存在先前未被充分認識的轉錄異質性。然而,只有極少數細胞標記物能夠對TEC進行可比較的表型鑒定。在本研究中,我們利用大規模并行流式細胞術和機器學習將已知的TEC表型解構為新的亞群。利用CITE-seq技術,將這些表型與細胞的RNA譜進行關聯,從而實現了對相應的TEC亞型的表型鑒定。這種方法允許表型鑒定圍產期cTEC并確定其在皮質基質框架中的物理定位。此外,我們展示了圍產期cTEC在響應發育中的胸腺細胞時比例的動態變化,并揭示了它們在陽性選擇中的非凡效率。總的來說,我們的研究確定了一些標記物,使我們能夠解析胸腺間質的復雜性,同時實現了TEC亞群的物理分離,并將特定功能歸屬于個體TEC亞型。
該研究于2023年7月發表在《Nature Communications》,IF:16.6。
技術路線
結論
1、跨胸腺基質細胞亞群的細胞表面表達圖譜的建立
為了在表型水平上解析胸腺間質的異質性,我們試圖確定可靠準確地識別TEC亞群的新的細胞表面標記物,這些亞群之前只通過細胞的基因表達譜進行定義。為此,我們使用大規模并行流式細胞術對260個單個細胞表面標記物進行染色,并采用Infinity Flow這種計算機機器學習算法進行分析。胸腺基質細胞從1周、4周和16周的小鼠中分離為單個細胞,然后進行物理富集,并隨后用12個骨干標記物染色,這些標記物要么單獨,要么組合在一起可可靠地識別出血細胞造血細胞(CD45),不同的上皮細胞(EpCAM1,Ly51,UEA1,MHCII,CD40,CD80,CD86,Sca1,AIRE,Podoplanin),內皮細胞(CD31)和一些間質細胞(Sca1,Ly51,Podoplanin)(圖1a)。下一步,將細胞分成若干等分,并分別對260個探索性標記物進行染色。在樣本獲取后,使用Infinity Flow在單個細胞分辨率上預測每個探索性標記物的表達水平。所得到的表達預測基于記錄的骨干標記物的非線性函數。單細胞分析流程Seurat進一步分析和可視化觀察到的異質性和共表達模式。數據的分層聚類結果顯示,從1周大的小鼠中獲得的數據產生了7個簇,而來自較年長動物的數據產生了10個簇,通過統一的流形近似投影(UMAP)在二維平面上呈現。
在三個不同時間點的每個時間點,可以根據關鍵標記物的表達可靠地識別主要胸腺基質細胞類型、上皮細胞、成纖維細胞、周皮細胞和內皮細胞,包括識別 TEC 的 EpCAM1 (CD326)、標記成纖維細胞的 CD140a、Ly51 和CD146 挑出周皮細胞,CD31 染色內皮細胞。其他標記識別了這些細胞簇內的亞群。選定的 260 個探索性標記中還包含一些用于檢測骨干表位的抗體特異性,這允許在探索性標記和相同主要標記之間進行直接比較,從而驗證 Infinity Flow 算法的實用性。
初始表達分析不僅通過流式細胞術證實了胸腺基質細胞類型之間的異質性,而且還揭示了各個 TEC 亞群的相對代表性隨時間的動態變化。在第二次分析中,我們專門關注 EpCAM1+ 細胞,并在 1 周齡非老年小鼠中公開了三個獨立的 cTEC 亞群(由細胞的 Ly51 和 UEA1 差異表達定義),從而說明早期 cTEC 群體具有更大的異質性。壽命在 4 周齡及以上的小鼠中,具有低表面 MHCII 表達的 mTEC(稱為 mTEClo)根據分析的表面標記的差異表達分為 4 個獨立的亞簇(圖 1b-d)。
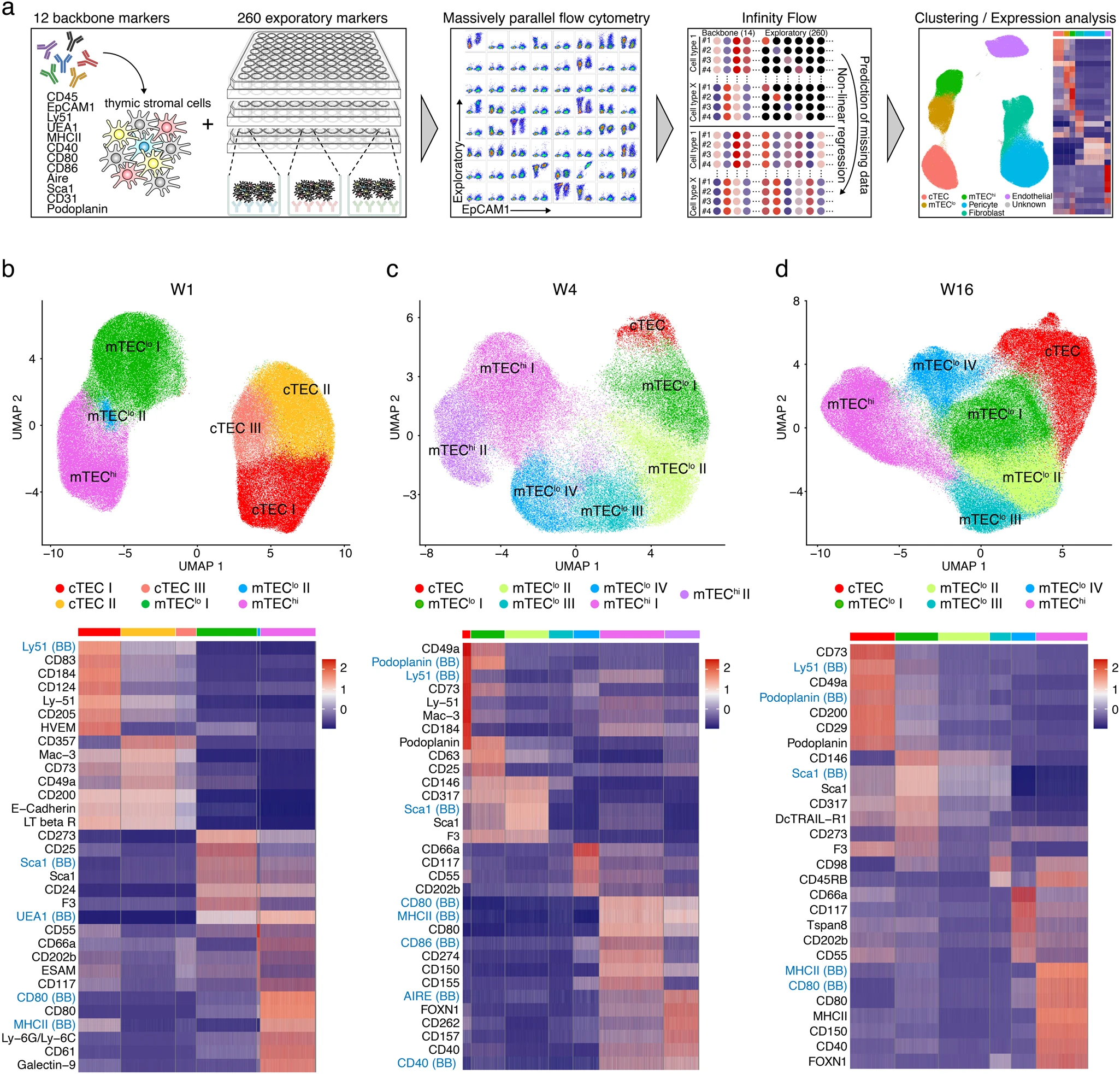
圖1 Infinity Flow分析揭示TEC異質性
2、通過差異細胞表面標志物表達鑒定 cTEC 異質性
我們接下來查看CD83、CD40、hvem(CD270)和Ly51的表達是否明確地對單個cTEC亞群進行了分類,因為它們在1周齡小鼠中發現的cTEC簇的強度分布不同(圖2a)。CD40和hvem的表達僅限于指定為cTEC I的亞群(見下文),而另外兩個標記在所有cTEC亞群中都被檢測到,但在cTEC I上有更強的信號(圖2a)。
分析先前發表的TEC13的scRNA-seq數據集,在圍產期cTEC中檢測到CD83、CD40和Enpep(編碼Ly51)的轉錄本,盡管在不同的水平上(圖2b,c)。相反,編碼HVEM的基因Tnfrsf14的轉錄本只在幾個TEC中檢測到,但在幾個簇中檢測到,因此未能明確識別圍產期cTEC。這一發現突顯了基因表達研究在識別與細胞RNA圖譜匹配的表面標記方面的局限性。為了進一步評估cTEC I亞簇與scRNA-seq確定的TEC亞型的關系,我們用SingleR軟件生成了一個相似性分數,它將單個細胞的RNA表達譜與計算出的cTEC I細胞表面表達模式聯系起來。這一分析表明,cTEC I與圍產期cTEC配對的相似性分數最高(圖2D)。
然后,我們的目標是定義允許通過流式細胞術分離圍產期cTEC的表面標志物。我們使用了1周齡小鼠的cTEC I簇中高表達的標記,同時排除了從4到16周齡動物分離的大多數成熟cTEC上檢測到的標記(圖1b-d;2a),因為老年動物中的皮質上皮群只含有比例非常低的圍產期cTEC。在cTEC群體中,我們發現了一組同時表達CD83和CD40但在出生后早期Sca1陰性的細胞亞群(圖2e)。CD83+CD40+Sca1?上皮細胞的比例在整個生命過程中發生了實質性的變化,隨著細胞的相對表達在器官發生過程中逐漸增加,在1周齡的小鼠中穩定在(4.6×104±1.4萬個細胞),隨后下降,在8周齡的動物中表現出最低的表達(2.4×103±2.3x103個細胞;圖2e,f)。
圍產期cTEC與其他cTEC亞群(包括cTEC簇II和III)相比,Hvem、Ly51和MHCII的細胞表面水平較高,這使得在沒有Sca1的情況下,這些細胞通過CD83和CD40的高表達得以鑒定。圍產期cTEC也顯示出較高的Foxn1啟動子活性,如在報告小鼠中所證明的那樣,GFP的表達受Foxn1基因座的轉錄控制(圖2g)。
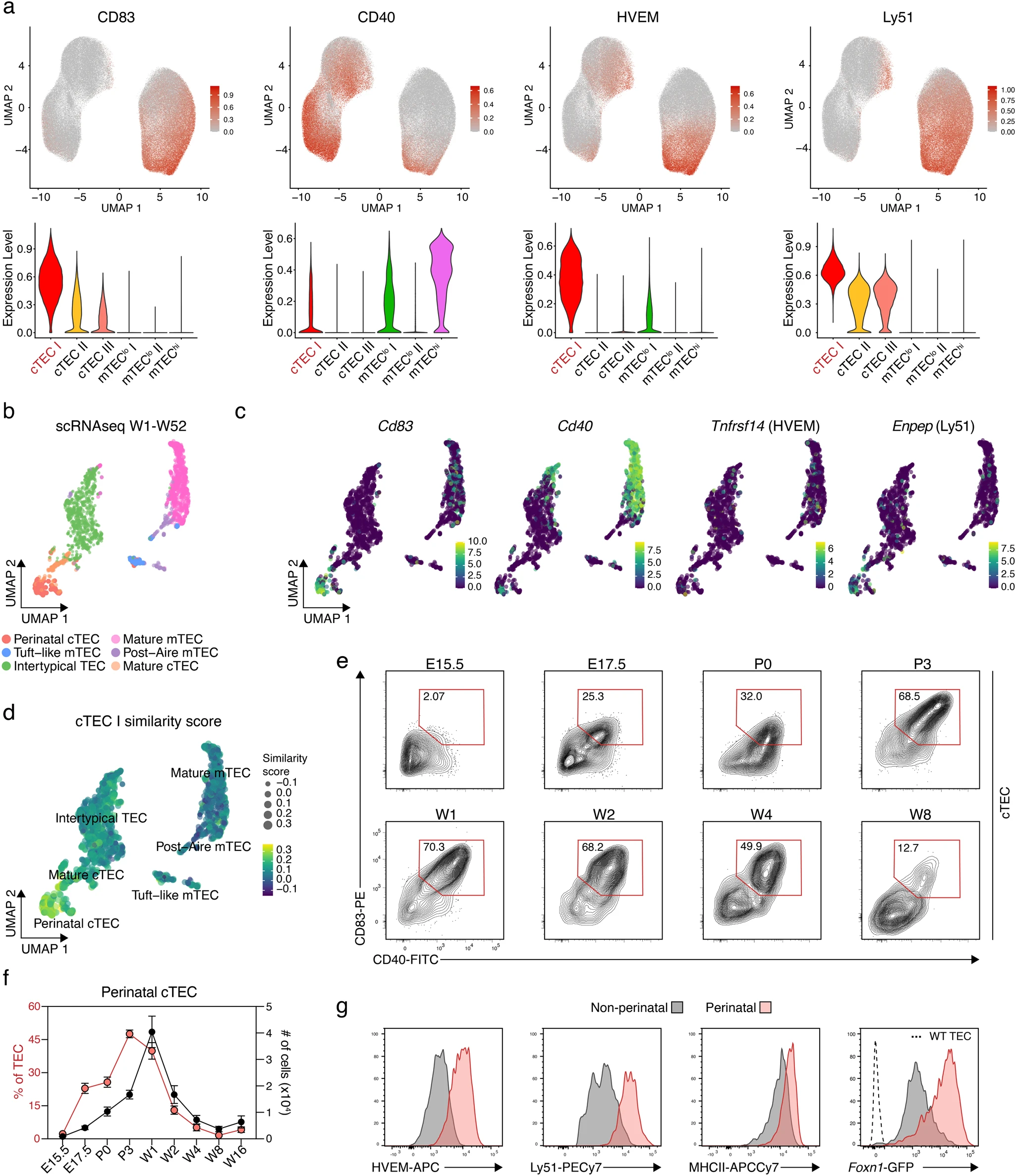
圖2 圍產期cTEC的表面表達譜
3、典型和簇狀TEC的鑒定
對成年小鼠的Infinity Flow分析顯示出4個明顯的mTEClo簇。簇I和II在4周和16周的小鼠中觀察到,并且對于大多數260個探索性標記物(圖1b-d)顯示出相似的表達譜,包括Sca1和CD146的共同表達(圖3a,b)。為了將這兩個表型定義的亞群與它們對應的轉錄組確定的TEC亞型相匹配,我們對單個TEC的RNA譜進行了檢測,以確定Ly6a / Ly6e(編碼Sca1)和Mcam(編碼CD146)的表達情況。雖然Ly6a / Ly6e的轉錄本尤其在亞型TEC中被檢測到,但Mcam特異性RNA僅在不同的TEC中以低水平檢測到,但主要在亞型TEC中檢測到(圖3c)。這種亞型的轉錄特征特征是cTEC和mTEC的特征,正如傳統表面標記物Ly51和UEA反應性所定義的表型一樣,這些特征貢獻于這種獨特的TEC亞型。再次使用SingleR軟件包,計算了4周和16周mTEClo I和II與亞型TEC之間的相似度得分最高(圖3d)。mTEClo亞群包含共表達Sca1和CD146的細胞,而且這種表型的細胞隨著出生后的年齡增長而增加(圖3e,f)。盡管最初只在mTEClo中檢測到,但這個亞群在4周以上的小鼠的cTEC區域中也越來越多地觀察到(圖3e,f)。
沒有找到一組專門識別mTEClo簇III的獨特的表面標記。然而,在沒有Sca1和CD63陽性的情況下同時表達CD66a和CD117確定了mTEClo簇IV。這個簇只在成年小鼠中檢測到(圖4a),盡管在1周齡動物的mTEClo簇II中也可以檢測到定義的4個細胞表面標記。因此,1周齡小鼠的mTEClo II簇可能代表了在老年動物中形成單獨簇mTEClo IV的上皮細胞。單細胞轉錄分析僅部分符合mTEClo簇的表型分析,因為在絕大多數TEC中確實可以檢測到Ly6a/Ly6e和CD63特異的RNA(圖3c和4b),而這些細胞中大部分缺乏Ceacam1(編碼CD66a)和Kit(編碼CD117)的轉錄本(圖4b)。相似性得分顯示mTEClo簇IV與AIRE后和簇狀mTEC之間的最佳匹配(圖4c)。
接下來,我們試圖定義屬于mTEClo IV簇的細胞的表型特征,以允許通過流式細胞術進行物理分離。為此,我們在Sca1-CD63-mTEClo中鑒定了CD66a和CD117陽性的細胞亞群,從而反映了mTEClo簇IV(圖4d)的特征。大部分Sca1-CD63-CD66a+CD117+mTEClo細胞(~70%)也表達絲氨酸/蘇氨酸蛋白激酶Dclk1(圖4e),它是簇狀mTEC的典型細胞內標志。雖然簇狀mTEC標記L1CAM在我們手中的染色不成功,但Dclk1陰性和陽性部分都具有先前描述的CD104lo簇狀mTEC表型。此外,簇狀mTEC中Dclk1陰性細胞的存在得到了先前scRNA-seq結果的支持。我們還觀察到,Sca1-CD63-CD66a+CD117+mTEClo中Dclk1的缺失與CD66a和CD117的表面表達降低相關,表明這些細胞尚未完全分化為簇狀mTEC。相反,絕大多數Dclk1陽性的TEC在Sca1-CD63-CD66a+CD117+mTEClo中檢測到。在沒有轉錄因子Pou2f3Dclk1的情況下,Sca1-CD63-CD66a+CD117+mTEClo細胞沒有表達(圖4f,g),從而證實它們是簇狀胸腺上皮細胞。利用這些表型特征,我們注意到4周齡小鼠中簇狀mTEC的存在以最高的比例和細胞密度隨時間變化(圖4H,I)。由于CD66a-CD117-細胞(“非簇狀”)在相對較少的Sca1?CD63?mTEClo中占相當大的比例(在4周時約為40%),我們試圖通過Bulk RNA-seq進一步確定它們的身份。具體地說,我們調查了這些細胞是否具有簇狀mTEC的轉錄特征。這一分析揭示了非簇狀細胞和簇狀細胞之間的主要轉錄差異。與簇狀細胞相關的基因在細胞的CD66a+CD117+部分中得到富集,包括Dclk1、Il25、Ceacam1和Kit。同樣,在先前的scRNA-seq實驗中確定的定義簇狀mTEC的top基因在這些簇狀細胞中表達水平非常高,而它們的轉錄產物在非簇狀細胞中不存在。將整個非簇狀轉錄組與注釋的TEC亞集的相關性證實了從被鑒定為簇狀mTEC的細胞。由于CD66a-CD117-非簇狀mTEC的基因表達譜與任何已知的mTEC亞群都不匹配,因此這些稀有細胞(約占總TEC的4%)可能代表mTEC亞群的混合。
簇狀mTEC起源于曾經表達組織限制性抗原Csnb15的mTEC。我們利用CsnbCre::Rosa26LSL-YFP報告基因來測試Sca1-CD63-CD66a+CD117+mTEClo是否表達Csnb的前體。與先前的研究一致,我們鑒定了Sca1-CD63-CD66a+CD117+mTEClo mTEC的70-80%帶有YFP標記,這表明它們代表真正的簇狀mTEC。MTEClo細胞由尚未表達轉錄促進劑AIRE的髓質上皮細胞組成,或者屬于一組已經從AIRE陽性的成熟mTEC分化而來的細胞。此前已證明簇狀mTEC至少部分來源于AIRE陽性前體,并富含表面糖蛋白Tspan8的表達,Tspan8是AIRE增強的組織限制性抗原。因此,我們測試了Sca1-CD63-CD66a+CD117+mTEClo(即絨毛狀)mTEC表達Tspan8陽性。多達60%的簇狀mTEC表達Tspan8,進一步證實了它們的身份,并確定這些細胞含有AIRE后的mTEC。YFP和Tspan8僅在Sca1+CD146+mTEClo典型TEC的一小部分中聯合表達,表明它們屬于TEC發育階段,尚未混雜表達組織特異性抗原。
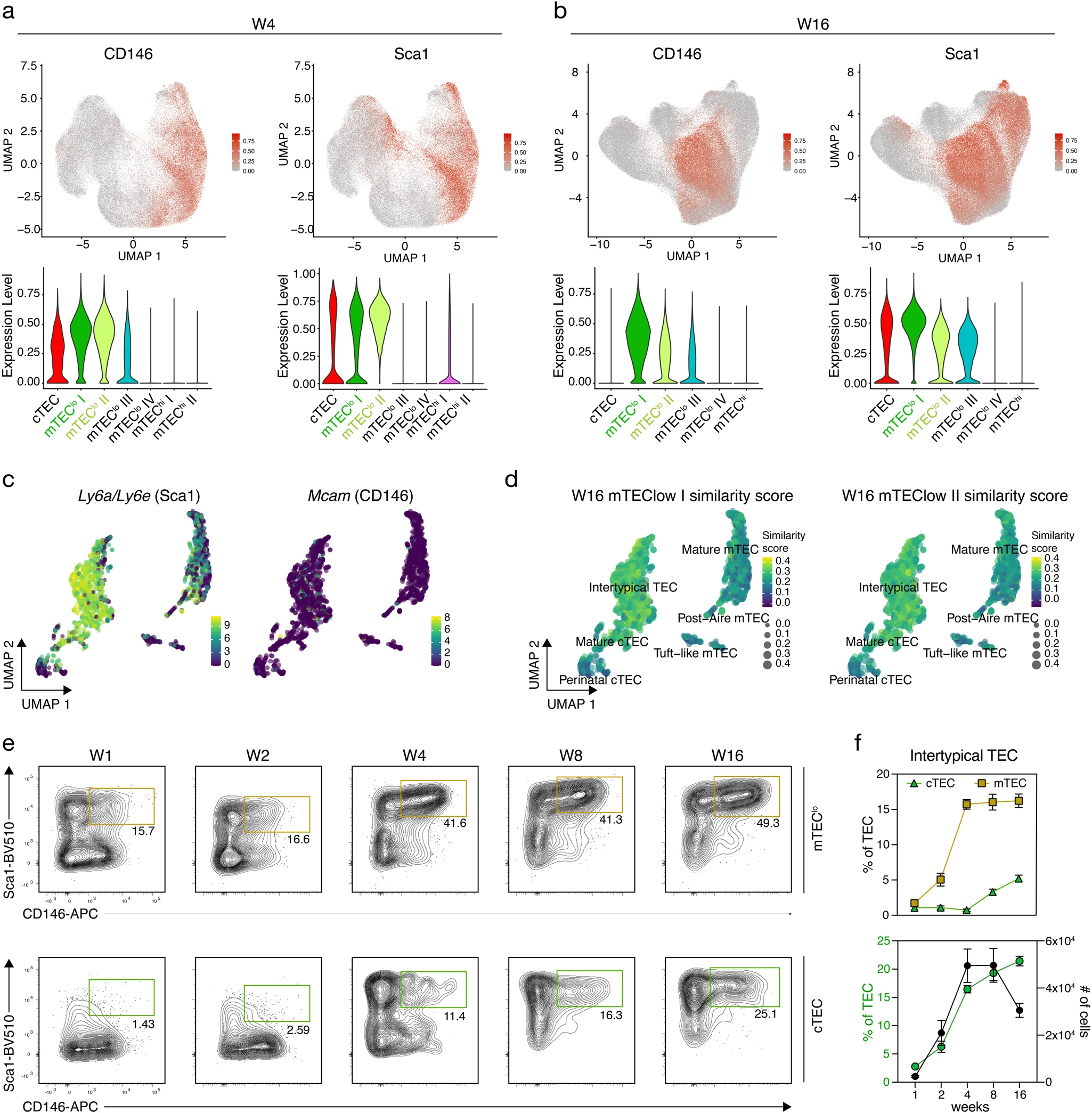
圖3 確定cTEC和mTEC中的典型TEC
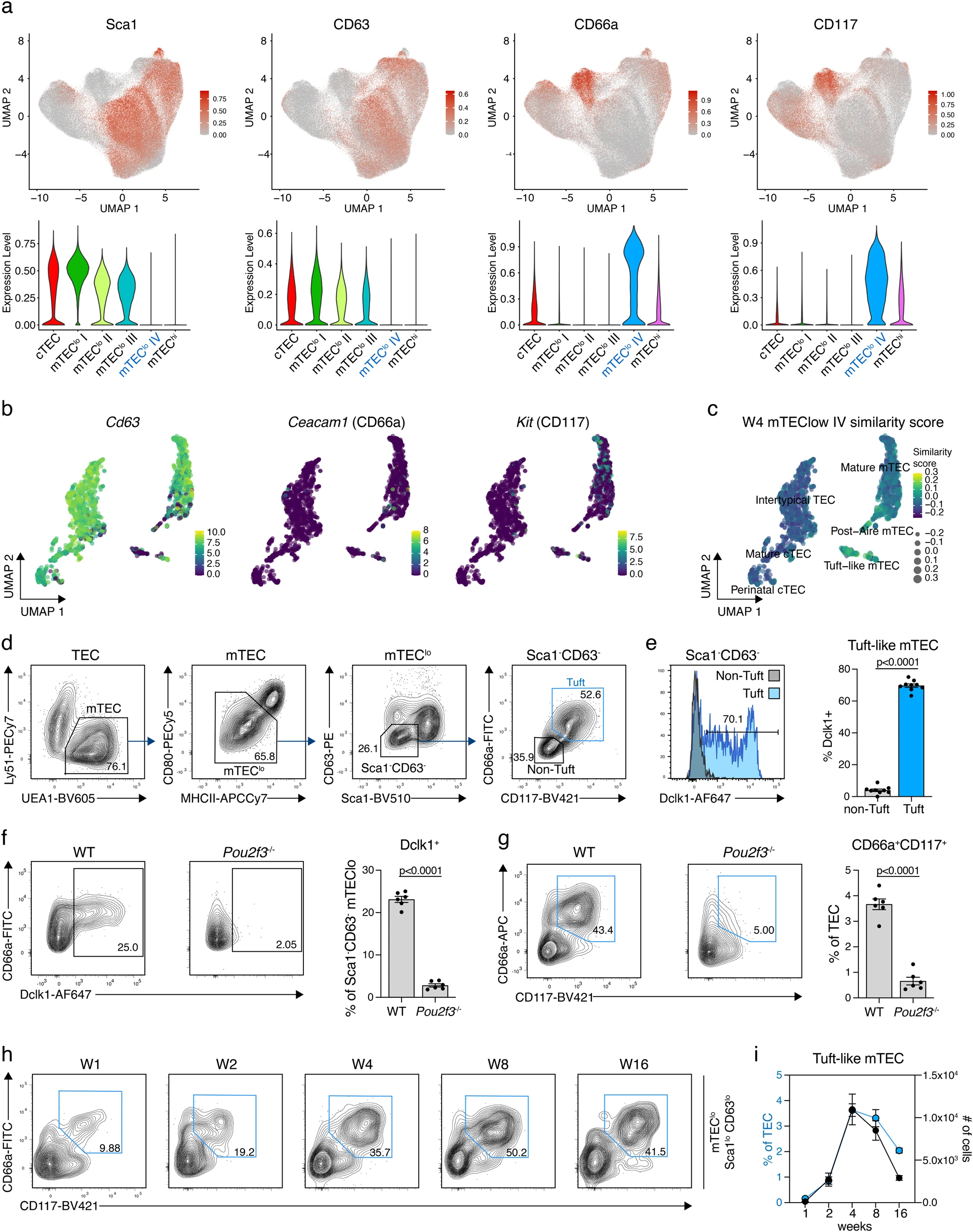
圖4 定義簇狀mTEC的表面標記組合
4、CITE-seq驗證新的TEC標記
接下來,我們使用CITE-seq同時測定了單個胸腺基質細胞表面蛋白和mRNA表達的豐度。這一方法也被用來明確地證明可以結合使用新描述的細胞表面標記識別特定的和先前定義的TEC亞型。從1周齡和16周齡小鼠胸腺中分離出CD45-Ter119-細胞,并用寡核苷酸偶聯抗體染色,每個抗體都分別針對EpCAM1、MHCII、UEA1、CD80、CD86、CD40、CD83、HVEM、CD73、SCA1、CD63、CD117、CD200、CD54、CD49a、CD274、CD9、Ly6G/Ly6C、CD6G/Ly6C和CD31。進一步對標記的細胞進行單細胞測序同時估計抗體衍生標簽(ADTs)的豐度。
細胞聚類分析鑒定出了12個簇,其中數據分別來自單細胞基因表達譜分析或ADT。所進行的細胞類型注釋是基于免疫基因組計劃(ImmGen)提供的基因表達譜,并驗證了各個簇的內皮細胞、成纖維細胞、間質細胞和上皮細胞的身份。因此,所選擇的表面標記物的組合足以識別各個間質細胞類型。
對僅對TEC進行基因表達譜分析的結果顯示出8個獨立的簇(A-H),而對ADT數據進行分析則識別出9個簇(1-9)(圖5a,b)。將這兩種方法進行比較發現幾乎成對的關系(圖5c)。觀察到的少數異常情況包括D和E簇,它們代表了4和5簇的混合,以及G簇,由于簇間Ly6C / Ly6G的差異表達而分裂成7和8簇(圖5d)。在CITE-seq分析中使用的有限數量的抗體鑒定出三個cTEC簇(定義為UEA1非反應性細胞:1對應于簇A [1/A],2/B和3/C),三個mTEClo簇(MHCIIloCD80lo:4/D,5/E和9/H)和三個mTEChi亞群(MHCIIhiCD80hi:6/F,7/G和8)(圖5d-f)。
接下來,我們將CITE-seq定義的TEC簇身份分配給我們之前分類的亞型。簇1/A和在較小程度上的2/B對應于圍產期cTEC。簇2/B進一步與成熟cTEC相關,而簇3/C與成熟cTEC和亞型TEC相關(圖5d,f)。簇4/D和5/E與亞型TEC相關,而簇6/F與成熟mTEC和增殖TEC最為相似。簇7/G和8/G與成熟mTEC顯示出很高的相似性,而簇9/H與tuft-like mTEC相關。值得注意的是,無法檢測到后Aire mTEC和神經(n)TEC的特征轉錄特征。此外,我們還分析了數據以確定最近描述的模擬mTEC亞群的基因轉錄特征。發現“tuft細胞”的轉錄本存在于簇9/H中,而類似microfold、enterocyte/hepatocyte和keratinocyte的TEC的mRNA特征則在成熟mTEC群體中的簇G/7-8中被檢測到。無法魯棒地鑒定出與神經內分泌、纖毛、離子細胞和肌肉細胞相關的基因在指定的TEC亞群中的表達。
特定TEC亞型隨年齡的變化,1周齡小鼠的1/A和2/B簇更加豐富,而16周齡小鼠的3/C、4/D、5/E、7/G和9/H簇的比例增加(圖5d)。在CITE-seq定義的簇中,第1/A簇中的Tec表達CD83、CD40和hvem蛋白最高,從而證實了該細胞為圍產期cTEC。這些標志物在第2/B群中表達減少,在第3/C群中完全缺失,表明前者代表了圍產期和成熟/典型間樣cTEC之間的發育中間細胞狀態(圖5d,g)。此外,cTEC成熟的同時,Foxn1轉錄減少,CD73、CD49a和Sca1蛋白表達增加。
CD117、CD63和Sca1蛋白的差異表達(通過ADT測量)將9/H簇確定為簇樣mTEC(CD117+CD63-Sca1-;見上文和圖5d,h),從而證實了用于識別這些細胞的流式細胞術定義和門控策略是準確和實用的(圖4g-i)。在第9/H簇(圖5h)中檢測到Dclk1和Ceacam1轉錄本,并與管狀mTEC亞型(圖5g,f)具有很高的相似性,進一步證實了這一結論。
基于ADT的Sca1蛋白表達檢測與cTEC(第3/C簇)和mTEClo亞群(第4+5/D+E簇;圖5d,f,h)中具有典型TEC轉錄特征的細胞相匹配。因此,僅通過Sca1的表達就可以明確地識別出典型的TEC。由于識別典型TEC的轉錄簽名分布在三個CITE-seq定義的簇(3/C、4/D和5/E;圖5d,f)上,CD146表達的檢測似乎進一步解卷TEC的異質性,因為Sca1+cTEC和Sca1+mTEClo的一部分CD146+染色呈陽性(圖3e)。
基于ADT的表面標記文件確定了單個TEC亞型。然而,相應的基因表達譜本身不足以識別這些細胞,尤其是因為表面蛋白和RNA表達之間偶爾存在差異。因此,CITE-seq可以驗證所選的、新穎的表面標記和所選的門控策略的實用性。他們共同鑒定了對應于特定轉錄定義的簇的四個TEC亞群和代表兩個相關簇的混合的兩個亞群,即UEA1-CD83+CD40+Sca1-圍產期cTEC(簇1/A),UEA1-CD83-CD40-Sca1-成熟cTEC(2/B),UEA1-CD83-CD40-Sca1+互典型mTEC(3/C),UEA1+MHCIIloCD80loSca1+典型mTEC(4+5/D+E),UEA1+MHCIIhiCD80hi成熟mTEC(6+7+8/F+G),以及UEA1+MIIloCD80loSca1-CD63-CD66a+117+CDt-like mTEC(9/H)。
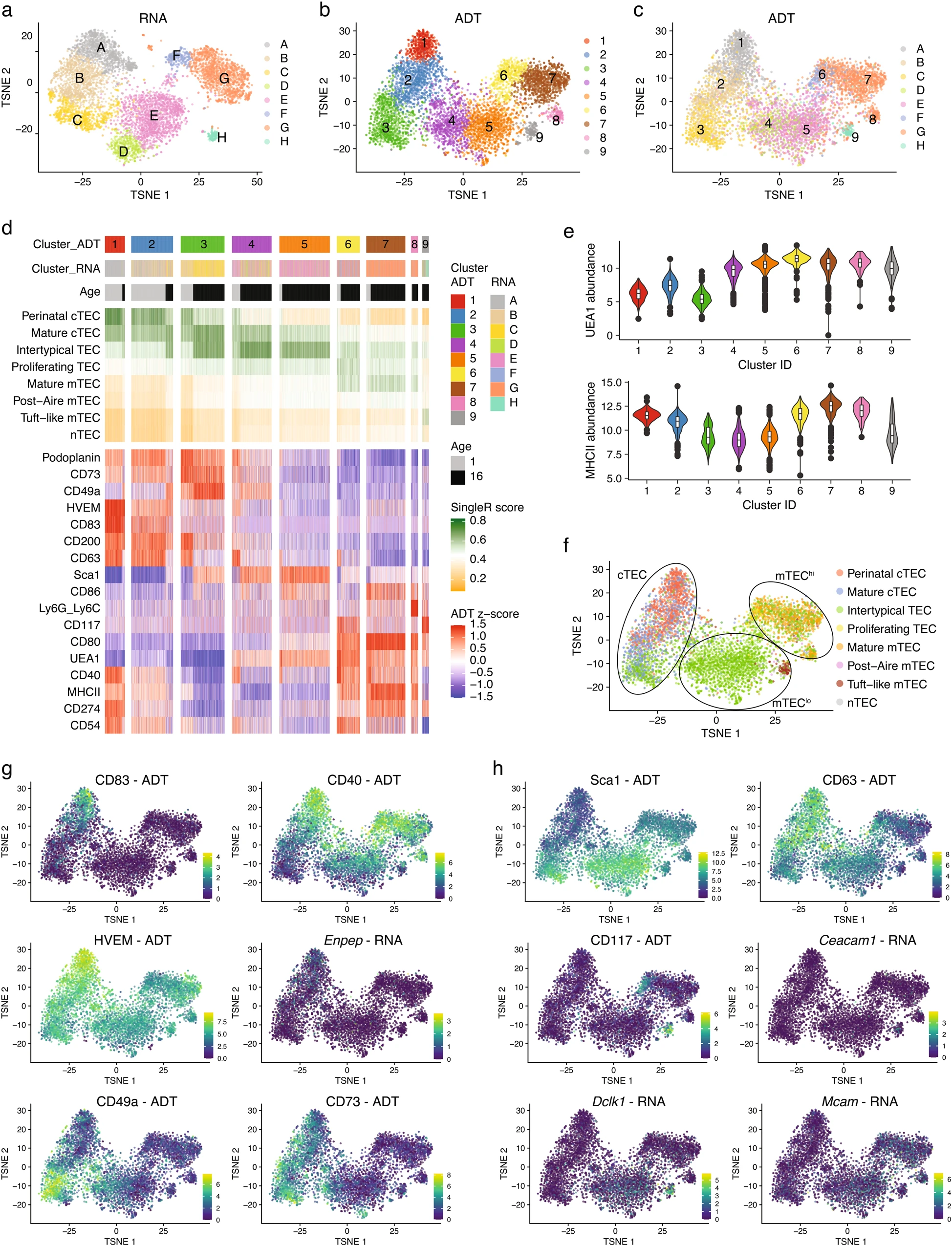
圖5 CITE-seq驗證新的TEC標記
5、圍產期cTEC表現出更強的陽性選擇潛力
接下來,我們試圖將圍產期cTEC定位于胸腺基質結構內。由于圍產期cTEC的Ly51豐度高于其他皮質上皮細胞群(圖2g),我們使用這種差異在胸腺組織切片上定位圍產期cTEC(圖6a)。免疫組織學中Ly51信號強度的定量檢測發現,這些細胞靠近髓質,Ly51信號逐漸增加,但細胞角蛋白8(K8)從被膜下區域向內皮質并最終深入皮質呈不變的染色(圖6a,b)。
新分配的表面標記使單個cTEC群體的體外分離和功能測試成為可能。因此,我們研究了圍產期(CD83+CD40+Sca1?)和非圍產期(CD83?CD40?)cTEC對陽性胸腺細胞選擇的影響。我們將這些細胞在胸腺上皮細胞培養物(TECx)中與CD69-CD4+CD8+(即預選雙陽性)胸腺細胞共同培養兩天。然后分析胸腺細胞與陽性胸腺選擇相關的表型特征,即TCR和CD5的上調(圖6c)。與由其他皮質上皮細胞組成的聚集體相比,由圍產期cTEC組成的TECx的胸腺細胞總數和CD5hiTCRβhi的胸腺細胞數量顯著增加(圖6d)。綜上所述,這些結果確定了圍產期cTEC與髓質并列,在選擇陽性胸腺細胞方面特別有效。
圍產期cTEC數量隨年齡增長明顯減少。因此,我們探索了這種變化是否與實施陽性胸腺細胞選擇效率的變化平行。因此,我們監測和比較了4周齡和16周齡胸腺細胞的成熟情況,并根據TcRβ和CD69的表達對胸腺細胞的成熟程度進行了分類(即0期:TcRβ?CD69?→階段1:TcRβ+CD69+/?→階段2:TcRβ+CD69+→階段3:TcRβ+CD69?)。在老年動物中,預選胸腺細胞(即階段0)的比例增加,而具有選擇后表型(階段2和3)的細胞的相對豐度顯著降低(圖6e,f)。這些體內結果表明,老年小鼠積極選擇胸腺細胞的能力受到了損害,這與圍產期cTEC的可用性下降有關(圖2e,f)。
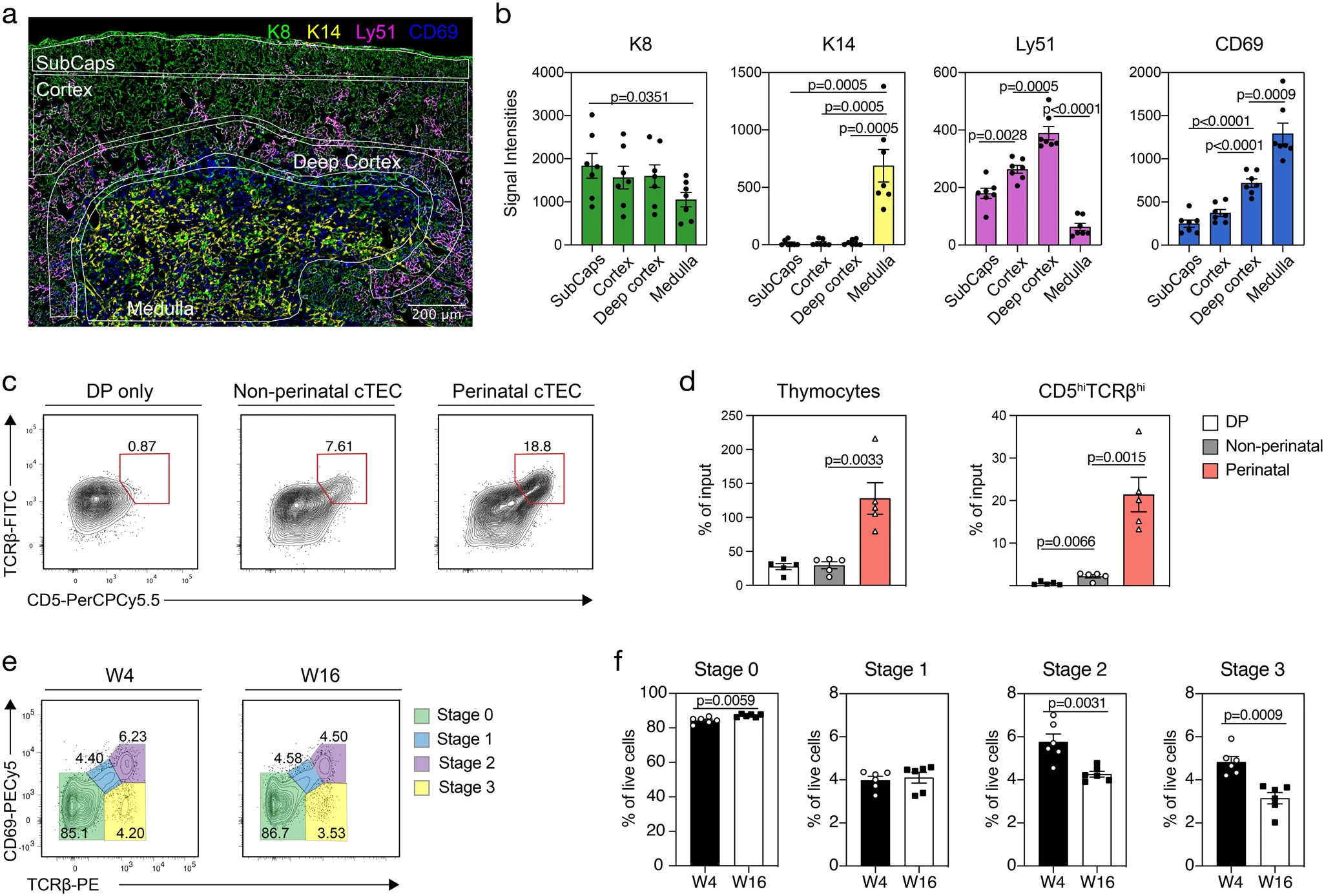
圖6 圍產期cTEC顯示陽性選擇能力增強
6、胸腺細胞串擾誘導圍產期cTEC成熟
最后,我們研究了胸腺交叉素是否能解釋圍產期cTEC比例隨年齡降低和胸腺細胞出生后增長之間的負相關關系。因此,我們首先確定了RAG2缺陷(RAG2?/?)小鼠的圍產期cTEC的比例,這些小鼠的胸腺發育不良繼發于胸腺細胞在DN3a階段的發育停滯。我們發現在這些小鼠中,圍產期cTEC的比例很高,不受年齡的影響(圖7a)。因此,胸腺細胞處于發育階段直到β-臨界點,并不影響圍產期cTEC比例隨年齡的變化。
為了探究后期發育階段的胸腺細胞,特別是未經選擇的CD4+CD8+(雙陽性,DP)胸腺細胞是否控制圍產期TEC的比例,我們將抗CD3ε的抗體注射到Rag2-/-小鼠體內。這種處理會導致未選擇的DP胸腺細胞的顯著增加。在注射抗體或對照物后的四周,經過活動治療的Rag2-/-小鼠的胸腺中含有大量的DP胸腺細胞,這與cTEC區域的數量和表型變化相關(圖7b-e)。后者通過圍產期cTEC的減少和非圍產期cTEC的增加,特別是Sca1+細胞的增加而標記出來(圖7d,e),這與我們的CITE-seq數據中的亞型TEC(圖5d,f,h)相一致。綜合這些結果表明,圍產期cTEC的比例受到未選擇的DP胸腺細胞的豐度和/或信號傳導的控制機制影響。
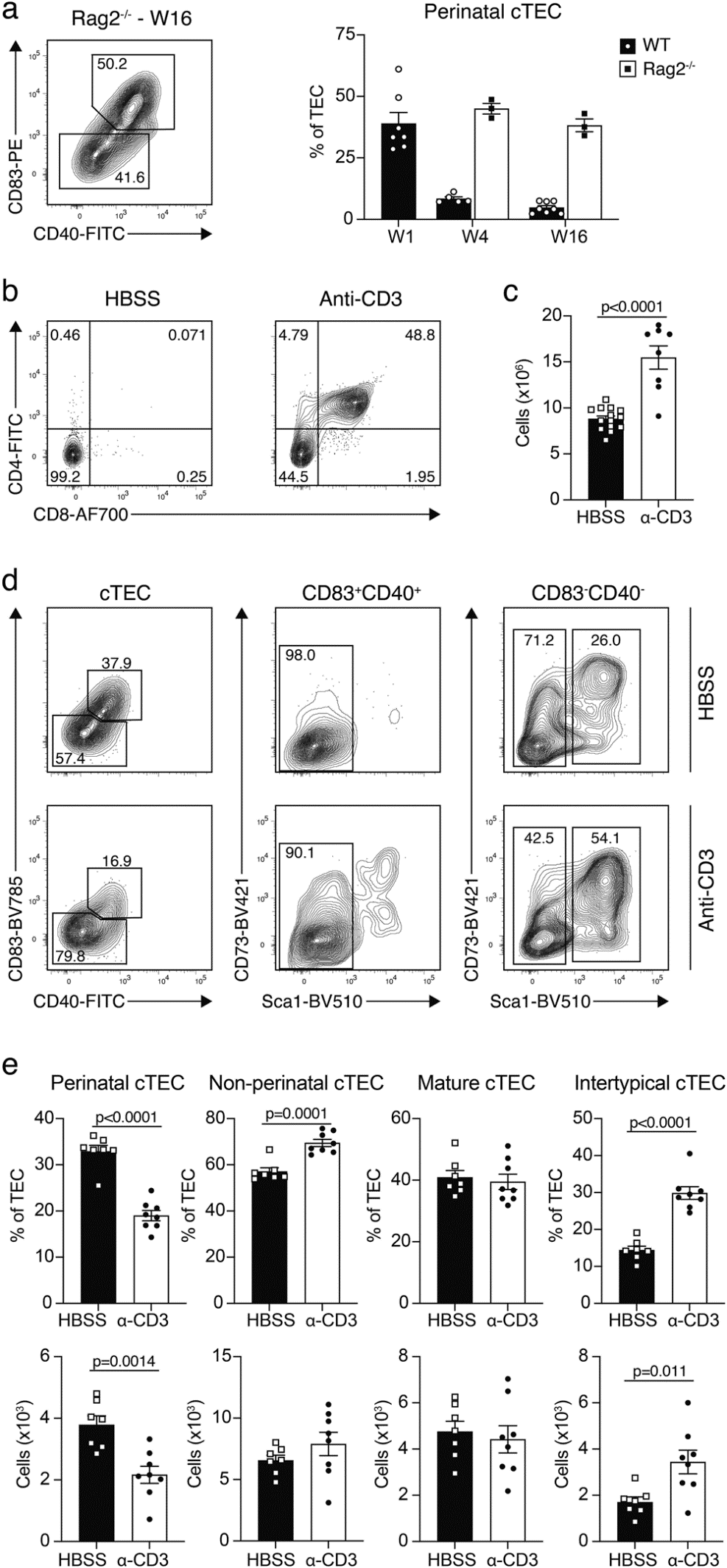
圖7 與胸腺細胞的串擾促進cTEC成熟。
實驗方法
TEC、流式細胞術、大規模平行流式細胞術、Infinity Flow、單細胞聚類與表達分析、組織學分析、TECx、CITE-seq、批量RNA測序。
參考文獻
Klein, F., Veiga-Villauriz, C., B?rsch, A. et al. Combined multidimensional single-cell protein and RNA profiling dissects the cellular and functional heterogeneity of thymic epithelial cells. Nat Commun 14, 4071 (2023). https://doi.org/10.1038/s41467-023-39722-9






