肝細胞癌經動脈化療栓塞后,TREM2+巨噬細胞抑制CD8+T細胞浸潤
肝細胞癌(HCC)經肝動脈化療栓塞術(TACE)后的免疫格局仍有待闡明。本研究旨在描述TACE后的免疫景觀和HCC進展的潛在機制。收集5例未經治療的HCC患者和5例接受TACE治療的患者的腫瘤樣本,并進行單細胞RNA測序。另有22個配對樣本使用免疫熒光染色和流式細胞術進行驗證。為闡明潛在的機制,體外共培養實驗和兩種類型的TREM2-KO / WT小鼠模型,即HCC細胞原位注射模型和自發性HCC模型。TACE術后微環境中CD8+T細胞數量減少,腫瘤相關巨噬細胞(TAMs)數量增加。TACE治療降低了CD8_C4簇,該CD8_C4簇高度富集腫瘤特異性CD8+T細胞。TREM2在TACE術后TAMs中高表達,且與不良預后相關。TREM2+TAMs比TREM2-TAMs分泌更少的CXCL9,但分泌更多的半乳凝素-1。半乳凝素-1促進血管內皮細胞PD-L1過表達,阻礙CD8+T細胞募集。TREM2的缺失也增加了CD8+T細胞的浸潤,這在兩種體內HCC模型中都抑制了腫瘤的生長。更重要的是,TREM2缺失增強了抗PD-L1阻斷的治療效果。本研究表明TREM2+TAMs在抑制CD8+T細胞中發揮重要作用。TREM2缺失通過增強CD8+T細胞的抗腫瘤活性,增加了抗PD-L1阻斷的治療效果。這些發現解釋了TACE術后復發和進展的原因,為TACE術后HCC免疫治療提供了新的靶點。本研究于2023年7月發表于《Journal of Hepatology》上,IF:25.7。
技術路線
主要研究結果
1、免疫細胞群的全局scRNA-seq分析
研究展示了發現隊列中5個未經治療的原發性HCC和5個TACE后HCC樣本的scRNA-seq(圖1A)。作者在驗證隊列中用TACE前后的22個配對樣本驗證了這一發現(圖1B)。圖1C顯示隊列的計算機斷層掃描圖像。
共鑒定出27個不同的簇,包括CD8、CD4、自然殺傷細胞(NK)、B、血漿和髓系細胞(圖1D)。與PT組(圖1E和F)相比,TT組髓系細胞數量增加,NK和CD8+T細胞數量減少。所有細胞簇在患者間共享,表明不存在患者特異性批次效應或患者異質性(圖1G-H)。這些發現得到了來自驗證隊列的免疫熒光(圖1I-J)和流式細胞術(圖1-L)的證實。
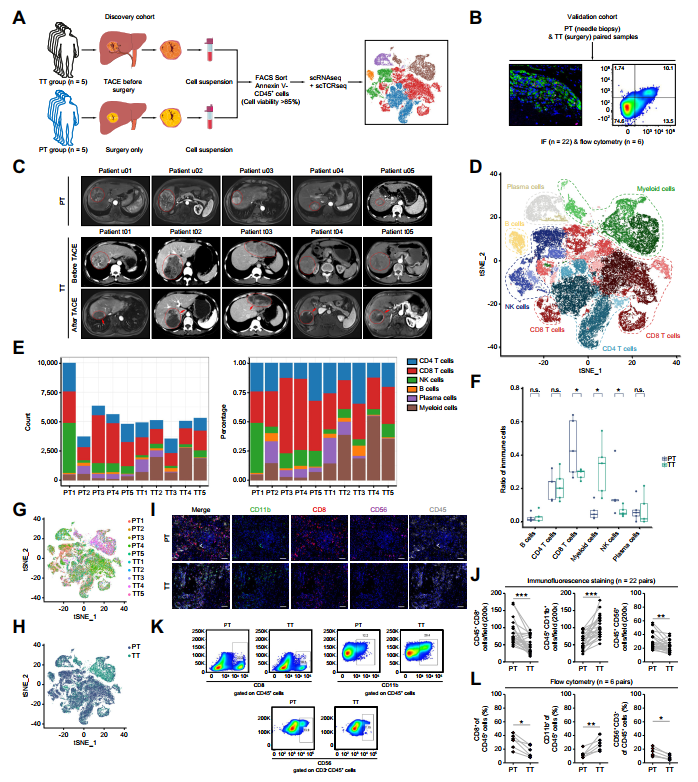
圖1 TACE治療減少CD8+T細胞的數量,但增加髓系細胞的數量
2、在TACE治療后,高度富集腫瘤特異性CD8+T細胞的CD8_C4亞群的頻率降低
將CD8+T細胞重新聚類為15個群體(圖2A)。差異表達基因(DEG)分析和細胞評分評估顯示,TT組CD8+T細胞的細胞毒性和耗竭降低,而氧化應激增加(圖2B、C)。令人驚訝的是,TT樣本中CD8_C4細胞的頻率顯著低于PT樣本(圖2D)。基于細胞毒性基因數量的增加和耗竭標志物的適度表達,軌跡分析發現CD8_C4細胞代表了介于效應性CD8+和終端耗竭性CD8+T細胞之間的過渡狀態(圖2E)。研究使用流式細胞術分析了驗證隊列中的6個配對HCC樣本,在TT樣本中檢測到PD-1intCD8+T細胞的頻率降低(圖2F、G)。粒酶-B主要表達于PD-1int CD8+T細胞亞群,與作者之前的研究結果一致。此外,TT組PD-1int CD8+T細胞中粒酶-B的表達量遠低于PT組(圖2H、I)。跨驗證隊列的免疫熒光實驗也驗證了TT組中粒酶-B+PD-1+CD8+T細胞數量減少(圖2J、K)。此外,基于TCGA數據庫的生存分析顯示,CD8_C4基因標簽組合與HCC患者較好的預后結局相關(圖2L)。作者使用轉移軌跡研究來探討CD8+T細胞在耗竭前階段的能量代謝途徑。研究發現,TT樣本的CD8+T細胞在擬時間階段4的脂蛋白代謝評分高于PT樣本(圖2M),而谷氨酸、糖酵解和三羧酸循環評分低于PT樣本(圖2M)。這些結果表明TACE治療在數量和功能上降低了CD8_C4簇。
作者的TCR測序分析證實這些發現。除CD8_C13(IELs)外,所有細胞均表達TCR(圖3A)。在許多類群中,擴張的克隆型數量在TT樣品中具有較低的趨勢(圖3B)。Hyper-expanded CD8+克隆(紅色)僅在PT樣本中觀察到,large-expanded CD8+克隆(橙色)數量在TT樣本中顯著較低(圖3C、D)。此外,對所有CD8+細胞簇的TCR克隆型進行系統檢測,發現CD8_C1至CD8_C4細胞簇具有較多的TCR克隆型,表明這四組細胞具有同源性。與PT組相比,TT組共用的CD8_C1 ~ CD8_C4克隆型顯著減少(圖3E),表明TACE治療后CD8+T細胞克隆擴增受阻。
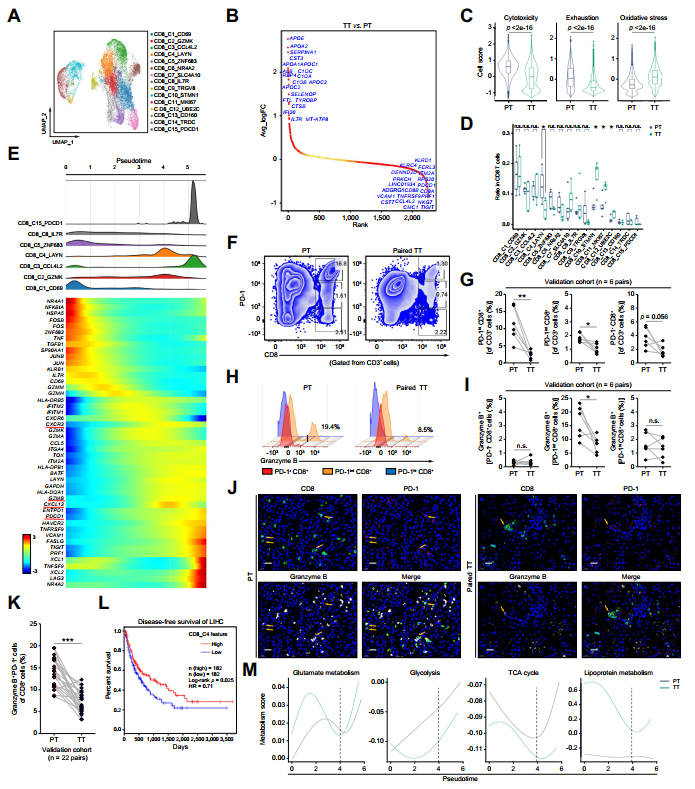
圖2 TACE治療后CD8_C4細胞數量減少
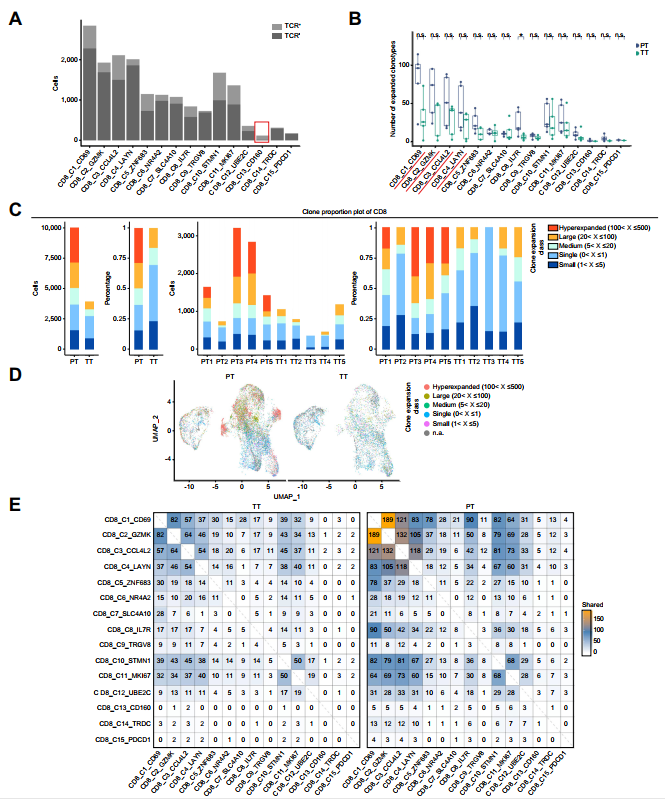
圖3 TACE后CD8+ T細胞的TCR克隆擴增減少
3、肝癌患者TACE治療后TREM2+TAMs數量增加
由于髓系細胞在調節T細胞浸潤和功能方面發揮關鍵作用,作者檢測了髓系細胞的scRNA-seq數據。它們被重新聚類成15個群體,包括巨噬細胞、單核細胞、常規樹突狀細胞和漿細胞樣樹突狀細胞(圖4A、B)。
大多數巨噬細胞/單核細胞的頻率在TACE治療后增加(圖4C)。DEG分析表明,TT組TAMs中TREM2表達上調,CD5L表達下調(圖4D)。作者通過流式細胞術從驗證隊列中驗證了這一觀察(圖4E、F)。作者的scRNA-seq數據還揭示了TACE治療后特定亞簇中TREM2的上調和CD5L的下調(圖4G)。有趣的是,來自TCGA數據庫的HCC隊列分析證實,CD45和CD68正常化的TREM2高表達是不良臨床預后的顯著指標。相反,在相同的正常化水平下,CD5L的高表達與更好的臨床結果相關(圖4H)。此外,免疫熒光也證實了驗證隊列中TT組中TREM2+CD68+TAMs的積累增加和CD5L+CD68+TAMs的浸潤減少(圖4I、J)。
接下來,作者對TAMs /單核細胞進行RNA速度分析,以探索跨TAMs的促腫瘤信號通路的變化,35個C1QC+TAMs和SPP1+TAMs具有末端進化狀態,(圖5A)。GO通路分析表明C1QC+TAMs在功能上與急性炎癥和補體激活通路相關。相反,SPP1+TAMs表達參與血管生成、成纖維細胞增殖和中性粒細胞活化的特定基因(圖5B)。與PT組相比,TT組補體激活、吞噬和血管生成相關基因的表達水平顯著升高,但IFN誘導基因的表達水平顯著降低(圖5C)。特別是與血管生成相關的基因在SPP1+TAMs中富集(圖5D)。總的來說,這些數據表明TAMs在TACE治療后表現出腫瘤誘導的血管生成表型。
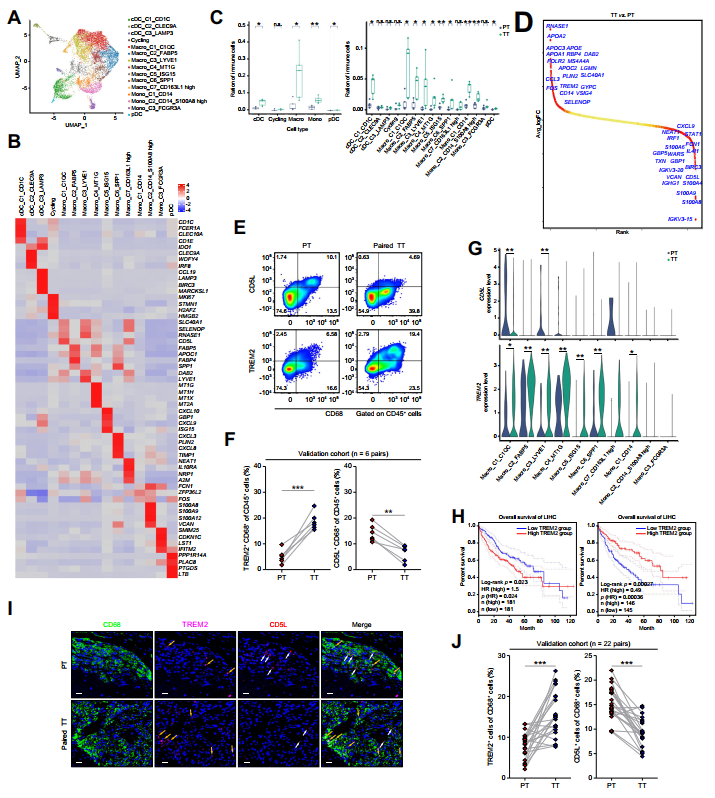
圖4 TACE治療后TREM2+TAM數量增加
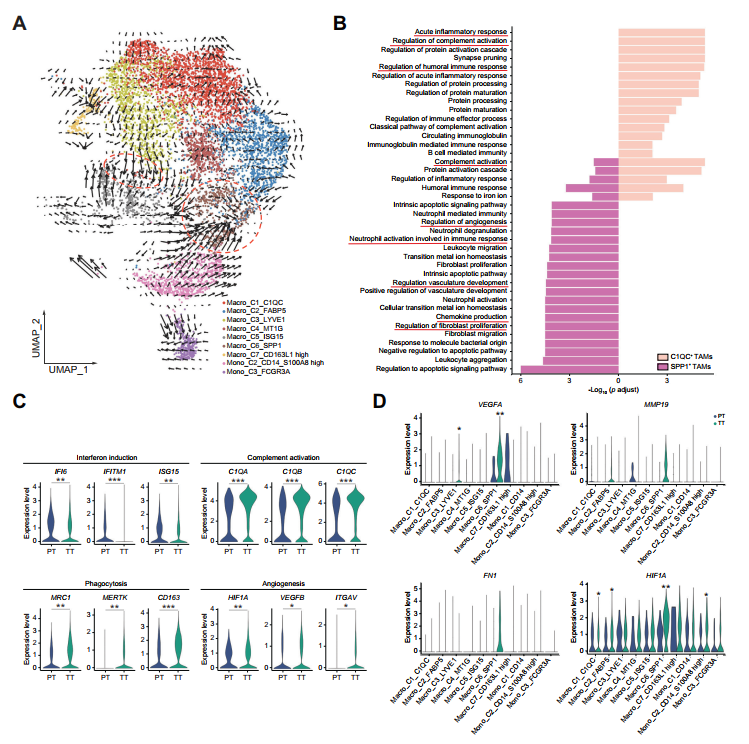
圖5 TT樣品中的TAM顯示出增強的血管生成表型
4、TREM2+TAMs通過低分泌CXCL9和增強GAL-1的產生來抑制CD8+T細胞的浸潤
作者使用受/配體分析來研究CD8+T細胞與TAM表型之間的關系。TACE治療后,趨化因子和檢查點DEG分析顯示CXCL9和PDCD1表達水平顯著降低(圖6A)。趨化因子受/配體分析進一步揭示了CXCL9 / CXCR3軸在CD8+T細胞浸潤中發揮著比CXCL10/CXCR3軸更重要的調控作用(圖6B)。有趣的是,在TT樣本中,CXCL9的表達顯著降低,而CXCL10和CXCR3的表達沒有顯著變化(圖6C、D)。此外,盡管CD8+T細胞中PDCD1的表達在許多TT樣本子簇中降低,但CD274配體在巨/單細胞中幾乎沒有變化(圖6E-G)。這些結果表明,TACE治療后CD8+T細胞的浸潤受到CXCL9 / CXCR3軸下調的阻礙,而不是PD-1 / PD-L1軸的下調。為進一步探索CXCL9下調的分子機制,作者研究了TREM2+vs . TREM2-巨噬細胞。火山圖表明,與CXCL9下調相反,LGALS1(GAL-1)在TREM2+TAMs中上調(圖6H),這會阻礙CD8+T細胞的功能。36-38此外,作者利用TCGA數據庫分析了TREM2與CXCL9 / LGALS1之間的遺傳相互作用,發現在HCC TAMs中TREM2與CXCL9呈負相關,而與LGALS1呈正相關(圖6I)。
為進一步研究TREM2+TAMs中CXCL9和GAL-1的分泌情況,作者采用流式細胞術對驗證組中的6個配對樣本進行檢測。雖然CXCL9主要在TREM2-TAMs中表達,但GAL-1在TREM2+TAMs中的表達明顯高于TREM2-TAMs;PT和TT樣品之間無顯著性差異(圖7A、B)。與此一致,ELISA實驗發現TREM2+TAMs比TREM2-TAMs釋放更少的CXCL9和更多的GAL-1(圖7C)。重要的是,基于TCGA數據庫,LGALS1的高表達和LGALS1hiTREM2hi被CD68正常化的基因標簽都是不良臨床預后的可靠指標(圖7D)。通過跨內皮遷移實驗,作者觀察到與TREM2+TAMs共培養時遷移的CD8+T細胞數量比與TREM2-TAMs共培養時減少。抗CXCL9抗體的加入阻斷了CD8+T細胞的遷移,而抗GAL-1抗體增強了CD8+T細胞的遷移(圖7E、F)。此外,與TREM2-TAMs相比,TREM2+TAMs對CD8+T細胞的細胞毒活性的抑制作用更強(圖7G),這與之前的研究結果一致。18此外,作者發現TREM2+TAMs釋放的GAL-1誘導了VE細胞PD-L1的過表達(圖7H)。來自驗證隊列的免疫熒光和流式細胞術檢測鞏固了TT樣本中PDL1+CD31+VE細胞數量的增加,但TT樣本中非血管區域的PD-L1+CD31-腫瘤細胞減少(圖7I-K),表明PD-L1+VE細胞作為抑制CD8+T細胞遷移的障礙。總體而言,TACE治療后,TREM2+TAMs低水平的CXCL9分泌和高水平的GAL-1分泌共同抑制了CD8+T細胞的浸潤和抗腫瘤活性。
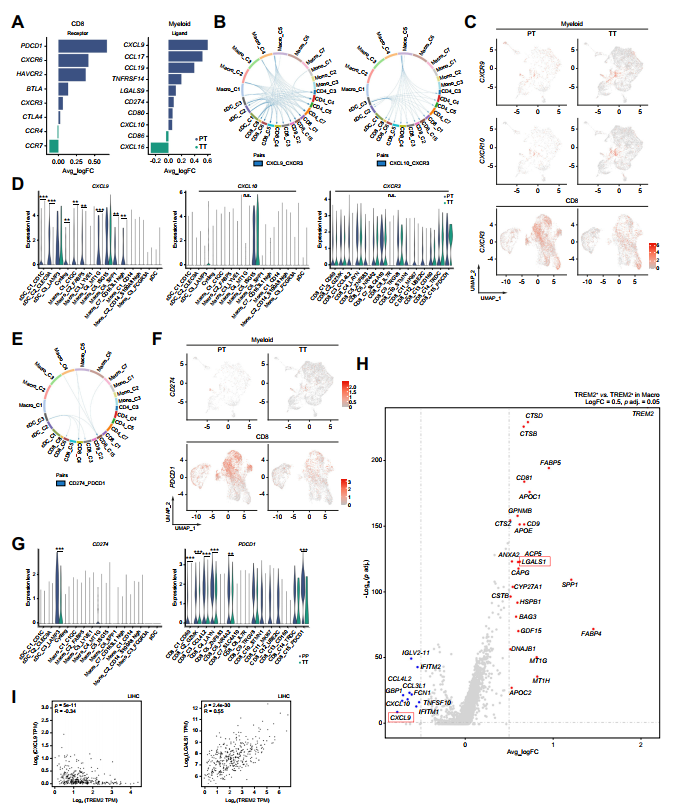
圖6 TREM2+TAMs中CXCL9表達降低,LGALS1表達升高
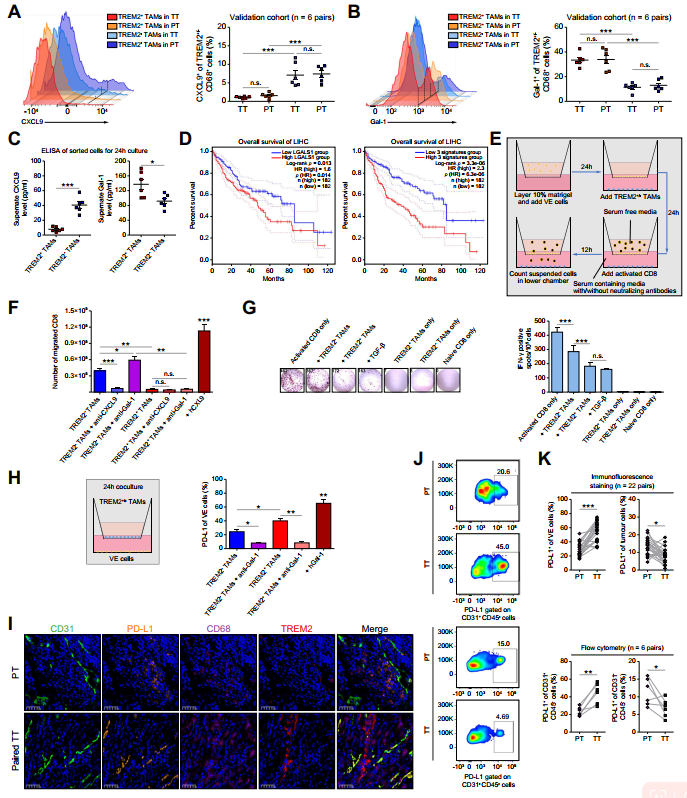
圖7 TREM2+TAMs通過低分泌CXCL9和增加GAL-1的產生,阻礙CD8+T細胞的浸潤
5、TREM2缺失減弱HCC腫瘤生長并提高抗PD-L1治療的療效
體內實驗確定TREM2+TAMs是否促進HCC腫瘤生長。構建兩種模型,即原位注射Hepa1-6細胞和基于NASH的自發性HCC。在兩種肝癌模型中,TREM2-WT小鼠的腫瘤生長呈進行性,而TREM2-KO小鼠的腫瘤生長明顯減弱(圖8A、B)。然后,作者檢測了兩種HCC模型中免疫細胞的浸潤情況。作者的數據顯示,雖然CXCL9+TAMs的頻率增加,但TREM2-KO小鼠中GAL-1+TAMs減少。此外,在TREM2-KO小鼠中,NK細胞和CD8+T細胞的頻率顯著升高,并伴隨CD8+T細胞中PD-1和IFN-c的上調。提示TREM2缺失增加NK / CD8+T細胞的浸潤,促進CD8+T細胞的活化和細胞毒性。結果與先前的研究一致。此外,PD-L1在CD31+VE細胞中表達下調,而在腫瘤細胞中表達上調(圖8C、D),兩種模型的免疫熒光實驗均驗證了這一發現(圖8E、F)。這一證據揭示了TREM2缺失抑制HCC腫瘤生長的潛在機制。因此,TREM2缺失可能增強腫瘤細胞對抗PD-L1檢查點阻斷的反應性。因此,作者采用上述兩種注射抗小鼠PD-L1抗體的HCC模型進行驗證。該方案在TREM2-KO小鼠中顯示出最強的治療效果(圖8G、H)。無論抗PDL1抗體處理與否,TREM2-KO小鼠CD8+T細胞均增加。TREM2-KO小鼠和抗PD-L1抗體注射組的IFN-c+CD8+T細胞也顯著增加(圖8I、J),具有較強的抗腫瘤活性。
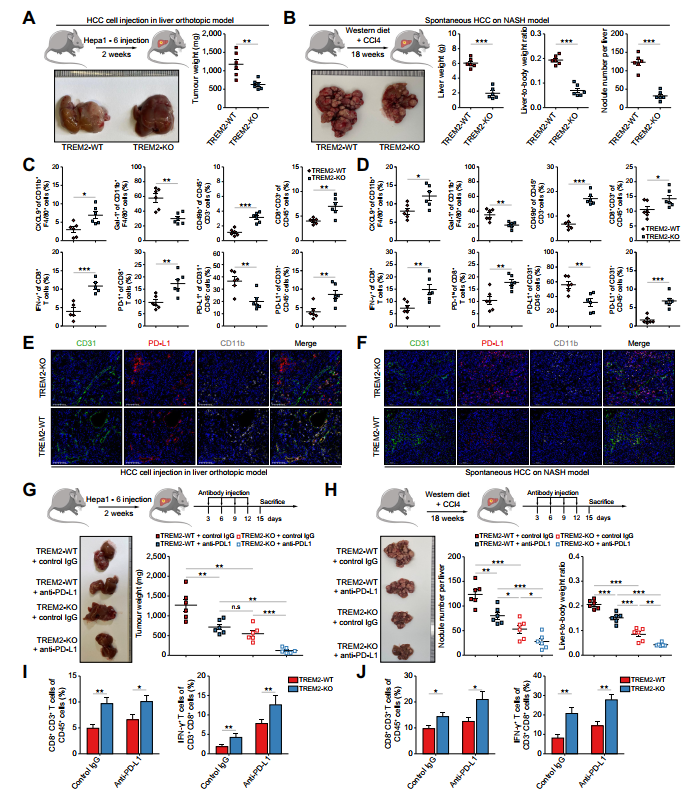
圖8 在兩種HCC模型中,TREM2缺乏可減緩腫瘤生長并增強抗PD-l1治療的療效
結論
總之,本研究數據顯示了TACE后HCC獨特的免疫景觀。作者為TREM2+TAMs引起TACE術后復發和免疫抑制的機制提供了充分的證據,并提出了令人信服的免疫治療靶點。
實驗方法
scRNA-seq單細胞懸液制備,scRNA-seq,血管內皮細胞與巨噬細胞共培養實驗,TREM2-KO小鼠,CD8+T細胞跨內皮遷移試驗,CD8+T細胞功能抑制實驗,流式細胞術,多重免疫熒光染色,ELISAs
參考文獻
Tan J, Fan W, Liu T, Zhu B, Liu Y, Wang S, Wu J, Liu J, Zou F, Wei J, Liu L, Zhang X, Zhuang J, Wang Y, Lin H, Huang X, Chen S, Kuang M, Li J. TREM2+macrophages suppress CD8+T-cell infiltration after transarterial chemoembolisation in hepatocellular carcinoma. J Hepatol. 2023 Jul;79(1):126-140. doi: 10.1016/j.jhep.2023.02.032. Epub 2023 Mar 6. PMID: 36889359.






