國自然熱點追蹤——m7G甲基化近期文獻摘要匯總
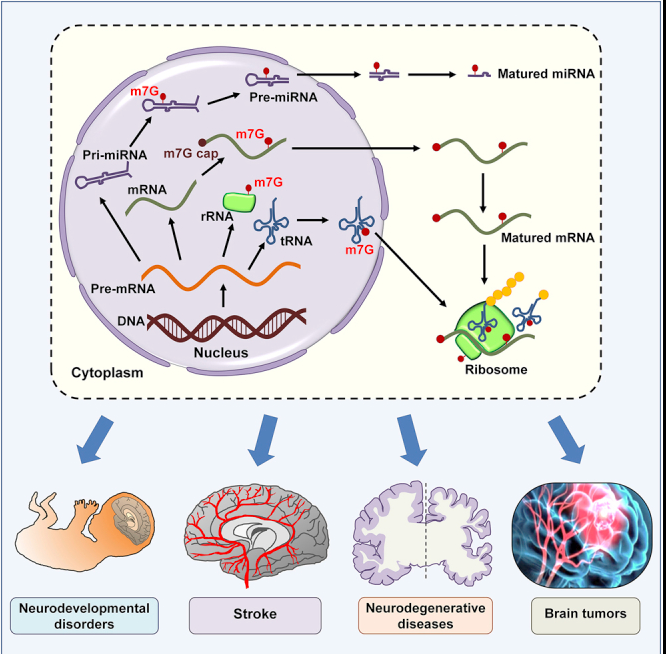
N7 -甲基鳥苷(m7G)是一種最常見的RNA表觀修飾,也是一種進化上保守的RNA修飾,最初是在信使RNA(mRNA)的5‘端發現的。大多數真核細胞mRNAs在其5′端的末端鳥苷的N7位置有一個甲基和一個正電荷。這種修飾穩定了轉錄物免受核外降解,并介導相關生物功能,包括轉錄延伸、pre mRNA剪接、核輸出和翻譯。m7G甲基化還被發現在轉移RNA(tRNA)和核糖體RNA(rRNA)的內部位置。
m7G tRNA修飾由異二聚體蛋白復合物催化,該復合物在哺乳動物中包括甲基轉移酶樣-1蛋白(METTL1)和WD重復結構域4(WDR4), METTL1/WDR4復合體可以將m7G安裝在mRNA上,這會影響mRNA的翻譯效率,也可以催化tRNA中m7G的修飾。 m7G在tRNA核苷酸位置46(m7G46)是最普遍的tRNA修飾之一。m7G46 存在于 tRNA 亞群的可變環區,tRNA-Phe 結構顯示 C13–G22-m7G46堿基三重相互作用,有助于穩定三級結構。在rRNA中,WBSCR22/TRMT112 復合物作為甲基轉移酶參與了18S rRNA前體的加工, 這對于 40S 核糖體亞基之前的核輸出是必需的。
1. METTL1-WDR4甲基化tRNA的結構和機制
RNA 的調控修飾對于正確的基因表達非常重要。 tRNA 富含各種影響其穩定性和功能的化學修飾。 tRNA 46 位的 7-甲基鳥苷 (m7G) 是一種保守修飾,可調節穩態 tRNA 水平以影響細胞生長。 METTL1-WDR4 復合物在人類中生成 m7G46,METTL1-WDR4 的失調與腦畸形和多種癌癥有關。 在這里,我們展示了 METTL1 和 WDR4 如何合作識別 RNA 底物并催化甲基化。 METTL1-WDR4的晶體結構和METTL1-WDR4-tRNA的冷凍電鏡結構表明,復合蛋白表面通過形狀互補性識別tRNA彎頭。 METTL1-WDR4-tRNA 與 S-腺苷甲硫氨酸或 S-腺苷高半胱氨酸的冷凍電子顯微鏡結構以及 METTL1 晶體結構通過揭示多種狀態的活性位點,為催化機制提供了額外的見解。 METTL1 N 末端將輔因子與 tRNA、催化環和 WDR4 C 末端的構象變化結合起來,充當激活 m7G 甲基化的開關。 因此,我們的結構模型解釋了 METTL1 N 末端的翻譯后修飾如何調節甲基化。 我們的工作共同闡明了 METTL1 修飾 m7G 的核心和調控機制,為理解其對生物學和疾病的貢獻提供了框架。

2. METTL1-WDR4 調節 m7G tRNA 修飾的結構基礎
RNA 的化學修飾在許多生物過程中發揮著關鍵作用。 N7-甲基鳥苷 (m7G) 是 大量tRNAs維持 完整性和穩定性所必需的。 含有甲基轉移酶 1-WD 重復序列的蛋白 4 (METTL1-WDR4) 復合物是一種甲基轉移酶,可修飾某些 tRNA 可變環中的 G46,其失調會導致多種癌癥類型的腫瘤發生。 WDR4 突變會導致人類發育表型改變,包括小頭畸形。 METTL1-WDR4 如何修飾 tRNA 底物并受到調節仍然難以捉摸。 在這里,我們通過對人類 METTL1-WDR4 的結構、生化和細胞研究表明,WDR4 可作為 METTL1 和 tRNA T 臂的支架。 tRNA 結合后,METTL1 的 αC 區域轉變為螺旋,與 α6 螺旋一起固定 tRNA 可變環的兩端。 出乎意料的是,我們發現 METTL1 預測的無序 N 端區域是催化口袋的一部分,并且對于甲基轉移酶活性至關重要。 此外,我們發現 METTL1 N 末端區域的 S27 磷酸化通過局部破壞催化中心來抑制甲基轉移酶活性。 我們的結果提供了對 METTL1-WDR4 tRNA 底物識別和磷酸化介導的調節的分子理解,并揭示了 METTL1 假定的無序 N 端區域作為甲基轉移酶活性的聯系。

3. TMEM11 通過 METTL1 介導的 ATF5 mRNA m7G 甲基化調節心肌細胞增殖和心臟修復
線粒體跨膜(TMEM)蛋白家族具有多種重要的生理功能。然而,其在心肌細胞增殖和心臟再生中的作用尚不清楚。在這里,我們檢測到TMEM11在體外抑制心肌細胞增殖和心臟再生。TMEM11缺失增強了心肌細胞增殖,恢復了心肌損傷后的心臟功能。相反,TMEM11過表達抑制了小鼠心臟中新生心肌細胞的增殖和再生。TMEM11直接與METTL1相互作用,增強了Atf5 mRNA的m7G甲基化,從而增加ATF5的表達。ATF5的TMEM11依賴性增加促進了Inca1的轉錄,Inca1是一種細胞周期蛋白依賴性激酶的抑制劑,通過與細胞周期蛋白A1相互作用,抑制心肌細胞增殖。因此,我們的研究結果表明,TMEM11介導的m7G甲基化參與心肌細胞增殖的調節,靶向TMEM11-METTL1-ATF5-INCA1軸可能作為促進心臟修復和再生的新治療策略。

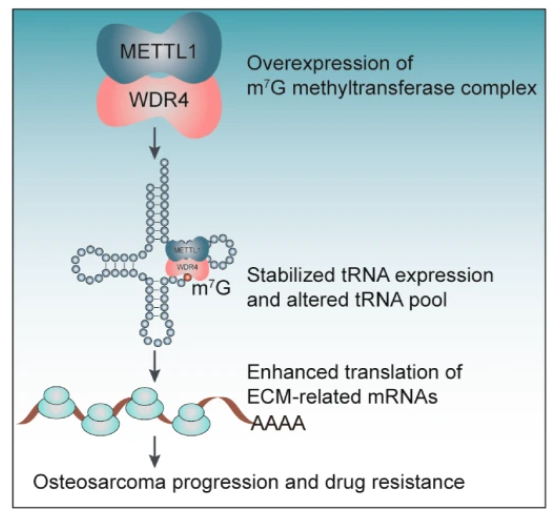
4. METTL1/WDR4介導的tRNA m7G修飾和mRNA翻譯控制促進腫瘤發生和阿霉素耐藥性
骨肉瘤是導致青少年和兒童高死亡率的最常見骨腫瘤。tRNA m7G甲基轉移酶METTL1位于染色體12q14.1中,該區域在骨肉瘤患者中經常擴增,而其在骨肉瘤調節中的功能和潛在機制仍然未知。本文表明,METTL1和WDR4在骨肉瘤中過表達,與患者預后不良有關。敲低 METTL1 或 WDR4 導致 tRNA m7G修飾水平降低并阻礙體外和體內骨肉瘤的進展。METTL1/WDR4 過表達可促進骨肉瘤的增殖、遷移和侵襲。tRNA甲基化和mRNA翻譯分析表明,METTL1/WDR4 修飾的 tRNA 可通過更多 m7G tRNA 解碼密碼子增強 mRNA 的翻譯,包括細胞外基質 (ECM) 重塑效應子,從而促進骨肉瘤進展和對阿霉素的化療耐藥。研究表明METTL1/WDR4介導的tRNA m7G修飾通過改變致癌mRNA翻譯來增強骨肉瘤進展和對阿霉素的耐藥,具有關鍵的致癌功能,表明METTL1抑制聯合化療是治療骨肉瘤患者的有希望的策略。
5. QKI將m7G修飾的內部轉錄物穿梭到應激顆粒中并調節mRNA代謝
N7甲基鳥苷(m7G)修飾通常發生在mRNA 5‘端或tRNA/rRNA內,也存在于mRNA內部。盡管m7G 5‘端對于pre mRNA加工和蛋白質合成至關重要,但mRNA內部m7G修飾的確切作用仍然難以捉摸。在這里,我們報道了mRNA內部m7G被震動蛋白( Quaking proteins ,QKIs)選擇性識別。通過對m7G甲基組和QKI結合位點的轉錄組全譜分析/定位,我們鑒定了1000多個具有保守“GANGAN(N=a/C/U/G)”基序的m7G修飾和QKI-結合的高置信度mRNA靶標。 QKI7與應激顆粒(SG)核心蛋白G3BP1相互作用(通過C末端),并將m7G修飾的內部轉錄物穿梭到SG中,以調節mRNA在應激條件下的穩定性和翻譯。具體而言,QKI7減弱河馬信號通路中基本基因的翻譯效率,從而使癌癥細胞對化療敏感。總之,我們將QKIs表征為調節靶mRNA代謝和細胞耐藥性的mRNA內部m7G結合蛋白。







