Nature子刊—干擾相分離促進抗腫瘤免疫

靶向PD-1/PD-L1軸的免疫療法已成為多種癌癥的一線治療。然而,由于調控PD-1/PD-L1的難以捉摸的機制,只有有限的一部分個體實現了持久的益處。生物分子縮合物涉及廣泛的生理過程,并且也已報道控制癌癥相關的失調。詳細研究生物分子冷凝物形成的機制可能為開發有效的靶向策略提供機會,因為腫瘤細胞中的靶向相分離過程有益于臨床。本文首先通過質譜、CHIP和空間共定位的方法確定了KAT8與IRF1之間能發生相分離。同時,KAT8在K78處乙酰化IRF1以促進其DNA結合,這與H4 K16乙酰化協同作用以增強PD-L1 的表達。又基于KAT8-IRF1縮合物的形成機制,開發了一種細胞穿透阻斷肽2142-R8,其能破壞KAT8-IRF1縮合物,抑制PD-L1的表達,增強體內和體外抗腫瘤免疫。
本文章于2023年3月發表于《Nature cancer》上,IF=22.7 。
技術路線














主要研究內容
1.KAT8能夠調控PD-L1的轉錄
使用全基因組CRISPR-Cas9基因敲除篩選來鑒定IFNγ暴露后腫瘤細胞中PD-Ll表達的調節因子。發現了編碼組蛋白乙酰轉移酶KAT8的基因是我們篩選中最顯著富集的基因之一(圖1a,b)。KAT8敲低后在多個細胞系(骨肉瘤細胞系143B,惡性黑色素瘤細胞系A375和肺癌細胞系A549)PD-L1的總蛋白和mRNA水平顯著降低(圖1c,d)。更重要的是,野生型(WT)KAT8,而不是其C316S催化缺陷突變體,挽救了KAT8耗盡細胞中PD-Ll和H4 K16 ac的下調,表明KAT8的乙酰轉移酶活性對于PD-L1表達的調節是關鍵的(圖1e,f)。接下來,研究了KAT8耗竭導致的PD-L1表達下調是否影響抗腫瘤反應。體外細胞毒性測定顯示耗盡KAT8顯著增強T細胞殺傷(圖1g)。在體內,KAT8耗竭抑制腫瘤生長并降低腫瘤重量(圖1h,i)同時增加小鼠中CD3+ CD8+ T細胞的腫瘤浸潤(圖1j-m)。KAT8消耗不能進一步延緩用抗PD-1治療的小鼠中的腫瘤生長(圖1n,o)。此外,免疫組織化學(IHC),表明在人類癌癥中KAT8和PD-L1之間存在正相關性(圖1p)。

圖1:KAT8在體內外調控PD-L1的轉錄
2.KAT8與IFR1相互作用并形成動態凝聚物
為了研究KAT8如何調節PD-L1 mRNA轉錄,我們應用鄰近標記方法,通過引入TurboID-tagged KAT8進入A375細胞以標記潛在的相互作用蛋白。使用質譜法,我們鑒定IRF1為標記的蛋白質之一。通過內源和外源水平的免疫沉淀進一步證實了KAT8和IRF1之間的相互作用(圖2b)。用單體增強型綠色熒光蛋白-KAT8(mEGFP-KAT8)和IRF1-mCherry轉染的細胞在細胞核中顯示小滴樣凝聚物(圖2c,左)。然而純化的mEGFP-KAT8或IRF1-mCherry單獨顯示出液滴形成的弱能力,而將兩者混合在一起顯著增強液滴形成(圖2c)。液滴形成不依賴于熒光蛋白標簽也不依賴于KAT8乙酰轉移酶活性(圖2d)。此外,液滴能夠隨時間融合,并且在體外和細胞中在光漂白后部分恢復(光漂白后熒光恢復(FRAP))(圖2e-g),這些液滴可被1,6-己二醇和高濃度NaCl破壞(圖2h,i)。總之,這些結果表明KAT 8-IRF 1凝聚物的動態和可逆性質。超分辨率成像顯示內源性KAT8和IRF1在細胞中形成小的凝聚物,并且觀察到共定位的凝聚物(圖2j-n)。此外,當兩種蛋白質濃度高于75 nM時,KAT8-IRF1液滴在體外形成(圖2o-q)。更重要的是,在來自患有癌癥(肺癌、黑色素瘤、乳腺癌和胃癌)的個體的樣品中,還觀察到KAT8和IRF1縮合物,并且兩種蛋白的熒光強度與PD-Ll表達呈正相關(圖2r )。總之,這些結果表明KAT8和IRF1可以在體內和體外形成縮合物。

圖2:KAT8與IRF1在體內外形成動態凝聚物
3.KAT8-IRF1的縮合依賴于多價互相作用
為了探索KAT8-IRF1縮合物的結構基礎,使用IUPred 2分析了這兩種蛋白質的氨基酸序列。將KAT8的氨基酸1-68(KAT81-68)和IRF1140-325(其包括反式激活結構域35)評分為IDR(圖3a,b)。KAT81 -68或IRF11140 -325的耗盡破壞了冷凝物的形成(圖3c,d),而不是預測的IRFl的IDR,負責KAT8相互作用(圖3e)。IRF1 DBD(即IRF1115 -325片段)的缺失也損害了與KAT8的縮合物形成(圖3c,d),表明IRF1的DBD介導與KAT8的相互作用,也是冷凝物形成所必需的。此外,將IRF11 -140與來自不相關轉錄因子MYC或OCT4的IDR融合恢復了與KAT8的縮合物形成,而單獨來自MYC或OCT4的IDR構建體則不能(圖1A)。3f)。光液滴測定還顯示,當KAT8和IRFl IDR與Cry 2融合時,藍光誘導增強了兩種蛋白質的IDR之間的縮合物形成(圖3g,h )。.總的來說,這些觀察結果表明多價相互作用模型,其中IRF1 DBD和KAT8之間的相互作用可能是冷凝物引發的先決條件,并且IRF1和KAT8兩者的IDR之間的弱混雜相互作用促進冷凝物形成。
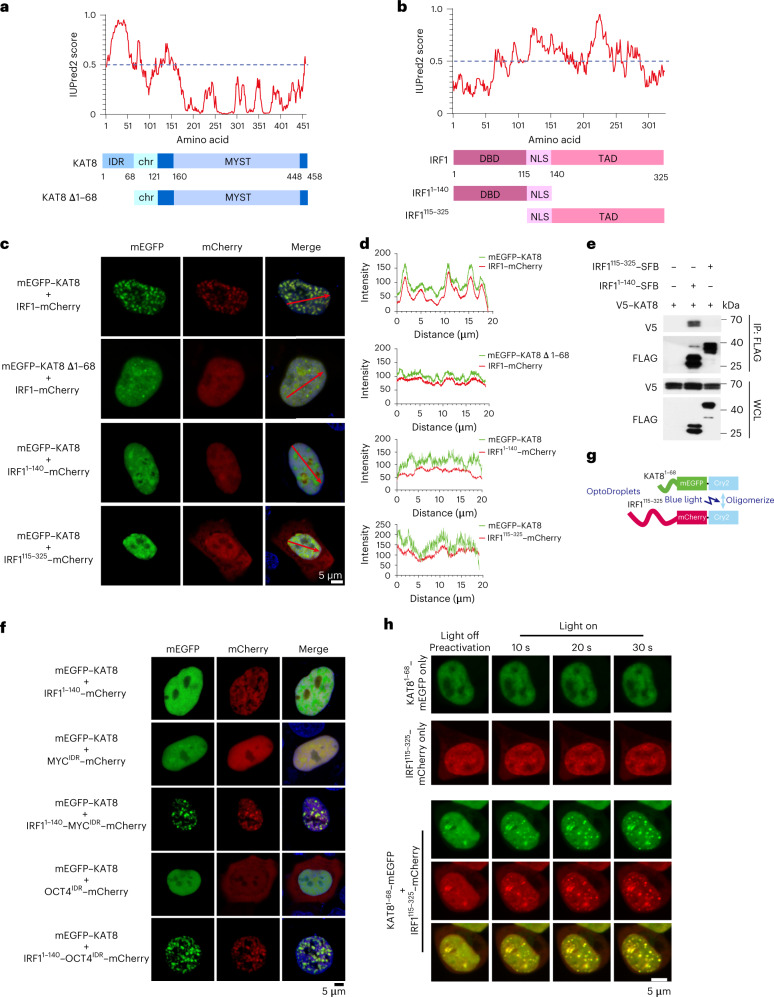
圖3:KAT8-IRF1縮合中的多價相互作用
4.KAT8-IRF1縮合物促進PD-L1 mRNA反式激活
接下來,研究了KAT8-IRF 1縮合物是否可以增強轉錄。轉錄機器組分,包括MED 1 IDR、CDK7、CDK9、BRD4和在絲氨酸5處磷酸化的活性RNA聚合酶II(RNA Pol II-S5 P),在KAT8-IRF1縮合物中富集(4a,b)。為了測試IDR介導的KAT8-IRF 1縮合在轉錄增強中的作用,設計了雷帕霉素誘導的相互作用系統,以通過將KAT8 IDR或IRF1 IDR與FKBP 12或FRB-Gal4 DBD融合來解偶聯結構化的IRF1 DBD-KAT8相互作用和混雜的IDR相互作用。雷帕霉素處理后,用KAT8 IDR-FKBP12和IRF1 IDR-FRB-Gal4 DBD共轉染的細胞在細胞核中顯示小的凝聚物(圖4c),表明該系統可以模擬由KAT8和IRF1 IDR相互作用引起的冷凝。然后,使用Gal4上游活化位點(UAS)報告基因測定評估了IDR縮合的反式激活作用(圖4d)。IRF1 IDR-FRB-Gal4 DBD的轉染增加了報告基因表達,而無IDR對照和KAT8 IDR-FKBP12顯示無活性,并且雷帕霉素誘導不能進一步增強報告基因表達。用KAT 8 IDR-FKBP12和IRF1 IDR-FRB-Gal4 DBD共轉染的細胞顯示出與在不存在雷帕霉素的情況下僅用IRF1 IDR-FRB-Gal 4 DBD轉染的細胞相似的報道基因表達水平,而報道基因表達在雷帕霉素處理后顯著增強(圖4 e)。此外,雷帕霉素劑量-反應曲線在KAT8 IDR-FKBP12和IRF1 IDR-FRB-Gal4 DBD穩定整合的UAS報告細胞中顯示非線性活化模式(圖4f)。這些結果表明IDR介導的KAT8-IRF1縮合促進反式激活。此外,在進行dCas 9-SunTag-sgARRAY介導的原位標記之后,觀察到內源性KAT8和IRF1在細胞中的PD-Ll啟動子處形成縮合物(圖4g-k)。總之,KAT8-IRF1縮合物促進PD-L1 mRNA反式激活。

圖4:KAT8-IRF1縮合物促進PD-L1 mRNA反式激活
5.KAT8乙酰化并促進IRF1的活性
接下來,測試了KAT8是否可以乙酰化IRF1。WT KAT8(但不包括其催化缺陷型C316S突變體)與IRF1的共轉染顯著增強了其乙酰化(圖5a)。.在應用針對乙酰化IRF1K78(K78ac)的特異性抗體后,通過體內和體外乙酰化測定進一步證實了WT KAT8而不是C316S突變體對IRF1K78的直接催化活性(K78ac)(圖5b,c)。更重要的是,耗盡KAT8導致內源IRFl在K78處的乙酰化降低(圖5d)。總之,這些數據表明KAT8特異性乙酰化IRF1K78。為了探索KAT8-IRF1縮合是否促進IRF1K78ac,進行有或沒有液滴形成的體外組蛋白乙酰轉移酶活性測定。IRF1K78ac在液滴中顯著增加(圖5e,f),并且液滴中的KAT8的乙酰化能力比本體中的高約39.67 ± 1.997倍(圖5g)。這些結果提供了KAT8通過共縮合促進IRFl乙酰化的證據。接下來,評估了IRF1 K78ac對PD-L1表達的影響。IRF1 K78R突變體未能上調PD-L1表達,并且在PD-L1啟動子處顯示出降低的豐度(圖5 h)。這些結果表明K78處的乙酰化對于IRFl的DNA結合是重要的。與這些數據一致,通過sgRNA處理消除KAT 8顯著降低IRFl在PD-Ll啟動子處的豐度(圖5i,j)。K78 R細胞表現出PD-Ll mRNA和蛋白質表達的顯著降低(圖5 k)。IRF1在PD-Ll啟動子處的豐度在經受IFNγ處理的K78R細胞中也顯著降低(圖5l)。同樣,由KAT8-IRF1 K78R形成的細胞內縮合物顯示出大的不規則和較低動態的簇,而不與RNA Pol II-SSP共定位(圖5m,n)。盡管K78 R突變體在體外顯示出與KAT8相互作用和共縮合的類似能力(圖5 o,p)。與WT液滴相比,由KAT8-IRF1 K78R形成的液滴顯示來源于PD-L1啟動子的DNA探針的募集顯著減少(圖5o)。總之,這些結果表明KAT8在K78處乙酰化IRF1,這增強了IRF1的DNA結合活性及其對PD-L1啟動子的定位和隨后的PD-L1 mRNA轉錄的激活。
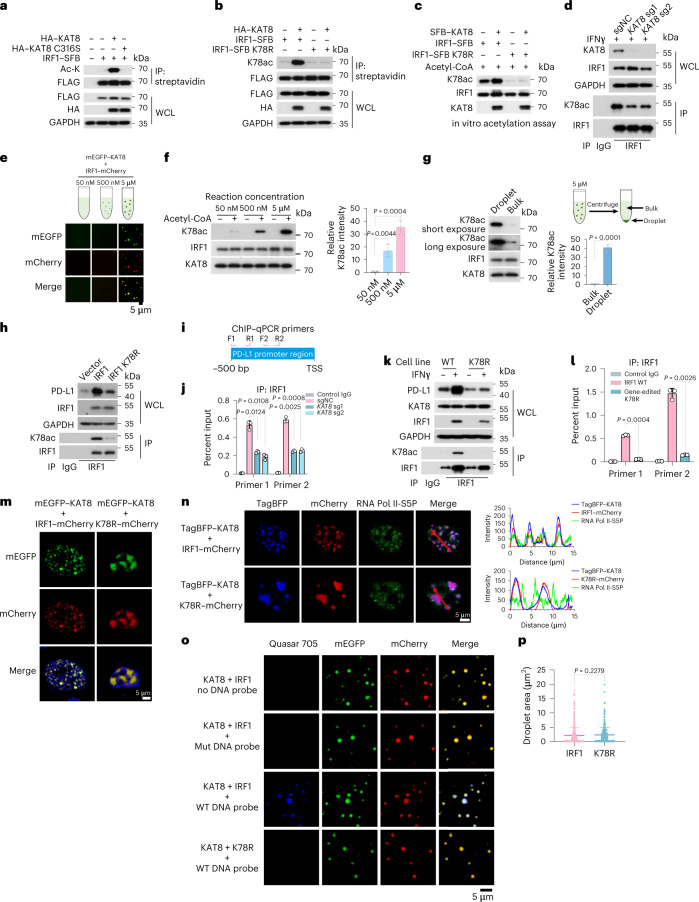
圖5:KAT8乙酰化并促進IRF1的活性
6.IRF 1乙酰化將KAT 8募集至PD-L1啟動子
KAT8是哺乳動物細胞中H4K16ac所需的主要乙酰轉移酶,研究KAT 8是否調節PD-Ll啟動子中的H4K16ac。KAT 8敲低細胞顯示出H4K16ac的總體減少,而其他H4乙酰化位點(H4K5ac、H4K8ac和H4K12ac)保持不受影響(圖6a)。來自ENCODE數據庫的染色質免疫沉淀測序(ChIP-seq)數據顯示KAT 8和IRF 1在PD-L1的啟動子區域富集(圖6 b)。ChIP-qPCR顯示,當KAT 8表達被sgRNA耗盡時,PD-L1啟動子處的H4K16ac也顯著降低(圖6c)。鑒于KAT8和IRF1的共縮合,評估了IRF1是否進而增強響應IFNγ的PD-L1啟動子處的KAT 8募集。具有IRFl耗竭的細胞在IFNγ處理后具有PD-Ll啟動子處的KAT 8和H4 K16 ac的豐度顯著降低(圖6d,e)。此外,K78R細胞在IFNγ暴露后還顯示出降低的KAT8定位和PD-Ll啟動子處的H4K16ac(圖6 f,g),表明IRF 1乙酰化增強PD-L1啟動子處的KAT 8募集和H4K16ac修飾作為正反饋。
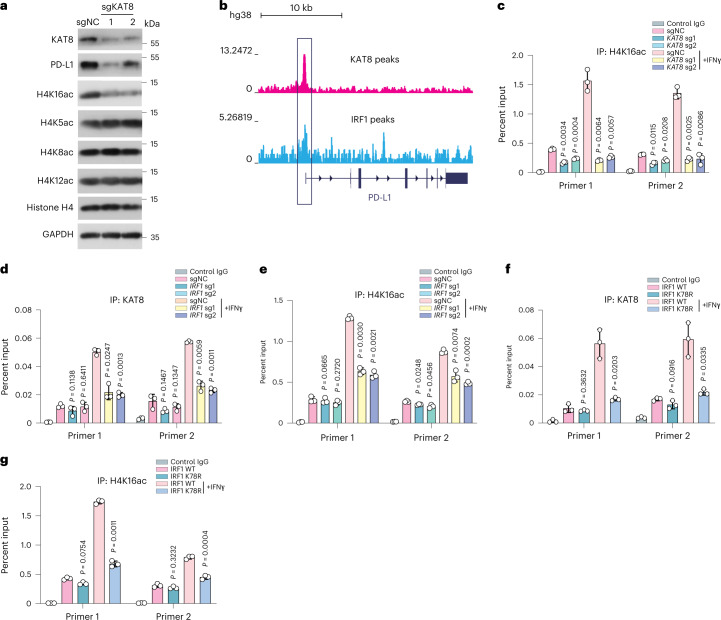
圖6:IRF 1乙酰化將KAT 8募集至PD-L1啟動子
7.破壞KAT 8-IRF 1縮合物抑制PD-L1表達
IRF1 DBD和KAT8之間的結構化結構域相互作用在縮合物形成中的重要作用,表明靶向結構化結構域相互作用也可能破壞KAT8-IRF1縮合物,而不是靶向非結構化IDR。為了測試該假設,構建了一系列IRF1 DBD截斷(圖7a)并各自在細胞中與KAT8共轉染以鑒定負責與KAT8相互作用的IRF1的最小區域。然后將人和小鼠中的完全保守的N-末端區域鑒定為負責IRF1-KAT 8相互作用的主要區域(圖7 b-d),并且預測的β-片層的關鍵殘基47、48(Mut)的突變消除了相互作用(圖7c-f)。接下來,合成了兩種肽,2142-R8和Mut-R8,其衍生自2142和Mut,其中8個精氨酸殘基融合到它們的C末端(R8)。為了評估2142-R8在細胞中的生理條件下對KAT8-IRF 1縮合物的破壞能力,使用具有V5-TurboID標記的KAT 8的鄰近標記系統(圖2a)。在用2142-R8處理細胞后,生物素標記的IRF1的水平顯著降低(圖7 g),表明細胞中IRF 1和KAT 8之間的相互作用被抑制。因此,IRF1 K78的乙酰化被抑制,并且PD-L1啟動子處的H4K16ac減少(圖7h,i)。同樣,在細胞中和體外2142-R8處理后,KAT 8-IRF 1縮合物減少(圖7j,k)。最重要的是,2142-R8有效地抑制了用IFNγ處理的細胞中PD-Ll表達的上調(圖7l,m)。此外,RNA測序分析顯示,2142-R8處理下調PD-Ll,而主要組織相容性復合物I類(MHCI類)相關基因和大多數IRFl下游的表達保持不變,這與來自KAT 8耗盡細胞的數據一致(圖7 n,o)。總之,這些結果表明了2142-R8破壞KAT 8-IRF 1縮合物抑制PD-L1表達。

圖7:2142-R8破壞KAT 8-IRF 1縮合物抑制PD-L1表達
8.2142-R8肽增強抗腫瘤免疫
評估2142-R8在增強抗腫瘤免疫中的功效,體外細胞毒性測定顯示2142-R8而非Mut-R8增強T細胞殺傷(圖8a)。在體內,用2142-R8而不是Mut-R8處理減少了荷瘤小鼠中KAT 8-IRF1斑點的共定位、腫瘤體積和腫瘤重量(圖8b-e)。同樣,腫瘤PD-Ll表達降低,并且活性CD8 + T細胞的浸潤通過2142-R8而不是Mut-R8增加(圖8f-l)。總之,這些結果說明2142-R8肽抑制PD-L1表達并增強體內抗腫瘤免疫。
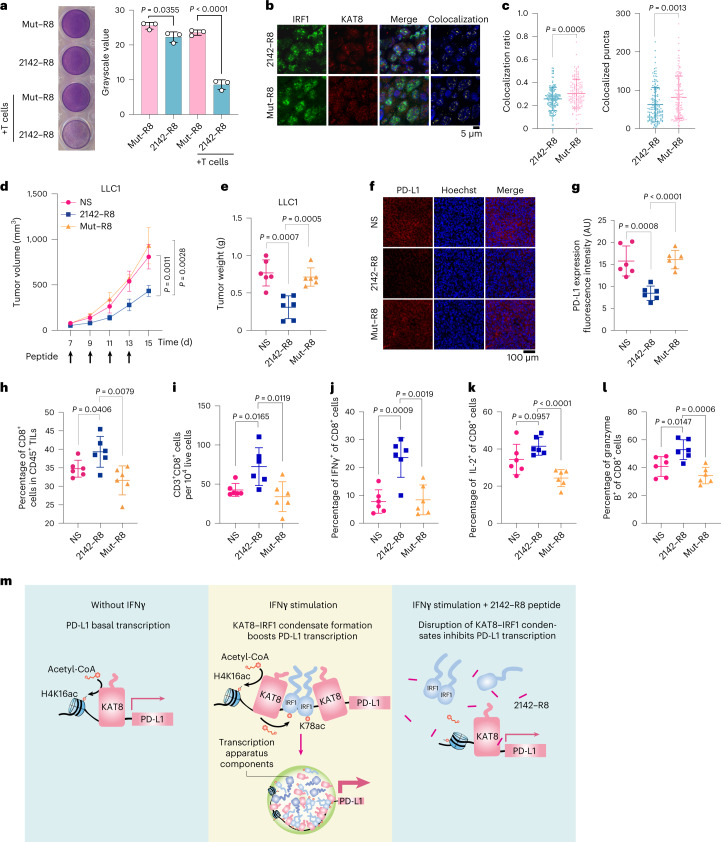
圖8:2142-R8肽增強抗腫瘤免疫
結論
越來越多的證據表明生物分子縮合物在調節癌癥發展,這表明靶向這一過程可能是有希望的。這篇文章在KAT8-IRF1縮合物的背景下,證明了IRF1 DBD和KAT8之間的特定結構化相互作用是縮合物引發的先決條件,而IRF1和KAT8 IDR的弱混雜相互作用促進縮合物形成。基于這種機制,鑒定了2142-R8肽,其可以阻斷IRF1 DBD和KAT8相互作用并破壞KAT8-IRF1縮合物的形成,隨后抑制PD-L1表達和增強體外和體內抗腫瘤免疫。總之,這些的數據表明,抑制癌癥相關冷凝物的形成可能是一種潛在的癌癥治療策略。
實驗方法
構建質粒,免疫共沉淀實驗,共轉染實驗,細胞免疫熒光實驗,組織IHC和熒光IHC,體外乙酰化測定,液滴和大量樣品的乙酰化,體外毒性試驗,肽下拉實驗,蛋白表達和純化實驗,相分離實驗,optoDroplets實驗,Gal 4-UAS-mEGFP報告基因實驗,質譜,鄰近標記分析,流式細胞術,dCas9-SunTag PD-L1啟動子可視化,全基因組CRISPR-Cas9基因敲除篩選,RNA測序和分析流水線,westernblot,RT-qPCR,體內成瘤實驗,熒光漂白恢復實驗。
參考文獻
Wu, Y., Zhou, L., Zou, Y., Zhang, Y., Zhang, M., Xu, L., Zheng, L., He, W., Yu, K., Li, T., Zhang, X., Chen, Z., Zhang, R., Zhou, P., Zhang, N., Zheng, L., & Kang, T. (2023). Disrupting the phase separation of KAT8-IRF1 diminishes PD-L1 expression and promotes antitumor immunity. Nature cancer, 4(3), 382–400. https://doi.org/10.1038/s43018-023-00522-1






