scRNA-seq揭示RCT誘導腫瘤生態系統重塑

放化療(RCT)是一種治療宮頸癌癥的有效方法,它不僅影響惡性細胞,而且影響腫瘤免疫和基質細胞。在本研究中,作者將RCT前后的宮頸癌組織進行單細胞RNA測序(scRNA-seq),發現RCT后殘留的上皮細胞上調MHC II類基因表達。此外,RCT過程中募集具有促炎性質的單核細胞樣髓系抑制細胞(MDSCs)和高表達細胞毒性基因的CD16+ NK細胞。然而,RCT后細胞毒性T細沒有顯著增加。該研究于2023年1月發表在《Signal Transduction and Targeted Therapy》,IF:39.3。
技術路線

主要研究結果
1. scRNA-seq鑒定RCT宮頸癌微環境動態變化
作者從2名宮頸上皮腫瘤患者中收集三份鄰近正常宮頸組織樣本用于scRNA-seq(圖1a)。此外,作者還利用了由15個免疫組織化(IHC)驗證的RCT前與RCT后宮頸癌樣本構成的cohort 1,以及由20個RCT前與RCT后宮頸癌樣本bulk RNA-seq數據構成的cohort 2(圖1b)。作者富集免疫細胞、上皮細胞、內皮細胞、成纖維細胞進行scRNA-seq。在這些細胞中,作者共注釋出9種細胞簇:髓系細胞,T細胞,漿細胞,B細胞,DC細胞,內皮細胞,內皮細胞,血管成纖維細胞,以及基質成纖維細胞(圖1c)。作者發現,RCT后上皮細胞顯著降低,而髓系細胞明顯升高(圖1d)。
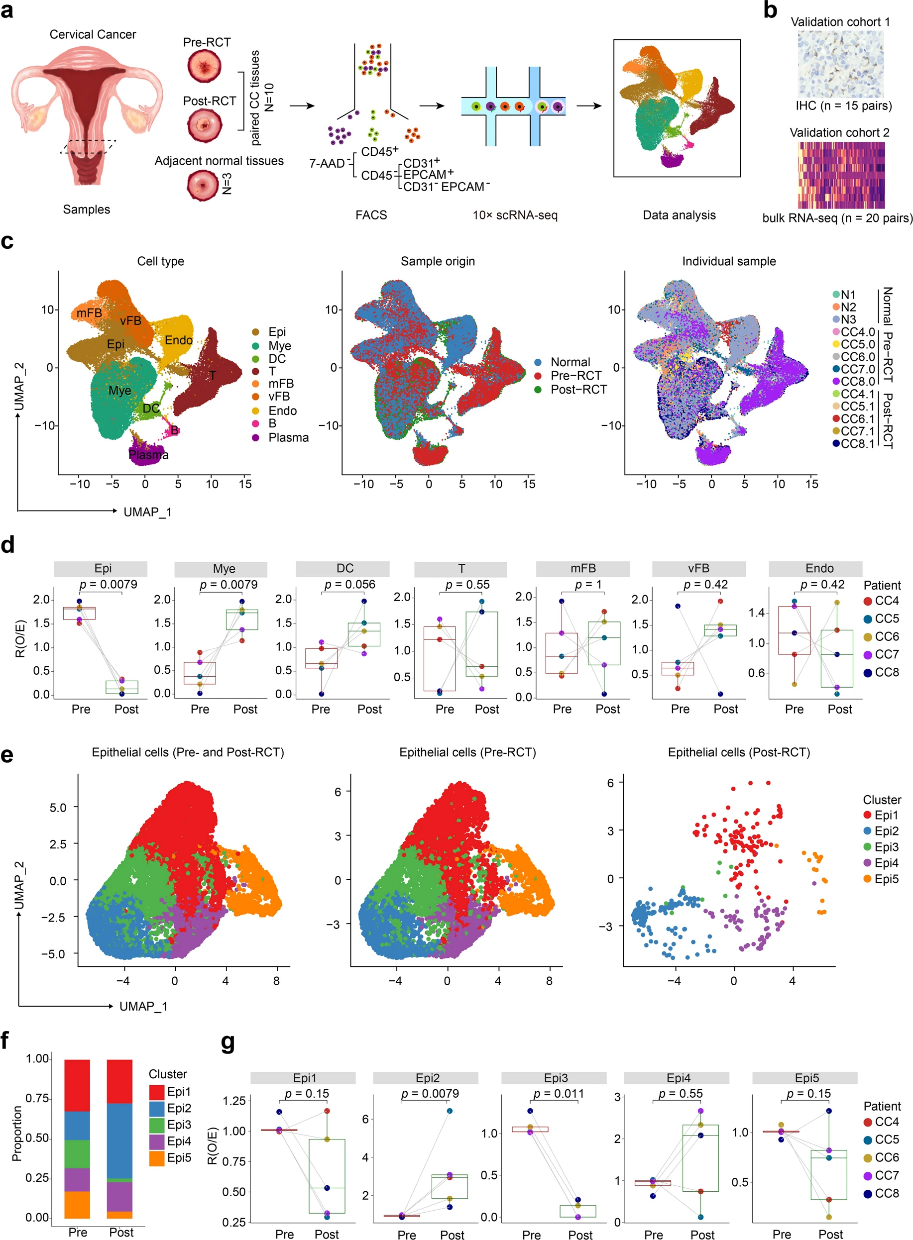
圖1:RCT前后宮頸癌單細胞微觀
2. 上皮細胞亞型之間存在不同的RCT敏感性和免疫原性
接下來,作者對上皮細胞進一步聚類,共產生五種亞群Epi1-5(圖1e)。RCT改變了這五種上皮細胞亞群比例,最顯著的是Epi2比例增加和Epi3比例減少(圖1f,g)。然后,作者對RCT如何影響上皮細胞亞群的免疫反應進行研究。免疫相關最高差異表達基因(DEG)和GO數據顯示,參與白細胞趨化、淋巴細胞活化、抗原呈遞和處理基因表達增加(圖2a–c)。RCT后,所有上皮細胞以及Epi1/4/5中顯著上調抗原呈遞和處理基因(包括MHC-II),雖然抗原處理和呈遞通路在Epi2/3中保持相對穩定,但只有Epi2顯示MHC-I表達下調(圖2d,e)。患者樣本中的特征基因表達也出現類似的變化:在多數患者中,觀察到的基因表達變化與總體基因表達變化相對應。來自cohort 1樣品的IHC染色也證實RCT后上皮細胞MHC-II基因表達上調(圖2f,g)。
接下來,作者評估RCT如何影響上皮細胞亞群的惡性特征。與正常和RCT后樣本相比,RCT前樣本中G2/S期基因表達比例更高(圖2h)。雖然3個上皮細胞亞群中非整倍體細胞(腫瘤細胞)比例在RCT后降為零,但在RCT 3周后檢測到Epi2/3中仍然殘留大量非整倍體細胞(圖2i)。盡管殘留的Epi2/3亞群在同時間點沒有發生增殖(圖2h),但Epi2高表達SPRR和S100A家族基因,它們是癌前期和癌轉移標志。
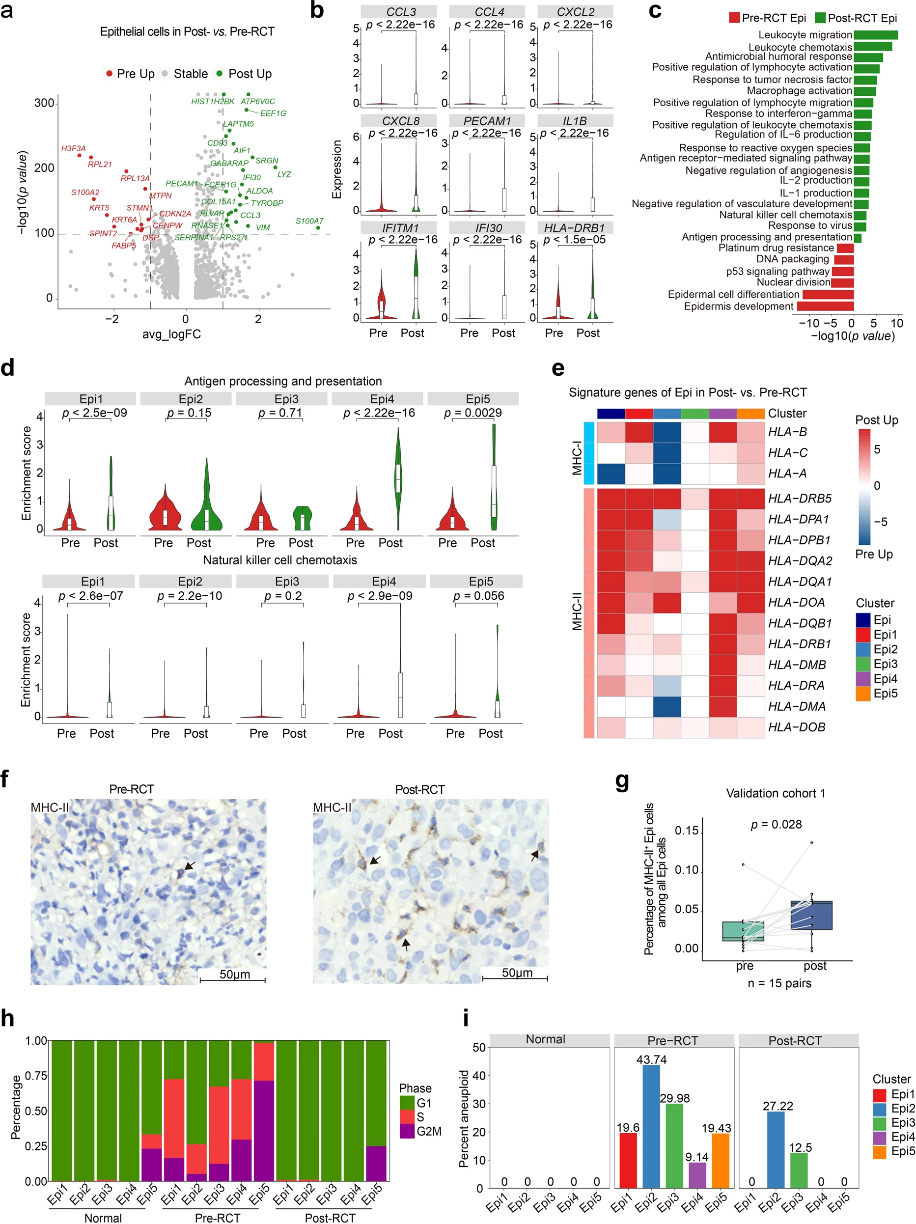
圖2:RCT激活上皮細胞免疫反應
3. RCT誘導髓系細胞促炎基因的表達
根據標記基因的表達,作者將髓系細胞分為七個亞群:三種巨噬細胞亞型、兩種單核細胞來源的髓系抑制細胞(M-MDSCs)和兩種DC群體(圖3a)。髓系細胞可能同時包含促腫瘤和抗腫瘤的細胞亞群。為驗證這一觀點,作者量化促炎M1-和抗炎M2相關基因在巨噬細胞亞群中的表達,發現它們顯示出M1和 M2綜合特征(圖3b)。髓系細胞組成在RCT后有所改變(圖3c,d): FCN1_M-MDSC相對比例顯著增加,CD1C_DC相對比例下降。cohort 1中的IHC以及cohort 2中bulk RNA-seq數據也證實了FCN1_M-MDSC的富集。無論細胞亞群比例如何,RCT后所有亞群的促炎信號均有所增加(圖3h)。GO結果顯示,參與白細胞遷移和激活的基因在RCT后中M-MDSCs、巨噬細胞和DC中表達增加(圖3i、j)。
與所報導的輻射募集MDSCs一致,作者觀察到M-MDSCs趨化和遷移的富集時期(圖3i),這可能有助于FCN1_MMDSC的增加(圖3d)。此外,FCN1_M-MDSC亞群的促炎和抗炎特征分別顯著上調和下調(圖3h)。總而言之,RCT通過誘導髓系細胞中促炎基因表達和促進具有促炎上調和抗炎下調功能的FCN1_M-MDSCs募集,改變了宮頸癌的免疫平衡。
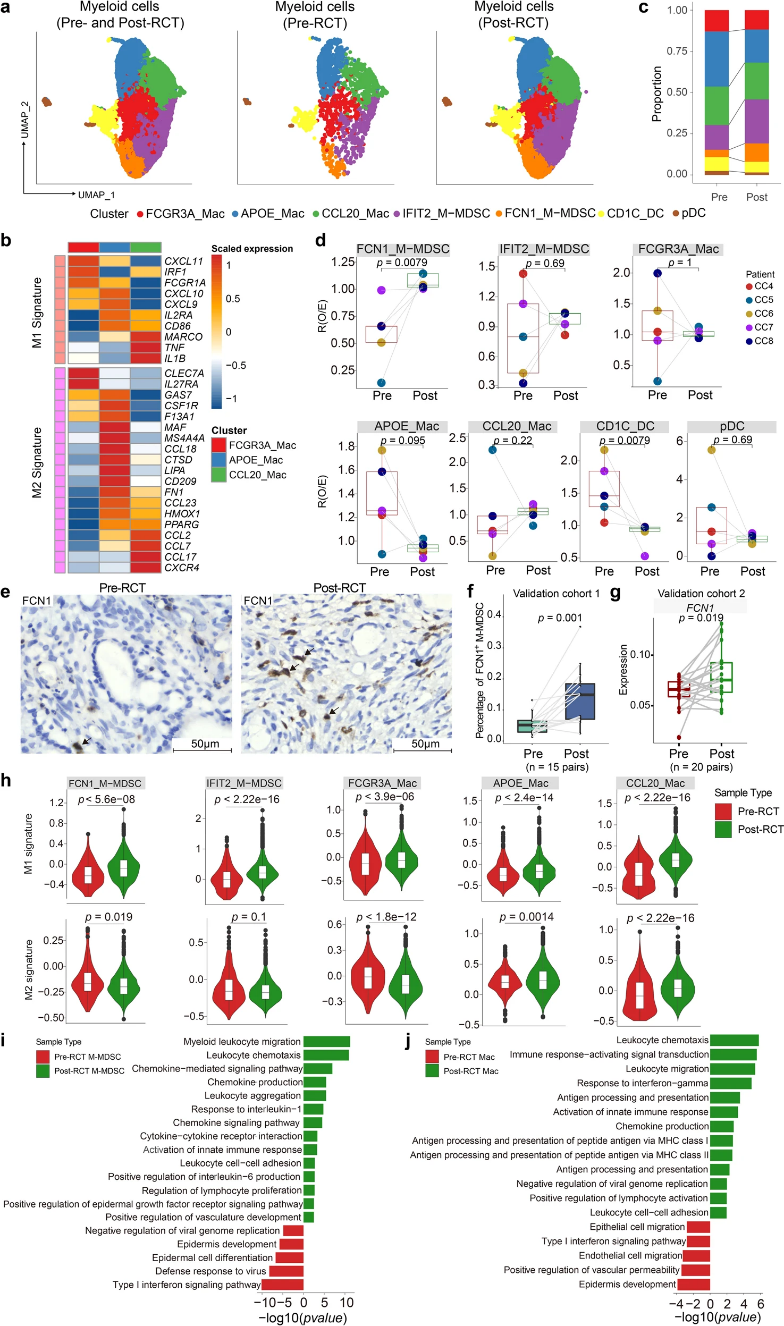
圖3:RCT增加具有促炎特征的FCN1_M-MDSC細胞
4. RCT嚴重影響淋巴細胞.
淋巴細胞中NK和T細胞具有促腫瘤或抗腫瘤作用。作者檢測到10個T細胞亞群和2個NK細胞亞群(圖4a)。RCT后,CD16_NK細胞比例顯著增加,而CD56_NK細胞比例保持不變(圖4b,c)。cohort 1樣本IHC驗證了CD16_NK細胞的增加(圖4d,e),cohort 2數據驗證了CD16表達的變化(圖4f)。NK細胞DEG和GO結果顯示,RCT后,兩個NK細胞亞群中與白細胞遷移相關基因以及CD16_NK細胞亞群中細胞毒性相關基因均有所增加(圖4g、h)。CD16_N K細胞增強了RCT后GZMB、GZMH和NKG7的表達,主要在NK細胞毒性顆粒中表達(圖4i)。同時,作者發現細胞毒性基因的表達與患者生存率呈正相關(圖4j)。隨著NK細胞組成發生變化,RCT后局部T細胞群也發生重組。其中,CD4_naive細胞顯著增加,而Exhausted_CD8_T細胞顯著降低(圖4k)。盡管所有T細胞亞群中的抑制特征下調,但細胞毒性評分沒有增加,這與NK細胞不同(圖4l)。
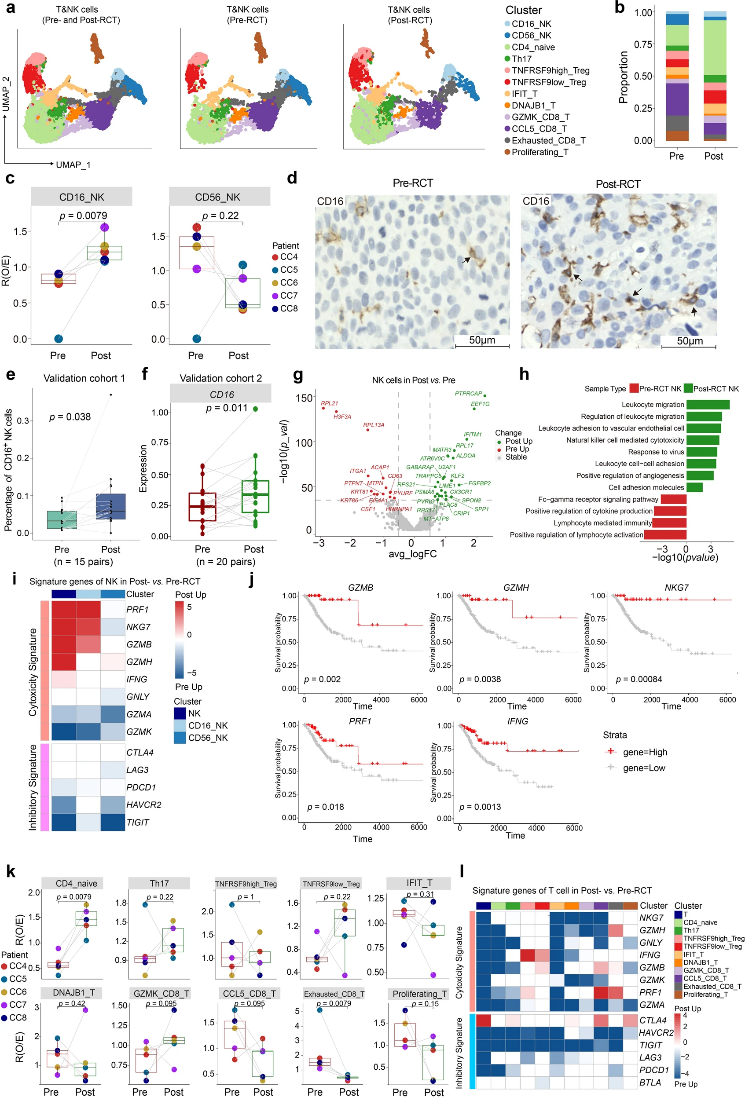
圖4:RCT增加具有細胞毒性特征的CD16_NK細胞豐度
5. RCT期間癌相關成纖維細胞減少促瘤特征基因表達
成纖維細胞影響腫瘤發展過程。作者鑒定成纖維細胞六個亞群:基質癌相關成纖維細胞(mCAF),炎性CAFs(iCAFs),抗原呈遞CAFs(apCAFs),血管CAFs(vCAFs)(圖5a)。作者比較了RCT前后CAF亞群特征。他們發現,iCAFs和一種apCAFs(以下稱為apCAF2)細胞比例顯著降低,而vCAF1細胞比例增加(圖5b,c)。CAF亞群特征基因表達結果顯示(圖5d),RCT后CAF血管生成特征減少,炎癥評分增加(圖5e,f)。腫瘤特征分析顯示,在RCT治療期間,TNF和JAK/STAT通路表達上調,血管生成通路表達下調(圖5g)。血管生成和免疫抑制均促進腫瘤生長,這些數據表明RCT可能減弱CAF腫瘤促進的功能。

圖5:RCT減弱癌相關成纖維細胞促瘤特征
6. RCT過程中內皮細胞增強血管生成、缺氧和炎癥基因表達
作者鑒定出五個內皮細胞亞群(ECs)(圖6a)。GO結果顯示,EC1富集于干擾素-γ通路和抗原處理與呈遞,EC2富集于上皮細胞遷移,EC3富集于細胞基質粘附,EC4富集于DNA損傷檢查,EC5富集于白細胞趨化(圖6b)。RCT期間,EC2細胞比例顯著降低,RCT后的EC2-4細胞比例占所有EC的一半以上(圖6c,d)。基因的表達和GO相關的EC發展、血管重塑以及缺氧在RCT期間富集于EC中,尤其是EC2-4(圖6e、f)。除了血管生成增強,參與上皮增殖的基因在內皮細胞中表達也顯著上調(圖6e,f)。此外,RCT后缺氧、血管生成以及炎癥相關基因顯著富集,包括TNF-κB和白細胞介素相關通路(圖6g)。
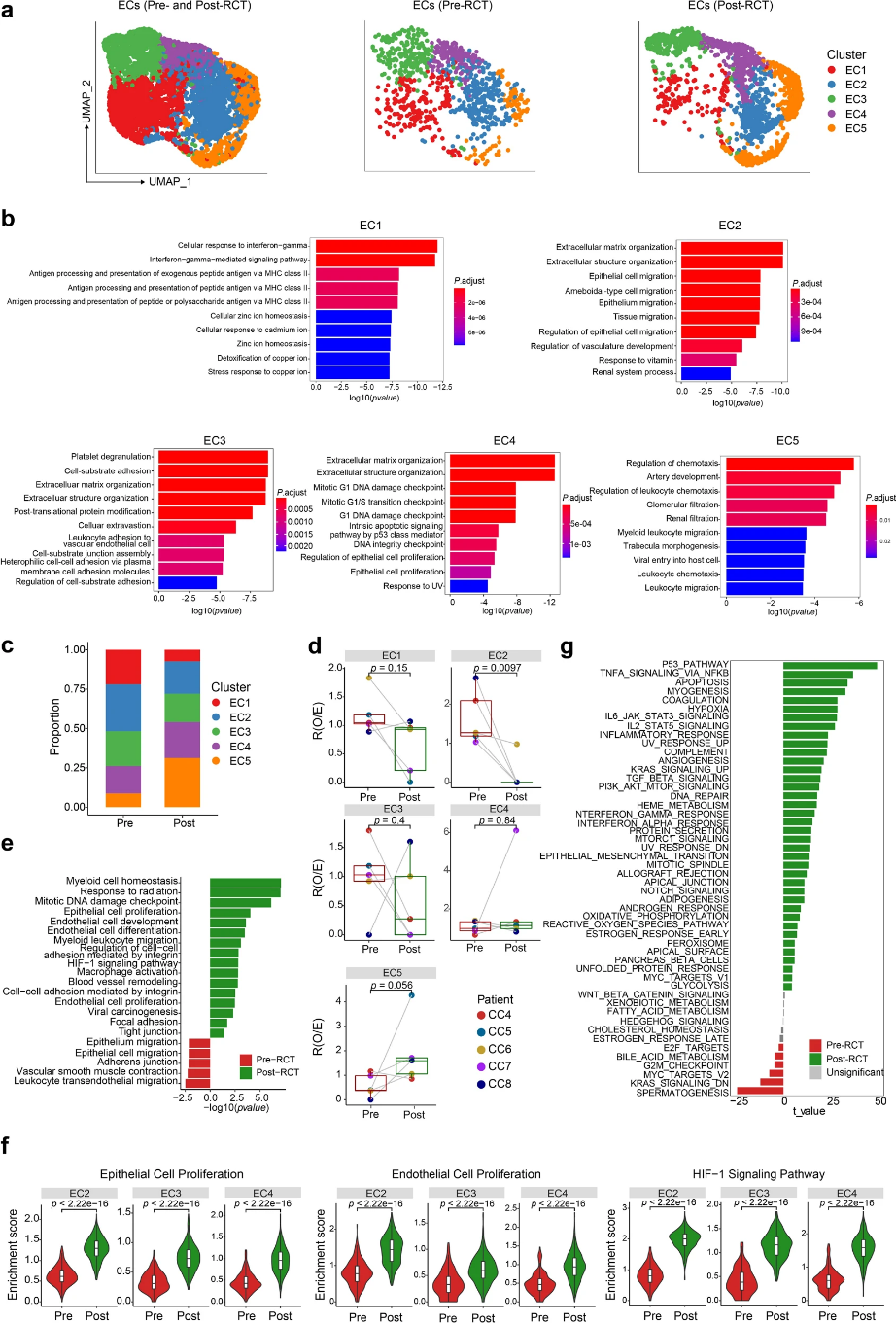
圖6:RCT增強內皮細胞血管生成、缺氧和炎性特征
7. 細胞亞群和細胞相互作用的臨床意義
為了解這些細胞亞群的臨床作用,作者使用CIBERSORTx來評估亞群細胞豐度。他們發現,vCAF2、Exhausted_CD8_T和EC2與宮頸癌患者預后不良顯著相關,而GZMK_CD8_T與預后良好顯著相關(圖7a)。此外,作者還研究了RCT前后樣品中上皮細胞、NK細胞、T細胞、M-MDSCs、巨噬細胞、DC和CAFs中細胞-細胞相互作用網絡(圖7b)。RCT后,M-MDSCs、NK細胞和CAFs具有更多的傳入相互作用,而上皮細胞、T細胞和DC具有較少的傳入相互作用(圖7b)。對于傳出相互作用,M-MDSCs、NK細胞和巨噬細胞在RCT后表現出較少的相互作用,而上皮細胞和CAFs表現出更多的相互作用。同時,作者觀察了RCT前后細胞亞群之間趨化因子的配體-受體相互作用(圖7c)。與RCT前相比,RCT后上皮細胞與M-MDSCs之間以及CAFs與M-MDSCs之間存在更多的相互作用。而NK細胞在RCT后與CCL5-CCR1具有更強的相互作用。
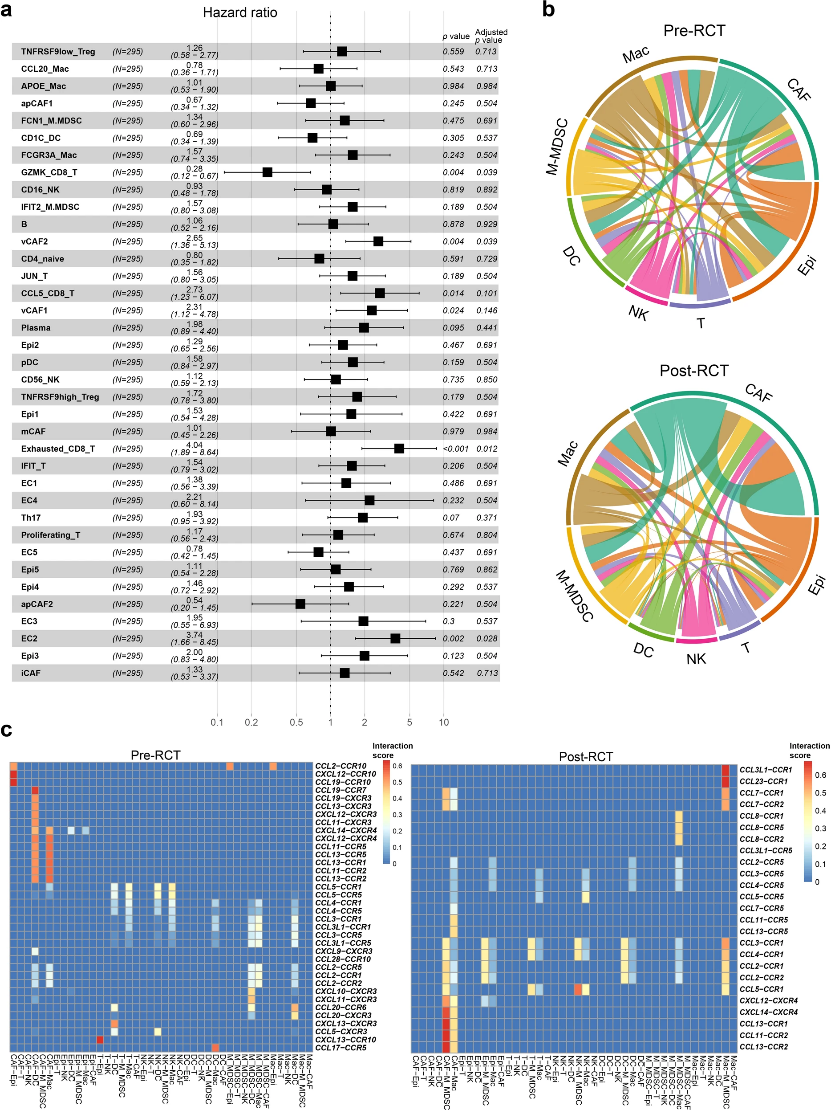
圖7:細胞亞群臨床作用和細胞互作
結論
作者展示了RCT誘導腫瘤生態系統重塑的綜合轉錄景觀。他們發現,RCT后留下了上調MHC II類基因表達的上皮細胞以及惡性上皮細胞。另外,RCT可引起抗腫瘤免疫反,包括募集表達細胞毒性基因的CD16+NK細胞和增加促炎特征的FCN1+M-MDSC細胞。
實驗方法
scRNA-seq,免疫組化染色
參考文獻
Liu C, Li X, Huang Q, Zhang M, Lei T, Wang F, Zou W, Huang R, Hu X, Wang C, Zhang X, Sun B, Xing L, Yue J, Yu J. Single-cell RNA-sequencing reveals radiochemotherapy-induced innate immune activation and MHC-II upregulation in cervical cancer. Signal Transduct Target Ther. 2023 Jan 30;8(1):44. doi: 10.1038/s41392-022-01264-9. PMID: 36710358; PMCID: PMC9884664.






