T細胞耗竭經(jīng)久不衰的熱點:Runx3?DNA甲基化的作用
以PD-1或PD-L1抗體治療為代表的檢查點阻斷免疫療法在臨床實踐中取得了巨大的成功。然而,低的臨床反應(yīng)率和缺乏預測免疫反應(yīng)的生物標志物限制了抗PD-1免疫療法的臨床應(yīng)用。作者此前發(fā)現(xiàn)低劑量DAC和PD-1-ab的聯(lián)合治療可以顯著提高cHL患者的完全反應(yīng)(CR)率,從32%提高到71%,這表明表觀遺傳調(diào)控和免疫治療的臨床反應(yīng)之間存在著明顯的相關(guān)性。本文證明Runx3的DNA甲基化在DAC刺激的PD-1-ab免疫治療過程中對CD8+T細胞的浸潤和分化起著關(guān)鍵作用,這為外調(diào)在免疫治療中的重要作用提供了一個支持機制。本文于2023年5月發(fā)表在《Molecular Cancer》IF:37.3雜志上。
技術(shù)路線

主要實驗結(jié)果
1、臨床樣本組學分析揭示抗PD-1/DAC免疫治療引發(fā)CD8+ T細胞的大規(guī)模甲基化重編程
作者招募了兩組患者,分別接受抗PD -1和抗PD -1/DAC (DP)治療。按照工作流程進行DNA甲基化EPIC和RNA-seq(Fig. 1a)。為探索患者CD8+ T細胞的DNA甲基化重編程譜,獲得了抗PD -1治療患者和預處理DAC患者的CD8+ T細胞的DNA甲基化譜(Fig. 1a)。與抗PD -1治療患者比較,在DAC刺激的抗PD-1治療的患者中檢測到大規(guī)模的去甲基化,并評估了與治療相關(guān)的臨床反應(yīng)(Fig. 1a-c)。此外,確定了295個低甲基化的差異DNA甲基化位點(DMSs),而高甲基化的DMSs數(shù)量為951,發(fā)現(xiàn)在DP聯(lián)合治療組中,低甲基化位點的數(shù)量明顯增加(Fig. 1d)。
為了進一步探索DNA甲基化重編程的動態(tài)特征及其與臨床結(jié)果的相關(guān)性,比較了C1D6(DAC治療后5天)階段與C1D0(治療前基線)階段以及C2D0(抗PD-1治療一個周期后)階段與C1D6(DAC治療后5天)階段的DMSs。結(jié)果顯示,DAC治療后發(fā)生了大規(guī)模的去甲基化,相反,在PD-1阻斷單藥治療組沒有觀察到動態(tài)的DNA甲基化重編程。此外,為確認個別患者的DNA甲基化重編程,定量分析了每個患者的全基因組甲基化水平和差異性甲基化水平(Fig. 1e)。結(jié)果顯示,DP組所有患者的所有CD8+T細胞在C2D0期間(抗PD-1治療一個周期后)都有明顯的去甲基化特征,這意味著DAC引起的去甲基化沒有表現(xiàn)出個體差異。此外,用統(tǒng)計分析法分析甲基化水平,在用抗PD-1與抗PD-1/DAC治療時,觀察到明顯的差異(Fig. 1f)。對DNA甲基化分布的分析顯示,在進行抗PD-1/DAC治療時,高甲基化位點發(fā)生了明顯的DNA去甲基化(Fig.1g)。
然后對DMSs進行了Ingenuity Pathway分析,結(jié)果顯示DMSs主要富集在T細胞衰竭和T細胞激活相關(guān)的通路中,包括T細胞衰竭信號通路、Th1和Th2激活通路,以及NFAT在免疫反應(yīng)調(diào)節(jié)中的作用(Fig.1h)。此外,還分析了DP組CD8+T細胞的C2D0(抗PD-1治療一個周期后)與C1D0(治療前基線)的狀態(tài)。DMSs也主要富集在T細胞衰竭信號通路、細胞毒性T淋巴細胞的CTLA4信號、干擾素信號和干擾素信號中(Fig.1h)。上述結(jié)果表明,DAC治療可能導致T細胞衰竭的逆轉(zhuǎn),增強T細胞的激活和浸潤。

圖1 DAC可以引發(fā)CD8+ T細胞的大規(guī)模重編程
2、Runx3是低劑量抗PD-1/DAC免疫治療改善臨床反應(yīng)的關(guān)鍵介質(zhì)
為研究DNA甲基化重編程是否與基因表達相關(guān),作者進行了RNA-Seq并分析了CD8+T細胞的表達譜。結(jié)果顯示,兩組CD8+T細胞中存在大量的差異表達基因(DEGs)。如火山圖所示,DEGs的表達倍數(shù)變化在C2D0(抗PD-1治療一個周期后)時期明顯增加(Fig. 2a)。通過分析DP組的差異,比較C2D0(抗PD-1治療一個周期后)與C1D0(治療前的基線),發(fā)現(xiàn)CCR2、TNFSF14和TNFSF4等基因下調(diào),CCL3、TIGIT IFNG和CD69等基因上調(diào),CCR3和CCR5等細胞因子在DAC治療后明顯上調(diào),而TOX在DAC治療后則下調(diào)。這些數(shù)據(jù)表明,耗竭T細胞可以被DAC逆轉(zhuǎn),即與浸潤相關(guān)的細胞因子被DAC上調(diào),而不是被抗PD-1上調(diào)。進一步進行IPA途徑富集分析(Fig. 2b)來探索這些發(fā)現(xiàn)可能的生物學意義。結(jié)果顯示,這些差異在T細胞衰竭途徑、Th1和Th2激活途徑和T細胞受體途徑中富集,這與DNA甲基化分析中DMSs的富集結(jié)果高度一致。通過tSNE分析,發(fā)現(xiàn)抗PD-1治療后的CD8+T細胞由兩個不同的群體組成(Fig. 2c)。
通過對DEGs和DMSs的多組學聯(lián)合分析,發(fā)現(xiàn)有3729個基因在DNA甲基化和表達譜方面有交集(Fig. 2d)。通過通路分析,發(fā)現(xiàn)這些通路主要富集在T細胞激活的調(diào)控、免疫系統(tǒng)中的細胞因子信號、免疫系統(tǒng)發(fā)育和白細胞細胞粘附通路的調(diào)控等方面,這表明DP的組合可能在免疫系統(tǒng)的發(fā)育、激活和對細胞因子的反應(yīng)中起核心作用。
由于DMSs和DEGs之間的一致性,作者對這兩個omics數(shù)據(jù)集進行了聯(lián)合分析。發(fā)現(xiàn)Runx3是受調(diào)控最明顯的基因。用DAC治療后,所有CR患者的Runx3啟動子上都保持穩(wěn)定的去甲基化水平和Runx3的高表達水平(Fig. 2e)。DNA甲基化和表達的相關(guān)性被證實(Fig. 2f)。以上數(shù)據(jù)表明在DAC刺激的抗PD-1治療過程中,Runx3啟動子的表觀遺傳重編程在調(diào)控Runx3表達方面起著關(guān)鍵作用。
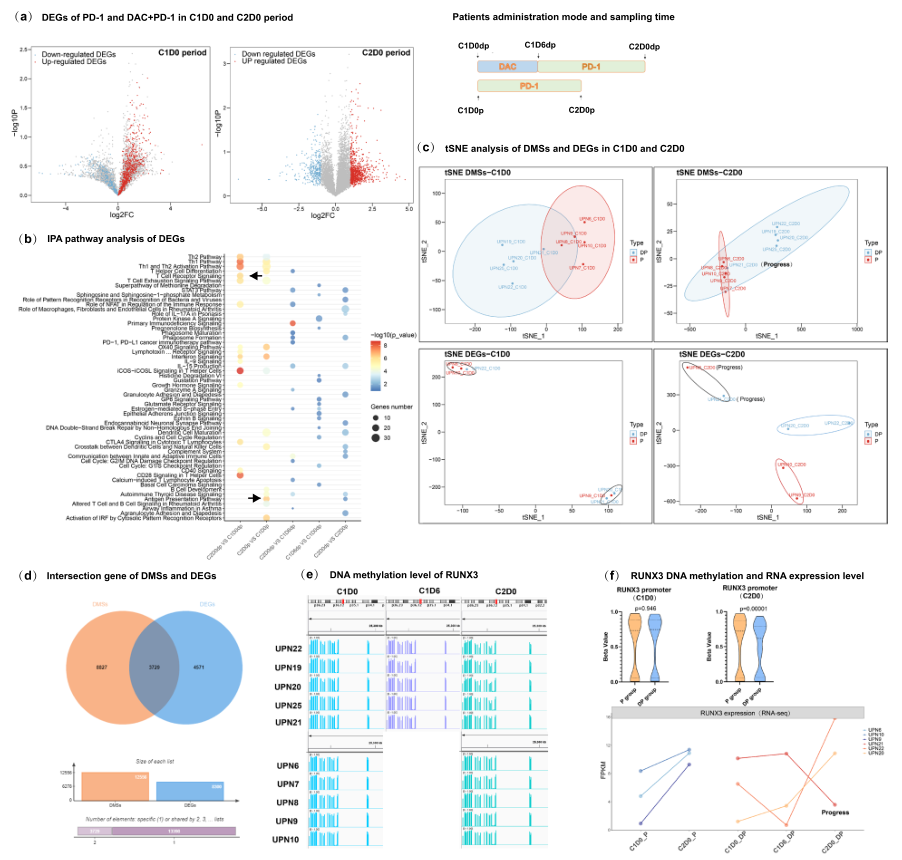
圖2 CD8 + T細胞的表達譜和多組學分析確定了DAC對CD8 + T細胞應(yīng)答的重要信號通路
3、在小鼠體內(nèi)DAC治療促進T細胞的浸潤,并下調(diào)T細胞的衰竭程度
為進一步研究DAC免疫療法 "表觀遺傳致敏 "作用的內(nèi)在機制,作者旨在在小鼠身上重現(xiàn)臨床觀察。為建立體內(nèi)小鼠模型,將MC38細胞植入C57BL/6小鼠,在指定時間用DAC、抗PD-1或抗PD-1/DAC治療,模擬患者的臨床情況(Fig. 3a)。如Fig. b-c所示,在MC38腫瘤移植小鼠中,發(fā)現(xiàn)DAC聯(lián)合抗PD-1明顯抑制腫瘤生長,促進TILs的浸潤。在MC38模型中,抗PD-1治療對腫瘤生長的抑制作用不明顯,但DAC和抗PD-1的聯(lián)合治療明顯抑制了腫瘤的生長。進一步用流式細胞儀分析CD8+T細胞的功能。如Fig. 3c所示,增殖型T細胞的比例明顯增加(ki67+CD8+T)。殺傷性(GranB+CD8+T,proferin+CD8+T)和分泌性細胞(IFN-γ+CD8+T)細胞的比例也明顯提高。
結(jié)果還顯示,Runx3的DNA甲基化狀態(tài)在DAC-和DAC/抗PD-1處理的小鼠CD8+T細胞中明顯下降,但在WT和抗PD-1處理的小鼠CD8+T細胞中沒有下降(Fig. 3d)。為探索外周免疫系統(tǒng)和腫瘤微環(huán)境的免疫狀態(tài),檢查了淋巴結(jié)、脾臟、外周血和腫瘤中T細胞的數(shù)量和功能。結(jié)果顯示,聯(lián)合治療組的血液、脾臟和淋巴腺中的CD3+T細胞數(shù)量減少。聯(lián)合治療中,CD8+T細胞在脾臟和血液中的數(shù)量減少,在淋巴腺中的數(shù)量增加。這表明腫瘤浸潤性T細胞的增殖、殺傷和分泌干擾素的能力都明顯增強,表明腫瘤微環(huán)境中T細胞功能的整體恢復(Fig. 3c)。流式細胞儀顯示,當細胞用DAC處理時,Runx3+CD8+T細胞的比例比用抗PD-1處理時增加得更多,當細胞同時用DAC和抗PD-1處理時達到峰值(Fig. 3D)。
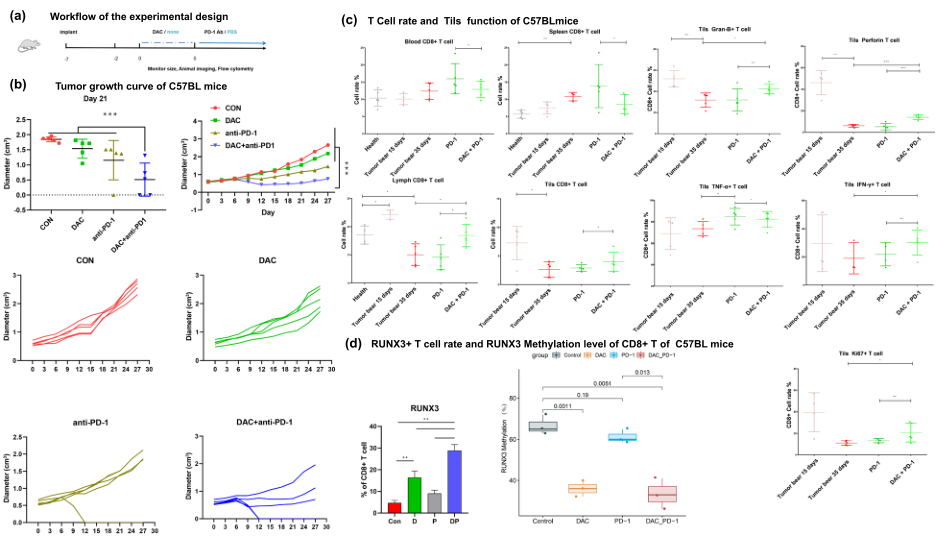
圖3 DAC通過去甲基化Runx3和促進Runx3表達,下調(diào)T細胞衰竭和上調(diào)T細胞浸潤
4、條件敲除Runx3證明Runx3對于DAC發(fā)揮抗PD-1耐藥的“表觀遺傳增敏劑”作用是必不可少的
為排除Runx3在腫瘤細胞中的抗腫瘤作用,構(gòu)建了條件敲除小鼠,以證明Runx3在T細胞和免疫治療中的特異性功能。Runx3 flox小鼠是通過基于CRISPR/Cas9的方法產(chǎn)生的。用CRISPR設(shè)計工具(http://www.sanger.ac.uk/)設(shè)計了兩個sgRNAs,針對小鼠Runx3的NM_019732.2轉(zhuǎn)錄本第4外顯子的上游或下游區(qū)域。通過隨后與Lck-cre小鼠的雜交和基因型鑒定,最終構(gòu)建了Runx3fl/fl;Lck-Cre小鼠。Runx3fl/fl小鼠在體重和發(fā)育方面沒有表現(xiàn)出差異。沒有觀察到自身免疫性疾病。然后,Runx3fl/fl和Runx3fl/fl;Lck-Cre小鼠都被分為三組:對照組、抗PD-1治療組和抗PD-1/DAC治療組(Fig. 4a)。
Runx3fl/fl;Lck-Cre小鼠的抗腫瘤免疫力下降(Fig. 4a,b)。在對照組Runx3fl/fl小鼠中,抗PD-1組和DAC/抗PD-1組之間有顯著差異(Fig. 4c,d)。此外,在Runx3fl/fl;Lck-Cre小鼠中,DAC刺激的抗PD-1組和抗PD-1組小鼠的腫瘤生長曲線沒有顯著差異。腫瘤體積和質(zhì)量沒有明顯差異,這表明條件性敲除Runx3基因后,DAC的影響被消除了。
為進一步研究Runx3在CD8+T細胞中的作用,作者應(yīng)用單細胞流式質(zhì)譜分析(CyTOF),發(fā)現(xiàn)CD8+腫瘤浸潤淋巴細胞(TILs)的比例,發(fā)生了明顯變化。綜合分析表明,Runx3增加了Teff和TRM細胞的比例,干擾了免疫細胞亞型的平衡(Fig. 4c, d)。

圖4 免疫治療的表觀遺傳增敏作用在Runx3 fl/fl;Lck-Cre小鼠中被消除
5、Runx3在T細胞浸潤和效應(yīng)和記憶T細胞分化中發(fā)揮關(guān)鍵作用,并具有削弱T細胞衰竭的功能
腫瘤免疫治療由T細胞功能反應(yīng)的多個步驟組成。首先,T細胞分化為效應(yīng)T細胞,然后是記憶T細胞,以發(fā)揮抗腫瘤功能。其次,T細胞浸潤到腫瘤中以殺死腫瘤細胞是至關(guān)重要的。腫瘤微環(huán)境中缺乏免疫細胞是反應(yīng)低下的一個重要原因。第三,T細胞經(jīng)常處于衰竭或功能障礙狀態(tài),T細胞的衰竭也會影響PD-1抗體反應(yīng)率。為闡明Runx3的具體作用,進行CyTOF來比較條件性敲除小鼠和對照小鼠的T細胞功能。采用42種標記物,涵蓋了細胞因子、T細胞衰竭標記物、T細胞增殖和T細胞殺傷能力。由于觀察到DAC治療后CCR明顯增加,而且發(fā)現(xiàn)DAC促進T細胞在小鼠模型中的浸潤,因此在這42個標志物中包括了幾個CCR。
首先,觀察到Runx3缺乏的小鼠外周血、脾臟、腫瘤組織中CD8+T細胞和效應(yīng)T細胞的明顯下調(diào)(Fig. 5a, b)。此外, Runx3的缺失明顯下調(diào)CCR3和CCR5,從而影響了T細胞的浸潤(Fig. 5c)。Runx3的缺乏也通過影響T細胞分化和T細胞衰竭而損害T細胞功能(Fig. 5d)。觀察到Lag3、Tim3和CTAL4的水平增加,但IFNγ、TNFα和IL-2的水平下降。有趣的是,沒有發(fā)現(xiàn)Runx3缺陷的小鼠中PD-1的水平增加。以前的工作表明,PD-1只在T細胞被激活后表達,而Runx3缺陷明顯下調(diào)效應(yīng)T細胞和記憶T細胞,這反過來可能平衡PD-1的表達水平以增加耗竭的T細胞。
在對照組Runx3fl/fl小鼠中,發(fā)現(xiàn)DAC聯(lián)合PD-1抗體促進了T細胞的浸潤和TILs的分泌能力(IFN,TNF-α)。增殖能力(Ki67)和殺傷能力(GranB、Perforin等)明顯增加,這種促進作用在使用DAC后明顯增強。對于Runx3基因敲除的小鼠,T細胞的分泌、增殖和殺傷能力受到抑制,表明Runx3可能是DAC表觀遺傳致敏功能的關(guān)鍵媒介(Fig. 5c, e)。

圖5 Runx3缺失阻礙ccr的表達和CD8+ T細胞的腫瘤浸潤
6、Runx3預測抗PD-1免疫療法在一系列腫瘤類型中的反應(yīng)
作者認為研究Runx3水平是否能預測抗PD-1的免疫反應(yīng)將是有趣的。免疫療法已經(jīng)改變了各種腫瘤的治療格局,并在一些難治性腫瘤中表現(xiàn)出持久的反應(yīng)率,然而在一些接受治療的患者中卻出現(xiàn)了無反應(yīng)性和嚴重的免疫相關(guān)副作用。因此,迫切需要生物標志物來篩選能從免疫療法中受益的人。從此前的臨床研究中,作者發(fā)現(xiàn),Runx3的表達與臨床反應(yīng)之間有很強的相關(guān)性(Fig. 6a)。ROC曲線是評估生物標志物預測性能的一個有用的圖形工具(Fig.6a),表明生物標志物小組可以區(qū)分兩組:反應(yīng)組和非反應(yīng)組。繪制了Runx3與臨床反應(yīng)的ROC曲線,發(fā)現(xiàn)Runx3水平可以關(guān)鍵性地預測臨床反應(yīng)。Fig. 6b顯示,Runx3水平與效應(yīng)T細胞水平和記憶T水平相關(guān),而不是整體CD8+T細胞水平。因此,Runx3通過影響功能分化而不是CD8+T細胞的整體水平,對臨床ICB反應(yīng)做出貢獻。上述數(shù)據(jù)表明,功能性T細胞的數(shù)量,而不是T細胞的整體水平對臨床反應(yīng)起著重要作用。
作者探索了TISIDB數(shù)據(jù)庫,分析了Runx3水平和抗PD-1治療的臨床預后的相關(guān)性。發(fā)現(xiàn),Runx3水平與臨床預后和生存率有很好的相關(guān)性。在結(jié)直腸癌、乳腺癌和淋巴癌患者中,Runx3的高表達與抗PD-1治療方案的良好預后有關(guān)(Fig.6c)。這表明Runx3是抗PD-1免疫療法的一個重要調(diào)節(jié)因素,也是預測預后的潛在生物標志物。綜上所述,這些數(shù)據(jù)表明,Runx3不僅是DAC和CD8+T細胞功能的關(guān)鍵媒介,也是臨床免疫反應(yīng)的潛在生物標志物。
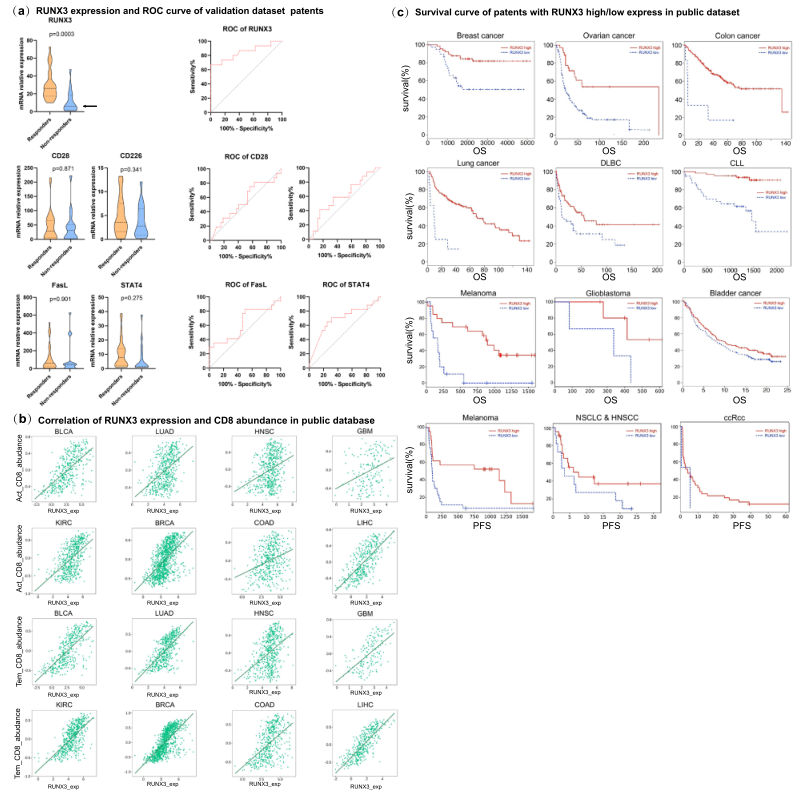
圖6 Runx3是臨床免疫治療反應(yīng)的關(guān)鍵分子標志物
本研究證明Runx3的DNA甲基化在DAC刺激的PD-1-ab免疫療法中對CD8 + T細胞的浸潤和分化起著關(guān)鍵作用,這為外調(diào)在免疫療法中的重要作用提供了一個支持機制。
實驗方法
構(gòu)建小鼠模型,DNA和RNA樣本制備,EPIC BeadChip methylation,RNA測序,Real-time PCR,MSRE-qPCR,小鼠荷瘤和藥物(Decitabine)處理以及免疫治療實驗,流式細胞術(shù)(FACS),單細胞流式質(zhì)譜分析(CyTOF)。
參考文獻
Liu, Z., Li, X., Gao, Y. et al. Epigenetic reprogramming of Runx3 reinforces CD8?+?T-cell function and improves the clinical response to immunotherapy. Mol Cancer 22, 84 (2023). https://doi.org/10.1186/s12943-023-01768-0






