P. gingivalis感染上調樹突狀細胞PD-L1表達,抑制CD8+?T細胞反應,加重口腔癌
欄目:最新研究動態
發布時間:2023-09-19
研究表明靶向Pg和/或其介導的信號通路可能是一種提高檢查點阻斷免疫療法療效的治療策略......
越來越多的證據表明,樹突狀細胞(DC)上PD-L1的表達對癌癥免疫治療至關重要,牙齦卟啉單胞菌(Porphyromonas gingivalis, Pg)的定植加劇了上胃腸道癌癥的進展。然而,在口腔癌感染環境中,Pg感染對DC中PD-L1表達的影響以及相關的免疫后果仍未研究。在培養細胞和全身感染實驗中,我們發現Pg感染以牙齦素依賴的方式增強了DC上PD-L1的表達。Pg感染通過上調卵清蛋白(OVA)脈沖DC上的PD-L1表達來抑制抗原特異性CD8+ T細胞。這種抑制表現為IFNγ、穿孔素、顆粒酶B和CD107a的減少。進一步分析表明,Pg顯著降低了CD8+ T細胞裂解OVA脈沖靶細胞的能力。此外,Pg感染增加了Akt和STAT3的磷酸化,導致PD-L1表達顯著增加。通過使用siRNA、過表達質粒和藥物抑制劑證實了這一點。與體外觀察結果一致,在同基因小鼠口腔癌模型中,Pg感染顯著增強了瘤內組織和頸部淋巴結DC上PD-L1的表達,并加速了口腔癌的進展,而Pg賴氨酸特異性、牙齦缺陷突變體則沒有這樣做。當用抗生素或STAT3抑制劑預處理腫瘤細胞時,Pg的這些影響在很大程度上減弱。因此,我們證明Pg感染通過Akt-STAT3信號通路上調DC上PD-L1的表達,抑制CD8+ T細胞的細胞毒性,并加劇口腔癌的生長,這表明靶向Pg和/或其介導的信號通路可能是一種提高檢查點阻斷免疫療法療效的治療策略。本文于2023年3月發表于Cancer Immunology Research (IF=12.02)。
技術路線:
結果:
(1) P. gingivalis感染以牙齦素依賴的方式上調DCs上PD-L1的表達
據報道,PD-L1在DCs表面組成性表達以抑制效應T細胞的激活。使用培養10天的GMDCs和Flt3l-DCs,我們首先檢查牙齦卟啉單胞菌感染是否影響DCs的頻率和成熟。與未受刺激的對照組相比,牙齦卟啉單胞菌感染提高了CD80/CD86的表達,但沒有顯著改變兩種DCs上CD11b和CD11c的表達(補充圖S1),這表明牙齦卟啉單胞菌感染可能影響DC的成熟,但對DCs的數量影響不大。接下來,我們檢測了PD-L1在GMDCs上對牙齦卟啉單胞菌感染的表達。我們發現,與未受刺激或共生菌S. sanguinis刺激的細胞相比,牙齦卟啉單胞菌感染顯著增加了GMDCs上PD-L1的表達(圖1A-C),Western blot進一步證實了這一點(圖1D)。我們未觀察到DCs上PD-L2的表達有任何顯著變化(圖1E)。因為GM-CSF刺激優先擴展2型常規DC (cDC2)亞群,而Flt3l刺激擴展1型DC (cDC1),我們接下來研究了牙齦卟啉單胞菌感染是否促進了Flt3l-DCs上PD-L1的表達。P. gingivalis侵襲后,Flt3l-DCs上PD-L1的表達顯著增加(圖1F-J)。
考慮到與CD8+ T細胞相比,Flt3l介導的cDC1細胞在腫瘤抗原交叉呈遞方面更有效,我們在整個研究中都使用了Flt3l-DCs。為了研究牙齦卟啉單胞菌的毒力因子對PD-L1表達的調控,我們接下來研究了感染△Kgp突變體是否會影響Flt3-DCs上PD-L1的表達。缺乏gingippain使P. gingivalis上調PD-L1表達的能力喪失(圖1F-J),Western blot進一步證實了這一點(圖1J)。由于干擾素是DCs上PD-L1表達的主要因素,我們還利用中和抗體阻斷I型IFN受體2和II型干擾素,以檢驗牙齦卟啉單胞菌是否通過干擾素的重新合成促進PD-L1表達。在使用中和抗體和同型對照治療的樹突狀細胞中,PD-L1未發生實質性變化(圖1K),表明干擾素可能不參與牙齦卟啉單胞菌增強PD-L1表達。綜上所述,我們的研究結果表明,牙齦卟啉單胞菌感染促進了DCs上PD-L1的表達,而牙齦蛋白酶是這一過程的關鍵因素。
接下來,我們檢測了PD-L1在脾DCs中的表達(MHC-II+ CD11c+;圖2A,B),小鼠接種牙齦卟啉單胞菌或其突變體△Kgp 24小時。同樣地,S. sanguinis被用作共生控制菌。與感染共生菌相比,P. gingivalis顯著增強了CD11c+MHC-II+細胞上PD-L1的表達,而△Kgp在很大程度上失去了這種能力(圖2C-E)。此外,我們使用了體內牙齦卟啉單胞菌慢性感染模型,正如我們在之前的研究中所做的那樣,來檢查感染小鼠中DC表型的可能改變。我們發現口腔牙齦卟啉單胞菌感染導致CLNs DCs上PD-L1表達顯著增加,而△Kgp突變體和共體對照則沒有這樣做(圖2F-H)。總之,這些結果首次證明,牙齦卟啉單胞菌在體外和體內促進DCs上PD-L1的表達,其方式依賴于賴氨酸特異性牙齦蛋白酶的存在。
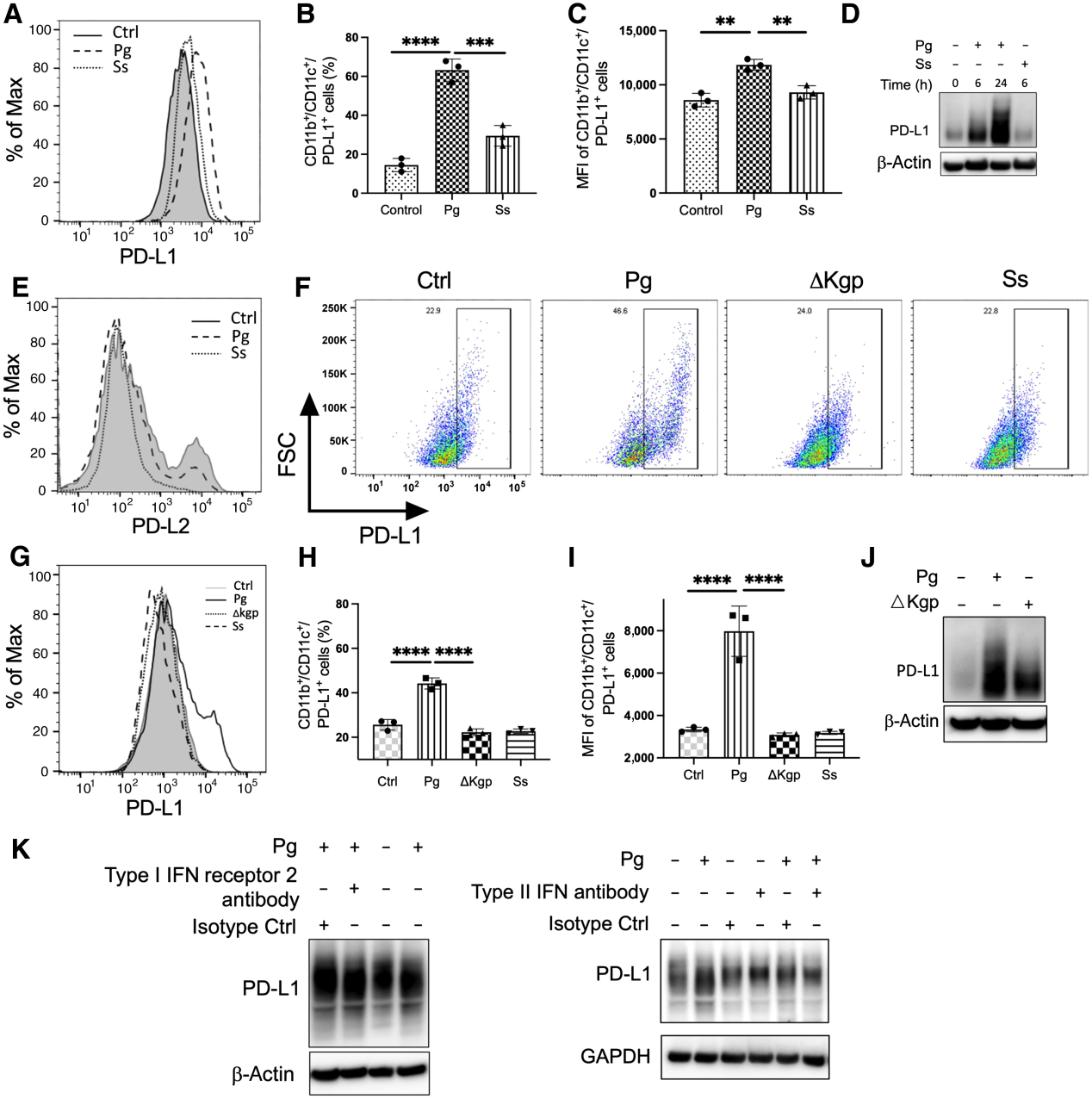
圖1:牙齦卟啉單胞菌感染增強PD-L1在GMDCs和Flt3l-DCs上的表達,并以牙齦素依賴的方式增強

圖2:體內牙齦卟啉單胞菌感染可促進DCs上PD-L1的表達
(2) P. gingivalis感染通過Akt和STAT3信號通路增強DC-PD-L1的表達
牙齦卟啉單胞菌感染激活了大量的信號級聯反應,導致炎癥免疫反應。鑒于Akt和STAT3都是PD-L1表達的關鍵驅動因素,我們接下來研究了牙齦卟啉單胞菌感染介導的DC-PD-L1上調是否通過Akt和STAT3進行。正如所料,P. gingivalis感染強勁增加一種蛋白激酶的磷酸化和STAT3(圖3A,B),但△Kgp變異僅略增強磷酸化STAT3和未能產生一種蛋白激酶磷酸化(圖3C)。考慮到Akt和STAT3磷酸化的趨勢(圖3A-C)與PD-L1表達的趨勢(圖1G-J)相似,P. gingivalis和△Kgp的挑戰下,PD-L1的升高可能是通過Akt和STAT3的調節。為了進一步證明這一點,我們使用特異性Akt抑制劑MK2206治療DCs,并檢測PD-L1在牙齦卟啉單胞菌侵襲下的表達。我們發現,抑制Akt可使牙齦卟啉單胞菌刺激的DC中PD-L1的表達呈劑量依賴性降低(圖3D-F),并通過Western blot證實了這一點(圖3G)。此外,Akt抑制可導致磷酸化和總STAT3減少(圖3G),這表明STAT3可能是Akt的下游靶點(圖3G)。通過觀察,STAT3抑制未能影響牙齦卟啉單胞菌刺激的DC中Akt的磷酸化,這一點得到了相反的證實(圖3H)。此外,我們發現通過siRNA對STAT3進行化學抑制或基因沉默,可導致牙齦卟啉單胞菌刺激的DC中PD-L1表達顯著降低(圖3I,J)。為了排除siRNA可能的脫靶效應,并驗證STAT3對PD-L1表達的影響,我們將編碼STAT3的質粒轉染到DC中,發現STAT3過表達(圖3K)會導致PD-L1在牙齦卟啉單胞菌攻擊后顯著升高(圖3K,L)。這些數據表明,P. gingivalis誘導DC上PD-L1表達升高是通過調節Akt-STAT3信號傳導。

圖3:P. gingivalis感染激活Akt-STAT3信號通路,從而促進DCs上PD-L1的表達
(3) P. gingivalis介導的Akt-STAT3信號通路促進PD-L1表達并抑制CD8+ T細胞活性
接下來,我們研究了牙齦卟啉單胞菌對CD8+ T細胞活化的可能影響。為此,用抗原OVA肽(SIINFEKL)預脈沖Flt3l-DCs,濃度為0.1至10 ng/mL,然后用牙齦卟啉單胞菌攻毒,并與來自OT-I小鼠的OVA特異性脾CD8+ T細胞共培養3天。因為觀察到1 ng/mL的OVA刺激產生最高水平的IL2 (補充圖S2),我們在接下來的實驗中使用這個濃度。P. gingivalis處理顯著提高了DC上PD-L1的表達,這與我們在圖1中的觀察結果一致,表明P. gingivalis感染在不同情況下促進PD-L1的表達(圖4A)。此外,OVA脈沖DC有效地激活了CD8+ T細胞,其表現為顯著增加的效應分子,包括Prf、GrB和CD107a,以及標志細胞因子IFNγ和IL2 (圖4B-G)。然而,當抗原脈沖DC受到牙齦卟啉單胞菌攻擊時,效應分子和標記細胞因子的產生顯著減少(圖4B-G),ELISA進一步證實了這一點(圖4D,E)。這些結果表明,牙齦卟啉單胞菌感染增強了PD-L1的表達,抑制了CD8+ T細胞活性。
為了進一步確定P. gingivalis是否通過調節STAT3和PD-L1介導CD8+ T細胞的抑制,我們首先使用STAT3抑制劑WP-1066治療抗原脈沖DC,然后用P. gingivalis攻擊并與CD8+ T細胞共培養。72小時后,我們發現WP-1066顯著降低了PD-L1的表達,同時提高了CD8+ T細胞中IFNγ、Prf、CD107a和GrB的表達(圖5A-E)。此外,我們還利用PD-L1拮抗劑結合肽(D)-PPA阻斷PD-L1/PD-1的結合,以確定PD-L1在牙齦卟啉單胞菌抑制CD8+ T細胞活性中的作用。正如預期的那樣,用(D)-PPA肽阻斷PD-L1對DC的抑制作用顯著減弱了牙齦卟啉單胞菌感染對Prf、IL2和GrB產生的抑制作用(圖5F-H)。綜上所述,這些數據表明牙齦卟啉單胞菌感染通過STAT3介導的DC細胞上PD-L1的表達抑制CD8+ T細胞活性。

圖4:牙齦卟啉單胞菌感染可促進DC-PD-L1并抑制CD8+ T細胞活性
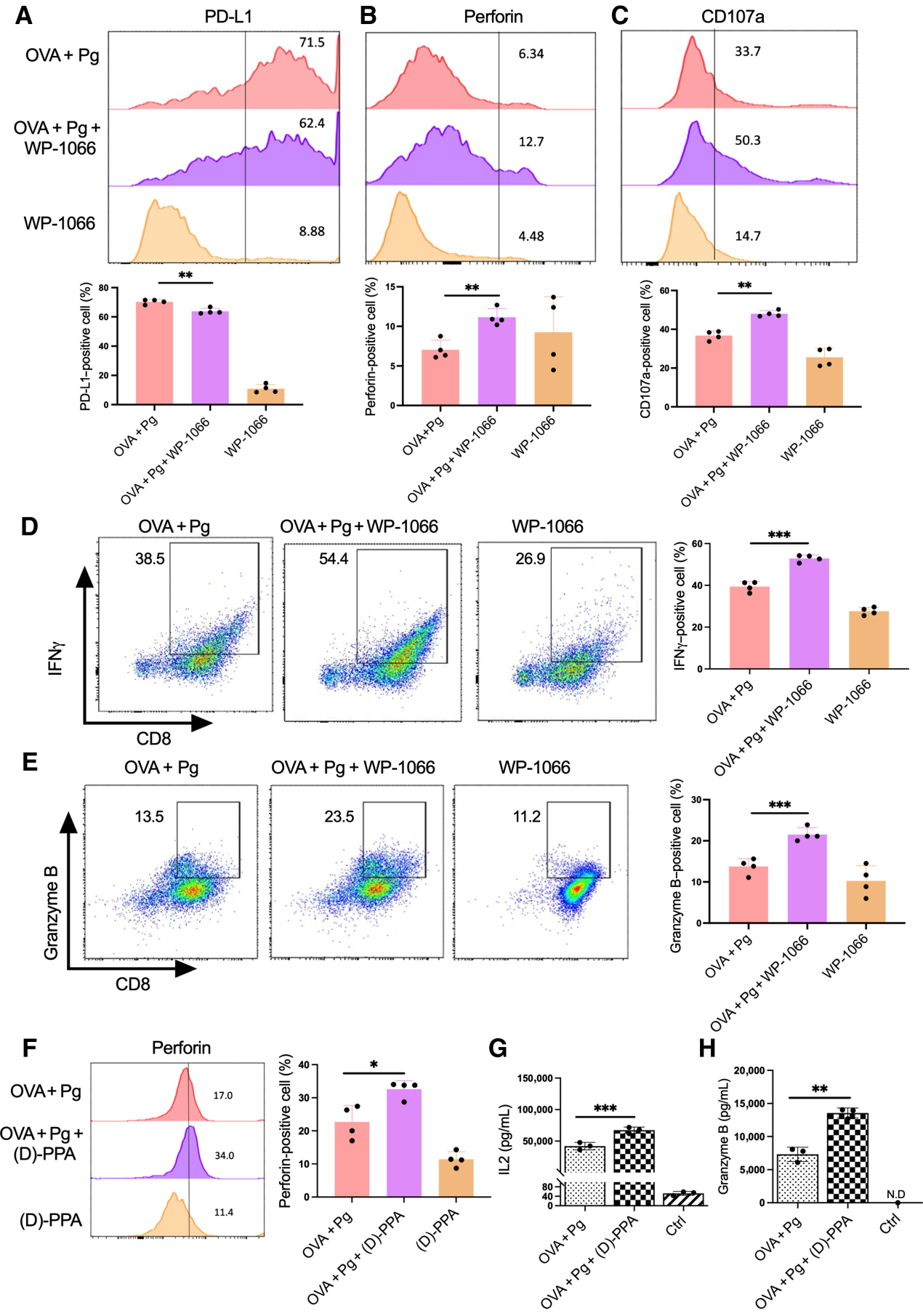
圖5:牙齦卟啉單胞菌感染通過調節STAT3活性抑制CD8+ T細胞活性
(4) 感染P. gingivalis可抑制CD8+ T細胞的細胞毒性
為了進一步評估牙齦卟啉單胞菌感染對CD8+ T細胞毒性的影響,我們接下來將CD8+ T細胞與靶細胞(EL4細胞系)共培養,靶細胞用兩種不同濃度的CFSE (1和0.1 mmol/L)。通過控制CFSE+CD8?細胞,我們在進一步分析中排除了可能的死細胞干擾(圖6A)。P. gingivalis在所有組(三種不同的效應/靶比)中顯著降低了CD8+ T細胞的細胞毒性,以裂解靶細胞的數量表示(圖6B,C)。經牙齦卟啉單胞菌預處理的DC細胞組的靶細胞裂解率顯著低于未處理的DC細胞組(圖6C)。此外,STAT3抑制顯著提高了CD8+ T細胞在牙齦卟啉單胞菌侵染下的細胞毒性(圖6D)。值得注意的是,與野生型親本菌株相比,感染△Kgp突變體顯著增加了裂解的靶細胞(圖6E)。總之,這些結果表明,牙齦卟啉單胞菌感染通過調節DC中STAT3激活和PD-L1表達來損害CD8+ T細胞的細胞毒性,這種能力至少部分地依賴于賴氨酸特異性牙齦蛋白酶的存在。
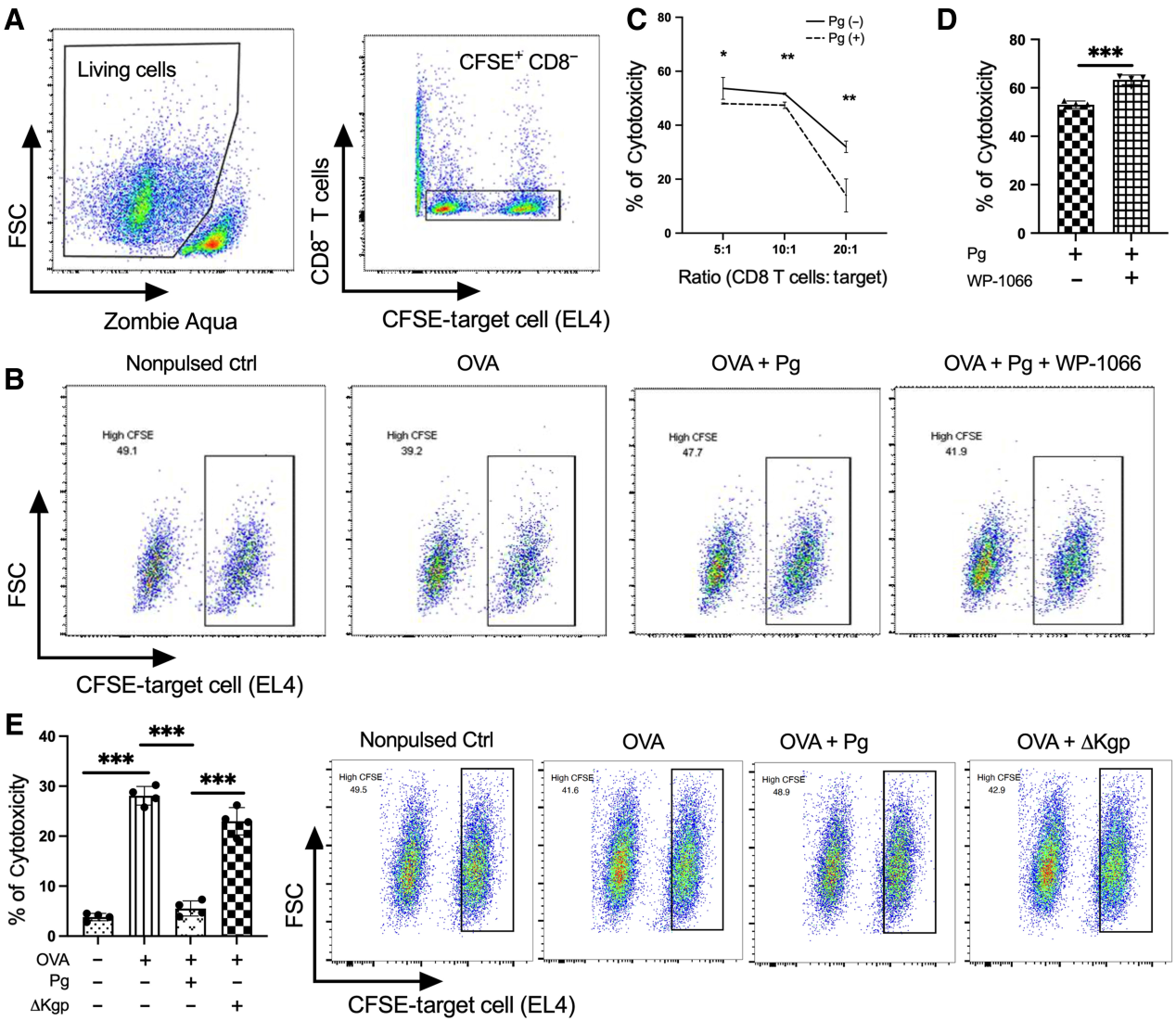
圖6:牙齦卟啉單胞菌感染抑制CD8+ T細胞的細胞毒性
(5) 在同基因口腔癌模型中,P. gingivalis感染促進DCs上PD-L1的表達,并加劇口腔癌的進展
為了評估牙齦卟啉單胞菌感染對口腔癌中DC-PD-L1表達和CD8+ T細胞活性的影響,我們接下來使用了一種同源小鼠模型,其中將經過或不經過牙齦卟啉單胞菌預處理的MOC1細胞接種到小鼠舌頭中(圖7A)。我們發現,來自牙齦卟啉單胞菌感染小鼠淋巴結的CD11c+MHC-II+ DCs比來自對照小鼠的DC的PD-L1表達明顯更高(圖7B;P<0.001)。然而,用STAT3抑制劑治療或喂食抗生素水可顯著降低PD-L1的表達(圖7B)。此外,牙齦卟啉單胞菌感染導致CD8+ T細胞上PD-1表達顯著增加(補充圖S2),這表明PD-L1和PD-1都可能是牙齦卟啉單胞菌調節CD8+ T細胞活性的靶點。PD-L1在DC上的過度表達已被證明會降低免疫治療的療效并加劇癌癥進展。因此,我們研究了牙齦卟啉單胞菌感染是否會加劇口腔癌的進展。與未處理的MOC1細胞相比,經牙齦卟啉單胞菌預處理的MOC1細胞發育成更大的腫瘤,根據先前研究中描述的舌組織腫瘤腫塊面積估計(圖7C)。然而,與僅感染牙齦卟啉單胞菌或假對照組相比,感染牙齦卟啉單胞菌的小鼠在接受抗生素或WP-1066治療后,腫瘤質量顯著下降(圖7C)。這些結果與先前大量研究一致,表明牙齦卟啉單胞菌感染促進腫瘤生長,惡化癌癥患者的預后。考慮到目前還沒有一種被廣泛接受的測量方法來估計MOC1介導的同基因模型中的腫瘤體積,我們使用臨床RECIST 1.1指南,并使用腫瘤腫塊的最長尺寸來估計腫瘤體積。正如預期的那樣,通過測量H&E染色圖像中腫瘤腫塊的最大直徑(圖7D,E),我們觀察到各組腫瘤體積變化的趨勢與測量腫瘤腫塊面積(圖7D,E)相似。此外,我們還使用免疫熒光檢測浸潤腫瘤組織的DC中PD-L1的表達。P. gingivalis感染顯著促進腫瘤內DC上PD-L1的表達,但抗生素或STAT3抑制顯著降低PD-L1的表達(圖7F,G, P<0.001),這與淋巴結DC上PD-L1表達的改變是一致的。
為了研究在口腔自然感染環境下牙齦卟啉單胞菌感染與腫瘤進展的臨床相關性,我們首先用口腔感染了牙齦卟啉單胞菌,然后將未感染的MOC1細胞接種到小鼠的舌頭中。如上所述,我們檢測了PD-L1在來自CLNs和腫瘤組織的DC上的表達以及腫瘤的生長情況。我們發現,口腔預感染牙齦卟啉單胞菌的小鼠的DC-PD-L1表達顯著高于未感染的對照組,盡管略低于接種預感染的MOC1細胞并隨后口腔感染牙齦卟啉單胞菌的小鼠(圖7H-J, P<0.001)。此外,腫瘤體積改變的趨勢與DC-PD-L1表達的趨勢相似(圖7K-M, P<0.001),表明牙齦卟啉單胞菌感染可能通過改變腫瘤微環境中的免疫景觀參與腫瘤進展。此外,在MOC1細胞中感染牙齦卟啉單胞菌△Kgp突變體未能顯著促進PD-L1表達和腫瘤進展(圖7H-M, P<0.001)。總之,這些數據驗證了我們的體外實驗結果,并表明在同基因小鼠模型中,牙齦卟啉單胞菌感染增強了PD-L1的表達并加劇了口腔癌的進展。

圖7:在同基因口腔癌模型中,牙齦卟啉單胞菌感染促進DCs上PD-L1的表達,并加劇口腔癌的進展
結論
我們首次證明了牙齦卟啉單胞菌感染可提高DCs表面PD-L1的表達,抑制CD8+ T細胞的細胞毒性,并加劇口腔癌的進展。此外,我們發現牙齦疼痛和P. gingivalis介導的Akt-STAT3信號的激活對于DC-PD-L1的上調和隨后CD8+ T細胞毒性的抑制至關重要。鑒于針對PD-1及其配體的抗體在癌癥免疫治療中的成功應用,我們的研究結果為進一步了解牙齦卟啉單胞菌的免疫抑制特性提供了更多的見解,并確定了操縱免疫反應的潛在靶點,從而提高癌癥免疫治療的療效。
實驗方法
小鼠、細菌和細胞培養,ELISA,Western blots,Stat3 siRNA和質粒轉染,淋巴細胞分離,DCs和OT-I T細胞共培養,細胞染色及流式細胞術,交叉呈遞試驗和CD8+ T細胞毒性試驗,全身細菌感染試驗,MOC1細胞接種誘導同源口腔癌模型及免疫組化
參考文獻
Ren, J., Han, X., Lohner, H., Hoyle, R. G., Li, J., Liang, S., & Wang, H. (2023). P. gingivalis Infection Upregulates PD-L1 Expression on Dendritic Cells, Suppresses CD8+ T-cell Responses, and Aggravates Oral Cancer. Cancer immunology research, 11(3), 290–305. https://doi.org/10.1158/2326-6066.CIR-22-0541.






