牙髓干細胞來源的外泌體通過GPER介導的cAMP/PKA/CREB信號通路激活NOD小鼠的唾液腺上皮細胞功能

干燥綜合征(SS)是一種以口干和眼干為特征的慢性、全身性自身免疫性疾病,好發于絕經期女性。口干癥是一種臨床常見的由唾液分泌不足引起的疾病,可導致吞咽困難、齲齒、牙周病等。隨著疾病發展,約2/3的SS患者出現全身免疫功能紊亂。外泌體是一種直徑40~150nm的細胞外囊泡,攜帶多種生物分子,可以轉移到受體細胞。據報道,間充質干細胞來源的外泌體(MSC-Exos)有助于細胞間通訊,已顯示出治療包括SS在內的各種炎癥性疾病的潛力。牙髓干細胞(DPSCs)是從牙髓組織中分離得到的一種間充質干細胞,具有高度增殖和較低的免疫原性。過去幾年中,研究人員主要利用DPSCs來源的外泌體(DPSC-Exos)來治療系統性疾病,因為它們具有抗凋亡、抗炎和再生等特性。然而,DPSC-Exos在緩解SS患者口干和恢復涎腺功能方面的療效尚不明確。該研究發表在《Journal of Translational Medicine》,IF:7.4。
技術路線

示意圖
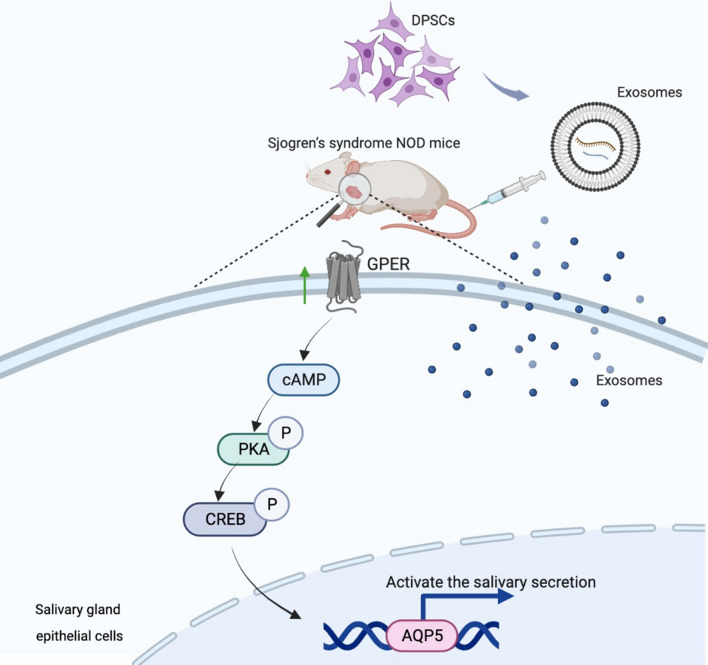
主要研究結果
1. 牙髓干細胞(DPSCs)的分離、培養和鑒定
分離人DPSCs,并在倒置相差顯微鏡下觀察不同代次的培養和細胞膜片培養(圖1A)。DPSCs呈成纖維樣細胞形態。DPSCs高表達MSCs表面標志物CD29(99.9%)、CD90(99.9%)、CD105(99.9%)和CD44(99.5%)。造血細胞標志物CD34、CD45、CD19和HLA-DR表達<1%(圖1B),表明DPSCs具有低免疫原性。多譜系分化實驗顯示了DPSCs的成骨(圖1C)、成脂(圖1D)和軟骨分化(圖1E)潛能。作者的結果證實了該研究中使用的DPSCs的MSC表型。
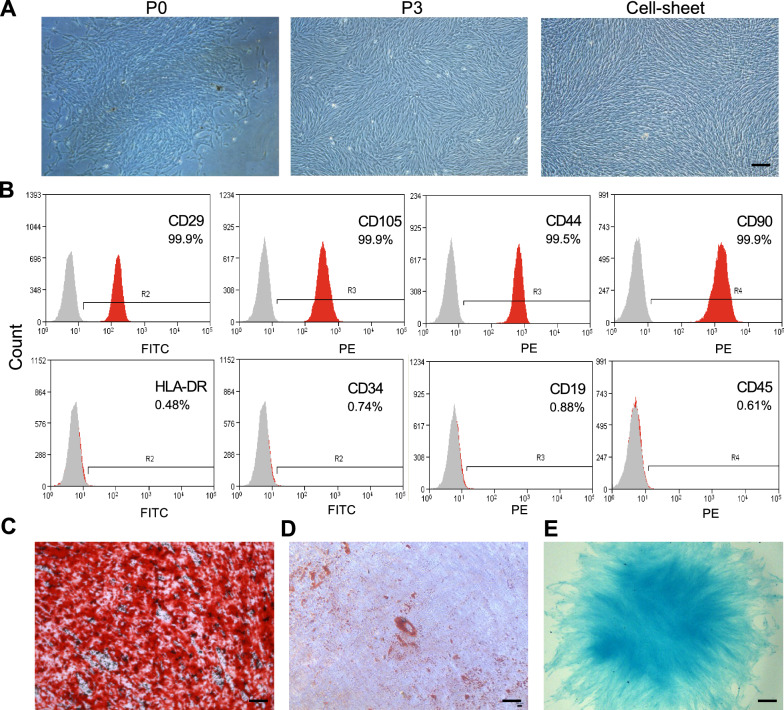
圖1 DPSCs的分離和鑒定
2. DPSC-Exos的分離和鑒定
采用超速離心法從DPSCs細胞片層條件培養基中分離DPSCs-exos。透射電鏡顯示,DPSC-Exos呈現典型杯狀形態的雙層膜結構(圖2A)。NTA顯示了DPSC-Exos在30-150nm的粒徑分布(圖2B)。DPSC-Exos表達典型的外泌體標志物ALIX、TSG101和CD63(圖2C)。在共培養的4小時內,DPSC-Exos很容易在SGEC中內化(圖2D)。總之,這些數據表明成功分離出了可內化于SGEC中的DPSC-Exos。

圖2 DPSCs膜片釋放外泌體(DPSC-Exos)的分離和鑒定
3. DPSC-Exos部分恢復了IFN-γ誘導的SGEC死亡和AQP5的下調
浸潤淋巴細胞分泌的IFN-γ可誘導SS相關的導管細胞凋亡,從而損害腺體分泌功能。因此,IFN-γ通常在體外用于模擬SS期間唾液腺的炎癥條件。在這項研究中,IFN-γ處理12 h顯著抑制了SGEC的增殖(圖3A)。為驗證DPSC-Exos對IFN-γ誘導SEGC死亡的影響,在SGEC中分別加入不同濃度(5、20、80 g/ml)的DPSC-Exos處理24、48、72 h。與IFN-γ組相比,20、80μg/ml DPSC-Exos處理組在48、72 h增殖逐漸增加(圖3A)。這些結果表明,DPSC-Exos具有減輕SS期間炎癥抑制的SGEC增殖的潛力。
RT-qPCR檢測不同濃度DPSC-Exos處理SGEC 48 h后內源性AQP5轉錄水平的變化。IFN-γ組AQP5 mRNA相對表達量顯著降低。DPSC-Exos恢復了IFN-γ對AQP5表達的抑制作用(圖3B)。在蛋白質印跡分析中,與IFN-γ處理組相比,DPSC-Exos(20 μg/ml)處理組AQP5表達較高(圖3C,D)。在免疫熒光分析中,與IFN-γ處理組相比,DPSC-Exos(20 μg/ml)組AQP5的熒光強度顯著增加(圖3E,F)。這些數據表明,在SS期間,DPSC-Exos具有上調SGEC中AQP5表達的潛力。
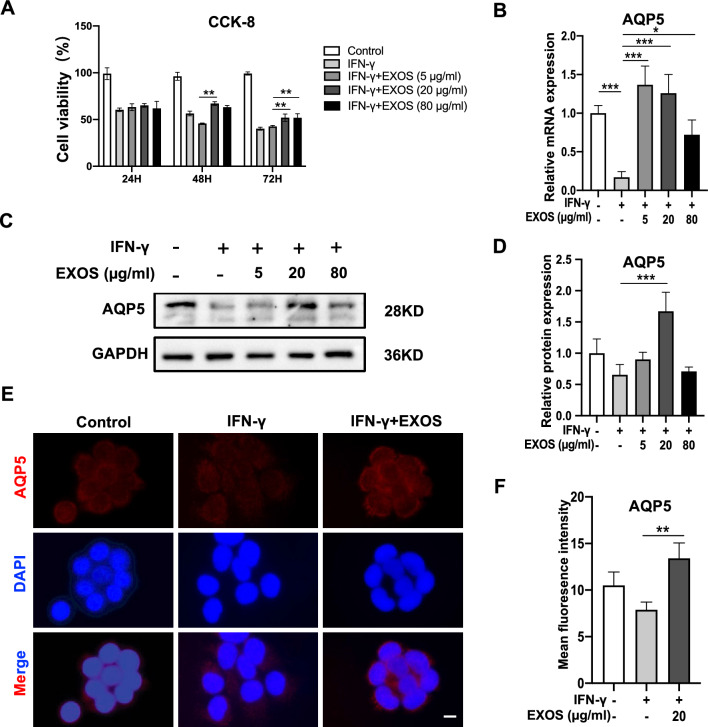
圖3 DPSC-Exos挽救了IFN-γ引起的唾液腺上皮細胞(SGEC)死亡和AQP5下調
4. IFN-γ預處理的SGEC和DPSC-Exos的轉錄組分析
在IFN-γ預處理的SGEC中加入或不加入DPSC-Exos(20 μg/ml)進行RNA測序,以鑒定差異表達基因(DEGs)。首先,主成分分析(PCA)顯示了組間數據的獨立性,說明數據具有可比性(圖4A)。與IFN-γ組相比,DPSC-Exos組共發現304個DEGs,其中142個上調,162個下調。GPER是DPSC-Exos組中上調的DEGs之一(圖4B)。根據基因本體(GO)富集分析,GPER在SGEC中的雌激素16-α-羥化酶活性中起作用(圖4C)。根據京都基因與基因組百科全書(KEGG)分析,GPER在cAMP信號通路、唾液分泌和雌激素信號通路中起作用(圖4D)。DEGs與STRING數據庫的交互關系分析顯示,唾液分泌、cAMP信號通路、雌激素信號通路之間存在相互作用(圖4E)。此外,重疊分析顯示GPER是參與這3條信號通路相互作用的關鍵DEG(圖4F)。這些數據表明,DPSC-Exos組過表達的GPER可能在改善SGEC活性中發揮作用。
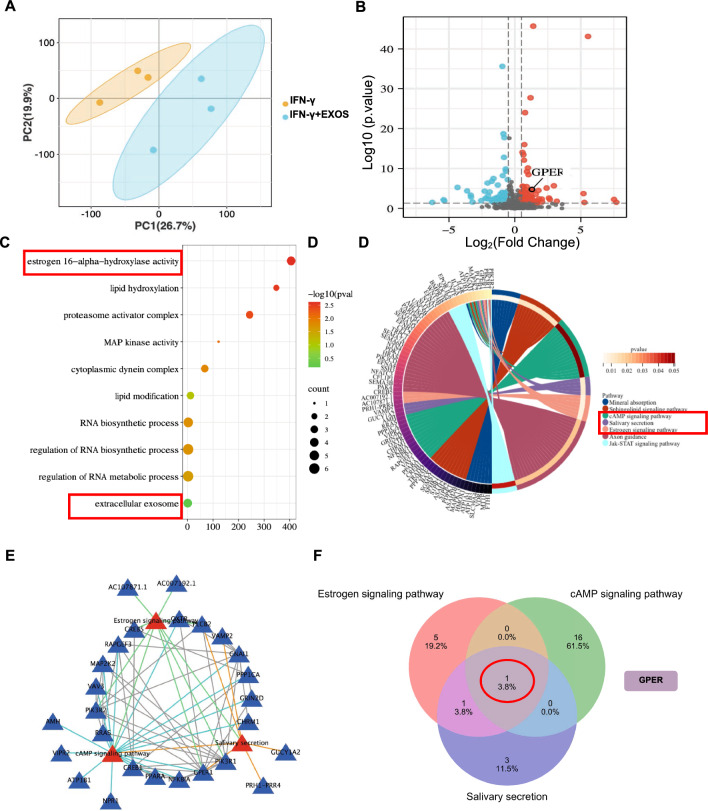
圖4 經或不經DPSC-Exos處理的唾液腺上皮細胞的轉錄組分析
5. DPSC-Exos組GPER表達量較高
熱圖顯示DPSC-Exos處理的SGEC中GPER上調(圖5A)。相關熱圖顯示GPER與唾液分泌相關的DEGs密切相關(圖5B)。免疫熒光分析顯示,IFN-γ組中GPER表達下調,DPSC-Exos恢復了IFN-γ抑制的SGEC中GPER表達(圖5C,D)。蛋白質印跡分析分析證實,與IFN-γ組相比,DPSC-Exos組中GPER表達較高(圖5E,F)。這些數據表明,DPSC-Exos具有上調IFN-γ處理的SGEC中GPER表達的潛力。

圖5 DPSC-Exos誘導唾液腺上皮細胞GPER表達
6. DPSC-Exos治療減輕了NOD/ltj小鼠的口干癥并恢復了唾液腺功能
作者使用NOD/ltj小鼠作為初級SS模型,該模型獨特地表現出唾液腺功能障礙,伴有外分泌腺中白細胞浸潤的出現和許多已知遺傳差異的同源品系。按照圖6A中所示進行動物研究。16周齡NOD/ltj小鼠的唾液流率較6周齡NOD/ltj小鼠降低。10周的DPSC-Exos治療穩健地促進了NOD/ltj小鼠的唾液流率(圖6B)。DPSC-Exos治療對唾液流率的影響甚至比羥氯喹治療(陽性對照組)更明顯。HE染色顯示,NOD/ltj小鼠腺管周圍腺泡空泡化明顯,腺體嚴重萎縮。與PBS處理的NOD/ltj小鼠相比,在HCQ和DPSC-Exos處理的NOD/ltj小鼠中,唾液腺中淋巴細胞浸潤灶的數量和面積顯著減少(圖6C)。基于DPSC-Exos改善了NOD/ltj小鼠的唾液分泌障礙,作者接下來研究了參與唾液分泌的關鍵蛋白AQP5和GPER在下頜下腺中的表達。免疫組織化學(圖6D,E)顯示,與PBS組相比,DPSC-Exos組腺泡細胞膜上的AQP5免疫染色,特別是頂端膜上的AQP5免疫染色強增強。與PBS組相比,DPSC-Exos組的GPER表達也上調(圖6F,G)。相反,GPER常在基底膜中著色,這與AQP5免疫染色不同。抗SSA/Ro和抗SSB/La抗體與SS患者較高的發病率相關。因此,對SS的臨床診斷具有重要價值。DPSC-Exos和HCQ處理可下調NOD/ltj小鼠的抗SSA/Ro和抗SSB/La血清水平(圖6H)。作者進行了蛋白質印跡測定(圖6I,J)和RT-qPCR實驗(圖6K)來檢測AQP5在小鼠下頜下腺中的表達水平。與PBS組相比,DPSC-Exos組和HCQ組AQP5的mRNA和蛋白表達水平均上調。這些數據表明,DPSC-Exos可上調下頜下腺中AQP5和GPER的表達。
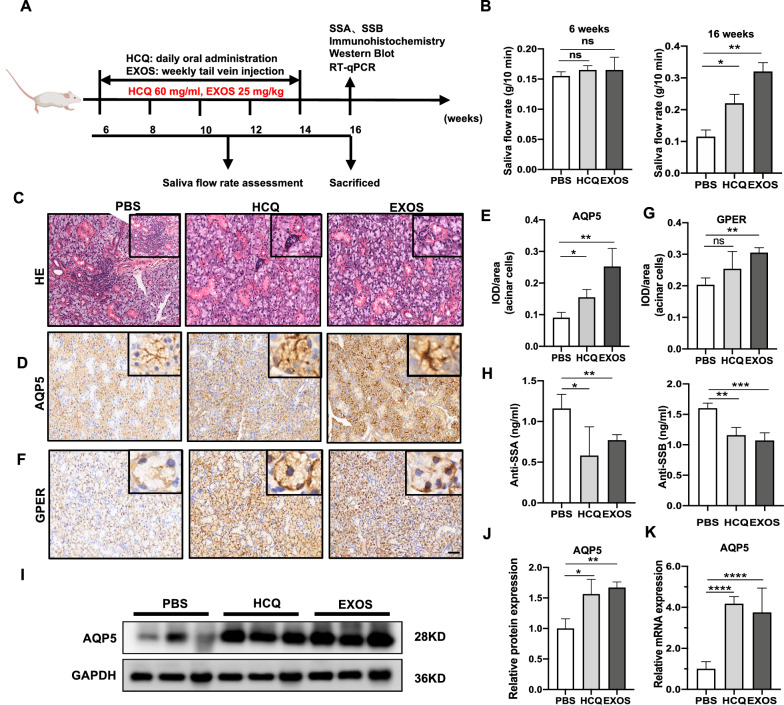
圖6 DPSC-Exos治療減輕了NOD/ltj小鼠的SS樣癥狀
7. DPSC-Exos通過GPER介導的cAMP/PKA/CREB信號通路上調SGEC中AQP5的表達
GPER的激活刺激cAMP的產生和細胞內鈣動員。作者分析了不同處理條件下SGEC中cAMP/PKA/CREB信號通路中AQP5、GPER、PKA(p-PKA)和CREB(p-CREB)4種顯著蛋白的表達。與IFN-γ組相比,DPSC-Exos組AQP5、GPER、PKA和CREB表達量較高(圖7A-E)。這一作用可被G15(GPER抑制劑)消除。不同處理條件下SGEC中cAMP水平的結果與蛋白質印跡分析結果一致(圖7F)。AQP5在非刺激條件下存在于脂筏中,當細胞內鈣離子濃度升高時,AQP5可以移動到頂端質膜。因此,鈣信號是AQP5短期調控的核心信號。流式細胞術結果顯示,DPSC-Exos組的細胞內Ca2+水平比IFN-γ組高約4倍,而G15處理消除了DPSC-Exos對細胞內Ca2+水平的影響(圖7G)。這些結果表明,DPSC-Exos通過GPER介導的cAMP/PKA/CREB信號通路恢復了IFN-γ對SGEC的抑制功能。

圖7 DPSC-Exos通過GPER介導的cAMP-PKA-CREB通路減輕了IFN-γ引起的唾液腺上皮細胞(SGEC)中AQP5的表達下調
結論
DPSC-Exos部分挽救了SS相關的炎癥誘導的SGEC死亡。SS相關炎癥降低了SGEC中唾液分泌標志物AQP5的表達,而DPSC-Exos逆轉了這一作用。DPSC-Exos治療減輕了NOD/ltj小鼠的腺體炎癥并增加了唾液流率。DPSC-Exos處理上調SGEC中的GPER,進一步激活cAMP-PKA-CREB信號通路,促進唾液分泌。該研究結果表明DPSC-Exos可能用于SS治療。
實驗方法
動物實驗,免疫組織化學,CCK-8檢測,實時定量PCR(RT-qPCR),蛋白質印跡,免疫熒光,mRNA測序,生物信息學分析,酶聯免疫吸附測定(ELISA)
參考文獻
Hu S, Chen B, Zhou J, Liu F, Mao T, Pathak JL, et al. Dental pulp stem cell-derived exosomes revitalize salivary gland epithelial cell function in NOD mice via the GPER-mediated cAMP/PKA/CREB signaling pathway. J Transl Med. 2023 Jun 3;21(1):361.






