邪惡推手:apCAFs新亞群誘導Treg細胞擴增
實驗方法:免疫組化,RT-qPCR,WB,小鼠模型,譜系追蹤測定,腫瘤類器官,流式分選,細胞共培養,Treg抑制實驗,RNA測序,單細胞RNA測序及其生信分析
最新研究發現了一種獨特的癌癥相關成纖維細胞(CAF)群體,稱為抗原呈遞CAFs(apCAFs),其特征是主要MHC II類分子的表達,表明其具有調節腫瘤免疫方面的功能。本研究通過整合多項單細胞RNA測序和進行穩健的譜系追蹤分析,發現apCAFs來源于間皮細胞;在胰管腺癌(PDA)進展過程中,間皮細胞通過下調間皮特征并獲得成纖維細胞特征形成apCAFs,這一過程由IL-1和TGF-β誘導;apCAFs以抗原特異性方式直接連接并誘導初始CD4+ T細胞分化為調節性T細胞(Tregs);靶向間皮細胞標志物mesothelin可有效抑制間皮細胞向apCAF轉化和apCAF誘導的Treg形成。
技術路線:
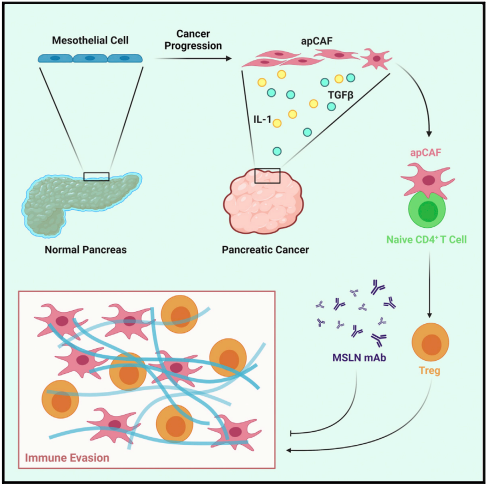
主要實驗結果:
1、apCAFs來源于間皮細胞
作者之前通過scRNA-seq分析了多種PDA的基因工程小鼠模型(GEMMs)(正常胰腺、早期KIC、晚期KIC、晚期KPC和晚期KPfC [KrasLSL-G12D/+; Trp53 fl/fl; Pdx1Cre/+]),并確定了正常胰腺和早期PDA中的三個成纖維細胞群(FB1、FB2和FB3)以及后期PDA中的兩個群(FB1和FB3)。為了解成纖維細胞在這些模型之間的關系,將來自正常胰腺、早期KIC、晚期KIC、晚期KPC和晚期KPfC的所有成纖維細胞投影到tSNE圖上,并進行聚類(圖1A),并鑒定到成纖維細胞的四種分子亞型(圖1B),其中FB1和FB2在此前的報道中已有描述,但此前鑒定的FB3亞群在這里聚為了3類,所以命名為FB3和FB3B,其中FB3B在所有晚期GEMMs中都有特異性擴增(圖1C)。然后研究FB3A和FB3B的轉錄譜,發現每個亞型都以MHC II通路和間皮細胞基因的表達為特征(圖1D-1E)。但與FB3A相比,FB3B的間皮標志基因表達水平較低,炎癥和肌纖維母細胞性基因表達水平升高(圖1D,1F)。這些數據表明FB3A和FB3B為間皮細胞,FB3A為正常間皮細胞,FB3B為成纖維表型的間皮細胞。
為了解這些間皮細胞相關群體之間的關系,作者整合了三個成纖維細胞數據集,并使用UMAP進行聚類和降維,結果顯示來成纖維細胞分為11個不同的集群(圖1G)。為識別間皮細胞簇,生成MHC II通路和間皮細胞基因的UMAP圖,發現聚類7和9表達這些特征基因(圖1H)。根據數據集的來源強調成纖維細胞的分布,以了解FB3A、FB3B、apCAFs和正常間皮細胞之間的關系(圖1I)。發現合并數據中的聚類7(圖1G)具有與FB3A相同的特征,聚類9與FB3A相同,提示簇7代表正常間皮細胞,簇9代表成纖維細胞間皮細胞群。因此,本研究中將簇9定義為apCAFs,簇7定義為正常間皮細胞。
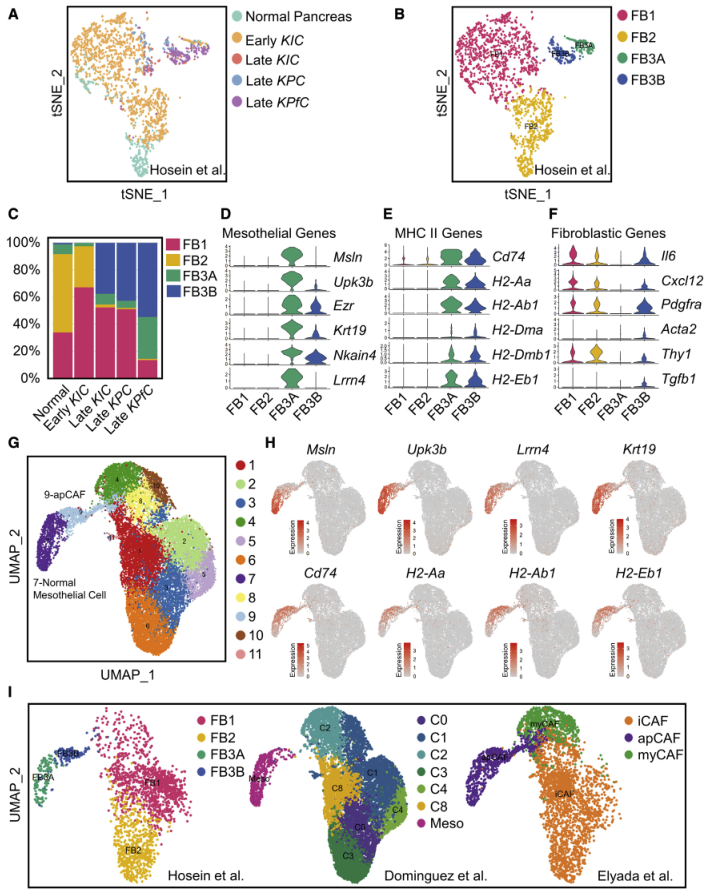
圖1 scRNA-seq綜合分析正常間皮細胞與apCAFs的關系
2、在PDA進展過程中,間皮細胞擴張并促進粘連形成
收集3只KPfC小鼠的晚期腫瘤(PDA1、PDA2、PDA3),消化成單細胞懸液,分析apCAFs的比例(圖2A),發現所有三種腫瘤都由apCAFs組成,其百分比與iCAFs和myCAFs相當。為追蹤PDA進展過程中間皮細胞的命運,作者使用CFSE燃料進行譜系追蹤測定,將CFSE注射到野生型小鼠的腹腔內,并在2天后獲取胰腺,發現正常胰腺的間皮被細胞示蹤染料標記(圖2B),相反,在60天大的KIC或KPfC荷瘤小鼠身上進行了同樣的檢測,并且發現CFSE標記的細胞從間皮區域滲入到腫瘤基質中(圖2B)。為確保CFSE信號是間皮細胞特異性的,將CFSE標記的組織與cadherin-11共同染色(圖2C),發現在正常的胰腺和PDA中,CFSE+細胞也是cadherin-11+;此外,與胰腺癌細胞標志物SOX9共同染色,發現CFSE+的細胞與SOX9+的癌細胞不同(圖2C),進一步支持CFSE信號對間質細胞的特異性。
鑒于在胚胎發育過程中,間皮細胞可以分化為成纖維細胞和平滑肌細胞,所以作者用正常的間皮細胞(簇7)、apCAF(簇9)和其他密切相關的成纖維細胞群(集群1、4、8和10)進行偽時間分析,發現盡管正常的間皮細胞在成為apCAF時獲得了成纖維細胞的特征并趨向于成纖維細胞,但它們對其他CAF群體的形成貢獻有限(圖2D),這支持iCAF和myCAF系來自常駐成纖維細胞。由于apCAFs通過下調間皮細胞基因和上調成纖維細胞基因獲得了差異基因標簽(圖2E),所以對apCAFs中上調的基因進行通路和功能富集分析,以確定驅動這種基因特征變化的生物學過程,結果發現許多已識別的生物過程與損傷或炎癥反應有關(圖2F),這表明來自腫瘤小生境的創傷相關信號可以誘導apCAF的形成。
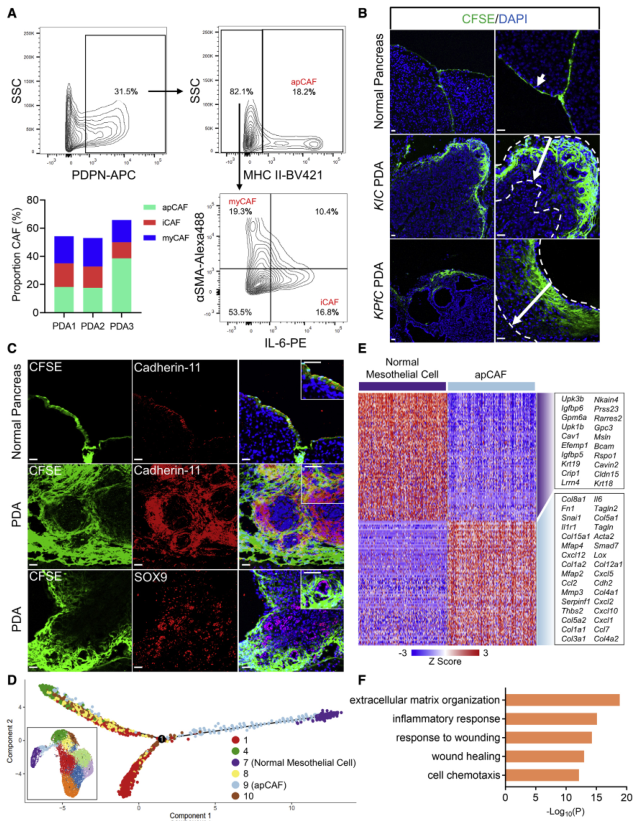
圖2 間皮細胞在PDA形成過程中擴增并獲得成纖維細胞特征
3、創傷相關腫瘤旁分泌信號誘導間皮細胞—apCAF轉變
為驗證間皮細胞—apCAF的轉化,以及在PDA進展過程中確定間皮細胞的命運,利用一個由間皮細胞特異性基因Wt1啟動子驅動的可誘導Cre-loxP系統構建Wt1CreERT2;R26LSL-tdTomato模型(圖3A)。Wt1CreERT2/+;R26LSL-tdTomato/+小鼠在Wt1基因位點表達Cre-ERT2融合蛋白。CreERT2在他莫昔芬(TAM)處理后會從R26位點切除LSL序列,這將不可逆地誘導tdTomato表達。將TAM注射入Wt1CreERT2;R26LSL-tdTomato模型小鼠并收集胰腺(圖3B)。結果顯示正常胰腺間皮表達tdTomato(圖3C-3D)。作為陰性對照,R26LSL-tdTomato小鼠沒有Wt1CreERT2不表達tdTomato(圖3E)。接下來,追蹤PDA進展過程中間皮細胞的命運。將Wt1CreERT2;R26LSL-tdTomato小鼠胰腺內的間皮細胞標記為tdTomato+,原位注射源自KPfC小鼠的同基因PDA細胞系,在植入后3周收獲成熟腫瘤(圖3B),發現間皮細胞在PDA中大量擴增,tdTomato+細胞分布在腫瘤周圍和內部(圖3F-H)。此外,在正常胰腺中,間皮細胞不表達成纖維細胞標志物,如aSMA和IL-6(圖3C-3D),而PDA內可見tdTomato+aSMA+(圖3F)或tdTomato+IL-6+(圖3G)細胞。間皮譜系追蹤實驗強有力的證明間皮細胞獲得成纖維細胞特征,并有助于PDA的間質形成。
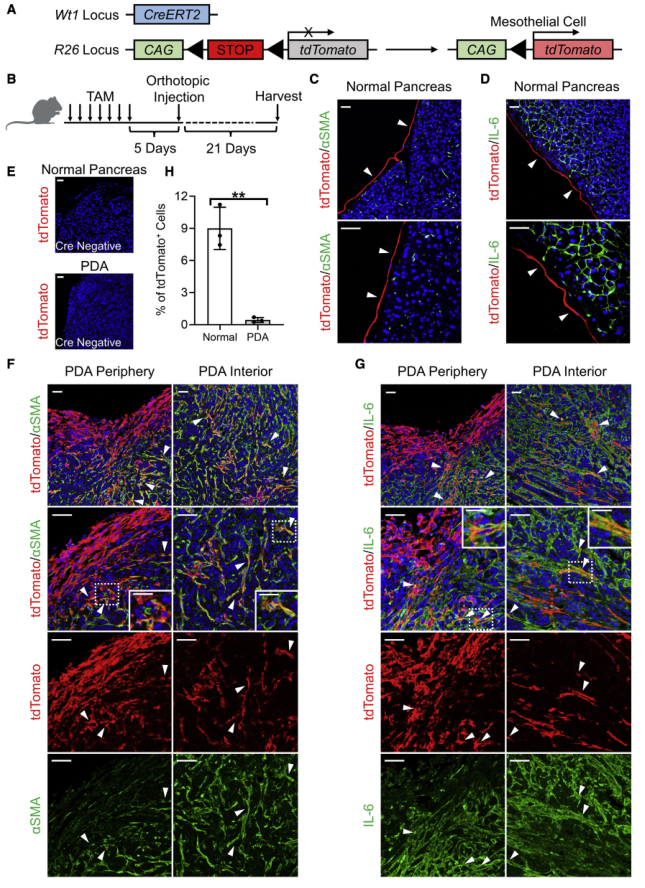
圖3 PDA中間皮細胞的譜系示蹤與可誘導轉基因小鼠模型
4、間皮細胞系再現間皮細胞—apCAF轉變
為研究腫瘤旁分泌信號是否能誘導間皮細胞分化為apCAFs,建立小鼠胰腺間皮細胞系。將間皮外植體接種到組織培養皿中,接種后5天,細胞開始從間皮遷移(圖4A)。一旦融合,這些細胞進行流式細胞術,其中95%的細胞為podoplanin和MHC II雙陽細胞(圖4A),將這些細胞命名為胰腺間皮細胞(PanMeso)。對第10-20代PanMeso細胞進行轉錄組分析,發現其具有穩定的間皮基因標簽和低表達的成纖維細胞基因(圖4B)。用KPfC PDA類器官條件培養(CM)基處理PanMeso細胞,發現其顯著降低間皮細胞基因的表達(圖4C)。對差異上調的基因進行功能富集分析,發現其主要參與傷口和炎癥響應(圖4D),這與單細胞測序結果一致。進一步對腫瘤進行eGFP和aSMA或IL-6的IHC染色,發現TME誘導eGFP+ PanMeso細胞表達aSMA和IL-6(圖4E和4F)。綜上所述,使用PanMeso細胞的體外數據再現了間皮細胞的成纖維細胞轉化,并強調了腫瘤旁分泌信號在促進這一過程中的重要性。
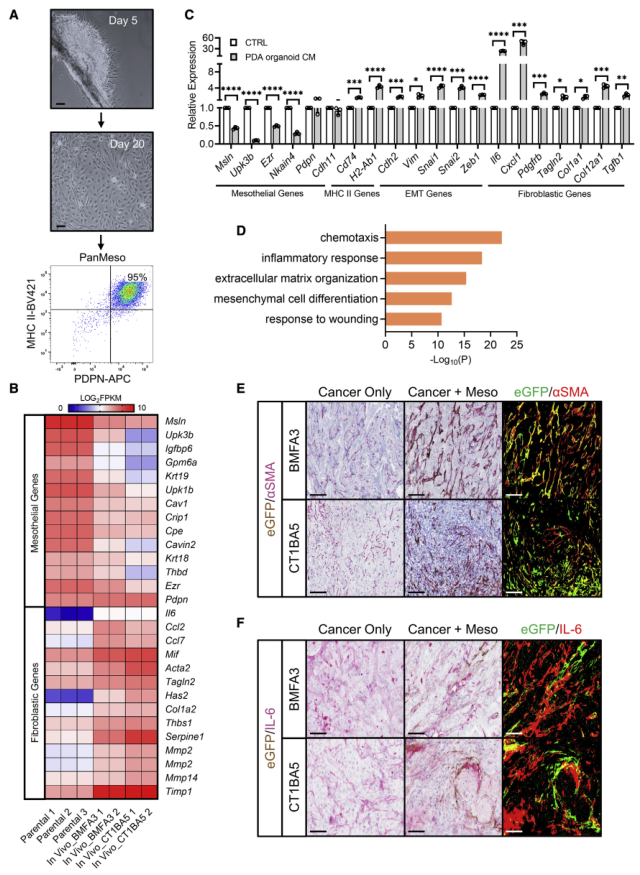
圖4 PanMeso細胞中間皮細胞- apCAF轉變的概述
5、apCAFs誘導幼稚CD4+ T細胞轉變為Tregs細胞
采用圖5A中的方案對KPfC腫瘤進行流式細胞術分選,對分選的細胞進行OVA處理,然后和CD4+ T細胞共培養。結果顯示正常間皮細胞和apCAFs能以OVA依賴的方式誘導T細胞擴增早期激活標志物CD25和CD69的表達,而iCAFs和myCAFs則不能(圖5B-C)。隨后使用PanMeso細胞重復上述實驗(圖5A),PDA類器官CM誘導的apCAFs形成導致PanMeso細胞的抗原提呈能力增加(圖5B-C)。
隨后為探究apCAFs是否誘導Treg細胞形成,檢測和OVA處理的apCAFs細胞共培養的CD4+ T細胞的Treg細胞的存在,結果顯示apCAFs以抗原特異性的方式誘導Treg的形成(圖5D-E)。進一步檢測apCAFs誘導形成的Tregs細胞的免疫抑制功能,如圖5F-G所示,其顯著抑制CD8+ T細胞的增殖。綜上所述,這些數據表明apCAFs可能是一個獨特的免疫調節CAF群體,可以通過抗原依賴的TCR連接誘導Treg的形成和擴增。
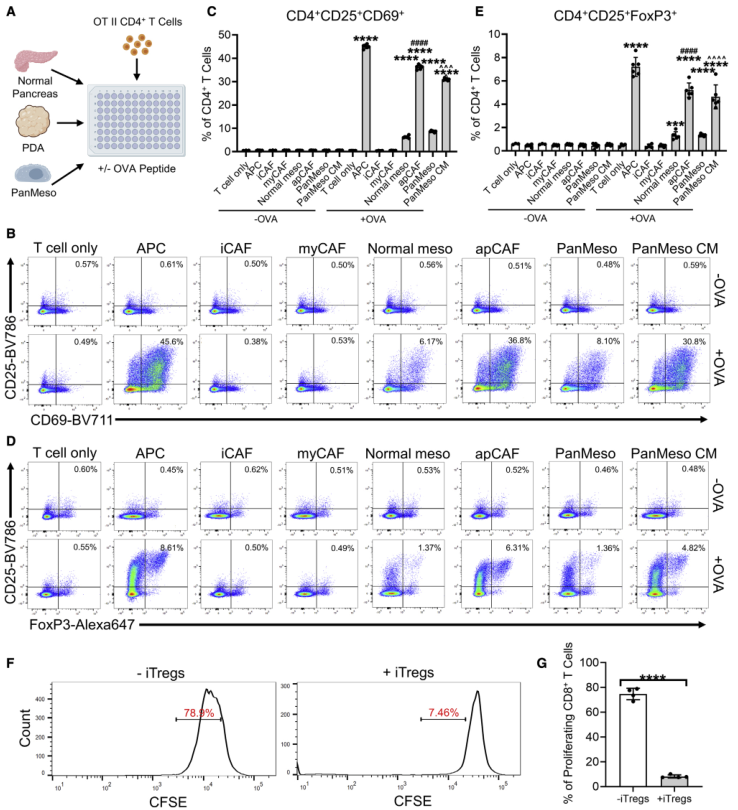
圖5 apCAFs誘導幼稚CD4 + T細胞進入Tregs
6、apCAFs存在于人類腫瘤中并與Tregs相關
為證明apCAFs與人類的相關性,收集人PDA腫瘤組織并進行多色免疫熒光觀察apCAFs與Tregs。PDGFRa在除了間質細胞外的所有CAF類群中表達,所以PDGFRa+CD74+特異性標記apCAFs,PDGFRa+CD74—標記其余類型CAFs(圖6A)。結果顯示,在人PDA中,apCAFs豐度具有異質性(圖6B),并且與Tregs具有相關性,與其它CAF無相關性(圖6C-D)。此外,作者使用上述小鼠apCAFs基因特征表征了兩個人PDA和卵巢癌的單細胞數據集,發現兩者間有重疊(圖6F-G)。因此,以上表明在人腫瘤中也存在apCAFs并與Tregs相關。
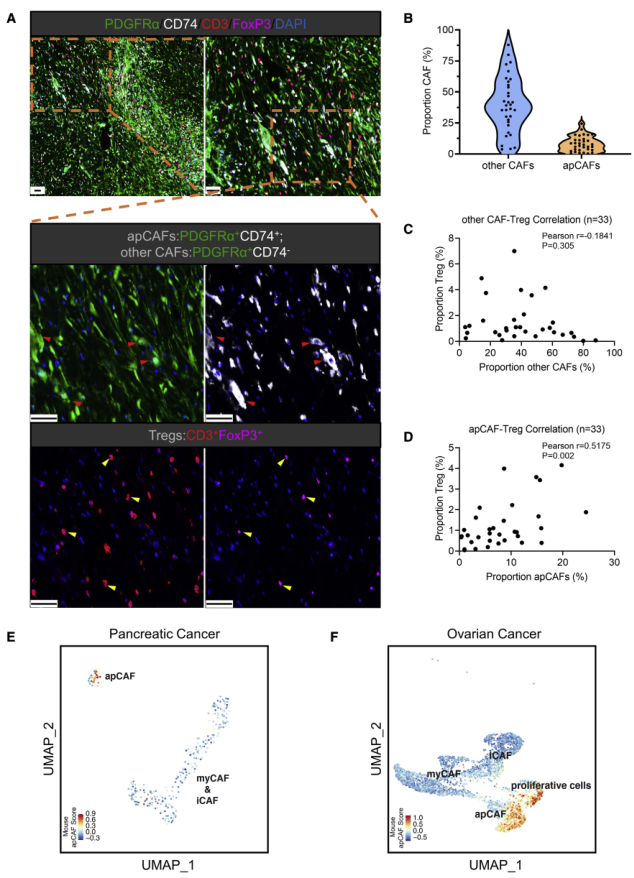
圖6 apCAFs存在于人類腫瘤中,并與Treg相關
7、IL-1和TGF-β參與間皮細胞—apCAF轉化
為確定驅動間皮細胞向apCAF轉化的信號通路,提取在apCAF中上調的差異基因,并對它們進行motif富集分析,鑒定到NF-kB通路的Nfkb1和Rela,TGF-β信號通路的Smad1,Smad3,Smad4(圖7A)。IL-1誘導的NF-kB信號通路被預測負責iCAF譜系的形成,而TGFβ被預測驅動myCAF譜系。為驗證這一結果,使用PDA類器官CM處理PanMeso細胞,結果顯示NF-kB和TGF-β信號通路均被激活了(圖7B)。隨后檢測IL-1和TGFβ是否驅動間皮細胞的apCAF表型,結果顯示,與對照組比較,IL-1和TGFβ處理的PanMeso細胞中間質細胞基因的表達顯著下降(圖7C),相反成纖維細胞相關基因顯著上調表達(圖7D)。這些結果表明IL-1和TGFβ可以驅動間皮細胞向apCAF表型轉化。
接下來探究IL-1和TGFβ是否影響間皮細胞的功能。結果顯示OVA特異性TCR激活被IL-1和/或TGFβ預處理的PanMeso細胞增強(圖7E-7F)。此外,IL-1和/或TGFβ預處理的PanMeso細胞顯著增強Treg細胞數量(圖7G-7H)。以上數據表明,IL-1/NF-kB和TGFb信號通路負責正常間皮細胞分化為apCAFs,并具有活化CD4+ T細胞和促進其分化為Treg的能力。
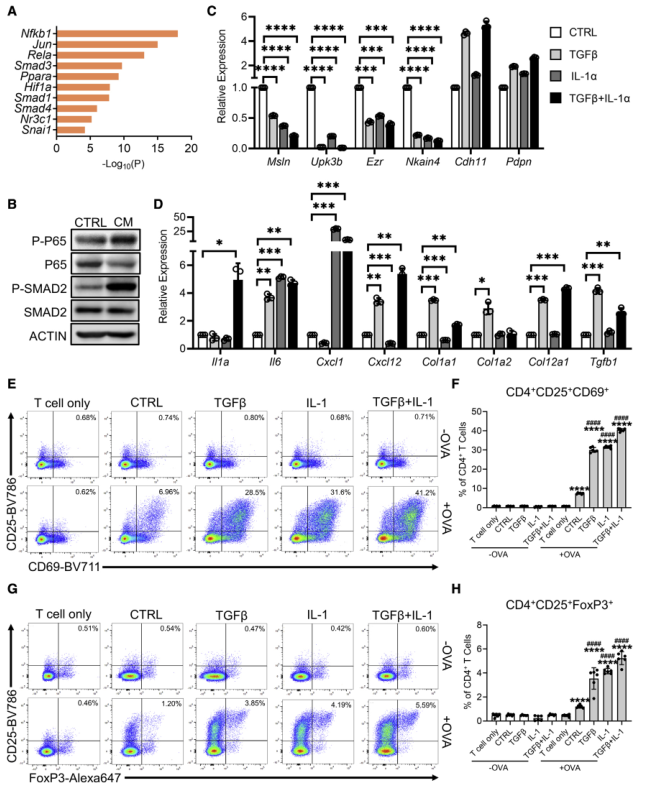
圖7 IL-1和TGF-β參與間皮細胞—apCAF轉化
8、靶向間皮素可抑制間皮細胞向apCADs轉化
有兩篇報道使用小鼠特異性阻斷單克隆抗體(mAb)對抗間皮細胞標記物間皮素(MSLN Ab)來抑制間皮細胞向成纖維細胞的轉變。因此,作者測試了mAb對間皮細胞apCAF形成的影響。使用PDA類器官CM、對照Ab、MSLN Ab處理PanMeso細胞,結果顯示MSLN Ab顯著抑制由PDA類器官CM引起的間質基因的下調和EMT及成纖維細胞基因的上調(圖8A)。在小鼠體內,MSLN Ab顯著減少TAM誘導的Wt1CreERT2;R26LSL-tdTomato小鼠的tdTomato陽性細胞(圖8B-C)、tdTomato+aSMA/IL6+雙陽性細胞(圖8D-E)。
功能實驗顯示,MSLN Ab可抑制因PanMeso細胞的PDA類器官CM引起的抗原呈遞和Treg細胞誘導能力(圖8F-I)。重要的是,MSLN Ab可抑制腫瘤生長和腫瘤中Treg細胞比例(圖8J-M)。綜上所述,以上表明靶向MSLN可能是有效抑制間皮細胞向apCAF轉化和克服apCAF誘導的免疫抑制的潛在策略。
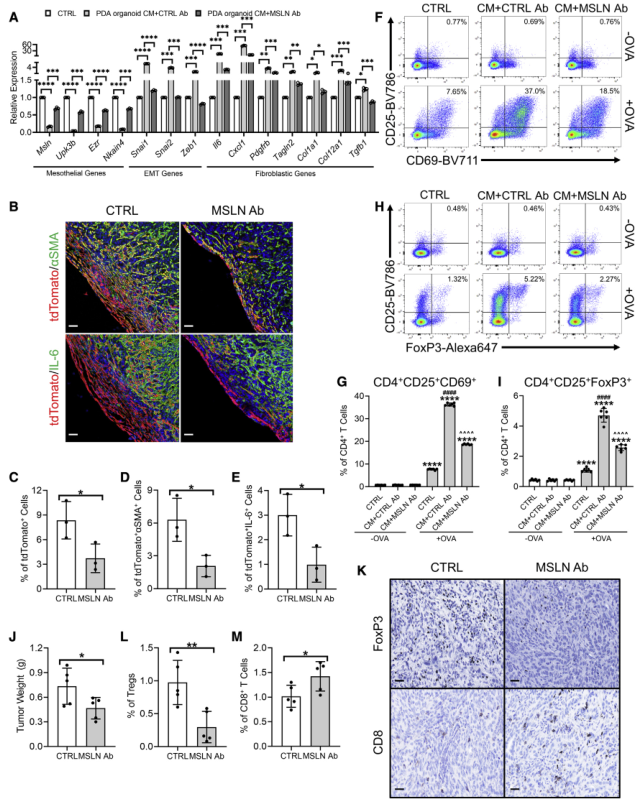
圖8靶向間皮素可抑制間皮細胞向apCADs轉化
參考文獻:
Huang H, Wang Z, Zhang Y, Pradhan RN, Ganguly D, Chandra R, Murimwa G, Wright S, Gu X, Maddipati R, Müller S, Turley SJ, Brekken RA. Mesothelial cell-derived antigen-presenting cancer-associated fibroblasts induce expansion of regulatory T cells in pancreatic cancer. Cancer Cell. 2022 Jun 13;40(6):656-673.e7. doi: 10.1016/j.ccell.2022.04.011. Epub 2022 May 5. PMID: 35523176; PMCID: PMC9197998.






