外泌體的分離和統計你知道多少?
外泌體是直徑為30-150 nm的小細胞外囊泡。多年以來,外泌體被認為是細胞成熟過程中產生的“垃圾”。然而,隨著最近從不同類型的外泌體中分離出各種蛋白質,脂質和遺傳物質(例如,miRNA,mRNA,DNA分子以及lncRNA),它們在細胞通訊和表觀遺傳調控中的關鍵作用已經顯現。在生理和病理條件下,幾乎所有類型的細胞都可以釋放外泌體,這些外泌體通過轉運關鍵蛋白和遺傳物質(例如miRNA,mRNA和DNA)在細胞通訊和表觀遺傳調控中發揮重要作用。目前,在Clinicaltrials.gov上注冊了127種與外泌體相關的臨床試驗(2017年為26項試驗),涉及多種疾病的治療和診斷。因此,已經深入研究了基于外泌體的疾病診斷和治療方法。Dongbin Yang團隊所在的多個中國醫院與澳大利亞和美國的醫療機構及研究中心于2020.02.19聯合發表于Theranostics( 影響因子:8.063)的一篇文章,通過全面分析外泌體分離策略的進展,詳細介紹了,當前外泌體分離技術的全景視圖,為從各種類型的生物基質中高效分離外泌體的新型方法的發展提供了前景。此外,從基于外泌體的診斷和治療的角度來看,作者強調定量外泌體和微囊泡分離的問題。

1.差速超離心法分離外泌體的示意圖
差速超離心法是利用離心力從300×g到100,000×g的多個離心循環來實現的。每離心一步后,除去細胞、細胞碎片、凋亡小體等微丸,收集上清進行離心。在最后離心后(即除去上清,收集外泌體含球團和污染蛋白。離心在4℃下進行。

2.梯度超離心法分離外泌體的示意圖
(A)等密度梯度超離心法是通過在從底部到頂部逐漸降低的層中添加介質來制備的。長時間離心后,細胞外成分包括外泌體、凋亡小體和蛋白聚集物在密度相近的培養基中達到靜止位置。然而,由于等密度梯度超離心僅依賴于樣品中不同溶質之間的密度差,該方法不能分離與外泌體具有類似浮力密度的物質(如微泡)。(B)移動帶梯度超離心法通常包括兩個梯度介質段。最上層是密度低于樣品所有溶質的介質。底部是高密度的墊子。由于溶質的密度都大于梯度介質的密度,離心后,不僅根據密度,而且根據質量/大小,將所有溶質依次分離,從而可以分離密度相當但大小不一的小泡。

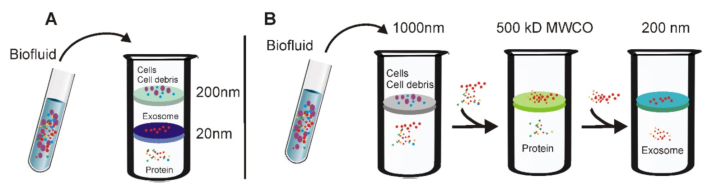
3.超濾法分離外泌體的示意圖
(A)串聯配置的微過濾器。細胞外液通過串聯配置的微濾器,其尺寸排阻極限在20-200 nm附近。當穿過兩個膜時,包括細胞碎片,凋亡小體和大部分微囊的大囊泡被捕獲在200nm膜中,而直徑20至200nm的囊泡則保留在下部20nm濾膜上。(B)順序超濾。首先將細胞外液通過1000納米過濾器以除去較大的顆粒(例如細胞或細胞碎片);然后將濾液通過截留值為500kD的第二個過濾器,以除去小顆粒,例如游離蛋白。最后,通過200nm濾光片收集<200nm的外泌體。
4.切向流過濾確保高效的超濾示意圖
在切向流過濾期間,進料流平行于膜面流動。所施加的壓力使一部分氣流根據過濾器的尺寸通過膜。由于膜始終在平行流動力的作用下,可以有效地減少潛在的堵塞。在切向流過濾過程中,將剩余部分重新循環回給料池以進行重復過濾,以確保徹底過濾。

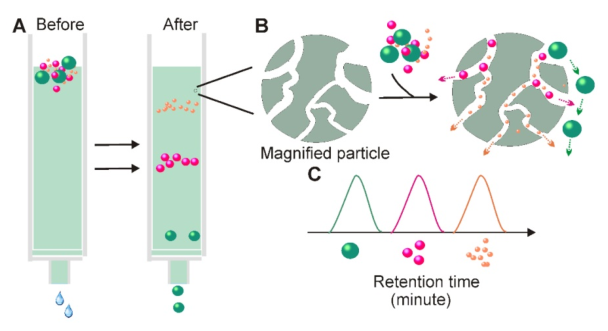
5.體積排阻色譜的外泌體分離原理
當溶液通過由多孔樹脂顆粒組成的固定相時,分子可以根據尺寸(A)進行分離;雖然流體動力學半徑小于固定相孔的顆粒進入孔中以獲取更長的傳輸距離,但無法進入孔中的較大顆粒直接在樹脂(B)周圍移動。這導致具有不同尺寸的顆粒表現出不同的保留時間,因此有利于基于尺寸的分離。
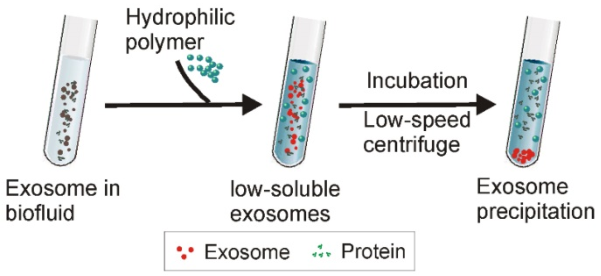
6.聚合物沉淀策略示意圖
在將高親水性聚合物添加到含外泌體的溶液中后,外泌體周圍的水分子被聚合物束縛,降低了外泌體的溶解度并誘導其隨后的沉淀。低速離心可以很容易地收集外泌體。
7.水兩相系統的外泌體分離示意圖
當將疏水性更高的聚乙二醇(PEG)和親水性更高的葡聚糖溶液混合時,可能會發生兩相系統。將PEG和右旋糖酐添加到含外泌體的溶液中,然后進行孵育和低速離心后,蛋白質和其他大分子復合物優先聚集在PEG中,而外泌體優先聚集在右旋糖酐相中。

8.基于免疫親和力的外來體分離示意圖
首先,將識別外泌體特異性標志物的抗體固定在固體基質上。用抗體偶聯的固體基質孵育含外泌體的液體后,可將外泌體富集到此類固體基質上。可以通過額外的洗脫步驟收集游離的外來體。

9.適體介導的免疫親和力
適體通過構象互補識別并結合其靶標。在調整了緩沖系統的關鍵因素(如鹽類型和離子強度)之后,適體的形狀發生變化并釋放結合的靶分子。

10.集成的微流技術可實現結合的外泌體分離和分析
在將含有外泌體的液體添加到鞘層介質中之后,可以基于細胞外囊泡的物理和生化特性,通過不同的方法分離包括外泌體的液體中的顆粒。重要的是,在信號檢測平臺的幫助下,這些小型化的微流控設備不僅實現了從少量體液中快速隔離外來體,而且還可以進行實時外來體表征以進行原位診斷。

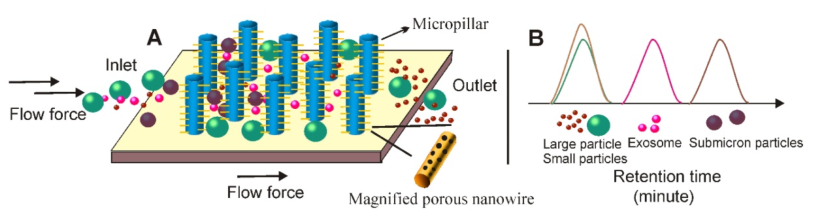
11.納米線的外泌體脫扣系統的原理
(A)與基于SEC的分離類似,可以通過在均勻分離的微柱壁上壓印含多孔硅的納米線,創建微柱上的納米線結構。在將含外泌體的液體添加到微柱上的納米線分層結構后,液體中的顆粒會經歷不同的命運;(1)直接從亞微米微柱陣列中排除較大的顆粒(例如細胞);(2)具有亞微米尺寸(例如,細胞碎片)的顆粒能夠進入微柱間隔,但無法進入30-200 nm納米線間隔;(3)小分子(例如蛋白質)在納米線間隔內移動而不受阻礙;(4) 30–200 nm的粒子(例如外泌體)被納米線森林所阻擋。(B)具有不同尺寸的顆粒呈現不同的保留時間,因此有利于尺寸依賴性分離。
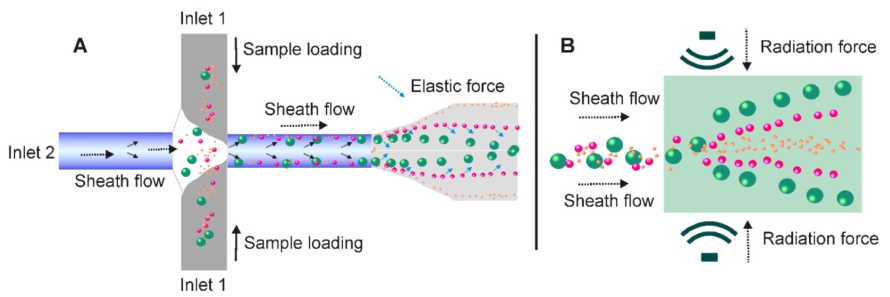
12.非接觸式微流控技術簡化了外泌體分離程序
(A)在基于粘彈性介質流的微流系統中,含囊泡的流體(從inlet 1添加)遇到鞘流(從inlet 2添加),并首先沿微通道壁對齊。在施加由流體的粘彈性產生的彈性提升力后,外泌體和其他細胞外成分會根據其大小被驅向微通道的中心線,較大的顆粒最終會到達中心線。 (B)在超聲波的壓力下,具有不同機械性能(例如,可壓縮性,尺寸和密度)的顆粒經受不同的輻射力,并導致連續地無接觸且依賴尺寸的外泌體分離。
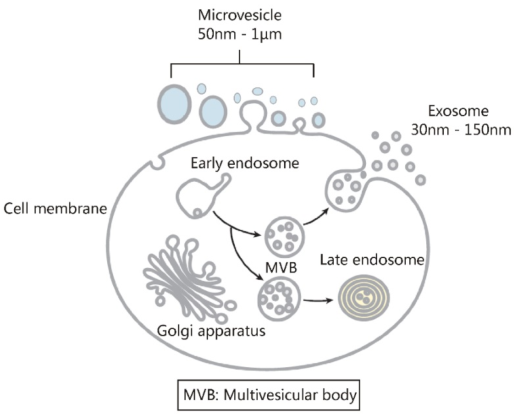
13.細胞外囊泡主要由兩種具有相似理化特性的囊泡組成
細胞外囊泡包括外泌體和微囊泡。它們之間的主要區別在于它們的亞細胞起源。微囊泡是從細胞膜上脫落50-1000 nm的顆粒。外泌體是源自內體的30–150 nm細胞外囊泡,它們在細胞膜和多囊體融合后通過胞吐作用分泌到體液中。由于缺乏有效的策略來分離微泡和外泌體,仍然很難精確評估其理化性質和功能。
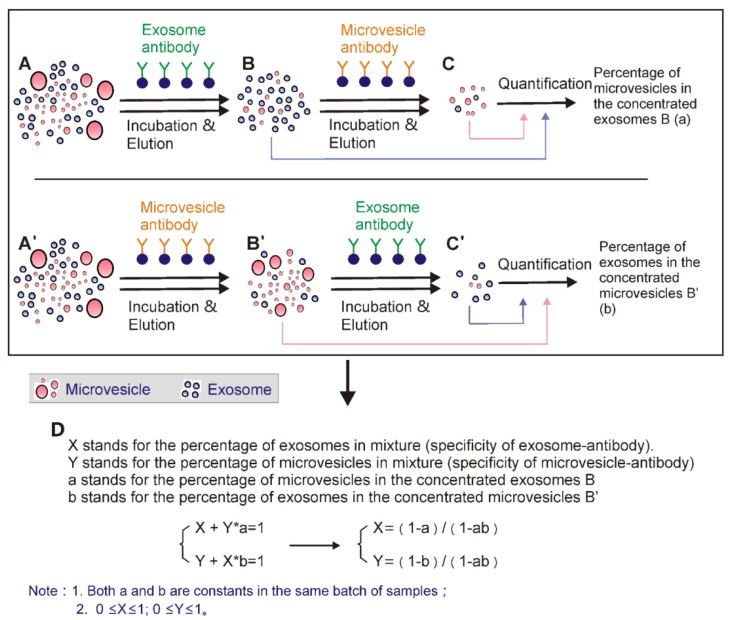
14.通過囊泡和微囊泡標記物特異性抗體計算胞外囊泡的囊泡和微囊泡組分的比例
細胞外囊泡A(A’)通過聚合物沉淀濃縮。然后使用相應的基于抗體的免疫親和捕獲法提取外泌體(B)或微囊泡(B');洗脫后,使用基于抗體的免疫親和方法從洗脫液中再次提取外泌體(C’)和微泡(C)。然后,對提取的外泌體(B,C')和微囊泡(B',C)進行定量。使用D中所示的公式計算原始細胞外囊泡中外泌體和微囊泡的比例。
參考文獻:
Yang Dongbin,Zhang Weihong,Zhang Huanyun et al. Progress, opportunity, and perspective on exosome isolation - efforts for efficient exosome-based theranostics.[J] .Theranostics, 2020, 10: 3684-3707.






