miRNA介導胰腺癌化學耐藥性
胰腺導管腺癌(PDAC)作為最致命的胃腸道惡性腫瘤,是癌死亡的第四大原因。基于吉西他濱(GEM)的化療方案是癌癥治療的重要組成部分,但化療抵抗是PDAC治療的主要挑戰。癌癥中miRNA表達失調可能是導致改變生物過程的關鍵因素,包括化學抗性。今日,小編分享給大家一篇關于PDAC化學耐藥性研究的文章。
技術路線:

結 果:
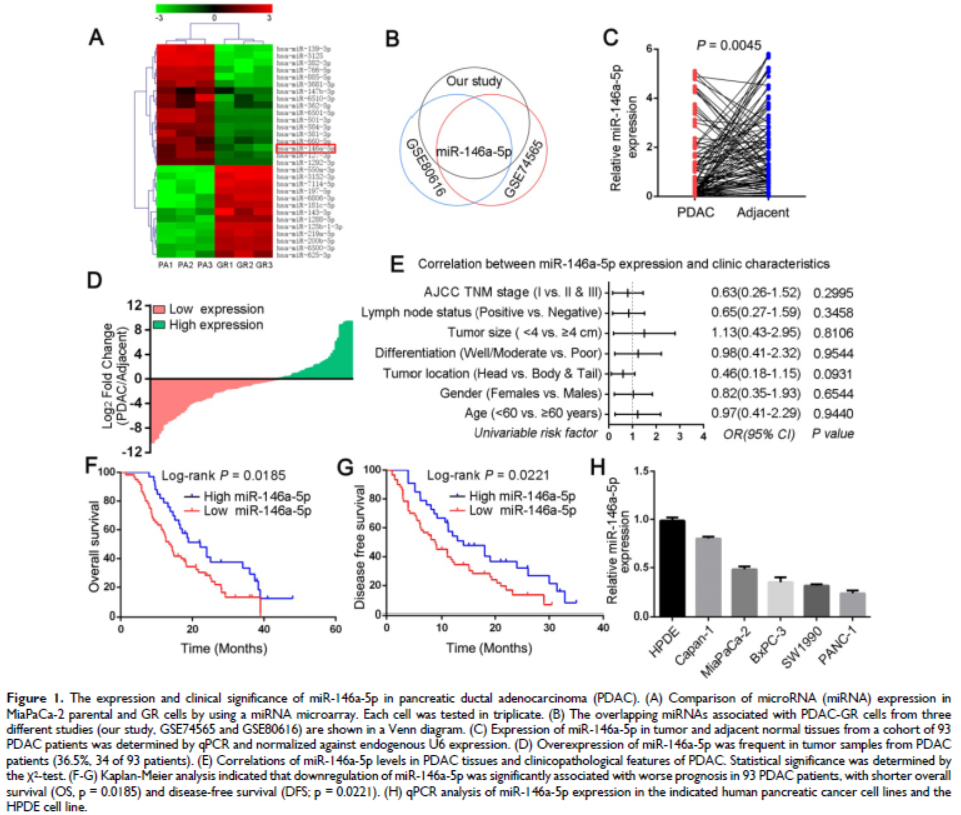
1. 耐GEM的PDAC細胞中MiR-146a-5p異常下調,并與PDAC患者預后不良相關
培養GEM抗性的PDAC細胞系(MiaPaCa-2-GR和SW1990-GR細胞),miRNA微陣列用于分析MiaPaCa-2-GR細胞與它們親代細胞之間同時上調或下調的miRNA,結合數據庫發現miR-146a-5p在所有PDAC-GR細胞系中均下調,比親代細胞表達低,表明miR-146a-5p在調節化學抗性中有潛在作用。進一步研究發現miR-146a-5p在PDAC腫瘤中低表達,且其表達與臨床病理特征無顯著關系,miR-146a-5p的下調與更短的預后相關。
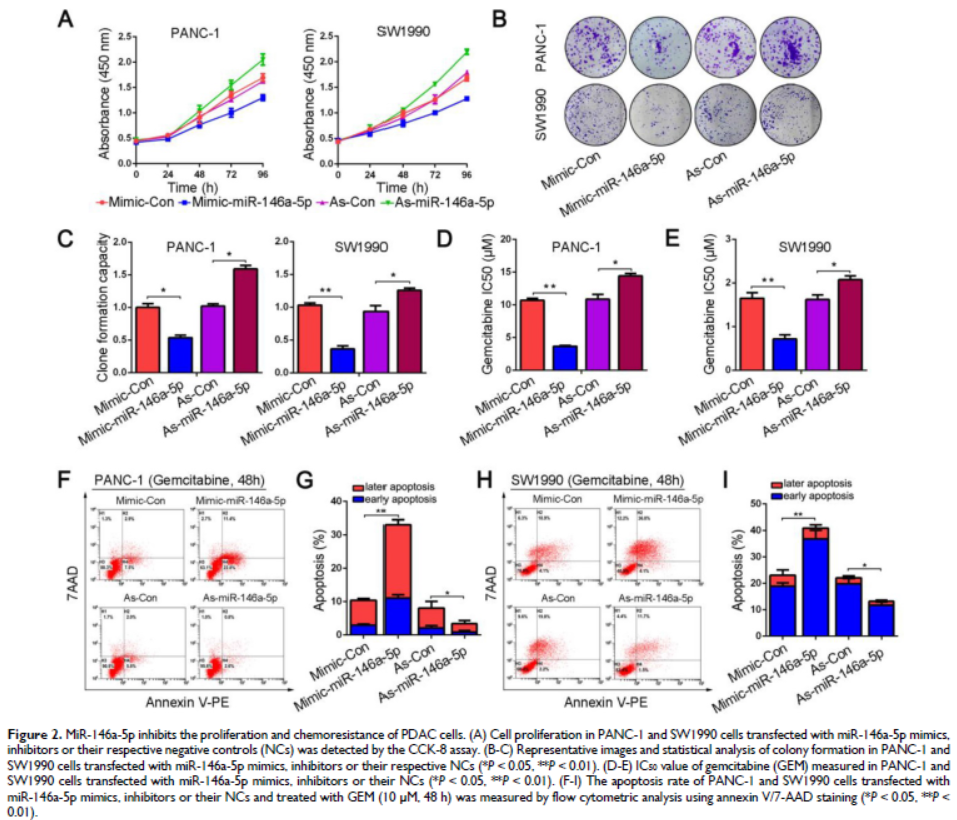
2. MiR-146a-5p抑制PDAC細胞增殖和化學耐藥性
miR-146a-5p的過表達顯著抑制PDAC細胞的增殖和集落形成能力。用各種濃度的GEM處理PANC-1和SW1990細胞持續48小時,發現GEM的IC50值在轉染miR-146a-5p模擬物的PDAC細胞中顯著降低,表明miR-146a-5p增強GEM的細胞毒性。抑制miR-146a-5p表達有相反效果。誘導凋亡是GEM抗腫瘤作用的關鍵機制,發現GEM誘導的細胞凋亡比率在轉染miR-146a-5p-mimic的細胞中增加,而miR-146a-5p的下調抑制GEM處理導致的細胞凋亡。這些結果表明miR-146a-5p不僅抑制細胞增殖,而且增強GEM的細胞毒性。
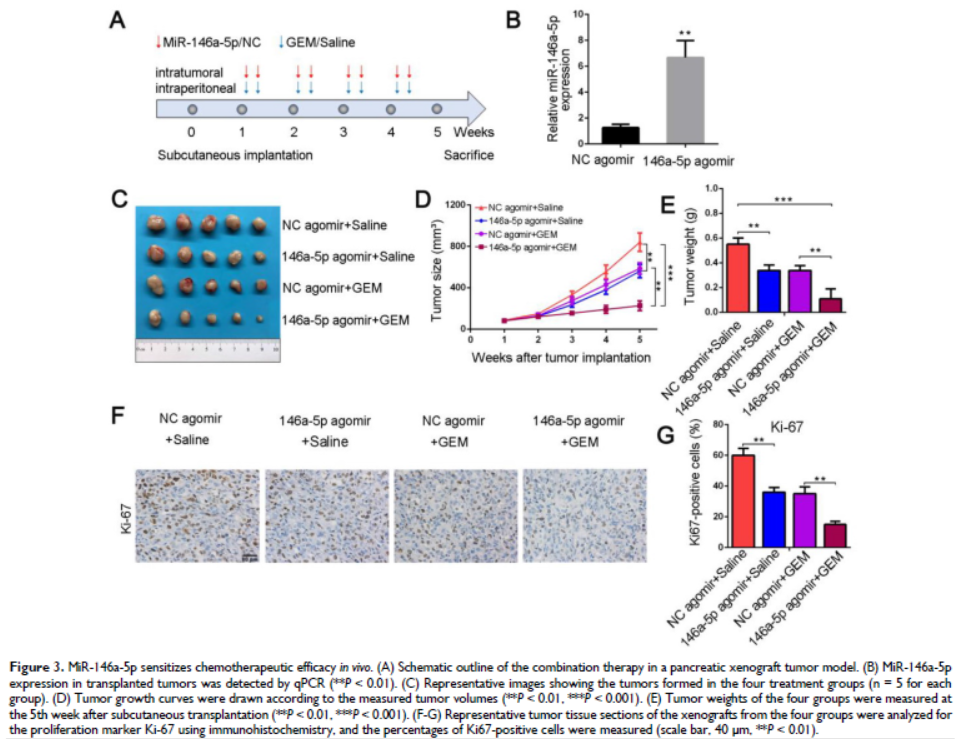
3. MiR-146a-5p可敏化胰腺異種移植腫瘤的化療療效
建立PDAC異種移植模型,當移植小鼠出現明顯的異種移植腫瘤,每周兩次用miR-146a-5p和GEM治療。miR-146a-5p agomir處理的異種移植腫瘤組織中miR-146a-5p的表達水平升高,腫瘤大小和重量顯著降低,GEM治療后進一步減少。miR-146a-5p agomir和GEM治療細胞增殖受到抑制,細胞凋亡明顯增加。這些結果表明,miR-146a-5p可以抑制腫瘤生長并使PDAC細胞對GEM治療敏感。
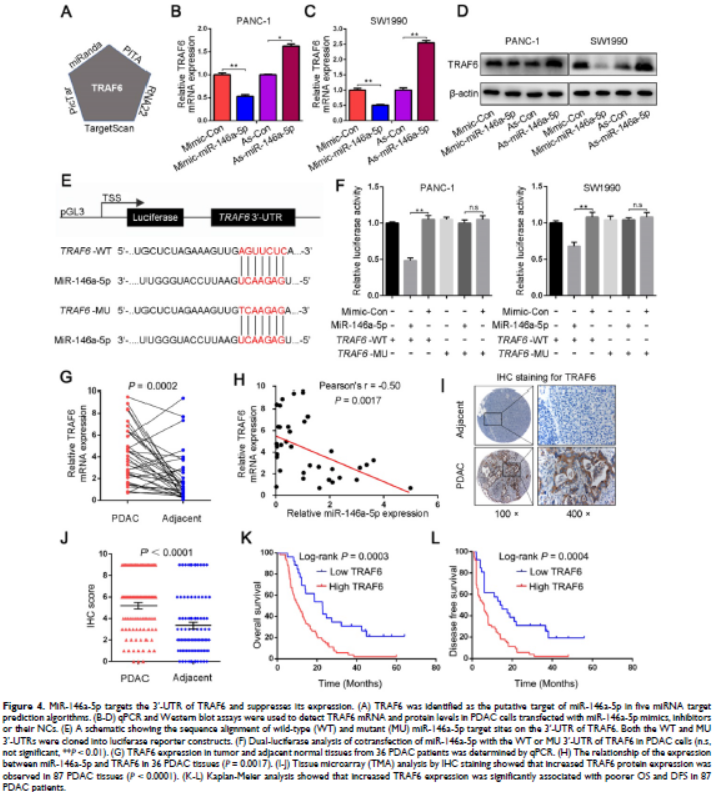
4. MiR-146a-5p靶向TRAF6的3'-UTR并抑制其表達
通過各種數據庫確定TRAF為miR-146a-5p的潛在靶標,miR-146a-5p模擬物處理的細胞TRAF6表達減少,在miR-146a-5p抑制劑處理的細胞中增加。螢光素酶實驗確認miR-146a-5p可直接與TRAF6結合并抑制其表達。在36對PDAC腫瘤和鄰近的正常組織中檢查TRAF6的表達水平,發現RAF6在PDAC組織中的表達明顯更高。IHC染色顯示TRAF6蛋白在PDAC組織中表達增加,并與更多的陽性淋巴結、分化差、更嚴重TNM期相關。TRAF6的增加表達與預后較差密切相關。
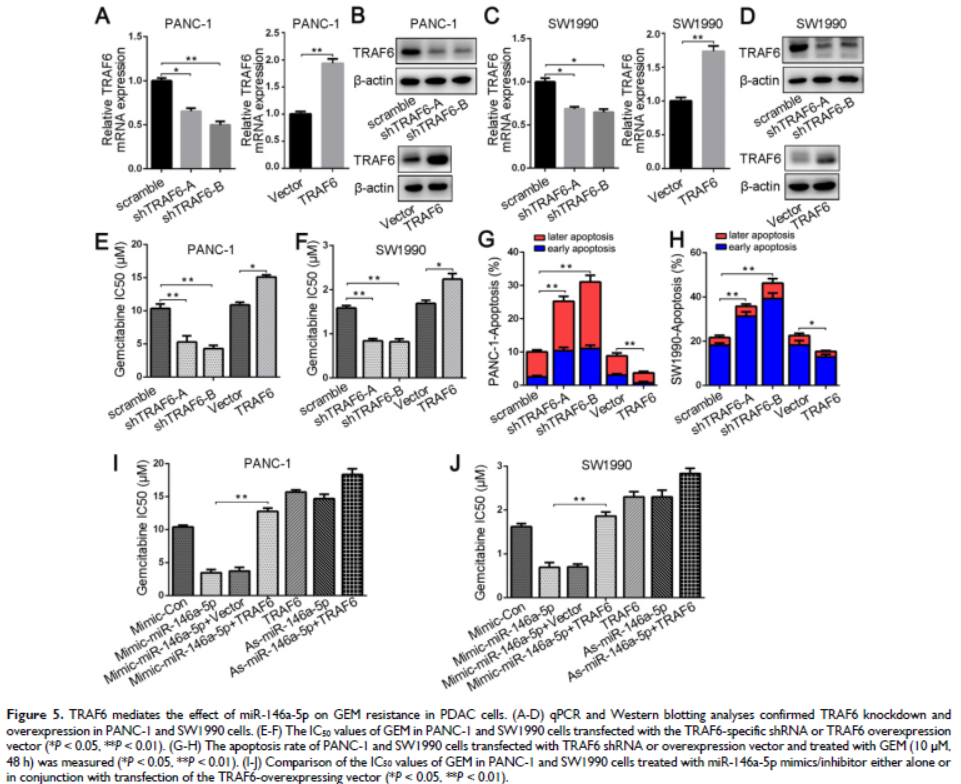
5. TRAF6介導miR-146a-5p對PDAC細胞的GEM抗性
在PDAC細胞中敲低或過表達TRAF6,發現沉默TRAF6降低了GEM的IC50值,并提高在PDAC細胞中的細胞毒性作用,而TRAF6過表達會增加IC50值,GEM誘導的細胞凋亡在RAF6-敲低細胞中增加。miR-146a-5p模擬物誘導的較低的IC50可被之后的TRAF6過表達所逆轉,miR-146a-5p抑制劑處理的細胞的高IC50值在過表達TRAF6時進一步增加,表明miR-146a-5p 對GEM的作用能被TRAF6 過表達抑制。這些結果表明miR-146a-5p通過直接調控TRAF6可使PDAC細胞對GEM的化學功效敏感。
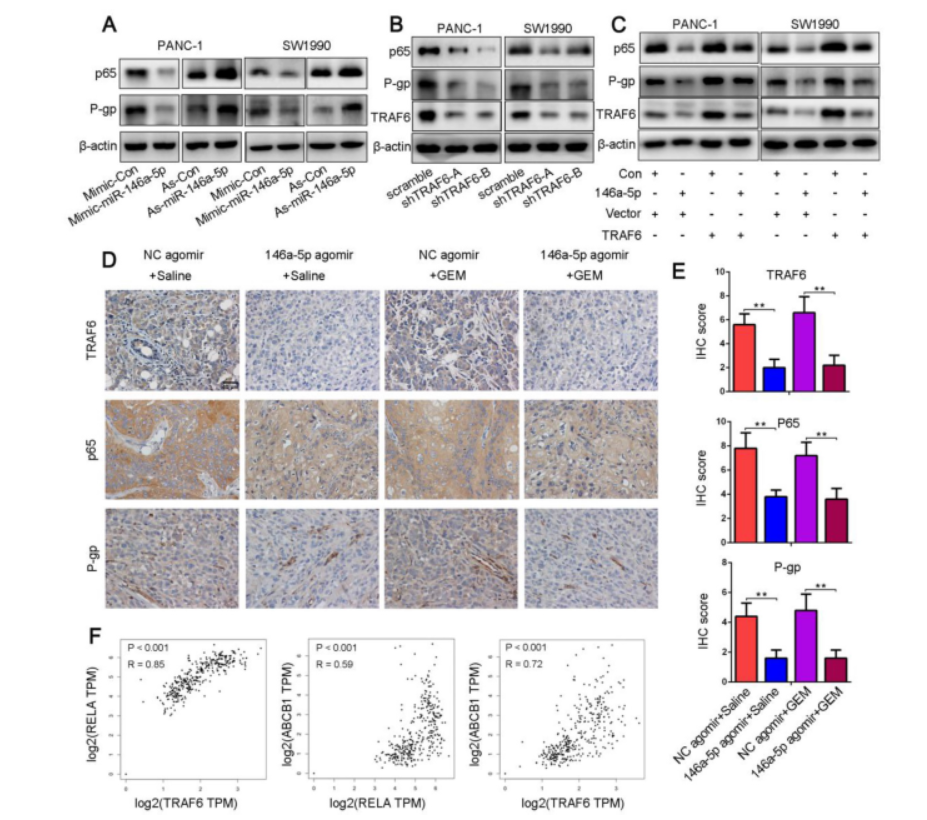
6. MiR-146a-5p通過TRAF6 /NF-κB p65 / P-gp軸負調節GEM抗性
NF-κB p65、P-gp與耐藥相關,TRAF6可作為NF-κB的分子橋和關鍵激活劑。研究發現miR-146a-5p過表達降低了NF-κB p65和P-gp表達水平,而這些蛋白質的水平在miR-146a-5p抑制后明顯增加。同樣,TRAF6敲低降低NF-κB p65和P-gp的表達水平。miR-146a-5p agomir處理的異種移植腫瘤中TRAF6,NF-κBp 65和P -gp的表達水平降低,數據分析發現TRAF6表達與NF-κBp 65(RELA)和P-gp(ABCB1)的表達呈正相關。這些結果表明miR-146a-5p通過TRAF6 /NF-κB p65/ P-gp軸調節PDAC細胞的GEM抗性。

總 結:
1. MiR-146a-5p可抑制PDAC細胞增殖和化學耐藥性;
2. miR-146a-5p通過TRAF6 /NF-κB p65/ P-gp軸調節PDAC細胞的GEM抗性。






