外泌體是如何破壞了血管的完整性?
外泌體在細胞間通訊中起著關鍵作用,因為它們包含信號分子和遺傳物質,正因為此,外泌體有關的高分文章層出不窮。在腫瘤發生過程中,已經證明腫瘤來源的外泌體促進腫瘤血管生成和轉移。

今天我們講述一篇關于外泌體通過觸發內皮細胞中的內質網應激來破壞血管完整性的文章,該文章題名為:“Exosomes derived from HeLa cells break down vascular integrity by triggering endoplasmic reticulum stress in endothelial cells”,發表在J Extracell Vesicles期刊上,影響因子: 11。本文探索了HeLa細胞來源的外體(海拉癌細胞株)及其相關機制。該研究發現,HeLa細胞來源的外泌體通過觸發內皮細胞中的內質網應激和破壞內皮完整性來促進轉移。外泌體的這種作用是不依賴于微核糖核酸的。
結果一、海拉癌細胞株破壞內皮細胞的TJs,破壞內皮細胞單層的屏障功能
要獲得外泌體(Exo)的效果海拉癌細胞株在內皮單層的通透性上,檢測癌細胞(Siha/GFP)的跨內皮侵襲。有更多的綠色熒光蛋白標記的Siha細胞通過胞外遷移海拉癌細胞株-經處理的人臍靜脈內皮細胞單層與經PBS或正常人臍靜脈內皮細胞外體處理的人臍靜脈內皮細胞單層相比(外體HCEC)。體外循環治療血管內皮細胞瘤海拉癌細胞株與用Exo處理的熒光探針相比,顯著增加了熒光探針通過電子傳輸層的次數HCEC或PBS。免疫熒光染色顯示,在用Exo處理后,人臍靜脈內皮細胞單層中的ZO-1和CLDN5均顯著減少海拉癌細胞株,但不適用于PBS或ExoHCEC。
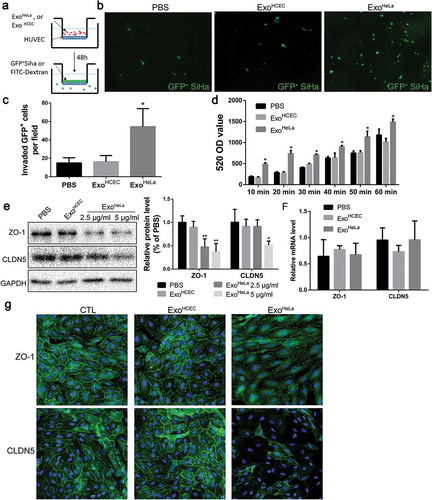
結果二、海拉癌細胞株血管通透性增加體內
為了進一步證明Exo的效果海拉癌細胞株內皮屏障體內,小鼠被注射了海拉癌細胞株或ExoHCEC通過尾靜脈注射FITC葡聚糖。在外耳道檢測到FITC-葡聚糖從耳朵血管中嚴重泄漏海拉癌細胞株-,但不是在ExoHCEC-或PBS處理的小鼠。在肺和肝中也觀察到類似的結果,因為在肺切片中檢測到更多的熒光和肝臟。在肺CD31陽性的內皮細胞中檢測到明顯較少的ZO-1和CLDN5。這些結果表明,海拉癌細胞株治療導致內皮細胞中TJ蛋白的下調,這增加了不同器官中的血管通透性。
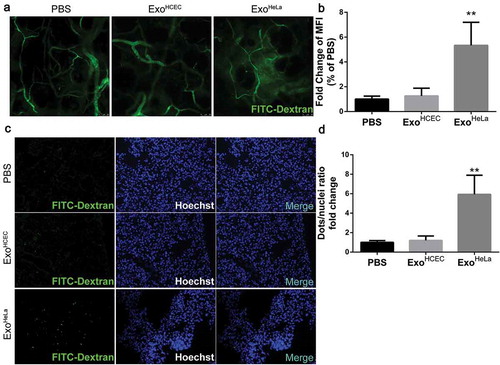
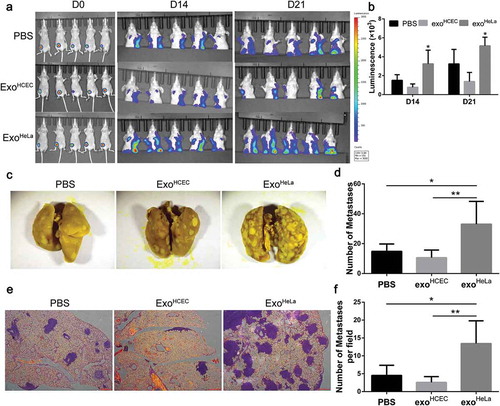
結果三、海拉癌細胞株促進腫瘤轉移體內
將小鼠乳腺癌4T1細胞用熒光素酶基因轉導并植入小鼠,連續3周每天注射外泌體,確定Exo是否海拉癌細胞株治療可以促進腫瘤轉移。在Exo中檢測到明顯更多的遠處轉移海拉癌細胞株-通過發光分析處理的小鼠,而三組之間原發腫瘤的大小沒有顯著差異。在Exo中檢測到超過兩倍的肺轉移海拉癌細胞株-與Exo相比,處理過的小鼠HCEC-處理過的小鼠。
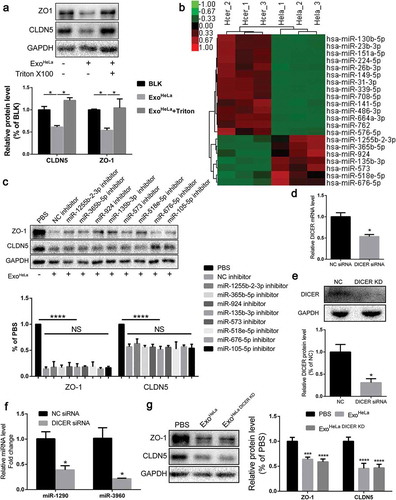
結果四、外體微小核糖核酸沒有引起TJs的下調
海拉癌細胞株-誘導內皮完整性的惡化,對內皮細胞的增殖和TJ蛋白與其他蛋白(VEGFR2,E2F1)在曲拉通處理后被逆轉,表明外泌體內部的成分是抑制作用的原因。由于外泌體的微小核糖核酸(miRNAs)在外泌體介導的效應中起重要作用,外泌體中所有的微小核糖核酸都被測序和分析。結果顯示,用miRNA抑制劑預處理人臍靜脈內皮細胞并不能逆轉內皮細胞中ZO-1或CLDN5的下調海拉癌細胞株。在HeLa細胞中DICER蛋白下調了約70%,DICER基因敲除并沒有減弱HeLa外體對人臍靜脈內皮細胞TJ蛋白的下調作用,表明miRNAs可能不參與HeLa外體對TJ蛋白的抑制作用。
結果五、抑制泛素化或自噬都不能逆轉ZO-1和CLDN5的蛋白水平
檢查Exo是否海拉癌細胞株-通過增強的泛素化途徑誘導TJ蛋白的下調,蛋白酶體抑制劑MG132與Exo一起被加入到人臍靜脈內皮細胞培養物中海拉癌細胞株。結果顯示,MG132沒有逆轉Exo的抑制作用海拉癌細胞株CLDN5和ZO-1的表達,表明泛素化途徑可能不參與TJ蛋白的下調,TJ蛋白的減少不是通過外切海拉癌細胞株誘導自噬。
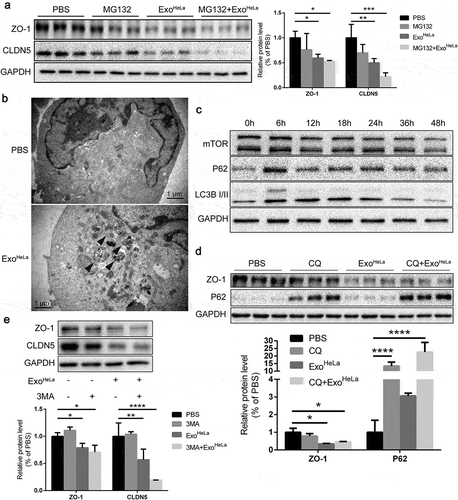
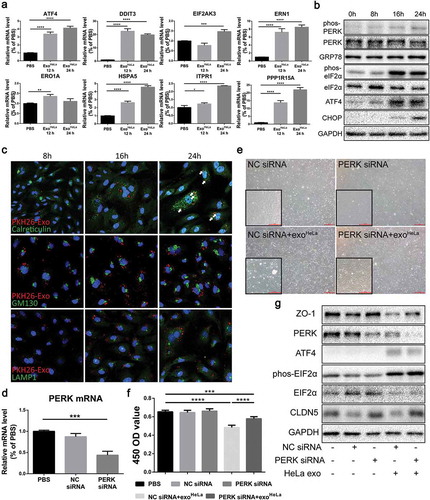
結果六、海拉癌細胞株誘導內皮細胞內質網應激
為了確定Exo的影響海拉癌細胞株在內皮細胞上,通過比較體外培養前后內皮細胞的基因序列,分析內皮細胞基因表達的變化海拉癌細胞株治療。GO分析和途徑分析確定了細胞功能的主要變化,如細胞存活、遷移和粘附、增殖、核糖核酸表達和炎癥。這些數據表明內皮細胞經外源性細胞外基質處理后誘發了內質網應激海拉癌細胞株。有趣的是,鈣網蛋白和LAMP1的點,而不是GM130,隨著外泌體治療的進展而增加,表明內質網和溶酶體內的同質性改變,并且內質網應激是內皮細胞TJ蛋白下調的原因。
結 論:
海拉癌細胞株引發內皮細胞的內質網應激,即來自癌細胞(如HeLa細胞)的外體成分可觸發受體細胞中的內質網應激。該研究可能為腫瘤轉移提供一種新的機制,并可能成為一種潛在的新的治療靶點。需要進一步的研究來確定引發內質網應激的外體成分的細節。






