慢加急性肝衰竭治療的新策略
慢加急性肝衰竭(ACLF)死亡率高。代謝重編程是細胞存活的重要機制。研究ACLF中肝細胞的代謝重編程可能為ACLF患者提供一種新的治療策略。接下來,小編為大家介紹發表于“Advanced Science”上的文章“Switching from Fatty Acid Oxidation to Glycolysis Improves the Outcome of Acute-On-Chronic Liver Failure”,為大家詳細介紹肝衰竭的代謝重編程機制。

本文分析了ACLF患者的代謝模式。利用肝細胞在高氨血癥和缺氧條件下建立ACLF的體外模型。在常規治療(對照組)的基礎上,對每天靜脈注射L-鳥氨酸和L-天冬氨酸(LOLA)和口服曲美他嗪(TMZ)的患者進行隨機臨床試驗。
結果:
1.ACLF患者肝組織代謝譜的研究
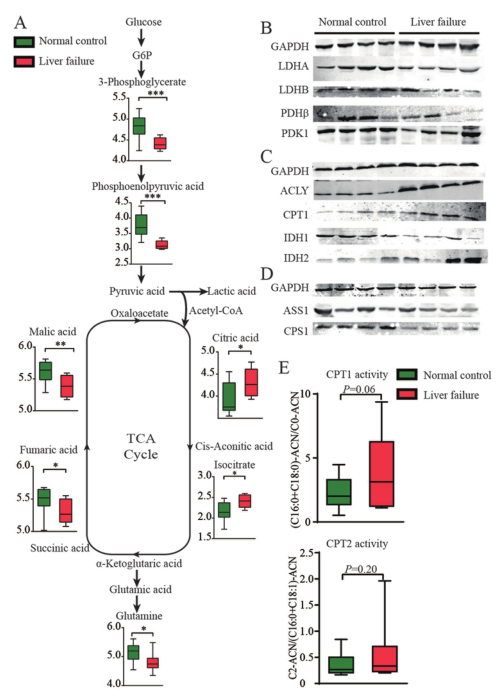
首先,我們分析了慢加急性肝衰竭患者和肝血管瘤患者肝組織的代謝模式。與正常對照組相比,ACLF患者的肝組織顯示出糖酵解和氧化磷酸化的抑制作用,其中甘油-3-磷酸、磷酸烯醇丙酮酸、富馬酸和蘋果酸的水平降低。檸檬酸鹽和異檸檬酸鹽水平升高,而ACLF患者肝組織中的谷氨酰胺水平降低,表明谷氨酰胺的利用增強(圖1A)。與這些結果一致,參與糖酵解和TCA循環的酶的表達被抑制(圖1B,1C)。此外,三磷酸腺苷檸檬酸裂解酶(ACLY)和肉堿棕櫚酰轉移酶1(CPT1)的表達上調,CPT1活性略有增加(圖1C,E),表明脂肪酸代謝活性增強。ACLF患者肝組織中的尿素循環減弱(圖1D)。這些結果揭示了ACLF患者功能失調肝細胞的代謝特點:糖酵解、TCA循環和尿素循環受到抑制,而FAO和谷氨酰胺的回補作用增強。
2.高氨血癥在缺氧的情況下有助于ACLF肝組織代謝模式的改變
為了了解ACLF的代謝重編程機制,我們建立了一個模擬ACLF患者肝細胞微環境的體外模型。我們發現氨積累是由體外缺氧誘導的(圖2A)。糖酵解、TCA循環、尿素循環和谷氨酰胺再利用受到抑制,但FAO得到增強(圖2B-E)。為了進一步確定氨暴露后的代謝變化,我們采用了穩定同位素標記技術。我們發現高氨血癥和缺氧的結合抑制了糖酵解和谷氨酰胺回補反應(圖2F)。因此,我們推測缺氧狀態下的高氨血癥可能是導致ACLF肝組織代謝模式改變的主要原因。

3.高氨血癥和缺氧后肝臟細胞存活的代謝機制
ACLF患者的治療目的是保護肝細胞再生。為了探討ACLF過程中肝細胞存活的機制,我們比較了存活的肝細胞和暴露于高氨血癥的整個肝細胞群體代謝模式的差異。與整個細胞群相比,存活細胞表現出增強的糖酵解(圖3A)。因此,缺氧、高氨血癥和糖酵解可能是ACLF治療的靶點。為了更詳細地研究ACLF中的代謝重編程,我們將重點放在FAO的增強上,因為FAO被認為是細胞除糖酵解和氧化磷酸化之外的主要能量來源。使用透析血清,我們發現暴露于高氨血癥的肝細胞糖酵解增加(圖3A)。這些數據表明FAO對高氨血癥和缺氧的肝細胞糖酵解有抑制作用。
在深入了解ACLF患者代謝重編程機制的基礎上,我們提出了一種新的ACLF患者治療策略:抑制FAO。曲美他嗪(TMZ)是抑制肝細胞中FAO的潛在候選藥物。我們發現TMZ增加了暴露于高氨血癥的肝臟細胞的糖酵解,這表現在丙酮酸水平增加,細胞外酸化率(ECAR)達到最大容量,同時伴有氨水平的降低(圖3B-D)。有趣的是,它還提高了氧耗率(OCR)的基礎水平和最大容量,并增加了ATP的生成,從而促進了氧化磷酸化(圖3E,F)。此外,TMZ有效地降低了暴露于NH4Cl的大鼠肝組織中的凋亡率(圖3G)。

4.TMZ抑制FAQ對ACLF患者的治療效果
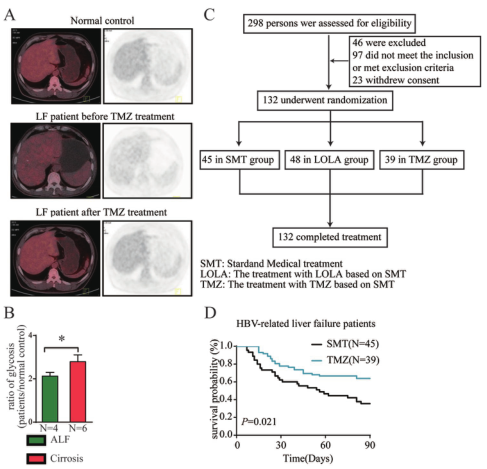
接下來,我們評估TMZ對ACLF患者的療效。首先,用PET-CT評估ACLF患者肝組織中的糖代謝。我們發現,與正常對照組和肝硬化患者的肝臟樣本相比,ACLF患者的肝臟樣本對18F-flude-oxyglucose(18F-FDG)的攝取較低(圖4A,B)。此外,服用TMZ的患者恢復對18F-FDG的攝取(圖4A)。接著,進行了一項隨機臨床試驗(圖4C)。我們發現,TMZ顯著提高了ACLF患者的總生存率(OS)(圖4D)。亞組分析顯示,TMZ能顯著改善丙氨酸轉氨酶或天冬氨酸轉氨酶水平低于400ul-1的患者的預后。由于嚴重的ACLF通常導致轉氨酶水平較低,這些結果表明TMZ在嚴重ACLF患者中尤其有價值。
結論:
我們確定了ACLF患者的代謝特征,這些代謝特征主要是由缺氧環境下的高氨血癥引起的。此外,糖酵解增強可能有助于肝細胞在高氨血癥和缺氧條件下存活。重要的是,FAO抑制高氨血癥肝細胞的糖酵解。我們還證明TMZ對治療ACLF有效。這項研究提供了一個切實可行的策略,通過使用TMZ靶向代謝重編程以提高患者的生存率。






