基金又一新方向———細胞焦亡的抑制
細胞焦亡(pyroptosis)是一種新發現的細胞程序性死亡方式,表現為細胞不斷脹大直至細胞膜破裂,導致細胞內容物的釋放進而激活強烈的炎癥反應。細胞焦亡是機體重要天然免疫反應,在拮抗感染和內源危險信號中發揮重要作用。相比于細胞凋亡(apoptosis),細胞焦亡發生的更快,并會伴隨大量促炎癥因子的釋放。2020年 03 月20日, Muendlein HI, Jetton D, Connolly WM, 等人,在Science上發表了一篇關于cFLIP抑制細胞焦亡的機制文章“cFLIP protects macrophages from LPS-induced pyroptosis via inhibition of complex II formation”。

細胞死亡和炎癥是宿主對感染的相互依賴的反應。 在焦細胞凋亡期間,白細胞介素1b(IL-1b)的釋放通過caspase-1和caspase-11介導的Gasdermin D孔形成。 在體內,對脂多糖(LPS)的反應導致IL-1b分泌。 然而,在體外,鼠巨噬細胞需要炎性體驅動的IL-1b成熟的第二個“危險信號”。 最近的報道顯示,在LPS活化的巨噬細胞中caspase-8介導的細胞凋亡,但在這些條件下有關IL-1b釋放的證據相互矛盾。 在這里,為了進一步表征LPS誘導的體外分泌機制,作者揭示了細胞FLICE樣抑制蛋白(cFLIP)在調節炎癥反應中的重要作用。
1.TAK1抑制之前的LPS啟動
LPS驅動的死亡需要CASP8和GSDMD,但不需要NLRP3,CASP1或CASP11。 這表明cFLIP L缺乏癥在LPS激活后嚴格促進焦磷酸化。 cFLIP L KD消除了抑制TAK1誘導發燒的要求。 cFLIP L的沉默概括了TAK1抑制作用(通過YopJ或5z7處理),暗示cFLIP L是響應LPS的主要細胞凋亡調節因子之一。
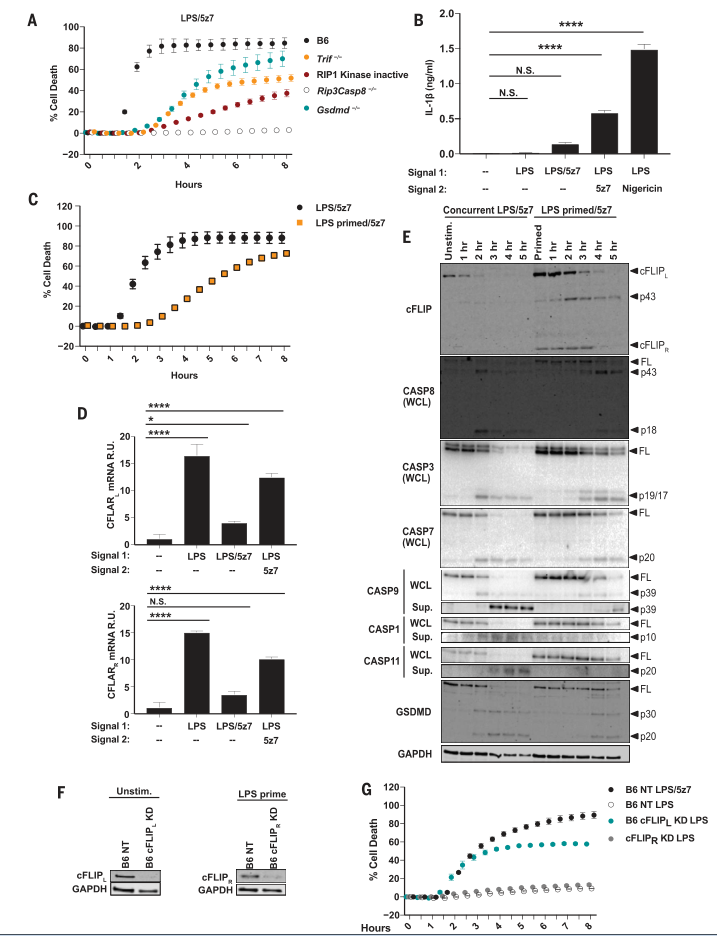
圖1. TAK1抑制之前的LPS啟動引發IL-1b釋放,抑制細胞死亡并調節cFLIP水平。
(A)BMDM中B6,無RIP1激酶失活(RIP1Ki),Trif-/-,Rip3-/-Casp8-/-和Gsdmd-/-的小鼠在LPS / 5z7處理下的細胞死亡。 (B)在指定治療后6小時,IL-1b從B6 BMDM中釋放。 LPS預灌注(10或100 ng / ml)分別在添加5z7或尼日靈之前4小時進行。 (C)與LPS / 5z7或LPS-pre-primed / 5z7同時刺激的B6 BMDM中的細胞死亡。 (D)在B6 BMDM中,LPS,LPS / 5z7或LPS預涂底漆/ 5z7處理1小時后,相對于Cflar mRNA水平標準化為Gapdh(磷酸甘油醛磷酸脫氫酶)。 R.U.,相對單位。 (E)cFLIP,GSMDD的全長(FL)和裂解產物,以及從LPS / 5z7或LPS–預處理的B6 BMDM的全細胞裂解液(WCL)或從上清液(Sup。)沉淀的胱天蛋白酶。 (F)B6 BMDM中的cFLIP蛋白水平被cFLIP L或cFLIP R擊倒或用非靶向(NT)對照轉導。(G)B6 BMDM中被cFLIP L或cFLIP R擊倒并被刺激的細胞死亡[在(F)中顯示的敲低程度]。來自細胞死亡測定和免疫印跡的數據代表了三個或更多獨立實驗,并且細胞死亡數據表示為一式三份孔的平均值±SD。 IL-1b釋放數據表示為來自三個或更多獨立實驗的一式三份孔的平均值±SD。使用方差分析(ANOVA)用于組間比較。
2.cFLIP L是響應LPS的細胞凋亡的主要調節劑之一
細胞死亡需要受體相互作用的絲氨酸/蘇氨酸蛋白激酶1(RIP1)和GSMDD的激酶活性,但伴隨著低的IL-1b水平,這可能是由于抑制了MAPK和NF-kB介導的前IL- 1b生產。與同時用LPS和5z7處理的細胞相比,在5z7處理之前用LPS預灌注的骨髓衍生巨噬細胞(BMDM)產生的IL-1b水平明顯更高。
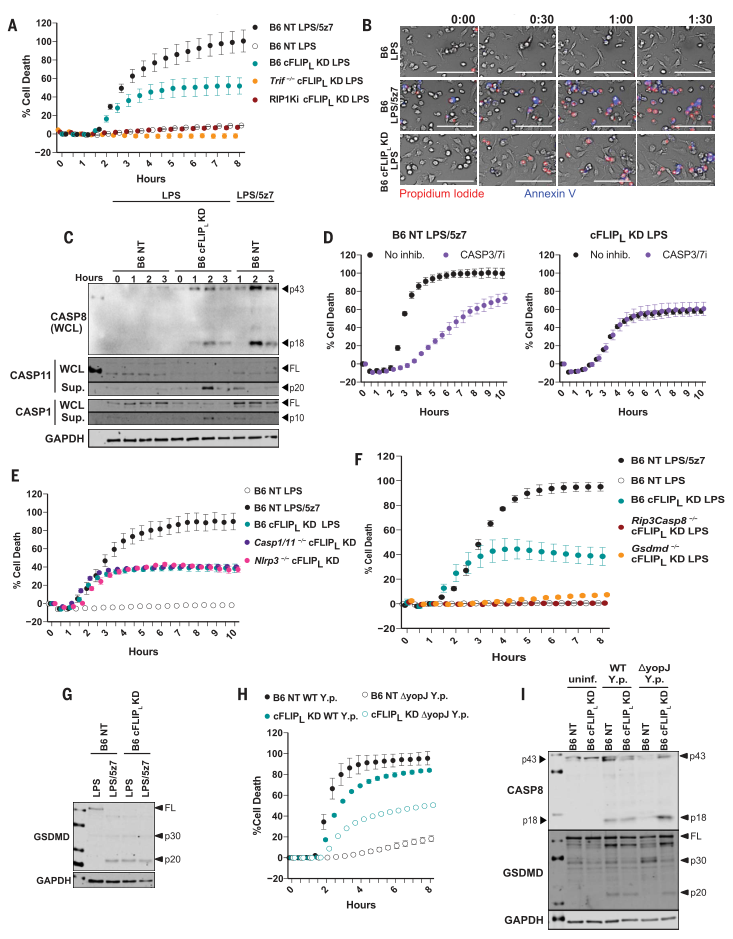
圖2. LPS在不存在cFLIP L的情況下誘導caspase-8介導的細胞凋亡。
(A)B6,Trif-/-和RIP1Ki BMDM中的細胞死亡被cFLIP L擊倒并受到刺激。 (B)用LPS或LPS / 5z7刺激長達1小時30分鐘的B6和B6 cFLIP L -KD BMDM中PI摻入和膜聯蛋白V染色的動力學20倍放大成像。比例尺:100 mm。 (C)從半纖維素裂解物(WCL)或從B6NT對照或B6cFLIP L -/-BMDMs的上清液中沉淀的所示半胱氨酸蛋白酶的全長和裂解產物。 (D)在LPS / 5z7刺激的B6巨噬細胞或LPS處理的cFLIP L -KD BMDM中用CASP3 / 7抑制劑抑制細胞死亡。 (E)用LPS或LPS / 5z7刺激的B6,Nlrp3-/-和Casp1-/-Casp11-/-巨噬細胞中的細胞死亡。 (F)B6,Rip3-/-Casp8-/-和Gsdmd-/-BMDM中的細胞死亡被擊倒并被刺激(如圖S3I所示的KD),刺激了cFLIPL。 (G)從B6NT控制器B6cFLIP L -KDBMDM刺激的全長和切割GSDMD所示。 在WT或YopJ缺陷型(DyopJ)Y。假性結核病刺激下的B6NT和B6cFLIP L -KD BMDM中,CASP8和GSDMD的細胞死亡和(I)裂解(圖S3L所示的KD的程度)。未感染,未感染。所有的免疫印跡和細胞死亡數據代表三個或更多獨立實驗。細胞死亡數據表示為一式三份孔的平均值±SD。
3.cFLIP L缺失促進LPS響應
cFLIP L不足足以驅動對LPS的復合物II的形成。 LPS / 5z7也推動了復合物II的形成,并且在早期時間點在復合物中檢測到了cFLIPL。 LFL誘導的cFLIP L -KD細胞中復合物II的形成依賴于TRIF和RIP1激酶活性。 在cFLIP L -KD細胞中,復雜II的形成和LPS誘導的細胞死亡都需要進行修飾。 因此,cFLIP L和RIP1的激酶活性調節TRIF信號下游的復合物II的形成,并決定細胞死亡的程度和方式。
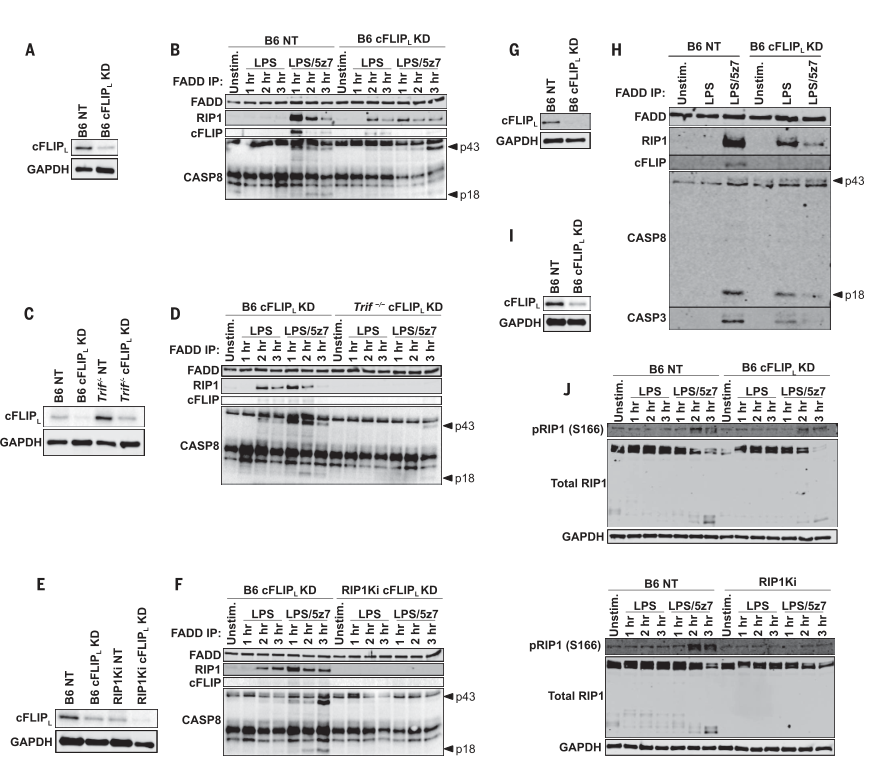
圖3. cFLIP L缺乏促進LPS響應,在TRIF下游形成復合物II。
(A)B6 BMDM中的cFLIP L蛋白水平被cFLIP L擊倒或用NT對照轉導。 (B)按指示刺激的B6 NT和B6 cFLIP L -KD BMDM中的FADD免疫沉淀(IP),并探測復合物II成分。(A)中顯示的敲低程度(C)B6和Trif-/-BMDM中的cFLIP L蛋白水平被cFLIP L擊倒或NT對照轉導。(D)B6和Trif-/-BMDM中的FADD IP被敲除cFLIP L,如所示被刺激,并探測復雜的II成分[(C)所示的敲低程度]。 (E)B6和RIP1Ki BMDM中的cFLIP L蛋白水平被cFLIP L擊倒或用NT對照轉導。 (F)B6和Trif-/-BMDM中的FADD IP擊倒cFLIP L,如所示進行刺激,并檢測復雜的II成分[(E)中所示的敲低程度]。 (G)B6 BMDM中的cFLIP L蛋白水平降低了cFLIP L或用NT控件進行轉導。 (H)如所示刺激2小時的B6 NT和B6 cFLIP L -KD中的FADD IP,并檢測復合物II成分[(G)中顯示的敲低程度)。 (I)B6 BMDM中的cFLIP L蛋白水平被cFLIP L擊倒或用NT對照轉導。 (J)LPS和LPS / 5z7刺激的cFLIP L沉默或NT對照B6和RIP1Ki BMDM中的總和pRIP1(S166)水平[(I)中顯示的敲低程度]。所有的免疫印跡代表三個或更多獨立實驗。
4.cFLIP L缺失,LPS激活的巨噬細胞迅速分泌IL-1b
當cFLIP L水平低時,CASP8同型二聚體容易形成。完全活躍的CASP8裂解并激活遠處的靶標,LPS激活的巨噬細胞迅速經歷熱解并分泌IL-1b。在不存在cFLIP L的情況下,CASP3,CASP7和CASP9對于CASP8驅動的細胞凋亡是必不可少的。相反,CASP8可能直接激活GSDMD來驅動細胞凋亡,而NLRP3炎癥小體來驅動IL-1b成熟和釋放。
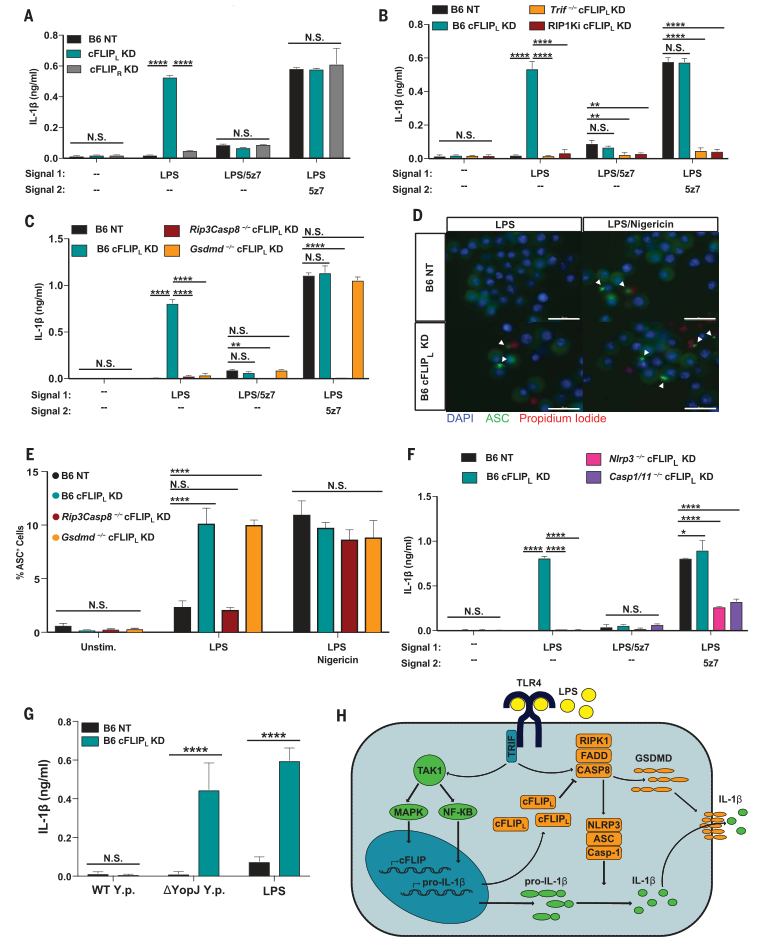
圖4. cFLIP L缺乏會驅動IL-1b成熟并響應來自LPS的單個信號而釋放。
(A到C)IL-1b從(A)B6 NT對照,B6 cFLIP L -/-和B6 cFLIP R -/-BMDM釋放; (B)為cFLIP L敲低的RIP1Ki和Trif-/-BMDM; (C)經過指定治療6小時后,RIP3 / CASP8和GSDMD缺陷型BMDM敲低cFLIP L。(D)用LPS刺激4小時,或用LPS尼日利亞霉素刺激2小時的B6 NT對照和B6 cFLIP L-/- BMDM中的ASC斑點的代表性60X圖像(圖S4D中顯示的敲低程度)。比例尺:30毫米。在針對cFLIP L的B6,Rip3-/-Casp8-/-和Gsdmd-/-BMDM中ASC +細胞的百分比。 (F) IL-1b在b6,Nlrp3-/-和Casp1-/-Casp11-/-巨噬細胞中釋放,對于cFLIP L沉默并如所指示的被刺激。(G)B6 BMDM對cFLIP L沉默并用WT或缺乏YopJ的(DyopJ)假結核耶爾森氏菌6小時。 (H)由cFLIP L調節的LPS驅動的細胞凋亡和IL-1b產生的模型。 IL-1b釋放和ASC百分比數據表示為來自三個或更多獨立實驗的一式三份孔的平均值±SD。方差分析(ANOVA)用于比較各組。
結 論:
長異構體cFLIP L的缺乏會促進復合體II的形成,從而引起焦磷酸化,并且它們僅響應LPS就能分泌IL-1b。






