CAFs分泌的外泌體通過增強的細胞干性和上皮-間質轉化來促進結腸癌轉移和化療耐藥
導語:
相關的成纖維細胞(CAFs):是一種處于持續活化狀態的基質細胞,在腫瘤進展中具有關鍵作用。結直腸癌 ((CRC):指結腸或直腸內的細胞異常生長所形成的癌癥,是全球第三大最常見的惡性腫瘤。癌相關的成纖維細胞(CAFs)是在腫瘤進展中起主要作用的關鍵基質細胞。但是,CAFs衍生分子調控大腸癌(CRC)轉移和化學耐藥性的分子決定因素尚未完全表征。
技術路線:
1.從結腸癌(CRC)和鄰近的正常組織中獲得CAFs和NFs。
2.使用超速離心法和外泌體快速沉淀試劑盒從培養基和血清中分離外泌體,并通過透射電子顯微鏡,納米跟蹤分析和免疫印跡進行表征觀察。
3.MicroRNA微陣列用于鑒定CAFs或 (NFs)分泌的外泌體中差異表達的miRNA。
4.外泌體的內化并通過免疫熒光觀察miR-92a-3p的轉移
5.使用博伊登(Boyden)室驗證遷移和侵襲性,細胞計數試劑盒-8,流式細胞術,平板集落形成,球形成實驗,尾靜脈注射等來以探討CAFs和NFs對原發性結腸癌肝轉移的作用,以及他們分泌的外泌體對結腸癌中上皮-間質轉化,干細胞特性,轉移和化療耐藥性的影響。
6.運用熒光素酶報告檢測,實時定量PCR,免疫印跡,免疫熒光和免疫組織化學染色來探討miR-92a-3p,FBXW7和MOAP1對CRC轉移和化療耐藥的調節作用。
研究結果:
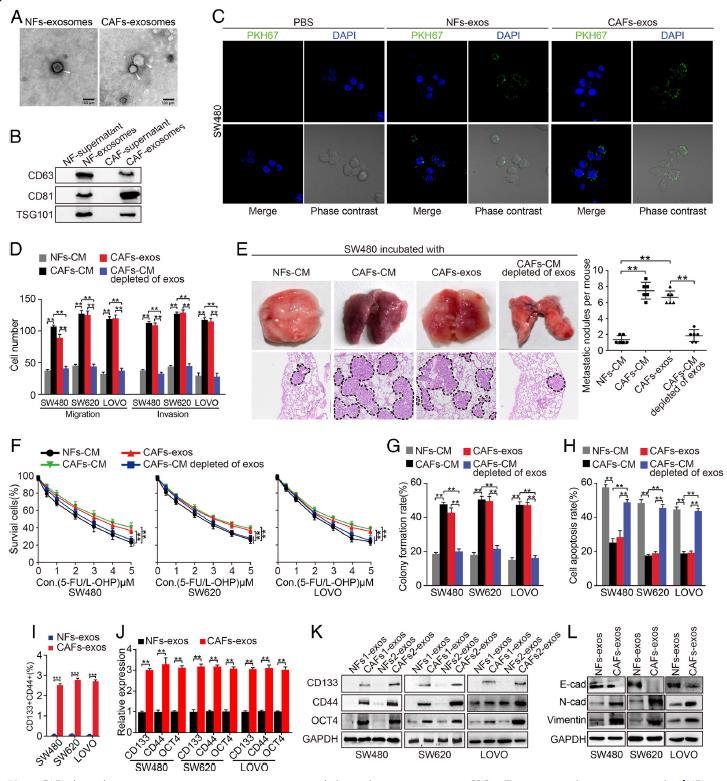
1.CAFs分泌的外泌體促進CRC細胞的轉移和抵抗5-FU / L-OHP。從結直腸癌組織和相應的正常結直腸粘膜中獲得了CAFs和NFs。與用NFs-CM處理的細胞相比,用CAFs-CM處理過的結腸癌細胞顯示出更高的遷移和侵襲能力,用CAFs-CM處理的CRC細胞顯示出增強的5-FU / L-OHP治療抗性。通過透射電子顯微鏡(TEM)揭示了杯狀結構外泌體,并測定了外泌體標記物CD63,CD81和TSG101蛋白在這些囊泡中陽性表達。通過激光掃描共聚焦顯微鏡(LSCM)觀察到PKH67標記的外泌體被CRC細胞內化。在小鼠模型中,CAFs-CM中外泌體的消耗抑制了肺轉移結節的形成。去除了外泌體的CAFs-CM處理CRC細胞時,CRC細胞的遷移和侵襲能力顯著降低。經5-FU / L-OHP治療, CAFs-CM處理的CRC細胞具有更高的存活和集落形成能力以及更低的細胞凋亡。用CAFs-exos處理的CRC細胞形成了較大的球體、癌干細胞性標記物CD133、間充質標記物等明顯增加,上皮標記物降低,CAFs-exos誘導CRC細胞上皮向間質轉化。以上結果表明,CAFs分泌的外泌體可能通過增強CRC中的干細胞特性和EMT來促進轉移和5-FU / L-OHP抵抗。
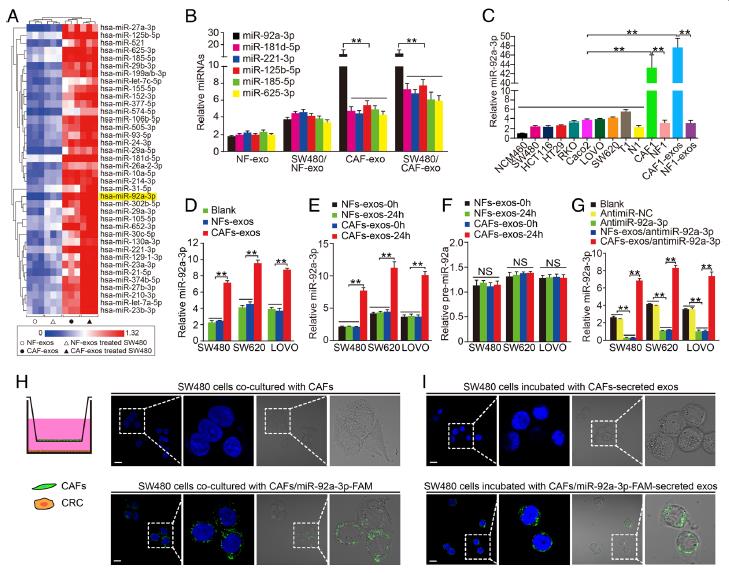
2.miR-92a-3p從CAFs直接轉移到CRC細胞。使用miRNA芯片測序,實時PCR驗證了在差異表達的miRNA中,CAF-exos和SW480CAFs-exos細胞中miR-92a-3p,miR-181d,miR-221,miR-125b,miR-185和miR-625的水平顯著增加。miR-92a-3p在CAFs和CAFs-exos的表達水平明顯增高,在SW480CAFs-exos,SW620CAFs-exos和LOVOCAFs-exos細胞中,MiR-92a-3p水平也顯著增加。說明CAFs-exos與CRC細胞中miR-92a-3p的增加有關。轉染miR-92a-3p sponge 或者miR-NC,轉染MiR-92a-3p的細胞中,MiR-92a-3p明顯下降。然而,同NFs-exos相比,與CAFs-exos孵育后,圖中三種CRC細胞中miR-92a-3p水平明顯升高。說明CRC細胞中miR-92a-3p的增加不是miRNA內源性合成的結果,而是CAFs-exos直接轉移的結果。使用Transwell實驗的結果也說明了miR-92a-3p通過外泌體直接從CAFs轉移到CRC細胞。
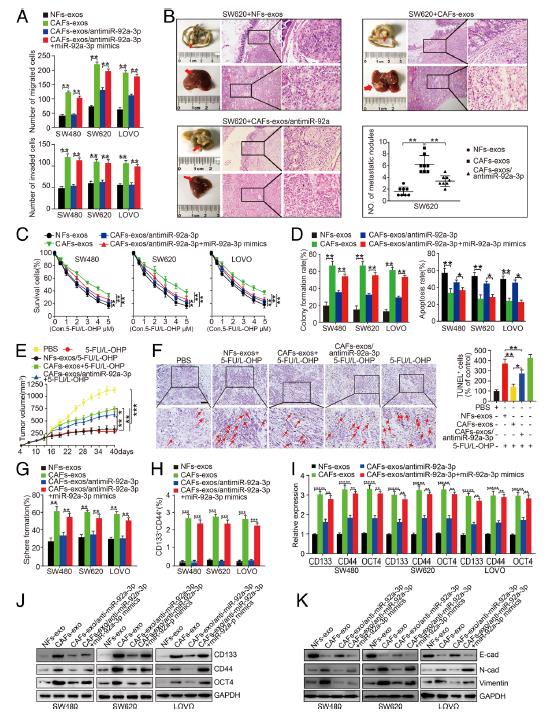
3.CAFs分泌的miR-92a-3p可增強CRC的干細胞特性,EMT,轉移和5-FU / L-OHP抵抗力。將miR-92a-3p-sponge轉染到CAFs-exos中可以大大減少了SW480CAFs-exos,SW620CAFs-exos和LOVOCAFs-exos細胞的遷移和侵襲。將miR-92a-3p模擬物重新引入CRC細胞可以逆轉miR-92a-3p海綿介導的細胞遷移和侵襲抑制作用。將SW620細胞注射到小鼠的腹側面,形成皮下腫瘤。 注射SW620CAFs-exos細胞的小鼠的肝轉移數量要多于注射SW620NFs-exos細胞的小鼠,而與對照組相比,用miR-92a-3p海綿轉染的CAFs-exos處理的SW620細胞的注射可以減少肝轉移。在體外和體內測定了CAFs-外泌體miR-92a-3p對CRC細胞對5-FU / L-OHP治療效果的影響。在CRC細胞中重新導入miR-92a-3p可以大大增強CRC細胞中的N-鈣粘蛋白和波形蛋白,并抑制E-鈣粘蛋白的表達。綜上實驗數據表明:CAFs通過將外泌體miR-92a-3p轉移至CRC細胞,促進了CRC的轉移和5-FU / L-OHP耐藥性并增強了干細胞特性和EMT。
4.FBXW7和MOAP1是miR-92a-3p的下游靶點。在表達miR-92a-3p的HEK293A,SW480,SW620和LOVO細胞中,具有野生型的FBXW7或MOAP1的酶活性被顯著抑制。相反,突變的FBXW7或MOAP1的熒光素酶活性沒有改變。此外,與Mock細胞相比,在表達miR-92a-3p的CRC細胞中FBXW7和MOAP1顯著降低(圖4d,e)。另外,與對照組相比,SW480CAFs-exos,SW620CAFs-exos和LOVOCAFs-exos細胞中的FBXW7和MOAP1蛋白均受到抑制,然而在CRC細胞中重新導入FBXW7和MOAP1則增加miR-92a-3p的水平。這些結果表明FBXW7和MOAP1是CRC細胞中miR-92a-3p的下游靶標。
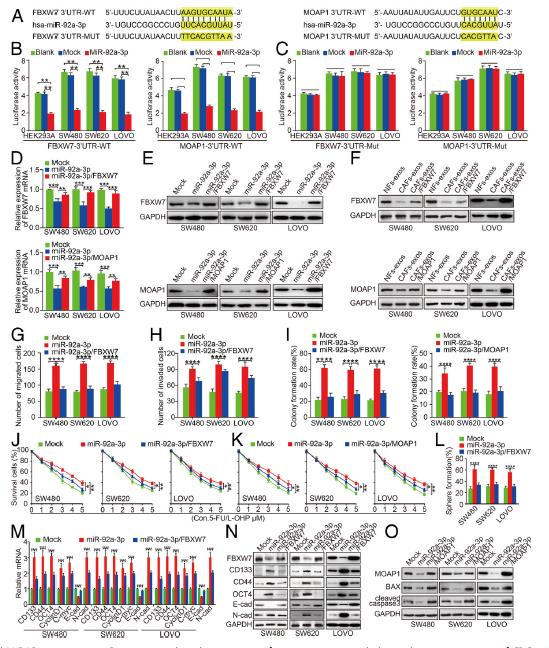
5.FBXW7和MOAP1在體內和體外減弱miR-92a-3p介導的CRC的干細胞特性,轉移和5-FU / L-OHP抗性。分別用FBXW7和MOAP1質粒轉染SW480,SW620和LOVO細胞。博伊登室試驗表明,FBXW7的重新引入可以抑制miR-92a-3p介導的促進CRC細胞遷移和侵襲。此外,在5-FU / L-OHP處理下,FBXW7和MOAP1的重新表達顯著降低了CRC細胞的集落形成和存活能力。 FBXW7的過表達抑制了miR-92a-3p的表達從而導致干細胞特性,增殖和EMT表型受到抑制,MOAP1 可誘導了CRC細胞中凋亡蛋白BAX的表達和半胱天冬酶-3的裂解,從而促進了癌細胞的凋亡。構建了細胞的慢病毒感染。SW620 / miR-92a-3p細胞在肺和肝臟中顯著形成更多的轉移結節。在5 FU / LOHP治療下,引入FBXW7胞可減少源自 miR-92a-3p細胞的皮下腫瘤,miR-92a-3p / FBXW7細胞衍生的腫瘤具有:較低的ki67增殖指數,但凋亡細胞和(caspase-3)凋亡蛋白表達卻有所增加。這些結果表明FBXW7和MOAP1可以在體內減輕miR-92a-3p介導的CRC細胞的轉移和化療耐藥性。
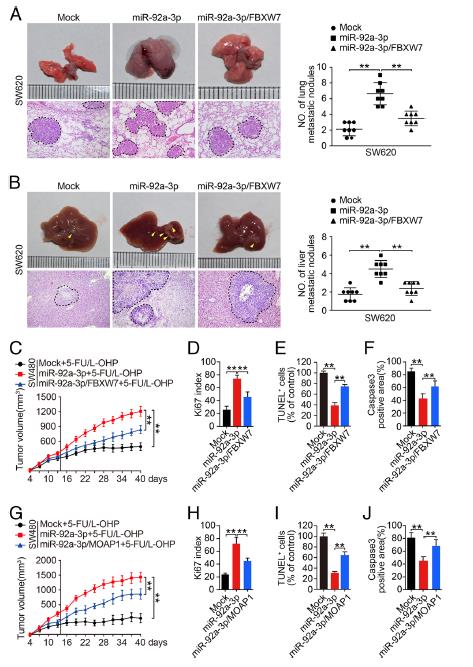
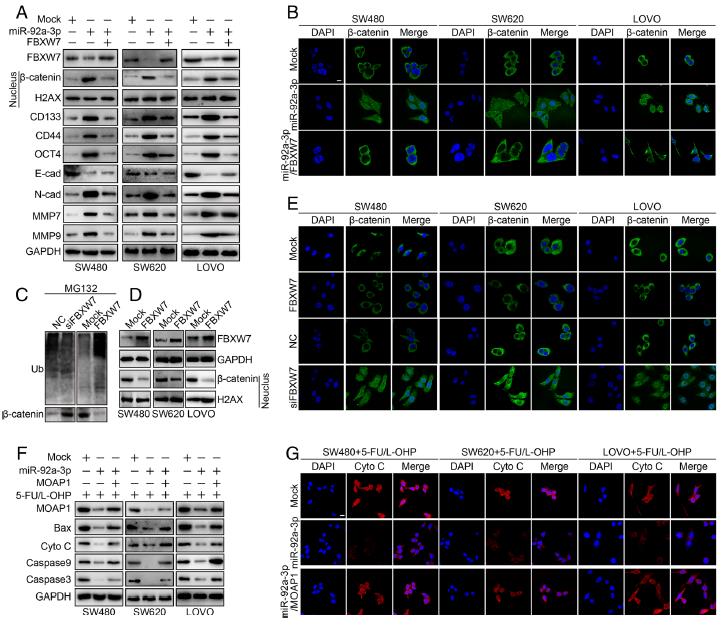
6.FBXW7和MOAP1通過促進β-catenin的泛素化降解和線粒體凋亡來逆轉miR-92a-3p的致癌作用。外源性miR-92a-3p的引入可顯著增加CRC細胞核中β-連環蛋白(β-catenin)的表達,而在表達miR-92a-3p的細胞中重新引入FBXW7會降低細胞核中β-catenin的表達。miR-92a-3p的過度表達在CRC細胞中增加了CD133,CD44,OCT4,N-鈣黏著蛋白,MMP7,MMP9但降低了E-鈣黏著蛋白。相反,在miR-92a-3p表達細胞中FBXW7的過表達卻顯示出相反的作用。發現FBXW7通過促進CRC細胞中的β-catenin泛素化和降解來抑制細胞核中的β-catenin. 在5-FU / L-OHP治療下, MOAP1減弱miR-92a-3p對CRC化療耐藥性作用的機制。這一過程說明FBXW7和MOAP1通過促進β-catenin的泛素化降解和線粒體凋亡來逆轉miR-92a-3p的致癌作用。
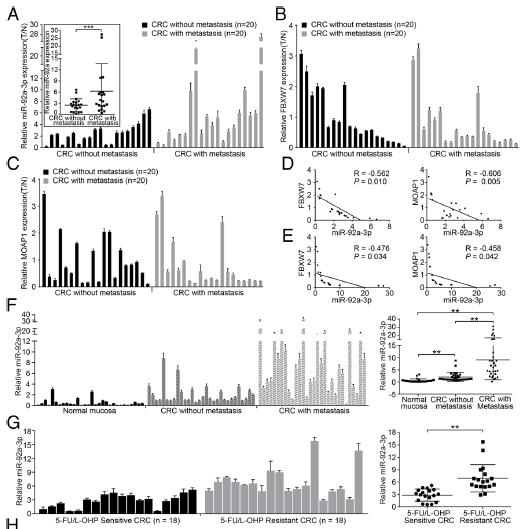
7.MiR-92a-3p與FBXW7和MOAP1負相關,血清中miS-92a-3p的高表達可預測CRC患者的轉移和化療耐藥性。實時PCR檢測了其在40例CRC組織和相應正常黏膜中的表達。與正常粘膜相比,miR-92a-3p在CRC組織中的表達更高。而且,與無轉移的CRC相比,有轉移的CRC中的miR-92a-3p更高。CRC組織中FBXW7和MOAP1的表達低于正常粘膜。相關分析表明,在有或沒有轉移的情況下,CRC都與miR-92a-3p與FBXW7和MOAP1呈負相關。臨床樣品檢測驗證了5-FU / L-OHP耐藥的CRC患者的外泌體miR-92a-3p顯著更高。FBXW7和MOAP1都是miR-92a-3p的下游靶基因,外泌體miR-92a-3p可能是CRC轉移和化療耐藥的預測指標。
總結:
CAF可以將富含miR-92a-3p的外泌體分泌到腫瘤微環境中。外泌體miR-92a-3p通過靶向CRC細胞中的FBXW7和MOAP1來促進遷移,侵襲,轉移,干細胞和5-FU / L-OHP化療耐藥性。此外,在轉移和5-FU / L-OHP化療耐藥的CRC患者血清中,外泌體miR-92a-3p上調。我們設想,阻斷CAF分泌的外泌體miR-92a-3p的功能可以用作CRC轉移和治療耐藥性的預測和治療的替代方法。
簡而言之,結直腸癌(CRC)細胞攝取與癌相關的成纖維細胞分泌的外泌體,導致CRC細胞中miR-92a-3p和干性,EMT,轉移以及5-FU / L-OHP耐藥性增加。具體地說,miR- 92a-3p通過直接結合FBXW7和MOAP1的3'UTR并抑制它們在CRC細胞中的表達,從而增強了侵略性和化療耐藥性。FBXW7和MOAP1的重新表達通過抑制CRC中的Wnt /β-catenin和線粒體凋亡來減弱miR-92a-3p的作用。






