LncRNA PVT1與食管腺癌的關系揭秘
PVT1在許多腫瘤類型中已作為致癌基因出現。然而,其在Barrett食管(BE)和食管腺癌(EAC)中的作用尚不清楚。本研究的目的是評估PVT1在BE/EAC進展中的作用,并揭示其對EAC的治療價值。本文通過qPCR檢測PVT1在正常、BE、EAC組織中的表達,并進行統計學分析,以確定PVT1表達與EAC(分期、轉移、生存)的關系,并檢測PVT1反義寡核苷酸(ASOs)的體內外抗腫瘤活性。

結果:
1.PVT1 lncRNA在EAC患者中的過表達與不良預后相關
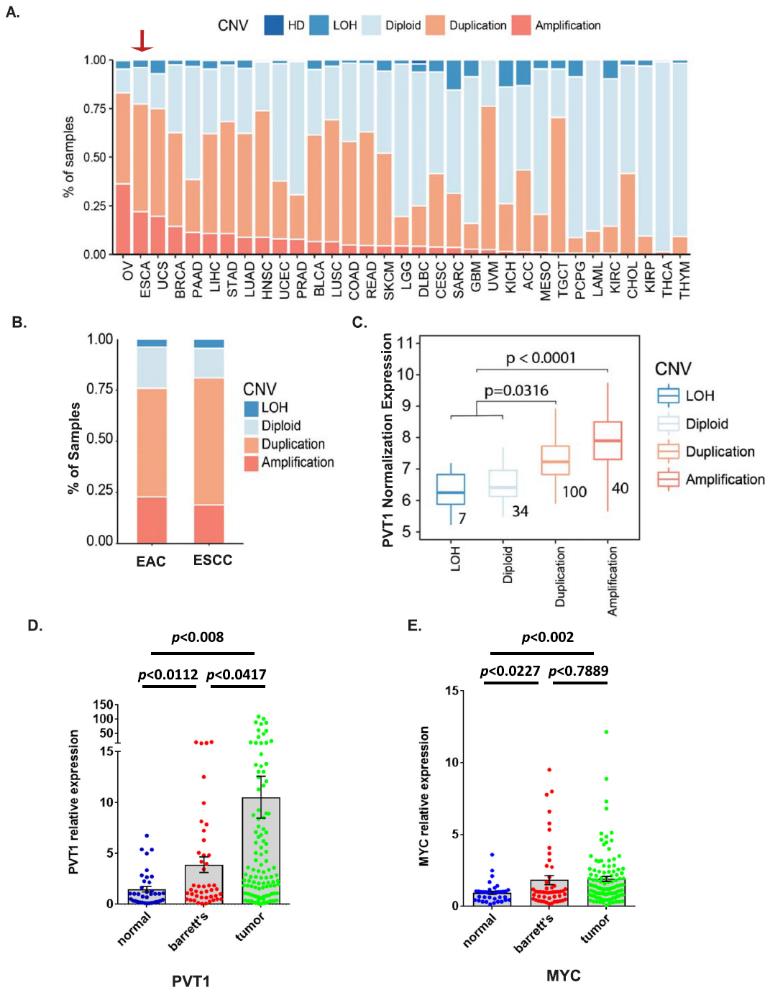
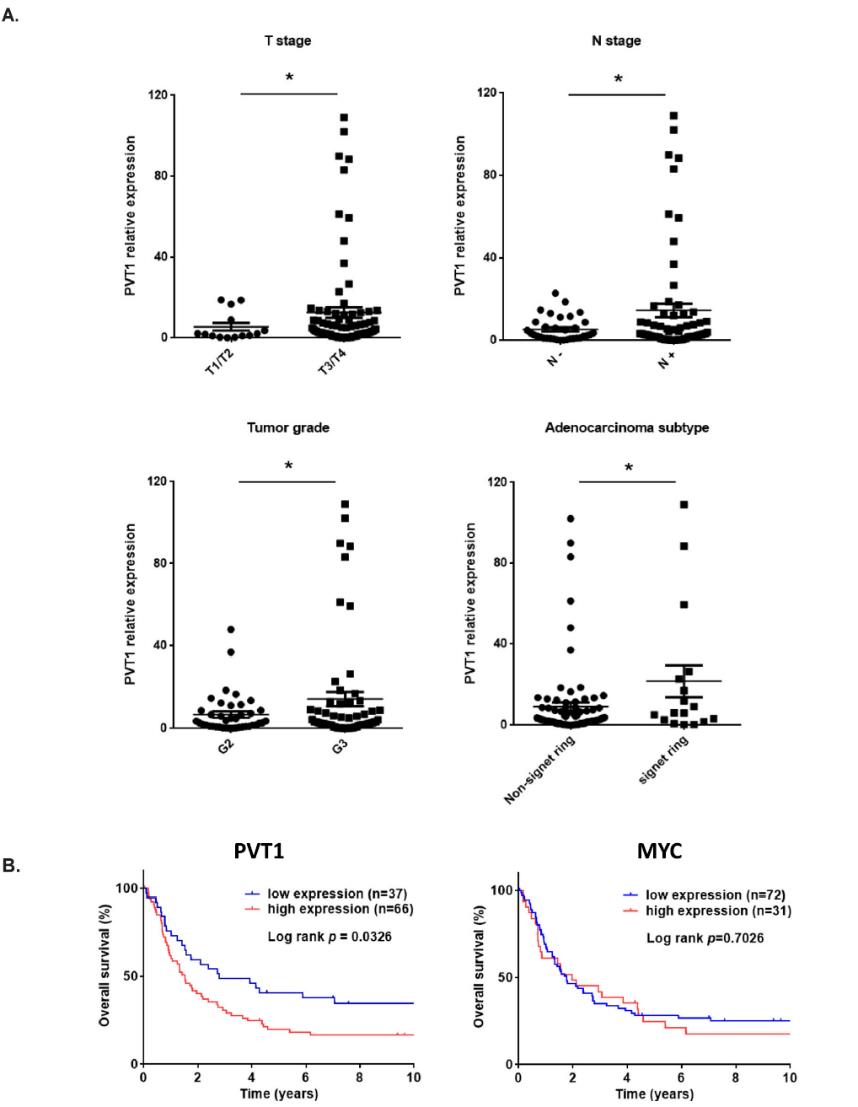
首先,利用TCGA數據集分析了多種癌癥類型的PVT1基因組改變,我們發現ESCA是第二大癌癥類型,存在20% PVT1擴增,約75%的ESCA病例同時存在擴增和重復(圖1a)。進一步分析兩種主要的ESCA亞型EAC和ESCC,我們發現EAC患者具有相對較高的PVT1擴增,其在西方人群中的發病率也較高,這使我們關注EAC(圖1b)。與ESCA中TCGA RNA Seq數據整合后,無論是復制還是擴增,PVT1的遺傳改變與PVT1的表達水平顯著相關(圖1c),提示EC中PVT1的遺傳改變導致其mRNA水平上調。為了證實TCGA數據集的發現,接下來,我們用qPCR在我們自己的患者隊列中檢測PVT1 lncRNA的表達。結果表明,PVT1 lncRNA的表達升高與BE的進展存在顯著的相關性(圖1d)。而且MYC mRNA在EACs中也顯著升高(圖1e)。另外,我們發現PVT1表達與臨床特征顯著相關。如圖2a所示,PVT1高表達與高T期、高N期、腫瘤分級不良顯著相關。Kaplan-Meier分析顯示,與PVT1 lncRNA表達水平較低的EAC患者相比,PVT1 lncRNA表達水平較高的EAC患者總體生存期較短(圖2b)。
2.PVT1的抑制抑制了EAC細胞在體內外的生長
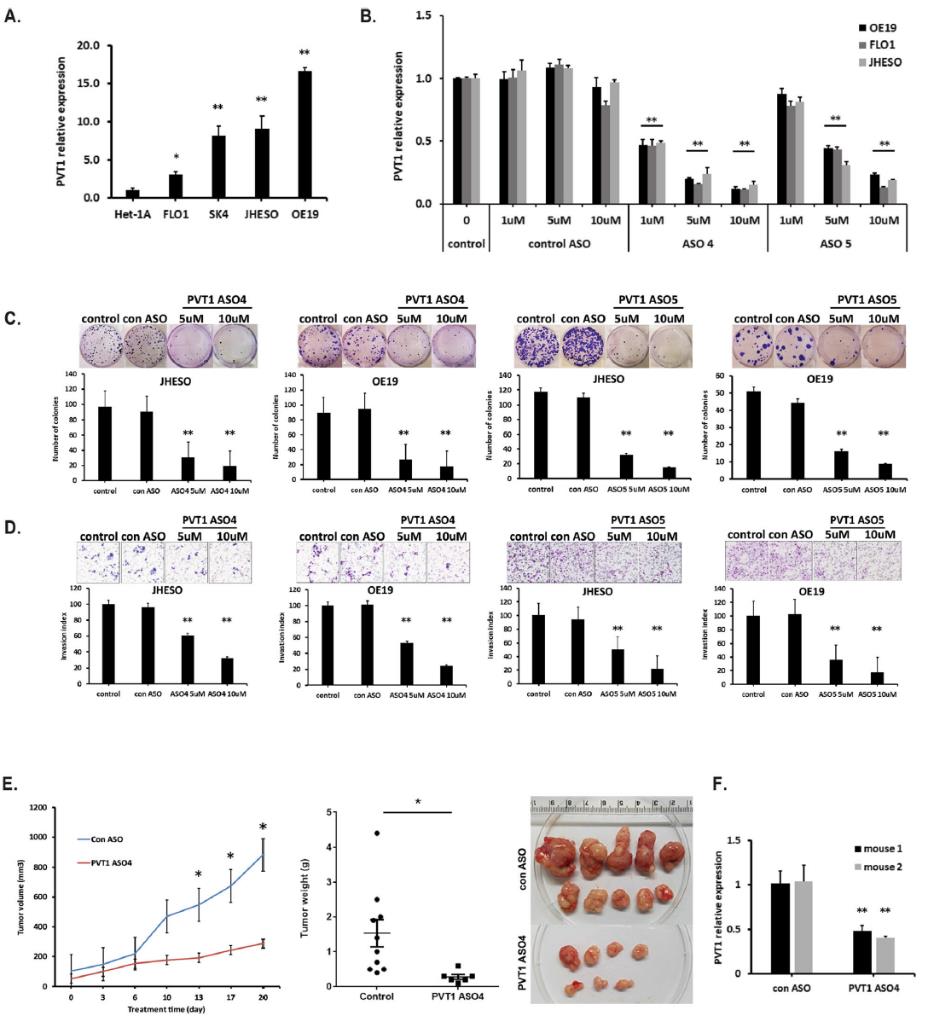
通過qPCR檢測PVT1在正常食管上皮細胞系和4個EAC細胞系的表達。與HET-1A細胞系相比,EAC細胞系中PVT1 lncRNA水平明顯升高(圖3a)。隨后,我們評估了人類PVT1特異性ASOs,發現三種PVT1 ASOs (ASO 4、ASO 5和ASO 6)在EAC細胞系中以劑量依賴的方式有效抑制了PVT1的表達(圖3b)。為了進一步闡明PVT1 ASOs對EAC細胞的抑制作用,我們在JHESO和OE19細胞中進行了集落形成和細胞遷移實驗。結果表明,與未處理或對照組相比,PVT1 ASOs均可顯著抑制EAC細胞的集落形成,且呈劑量依賴性(圖3c)。同樣,細胞侵襲實驗顯示,PVT1 ASOs處理EAC細胞后,侵襲細胞數量明顯減少(圖3d)。為了進一步研究PVT1 ASO抑制PVT1是否會影響體內腫瘤生長,裸小鼠皮下注射JHESO細胞。小鼠隨機分為對照組和PVT1組。治療3周后觀察腫瘤生長和腫瘤體積。PVT1 ASO組腫瘤體積及重量較對照組明顯下降(圖3e)。此外,經qPCR檢測,PVT1 ASO治療組腫瘤組織中PVT1的表達較對照組明顯下降(圖3f)。這些結果證實了PVT1 ASO對EAC的體外和體內抑制作用。
3.PVT1 ASOs抑制EAC細胞的CSC特性
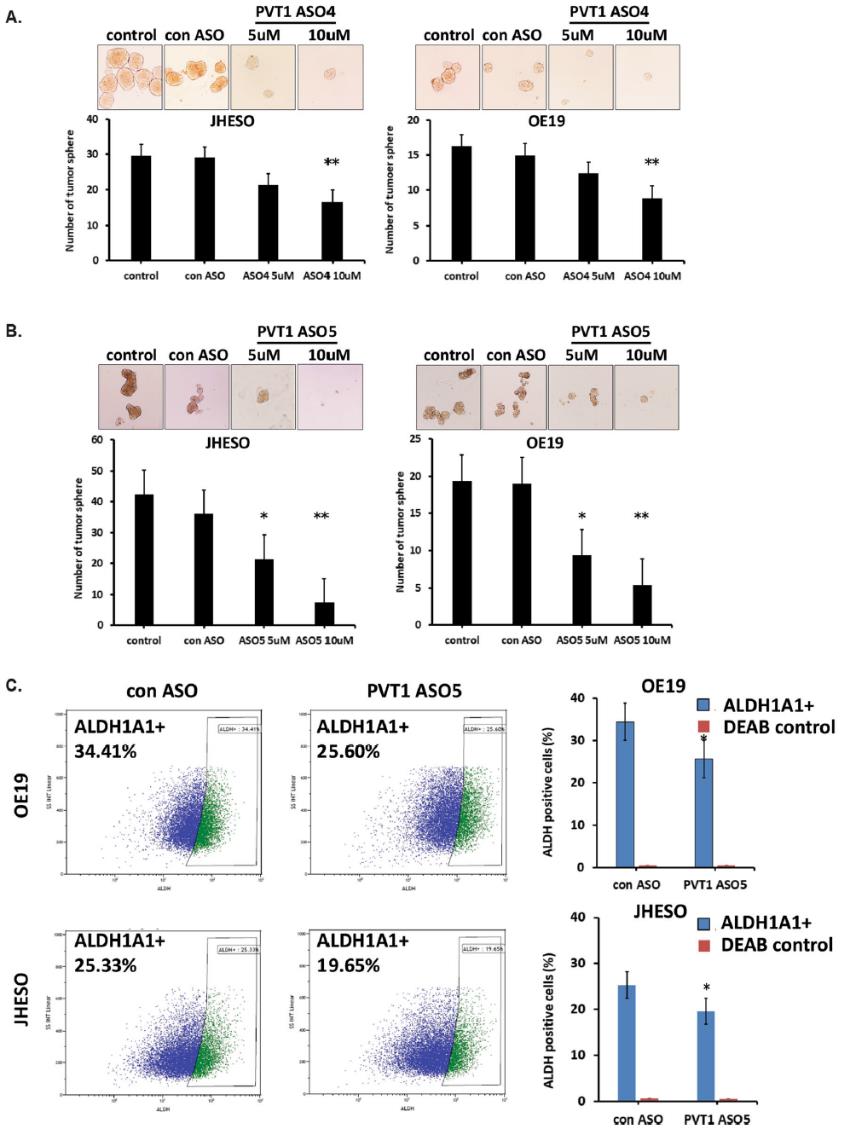
為了評估PVT1對EAC細胞的CSC特性的影響,我們對暴露于PVT1 ASOs的JHESO和OE19細胞系進行了腫瘤球實驗。從圖4a和圖b可以看出,PVT1 ASOs處理后,與對照組ASO治療的EAC細胞相比,JHESO和OE19細胞中腫瘤球的形成均明顯減少。當ASOs敲除PVT1后,ALDH1A1+細胞數量明顯減少(圖4c)。此外,ALDH1表達的減少與腫瘤球的大小和數量的顯著減少相一致。這些結果提示PVT1 lncRNA與EAC的CSC相關,可能在EAC的腫瘤發生/進展中起關鍵作用。
4.YAP1對EAC中PVT1的正反饋調節作用
為了識別EAC中參與調控PVT1的分子通路,我們使用PVT1 ASO對未經處理和處理的EAC細胞系進行了多個信號通路的RPPA分析。結果顯示,與對照組細胞相比,經PVT1處理的細胞中YAP1的表達明顯下調;相反,磷酸化的YAP1增加(圖5a),表明YAP1是PVT1潛在的下游靶標。接著通過qPCR進一步證實了PVT1和YAP1表達之間的相關性,即PVT與YAP1表達顯著相關(圖5b)。Pearson相關分析表明,YAP1表達與PVT1呈正相關(圖5b)。為了進一步證實PVT1與YAP1的正相關關系,我們以PVT1 ASOs為工具,測定EAC細胞系OE19和JHESO中PVT1被抑制后YAP1的變化。如圖5c所示,在兩個EAC細胞系中,控制YAP1磷酸化和降解的直接上游激酶磷酸化lats1在PVT1 ASO治療后呈劑量依賴性增加。與之相對應,PVT1 ASO處理的JHESO和OE19細胞中,Ser 127磷酸化的YAP1也顯著升高,而YAP1的表達降低(圖5c)。免疫熒光染色進一步證實YAP1核表達顯著降低,而LATS1磷酸化增加(圖5d)。
為了驗證YAP1是否反過來影響PVT1的表達,我們在SKGT-4 EAC細胞中產生了可誘導的YAP1 cDNA表達。如圖5e所示,成功誘導YAP1可顯著增加PVT1表達,與YAP1水平升高及其下游靶點SOX9、CTGF相關;與此相反,通過CRISPR/Cas9基因組編輯技術在SKGT-4細胞中高效敲除YAP1,在兩個克隆(YAP1 KO1和YAP1 KO2)中顯著降低了PVT1的表達,這與YAP1蛋白和mRNA水平的降低有關(圖5f)。總之,這些數據表明,PVT1和YAP1都是相關的,并相互積極調節,這可能為EAC的治療提供一種新的機制上的見解。
![說明: D:\Documents\QQEIM Files\2853119522\FileRecv\MobileFile\Image\0Z[(LRH%VAPG]YHWETSTD)L.png](https://img1.dxycdn.com/2020/0111/703/3390242141770554287-14.jpg)
5.同時抑制PVT1和YAP1可增強EAC細胞的體內外生長抑制
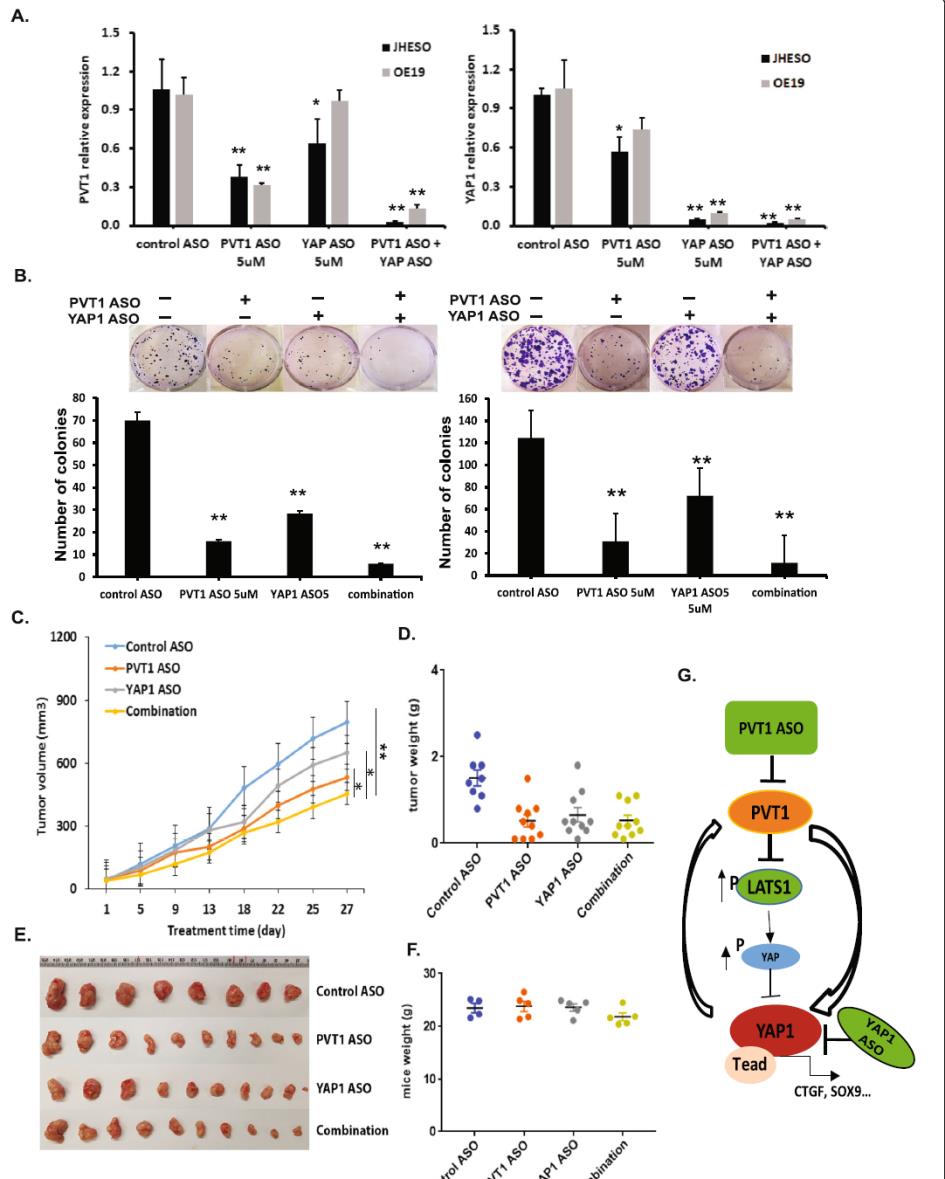
為了研究PVT1和YAP1聯合抑制是否具有更強的EAC抗腫瘤活性,我們利用PVT1和YAP1特異性ASOs進行了體外和體內實驗。如圖6a所示,雖然單獨使用PVT1 ASO或YAP1 ASO均可顯著抑制PVT和YAP1的表達,但二者聯合使用ASOs時,二者均可同時抑制PVT和YAP1的表達。在功能上,當用PVT1或YAP1 ASOs處理JHESO和OE19 EAC細胞時,ASO治療組的菌落形成數量和平均大小均顯著減少。此外,與單獨使用ASO治療的EAC細胞相比,聯合使用JHESO和OE19細胞的菌落更少(圖6b)。這些數據表明,阻斷PVT1和YAP1可在體外協同抑制EAC細胞生長。
為了評價其體內抗腫瘤作用,我們在JHESO異種移植小鼠模型中單獨或聯合使用PVT1和YAP1特異性ASOs,檢測了PVT1和YAP1特異性ASOs的抗腫瘤作用。裸鼠皮下注射JHESO細胞后,隨機分為4組(分別用對照ASO、PVT1 ASO、YAP1 ASO和聯合ASO治療)。體內異種移植實驗表明,與單純使用ASO手術治療相比,同時使用兩種ASOs治療可顯著降低腫瘤生長(圖6c-e),體重沒有明顯變化(圖6f)。綜上所述,這些結果表明在EAC細胞中存在著PVT1和YAP1的相互調控,同時抑制PVT1和YAP1比單獨抑制任何一個基因更能有效抑制EAC腫瘤的生長。因此,利用特異性ASOs聯合抑制YAP1和PVT1為EAC提供了一種新的治療策略。
結論:
PVT1對EAC具有侵襲性表型,是一個較差的預后因子。PVT1和YAP1聯合靶向治療提供了最高的治療指標,代表了一種新的治療策略。






