lncRNA Paupar通過調節(jié)PAX6的活性來促進α細胞的發(fā)育和功能
許多研究強調了胰高血糖素分泌失調在高血糖癥和糖尿病病因中的作用。 因此,了解胰腺胰島細胞發(fā)育和功能的機制對于發(fā)現(xiàn)糖尿病的新療法具有重要意義。 在這項研究中,胚胎小鼠胰腺和成年小鼠胰島之間的比較轉錄組分析確定了幾個胰腺lncRNA,這些胰腺lncRNA與必需的胰腺轉錄因子(包括Pax6相關的lncRNA Paupar)非常接近,并通過實驗證實了其分子功能。本文于今年10月發(fā)表在Cell Metabolism (IF:22.415)雜志上。
主要結果如下:
1、小鼠胰腺中調節(jié)發(fā)育的lncRNA鑒定
為了鑒定胰腺中受時間和空間調控的lncRNA,在成年小鼠胰島和胚胎第15.5天(e15.5)小鼠胰腺(EP)上進行了RNA-seq。如圖1A識別出572個候選lncRNA。 使用下列標準來定義2,728個胰腺lncRNA:(1)長度> 200個核苷酸(nt),(2)與蛋白質編碼區(qū)不重疊,(3)與假基因不重疊(Karro等,2007 ),以及(4)較低的預測編碼概率(圖1B)。FPKM 法處理過濾(圖1C)。這些參數產生了572個高信度胰腺lncRNA(圖1D)。兩個階段之間的比較轉錄組學表明,胰腺中大約一半lncRNA(279或48.7%)受到發(fā)育調控:108個lncRNA顯著富集EP和171個lncRNA中的SNP在成年胰島中顯著富集(圖1E)。為了獲得這些基因的功能,使用GREAT識別蛋白編碼的基因(圖1F),并對包括9個胰腺轉錄因子在內的基因做GO分析(圖1G)。
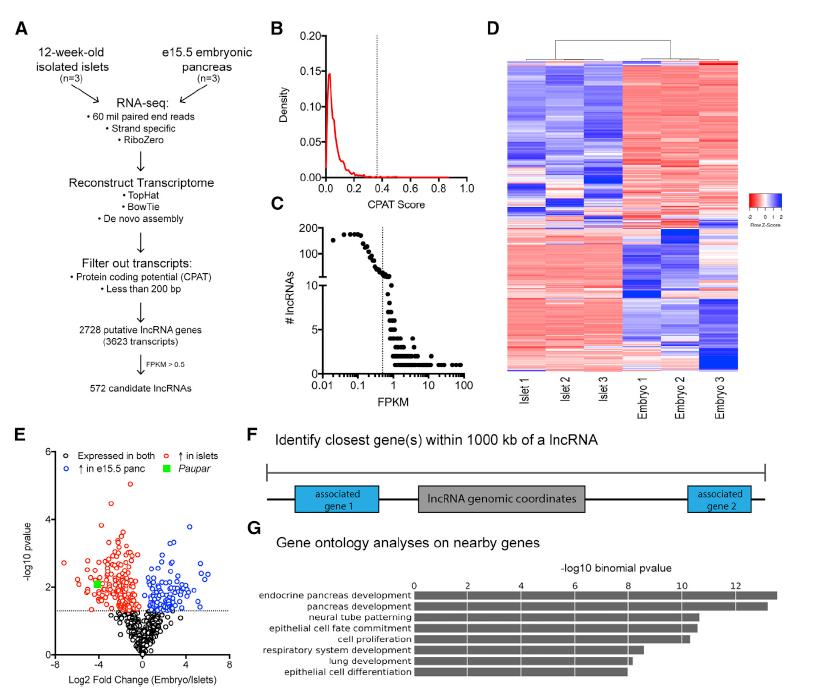
圖1系統(tǒng)鑒定小鼠胰腺中發(fā)育調節(jié)的lncRNA
2、Paupar是在胰腺α細胞中富集的一種細胞核lncRNA
Paupar是一個3482 nt基因,從Pax6上游反義轉錄8 kb,包含在Pax6os1的第一個內含子中,是一個未知功能的反義RNA(圖2A)。Paupar位于小鼠2號染色體上和人類11號染色體上的同義保守區(qū)域(UCSC LiftOver)。在其基因和與推定啟動子相對應的區(qū)域(圖2A)中,有許多與lncRNA相似的功能。除了在人類中調控發(fā)育和保守外,我們還確定了db / db小鼠(T2D模型)的胰島中Paupar的表達降低了2倍,這表明Paupar可能在胰島功能障礙中起作用(圖2B)。圖2C和D是Paupar表達的時空特異性和組織特異性。與其他胰島細胞類型相比,F(xiàn)ACS純化的小鼠α細胞和非α胰島細胞的表達分析證實Paupar在細胞中高度富集,而Pax6在兩個細胞群中均表達相同(圖2E)。 Gcg和Ins2在α和β細胞中的表達水平證明了樣品的純度(圖2E)。圖2F說明Paupar主要富集在細胞核。

圖2 Paupar是在胰腺α細胞中富集的一種細胞核lncRNA
3、Paupar調節(jié)Pax6 α細胞靶基因
Paupar的表達譜促使我們研究其在細胞中的調節(jié)功能。 三組獨特的反義寡核苷酸(ASO)成功將αTC細胞中的Paupar RNA下調了57%(圖3A)。與以前在N2A細胞中報道的相反,這里觀察到Paupar敲低Pax6表達沒有變化(圖3A),這表明Paupar RNA不影響Pax6轉錄。而Paupar敲低導致幾個Pax6 α細胞靶基因下調,包括Gcg,MafB,Arx和NeuroD1(圖3A)。 此外,Paupar 敲低的量與Gcg(圖3B)和MafB(圖3C)表達的減少呈正相關。這些表明,PAX6介導的α細胞基因調控對αTC中Paupar水平敏感。

圖3 Paupar lncRNA調控α細胞PAX6靶基因,并與幾種參與選擇性剪接的核蛋白相互作用
4、Paupar lncRNA與核蛋白相互作用參與選擇性剪切
為了進一步探究Paupar調控α細胞PAX6靶基因的分子機制,對RNA靶點進行捕獲雜交分析(CHART)鑒定Paupar的相互作用組。兩組Paupar 生物素寡糖(COs)均從αTC核提取物中下拉到Paupar RNA(圖3D和3E),但Paupar COs并沒有拉低Gapdh或TBP (圖3D和3E),證明CHART富集是由RNA介導的。基因/蛋白相互作用的檢索軟件顯示Paupa相互作用56個中的25個與Paupa相互作用的蛋白被預測至少與另一個與Paupa相互作用的蛋白作用(圖3F)。這些蛋白顯著富集于幾個圖3G途徑中。根據Paupar與12個帶注釋的富含絲氨酸和精氨酸的剪接因子(SRSF)中的8個之間的直接交互作用(圖3F),預測到完整的Paupar轉錄本具有1,685個SRSF結合位點。幾個最重要的SRSF位點位于Paupar基因座區(qū)域內,該區(qū)域在整個胎盤哺乳動物中具有高度序列保守性(圖3H,灰色矩形)。與Nkx2-2和Malat1相比,Paupar具有更多的SRSF結合位點,且Z值更高(圖3H)。總之,以上結果說明Paupar在α細胞中起調節(jié)選擇性剪接的作用。
5、Paupar促進Pax6選擇性剪接成激活Pax6 α細胞靶基因所需的亞型
圖4A是Pax6的兩種亞型示意圖,盡管非定量RT-PCR可檢測到細胞中的兩種同工型(圖4B),但鑒于較短的Pax6同工型的擴增會產生兩種同工型產物,我們只能量化Pax6 5a的表達(圖4A,黑色箭頭)。 為了直接測試Paupar是否促進Pax6的可變剪接,我們對來自Paupar缺陷型αTC的RNA進行了qRT-PCR。 結果發(fā)現(xiàn),Paupar KD并未導致總Pax6 mRNA水平的變化,但觀察到Pax6 5a的顯著特異性降低(45%)(圖4C)。 此外,Paupar介導的Pax6剪接調控直接通過RNA-RNA相互作用而不是通過SR剪接因子間接發(fā)生,因為Paupar和Pax6 RNA之間的關聯(lián)可以通過RNase處理部分消除(圖4D)。PAX6 ChIP測序結果顯示,對照中,PAX6與26,244個基因組位點相關,在Paupar KD之后,大約10%的PAX6位點(2,046個峰)顯示出不同的結合(圖4E)。在Paupar KD上表現(xiàn)出差異結合的區(qū)域在啟動子<1 kb的區(qū)域中較少,而更主要地位于基因間區(qū)域(圖4F)。對2046個差異結合的PAX6位點100 kb內的基因進行的GO分析顯示,主要富集在細胞功能相關的生物過程組分中,包括葡萄糖穩(wěn)態(tài),離子轉運調節(jié),和細胞對葡萄糖刺激的反應(圖4G)。為了確定Paupar KD是否引起PAX6介導的細胞基因調控的整體變化,將與差異結合的PAX6位點相關的基因與已發(fā)布的富含在α細胞的基因數據集進行比較。發(fā)現(xiàn)有60個基因具有統(tǒng)計學上的顯著重疊(圖4H),重疊的60個基因包含Paupar KD失調的幾個基因,如Gcg和MafB(圖3A)。這些結果,以及Paupar KD引起Pax6 5a的特異性下調,而不是總的Pax6 mRNA的表達下調(圖4E),證明Paupar通過替代剪接賦予Pax6 5a的α細胞特異性調控功能。
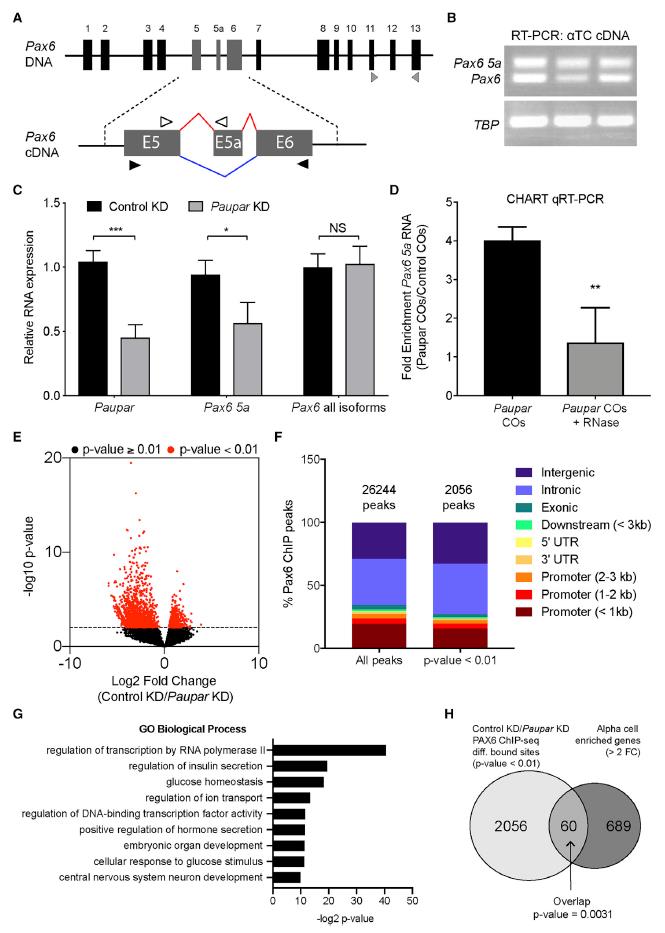
圖4 Paupar促進Pax6選擇性剪接成激活Pax6 α細胞靶基因所需的亞型
6、Paupar敲除小鼠損害α細胞的發(fā)育和功能
利用體內胰島素耐受性測試(ITT)來評估Paupar KO小鼠對急性低血糖反應的能力,與WT小鼠相比,Paupar KO小鼠降血糖明顯,這表明KO小鼠恢復基線血糖水平的效率較低(圖5A和B)。另外,Paupar KO小鼠不能應對低血糖癥可能是由于胰高血糖素分泌受損,為了測試這一點,在ITT之前和期間測量了血漿胰高血糖素。胰島素注射后30分鐘,Paupar KO小鼠的血漿胰高血糖素相對于WT小鼠降低了2.5倍(圖5C),表明Paupar KO小鼠在低血糖反應中分泌的胰高血糖素明顯減少。響應低葡萄糖反應,Paupar KO小鼠的分泌的胰高血糖素比野生型胰島少60%(圖5D)。為了確定這種鈍化的胰高血糖素分泌是否是由于胰島胰高血糖素含量降低所致,測量了胰島胰高血糖素的總含量,發(fā)現(xiàn)Paupar KO胰島的胰高血糖素總含量顯著低于對照(圖5E)。這些發(fā)現(xiàn)表明,Paupar KO胰島細胞生理功能受損部分是由于胰高血糖素含量降低所致。與生理表型一致,對Paupar WT和KO胰腺進行形態(tài)分析發(fā)現(xiàn),細胞占Paupar WT胰島的13%(圖5F),但僅占Paupar KO胰島的6%(圖5F和G),相當于α細胞群體平均減少了2.25倍(圖5H)。我們還觀察到與WT小鼠(71%)相比,Paupar KO小鼠(79%)β細胞面積相對于胰島面積有適度增加(圖5I-5K)。Paupar WT和KO小鼠之間的平均胰島大小沒有可測量的差異(圖5L-5N)。以上結果表明,Paupar是細胞正常發(fā)育和功能所必需的。
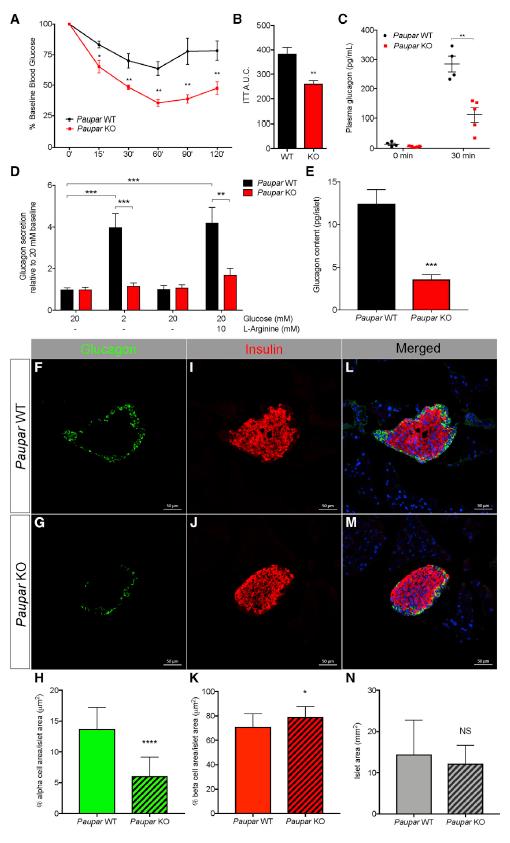
圖5 Paupar敲除小鼠損害α細胞的發(fā)育和功能
7、Paupar在體內調節(jié)必須的α細胞基因
對Paupar WT和KO6周齡小鼠的胰島進行全轉錄組分析,得到3,106個差異表達基因(DEG)(圖6A)。與α細胞特異性表型一致,DEG占所有已記錄的富含α細胞的基因的10%以上(圖6B)。此外,DEG包括許多細胞功能所需的因子和許多已知的PAX6a細胞靶標,包括轉錄因子(Arx,MafB,Irx1和Irx2)控離子通道(Kcnq2,Kcnip3)和胞吐機制(Sytl5和Sytl2)(圖6C)。與體外研究一致,Paupar KO小鼠的細胞Pax6 5a以及PAX6 α細胞靶基因顯著下調,而總Pax6 mRNA水平未發(fā)生變化(圖6D)。這些結果進一步證明Paupar介導的對PAX6 α細胞靶基因的調控是Pax6剪接而非轉錄水平。為了擴展對Paupar介導的PAX6靶基因調控的了解,確定了胰島中Paupar調控的3,056個基因與αTC中Paupar KD引起的PAX6結合改變的相關基因(2,056個)的關系。分析顯示兩個數據集之間328個基因顯著重疊(圖6E),包括許多必需的細胞基因,例如MafB,Arx,Irx1和Irx2,它們的失調可以直接解釋Paupar KO小鼠的表型。
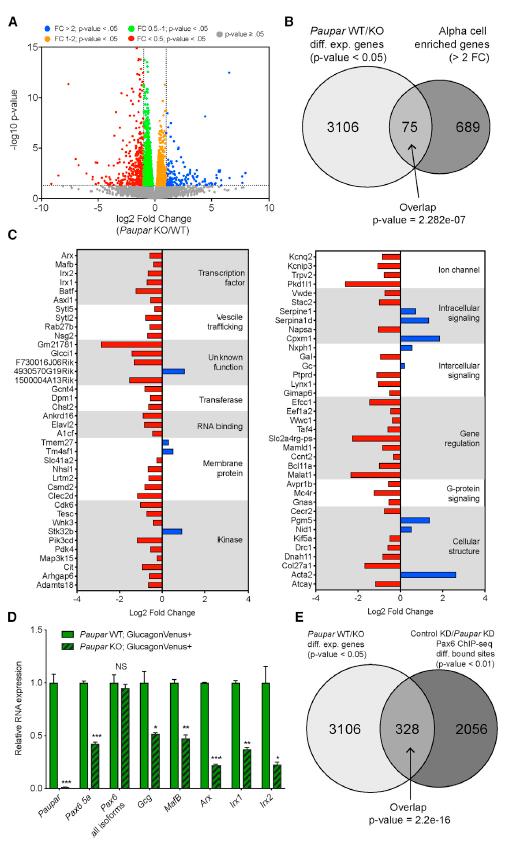
圖6 Paupar在體內調節(jié)必須的α細胞基因
基于綜上研究,作者提出一個模型,其中Paupar通過調節(jié)PAX6 a細胞靶基因所需的Pax6 5a亞型的選擇性剪接來促進細胞功能(圖7)。
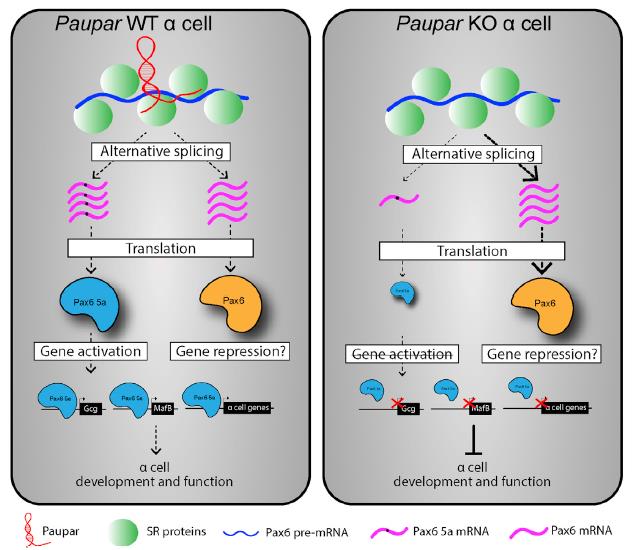
圖7 Paupa介導的pax6 α細胞靶基因調控模型
總而言之,本文對α細胞富集的lncRNA的分子和功能表征表明,lncRNA可能代表重要的組織和/或細胞受限治療靶標,以調節(jié)更廣泛表達的蛋白質的細胞特異性亞型的產生和功能。
參考文獻:
Singer Ruth A., Arnes Luis., Cui Yi., Wang Jiguang., Gao Yuqian., Guney Michelle A., Burnum-Johnson Kristin E., Rabadan Raul., Ansong Charles., Orr Galya., Sussel Lori., (2019). The Long Noncoding RNA Paupar Modulates PAX6 Regulatory Activities to Promote Alpha Cell Development and Function., Cell Metab., undefined, undefined.






