高分文章告訴你-外泌體如何促進腫瘤轉移
卵巢癌是最常見的婦科惡性腫瘤之一。 初步診斷時,大多數患者在腹膜腔內存在廣泛的轉移性生長,分階段發生在宏觀腫瘤細胞侵襲之前形成轉移前的微環境。轉移前微環境的形成支持隨后的轉移性病變。卵巢癌衍生的外泌體通過免疫抑制,血管生成,基質細胞重塑和致癌重編程誘導轉移前的微環境。該文(IF=10.679)強調了卵巢癌外泌體作為轉移前微環境形成的協調者,適合液體活檢的生物標志物和化療靶點的新興作用。

一、外泌體生物發生
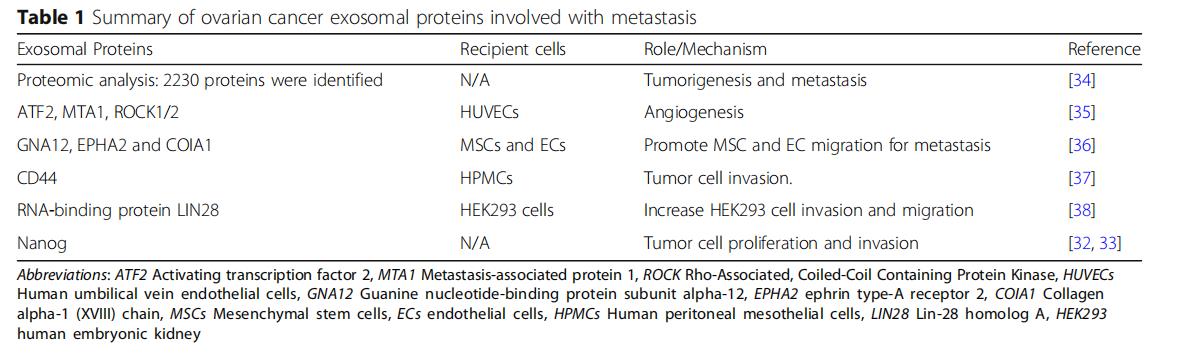
外泌體的性質和豐度由其來源的供體細胞決定,無論是健康組織還是腫瘤。外泌體生物發生涉及一系列細胞事件,最終致癌或生理亞型。供體細胞首先內化細胞外配體和產物以形成早期內體,然后新生外泌體作為腔內囊泡(ILV)出現,最終通過選擇性包含蛋白質,核酸和脂質而成熟為多囊泡內體(MVE)。一些MVE在溶酶體內融合并降解以提供細胞形成所需的能量和材料,而其他MVE通過高爾基體再循環或直接細胞分泌釋放到細胞外環境中。
二、卵巢癌 - 外泌體
卵巢癌與其他人類腫瘤的區別在于其通過腹水侵入腹腔,使其特別適合于在隔室內涉及各種內臟。從早期開始,腹水包含分離的腫瘤細胞,各種免疫細胞,間皮細胞和腫瘤相關的外泌體。這些外泌體可以從卵巢癌患者的腹水和血清中分離,而且含有獨特的卵巢癌特異性蛋白質信號(圖1b)。除了揭示潛在的惡性腫瘤外,外泌體蛋白質載體還起到增強卵巢腫瘤轉移進展的作用(表1)。例如,Nanog是一種參與腫瘤細胞增殖和癌癥干細胞自我更新的轉錄調節因子。與良性腹膜液相比,從高級別漿液性卵巢癌的腹水中取樣的外顯子中Nanog表達顯著增加,Nanog敲除研究顯示卵巢癌細胞的遷移和侵襲減少。
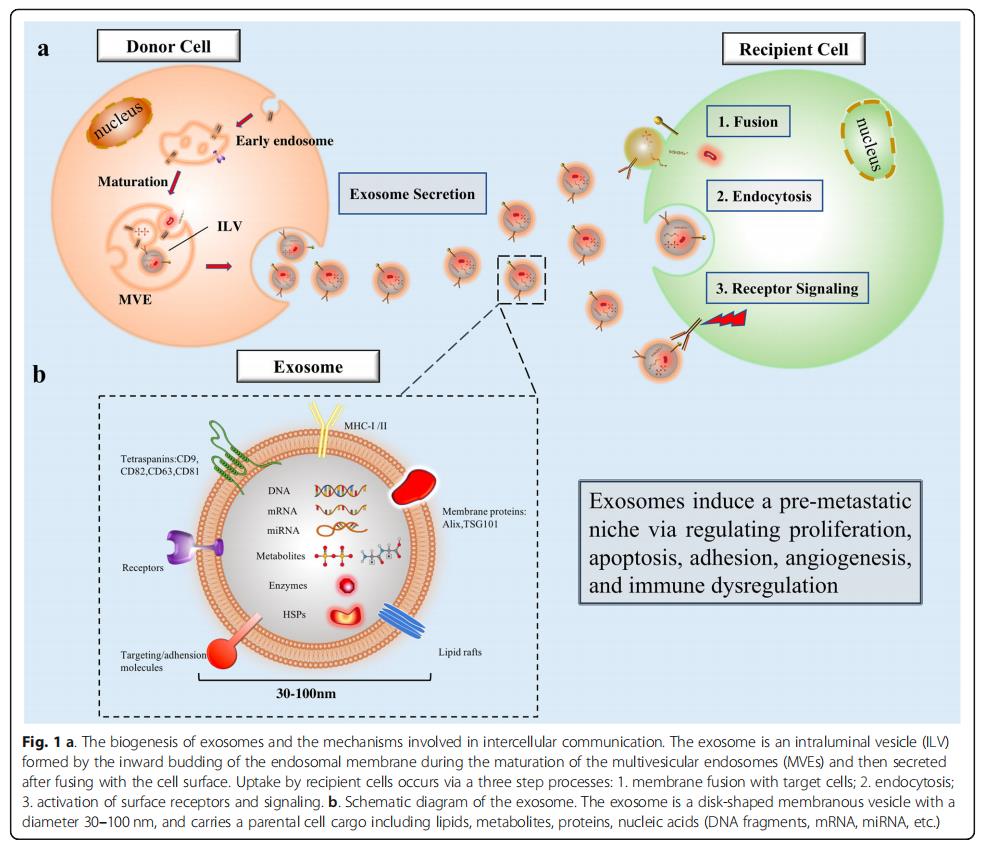
還在外泌體中鑒定了致瘤微小RNA(miRNA),其中它們被包封并保護免受核酸酶降解。在功能上,這些內體外miRNA在局部和全身調節靶細胞的基因表達。一旦脫落,卵巢癌衍生的外泌體將其miRNA水平轉運至腫瘤相關巨噬細胞(TAM),間皮細胞和腫瘤細胞本身。它們提供了惡性腫瘤初期轉移前微環境形成和轉移的說明(表2)。
三、外泌體在轉移前的微環境內引起免疫抑制
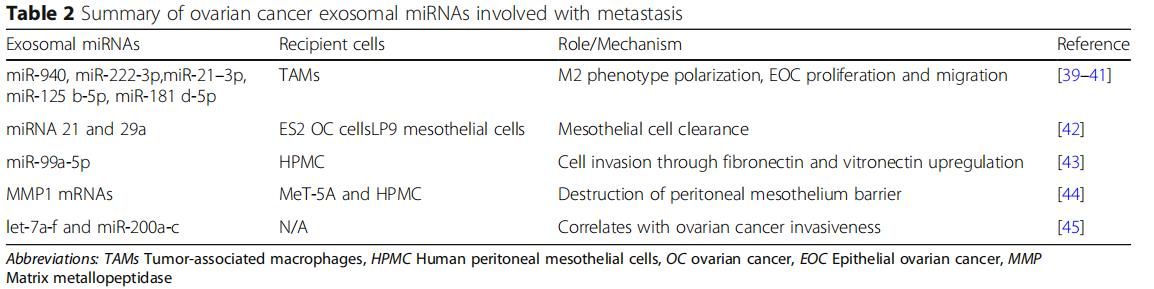
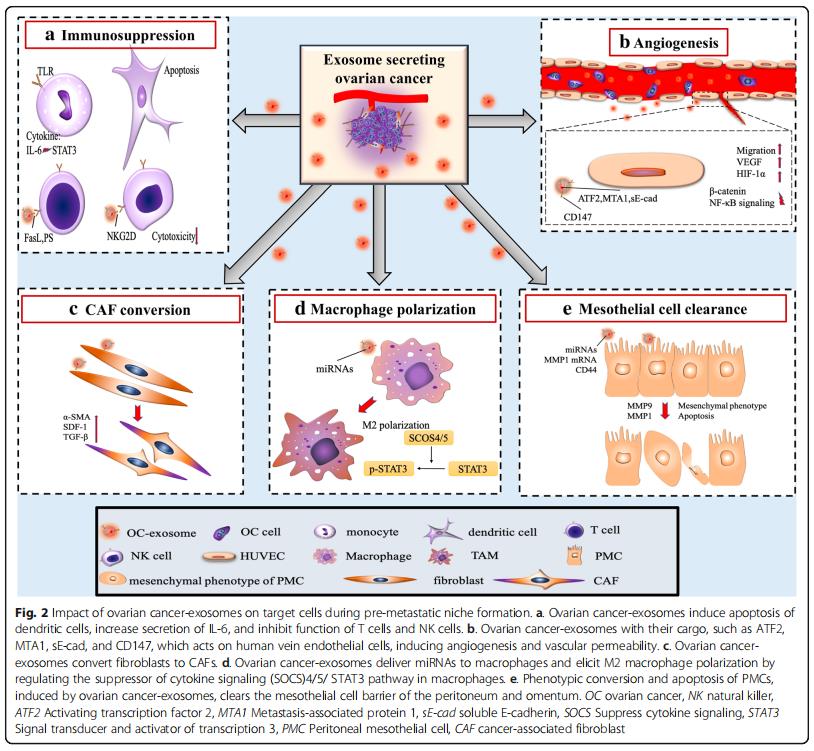
免疫系統是轉移的重要障礙,預轉移細胞在進入轉移部位時保護轉移細胞免于凋亡是非常重要的。從卵巢癌腹水中分離的外泌體可以誘導快速和可逆的T細胞停滯。最近的一項研究發現GD3是一種神經節苷脂,一種從腹水分離的外泌體在表面表達,通過作用于T細胞受體(TCR)來阻止T細胞。卵巢癌相關的外泌體還可以通過Toll樣受體(TLR)激活誘導單核細胞內IL-6的產生。然后IL-6激活免疫細胞,基質細胞和腫瘤細胞中的信號轉導和轉錄激活因子3(STAT3)途徑,其支持癌細胞的整體免疫逃逸(圖2a)。
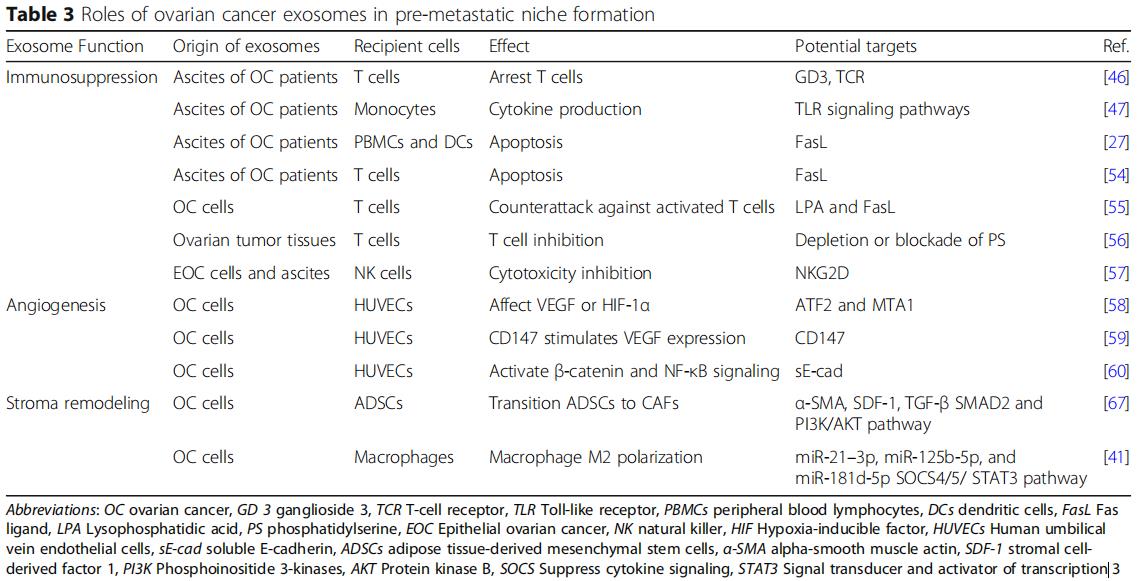
為了揭示外泌體對免疫細胞的直接影響,研究發現卵巢癌患者腹水的外泌體,其具有樹突細胞,造血干細胞和外周血淋巴細胞,通過誘導造血干細胞、樹突細胞和外周血淋巴細胞的凋亡而引起免疫抑制(圖2a),將正常外周血淋巴細胞與來自卵巢癌腹水的外泌體或患有良性卵巢囊腫的患者的腹膜洗液共培養,同時對淋巴細胞進行低基因表達分析。與良性卵巢囊腫組相比,惡性腹水共培養組中26種免疫抑制基因過表達,說明外泌體通過與白細胞的直接相互作用來抑制外周免疫的作用,從而允許未減輕的腫瘤侵襲。天然殺傷(NK)細胞和巨噬細胞的先天免疫細胞是抵抗腫瘤侵襲的有效生理防御,會強烈地募集到轉移部位。源自卵巢癌細胞的外泌體可以使腫瘤微環境中的這些免疫細胞沉默,并且在轉移前的微環境形成中至關重要。卵巢癌細胞還釋放攜帶外顯子的Fas配體(FasL),下調表面T細胞受體/ CD3-zeta(ζ)的表達并促進T細胞凋亡。在細胞水平,溶血磷脂酸提高卵巢癌細胞表面FasL的表達,從而促進FasL攜帶外泌體的釋放。此外,卵巢癌外泌體攜帶磷脂酰絲氨酸,通過阻斷細胞內信號級聯來抑制T細胞活化。NK細胞是一種重要的天然免疫效應細胞,能直接識別和殺傷腫瘤細胞。NKG2D受體配體是NK細胞重要的細胞毒受體,也是卵母細胞的靶點。
四、外泌體促進轉移前的微環境中的血管生成
卵巢癌外泌體,因促進血管生成而變得非常不成熟(圖2b)。在分子水平上,蛋白質組學揭示了激活轉錄因子2(ATF2)和轉移相關蛋白1(MTA1),其存在于卵巢癌外泌體中以上調血管生成。機制上,sE-cad陽性外顯子與內皮細胞上的VE-鈣粘蛋白結合,促使信號級聯最終激活β-連環蛋白和NF-κB;這刺激了內皮細胞遷移和整體血管通透性。盡管它們體積小,但越來越多的研究正在支持卵巢癌衍生的外泌體在培養廣泛的腹膜轉移的血管生成腫瘤微環境中的作用。
五、基質重塑中的外泌體
從原發性腫瘤轉移到次要部位的癌細胞的存活取決于基質微環境,腫瘤衍生的外泌體通過重塑轉移部位中的基質細胞來支持腫瘤細胞活力和轉移性傳播。在功能上,它們重塑轉移前細胞中的基質細胞,與轉移性微環境中的腫瘤相關巨噬細胞(TAM)相互作用,這些巨噬細胞負責腫瘤生長,侵襲,血管生成和整體轉移。
六、外泌體將成纖維細胞轉化為CAF
CAF是獨特的重編程的基質細胞,在癌癥起始細胞外基質重塑、進展、轉移前的微環境形成和轉移中起作用。單獨的卵巢癌衍生的外泌體,足以誘導正常基質成纖維細胞中的表型和功能,改變為致病性CAF(圖2c)。外泌體在將正常基質轉變為CAF中的作用。卵巢癌過度表達α-平滑肌肌動蛋白(α-SMA),SDF-1和TGF-β將脂肪來源的間充質干細胞轉變為CAF,將正常基質重編程為癌基質可以通過在繼發性轉移生長之前來自外泌體的細胞因子信號傳導來介導。
七、外泌體誘導巨噬細胞極化
巨噬細胞是多功能抗原呈遞細胞,經典地分為兩種極化表型:促炎(M1)和抗炎(M2)。腫瘤相關巨噬細胞(TAM)屬于M2亞型并且滲透惡性組織。在腫瘤微環境中,TAMs分泌IL-4,IL-5和IL-6,促進血管生成,基質重塑和免疫系統抑制。它們還通過STAT3信號級聯分泌TGF-β,SDF-1和VEGF,從而促進轉移前的微環境。在卵巢癌中,缺氧誘導因子(HIF)誘導富含各種miRNA的外泌體的釋放,當這些外泌體被未分化的巨噬細胞吞噬時,它們通過細胞因子信號傳導抑制因子(SOCS)4/5/STAT3途徑進行M2極化(圖2d)。與巨噬細胞共培養的卵巢癌細胞只能通過外泌體將其致癌的miR-1246轉移到M2巨噬細胞而不能轉移到M1巨噬細胞,miR-1246抑制劑和化療方案聯合應用可顯著降低體內腫瘤負荷。這些新興的工作支持了M2亞型在腫瘤發生和轉移前微環境形成的多個階段的作用。
八、在轉移前的微環境中,外泌體培養的細胞促進轉移
卵巢癌外泌體直接促進循環腫瘤細胞歸巢,定植和在轉移前微環境內的生長,同時抑制宿主抗腫瘤免疫應答。通過促進宿主細胞轉化為TAM和CAF表型來促進腫瘤細胞增殖和侵襲(表3)。由于TAM的細胞因子譜而發生的,由此它們分泌大量的EGF,其激活外周卵巢癌細胞中的EGFR。該EGF / EGFR信號級聯上調血管內皮生長因子-C,誘導卵巢癌細胞的增殖,遷移,粘附,球狀體形成和腹膜植入(圖3b)。在轉移前的微環境中,腫瘤衍生的外泌體將局部成纖維細胞轉化為CAF,通過其自身的外泌體支持腫瘤發生。
九、外泌體突破了轉移前微環境內腫瘤侵襲的障礙
腫瘤細胞的巢包括腹膜、網膜、腸系膜、橫膈膜和腹壁內臟的表面(圖3a)。轉移的這些病癥是由腹水內的轉運引起的,也會發生血管轉移到網膜的病例(圖3a)。在組織學上,網膜和腹膜都是松散的膠原網絡、具有血管化的結締組織、分散的成纖維細胞、脂肪細胞和巨噬細胞,它們被一層富含微絨毛的間皮細胞和薄的基底膜所覆蓋(圖3b)。在血源性途徑中,腫瘤細胞穿透表面內皮,并且在腹水途徑中,它們滲入間皮(圖3c)。
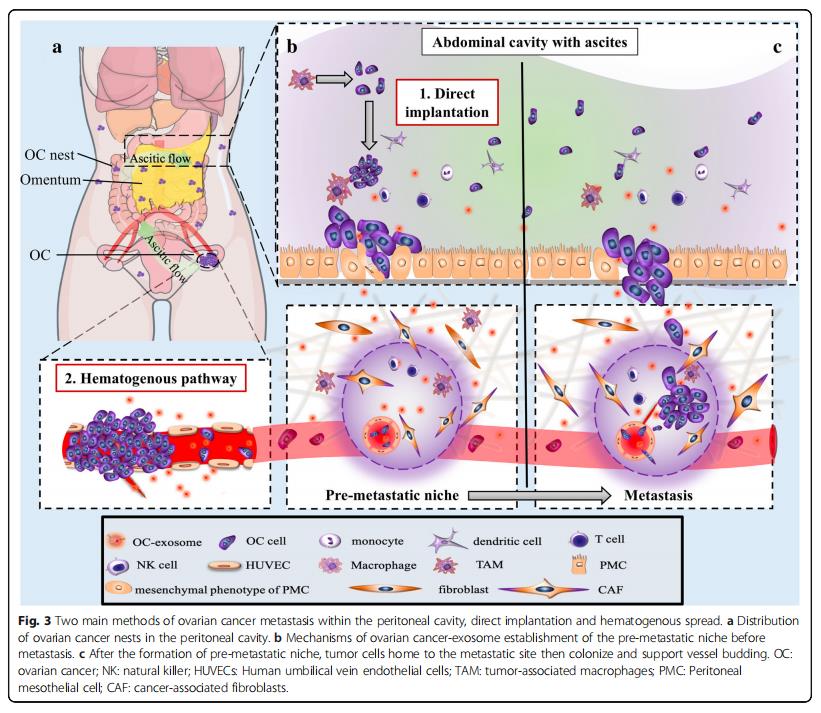
卵巢癌外泌體通過誘導血管內皮細胞遷移促進血管生成,促進腫瘤細胞歸巢到轉移前的微環境。在腹膜內臟中顯著缺乏間皮細胞表明這些細胞在腫瘤發生期間被清除,并且可能在大規模轉移性侵襲之前被清除。從機制上講,卵巢癌細胞將具有特異性miRNA的外泌體釋放到腹水中,從而重塑間皮細胞層以增強腹膜通透性(圖2e)。
十、外泌體作為轉移前的微環境標志物和治療應用
早期檢測轉移前的微環境是婦科腫瘤學領域的一個重要目標,除了具有轉移微環境特征的細胞外基質譜改變的區域之外,新技術已經尋求檢測高滲透性,缺氧性和炎癥區域。外泌體作為轉移前微環境形成的生物標志物具有穩定、豐富且具有腫瘤特異性等獨特優勢。液體活檢是一種可以從體液中分析循環腫瘤細胞的腫瘤衍生外泌體的技術。該技術通過高度特異性的靶選擇,生物抗原傳感和信號轉導技術檢測癌癥來源的外泌體。通過將卵巢癌外泌體嵌入工程化生物材料中,并植入小鼠模型的腹腔內來產生轉移前的微環境模擬物。這種人工轉移前的微環境有效地從腹水中募集和捕獲游離的卵巢癌細胞,從而防止這些細胞向正常的骨盆內臟轉移。當制備轉移前的微環境時,腫瘤衍生的外泌體經歷歸巢至優選的器官和細胞特異性位點。腫瘤特異性生物標志物和治療策略可能具有可接受的特異性。此外,鑒于卵巢癌外泌體內的轉移前生物標志物譜及其在轉移前微環境形成中的作用,液體活檢的最新進展診斷使外泌體成為早期篩查和檢測的一個有前途的新領域(表3)。
結論:
卵巢癌外泌體通過免疫抑制,血管生成,基質細胞重塑和致癌重編程促進轉移前的微環境形成。因其對形成腫瘤微環境的實質性影響,細胞脫落外泌體的作用而受到重視。 在迄今為止的臨床前工作中,動物研究中的外泌體已在體外分離和純化。液體活檢等新興技術可能會進一步表征其在體內的致瘤作用,并可能有助于充分揭示這些促轉移因子在卵巢癌中的臨床意義。






