外泌體與巨噬細胞
導語:
癌癥被認為是包括腫瘤微環境(TME)的復雜系統。腫瘤相關巨噬細胞(TAM)是TME中最常見的免疫相關基質細胞,并且癌細胞和TAM之間的通信對上皮性卵巢癌(EOC)的進展至關重要。源自EOC細胞的外泌體將巨噬細胞重塑為腫瘤促進的表型,即TAMs。其中:若探明外泌體和相關的miRNA是如何介導這一系列反應,那么上皮性卵巢癌治療或診斷生物標志物的新型靶標將拉開序幕。

一個大問題:
來自缺氧上皮卵巢癌細胞的外泌體遞送微小RNA到巨噬細胞如何會引發腫瘤促進細胞的表型變化?
技術路線:
1-上皮細胞癌細胞株培養和缺氧處理
2-外泌體的分離及電子顯微鏡檢驗
3-miRNA模擬物/抑制物的轉染和HIF-1α and HIF-2α的siRNA
4-安捷倫miRNA微陣列基因芯片分析
5-熒光素酶報告基因測定
6-miRNA表達評估及Western blot 分析
7-免疫組織化學著色以及數據分析
研究結果:
1、缺氧外泌體促進巨噬細胞極化。先分離純化SKOV3的外泌體,并用TEM鑒定。再將常氧和缺氧下SKOV3細胞分泌的外泌體分別處理無極化的巨噬細胞,與常氧外泌體相比,低氧外泌體促進巨噬細胞極化。
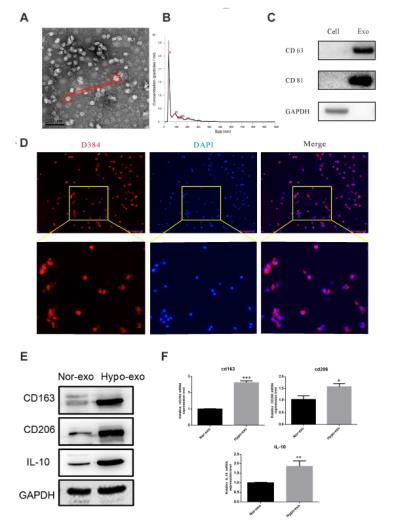
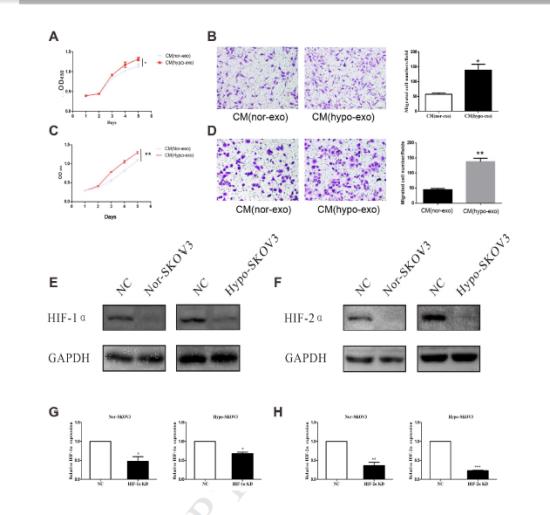
2、低氧外泌體誘導的巨噬細胞促進SKOV3細胞增殖和遷移收集了與常氧或缺氧下分泌的外泌體共同培養的巨噬細胞的上清液在不同條件培養基中處理正常SKOV3細胞和HO-8910細胞5天,每天進行CCK8檢測評估增殖情況。
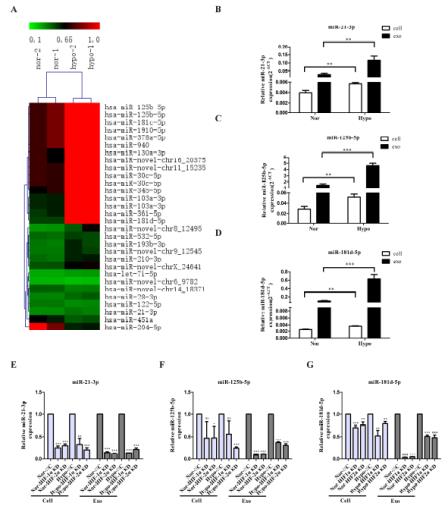
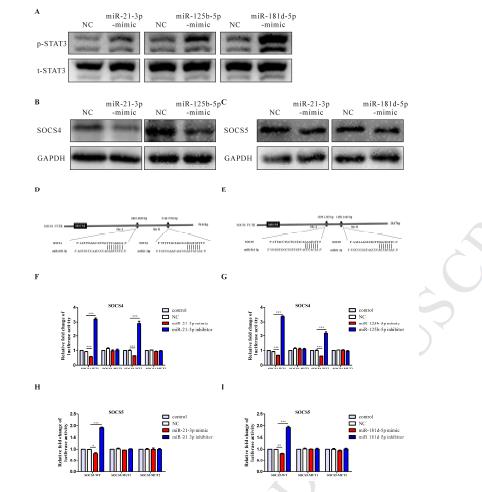
3、利用基因芯片技術篩選出25個上調的miRNA和5個下調的miRNA,并驗證了缺氧條件下誘導的外泌體比常氧條件下HIF-1α and HIF-2α誘導的外泌體中miR-21-3P、miR-125b-5p、miR-181d-5p表達水平更高。
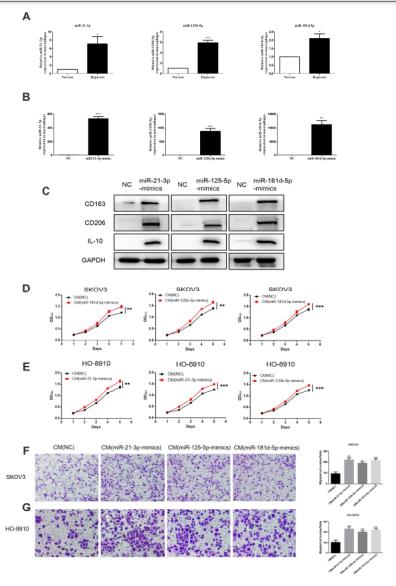
4、miR-21-3P、miR-125b-5p、miR-181d-5p模擬物處理通過M2極化促進SKOV3細胞增殖和遷移,用常氧或缺氧外泌體處理非極化的巨噬細胞,與常氧外泌體相比,三種miRNA與缺氧外泌體共培養的巨噬細胞中表達更高。再通過免疫印跡、qRT-PCR、以及Transwell實驗結果表明成功轉染三種miRNA模擬物的巨噬細胞能夠促進了上皮卵巢癌細胞的遷移。
5、通過轉染上調的miRNA到癌癥靶細胞,通過熒光素酶基因報告及免疫印跡等實驗證實了相關下游基因的表達水平, 由此說明miR-21-3P、miR-125b-5p、miR-181d-5p調控SOCS4/5、STAT3信號通路從而影響巨噬細胞的M2表型極化。
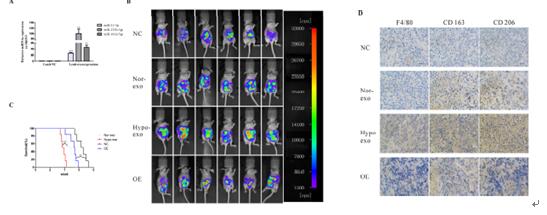
6、通過表達SKOV3-lucl-pur細胞株并有效轉染miR-21-3P、miR-125b-5p、miR-181d-5p模擬物,用不同濃度和不同條件下的癌細胞模擬物及外泌體對4組裸鼠進行腹腔注射。通過鼠內巨噬細胞的標記物CD163/CD206的表達水平測定以及裸鼠的解剖組織IHC等實驗結果得出缺氧條件下上皮細胞癌細胞分泌的外泌體通過三種miRNA誘導巨噬細胞的M2表型極化,從而促進該EOC增殖和遷移。
總結:
文章數據結果說明缺氧條件增加了EOC分泌的外泌體中miR-21-3p,miR-125b-5p和miR-181d-5p的表達水平,它們被巨噬細胞內吞,并通過HIF-1α and HIF-2α將非極化巨噬細胞促進TAM表型。然后,TAM促進EOC細胞增殖和遷移。同理可證,來源于缺氧EOC細胞的外泌體可能作為信使在癌細胞和巨噬細胞之間轉運miR-21-3p,miR-125b-5p和miR-181d-5p。靶向外泌體或miRNA的生物功能可以為EOC的臨床治療提供新的思路及方法。






