CircRNA通過ceRNA機制調控自噬影響腦缺血性中風
自從大隅良典因細胞自噬獲得2016年度諾貝爾生理學與醫學獎,自噬的研究熱度持續升溫。
自噬目前根據發生過程分為三類:Macroautophagy,Microautophagy和Chaperone-mediated autophagy CMA)。大自噬(Macroautophagy)即我們說的自噬(autophagy);微自噬(Microautophagy):是指溶酶體主動、直接吞噬胞漿成分的一種方式; 分子伴侶介導的自噬(Chaperone-mediated autophagy,CMA):一些分子伴侶,如hsp70,能幫助未折疊蛋白轉位入溶酶體。通常說的自噬泛指Macroautophagy.
CircRNA的研究也是近幾年開始熱門起來的,下面讓我們通過一篇文章來介紹如何將這兩大熱門聯系起來。
該文為東南大學的姚紅紅教授團隊于今年6月份發表在Attophagy雜志(IF=11.1)上,題為”Novel insight into circular RNA HECTD1 in astrocyte activation via autophagy by targeting MIR142-TIPARP: Implications for cerebral ischemic stroke“, 揭示circHECTD1同過ceRNA機制調控自噬,參與腦缺血中風過程。
研究人員首先通過circRNA芯片技術在中風小鼠模型-短暫性大腦中動脈閉塞缺血性腦組織中發現環狀RNA circHECTD1顯著高表達,同時在AIS中風病人的血漿樣本得到證實。敲低circHectd1表達后,可明顯減少中風小鼠模型的腦梗塞區域,減少神經毒性以及改善星形膠質細胞,進一步分子機制研究表明,circHECTD1可以通過miRNA海綿作用競爭性吸附miRNA-142,抑制miRNA-142的活性,導致TIPARP(TCDD誘導型聚[ADP-核糖]聚合酶)表達的抑制,隨后通過巨自噬/自噬抑制星形膠質細胞活化。
研究方案:
1、篩選腦缺血相關circRNA----( circHECTD1在缺血腦組織中上調)
作者首先在中風模型和對照小鼠的缺血性腦組織(n=3),進行circRNA芯片檢測,篩選到5個上調的circRNA(Figure1 A,B,C); 并設計divergent 和convergent引物在cDNA和gDNA上進行PCR鑒定(Figure1 D),定量PCR結果驗證了circ_008488(circHECTD1)的顯著高表達;為驗證該circ參與中風,作者在急性缺血性中風(AIS)(n=37)和健康人(n=47)血漿中通過PCR驗證circHECTD1的上調(E)。

二、 circHECTD1 功能驗證-----(干擾circHECTD1后腦梗塞降低)
為驗證其中風功能,作者將攜帶circHECTD1 siRNA的慢病毒顯微注射入小鼠側腦室(A),驗證siRNA的傳染效果(B)和干擾circHECTD1的效果(C),慢病毒注射2周后開始構建tMCAO模型,24小時后核磁共振檢查腦梗面積,TTC染色檢測體積,發現干擾circHECTD1后腦梗死面積顯著降低(D,E); 神經缺陷得分也顯著下降(F)。

三、circHECTD1 作用機制
1.體內干擾circHECTD1后抑制星形膠質細胞活性
為研究其機制,研究者在同樣的實驗組(中風模型和對照小鼠的缺血性腦組織,n=3),進行mRNA芯片檢檢測,發現515個上調和87個下調(1.5倍)mRNA(A,B,C); 為驗證芯片結果,對GFAP進行PCR和wb檢測,驗證其高表達(D,E); 并驗證GFAP與circHECTD1共定位(F);為驗證circHECTD1角色,將circHectd1-siRNA-GFP注射模型小鼠,免疫熒光顯示GFAP與circHectd1-siRNA共定位(G);腦切片免疫熒光標記星形膠質細胞標志物,顯示活性星形膠質細胞出現在皮質半影區(H); 活性星形膠質細胞在circCon siRNA組中升高,但在circHectd1-siRNA組中得到改善(I,J), WB進一步驗證GFAP在circHectd1-siRNA組中顯著降低。

2.體外干擾circHECTD1后抑制星形膠質細胞活性
作者進一步在小鼠星形膠質細胞(AS)和人膠質瘤細胞A172中檢測circHECTD1對星形膠質細胞活性的影響。

3. circHECTD1介導的星形膠質細胞活性的機制研究---- circHECTD1 結合MIR142
首先FISH對circHECTD1進行定位,發現主要位于細胞質,因此作者研究其是否作為ceRNA結合miRNA,RNAhybrid軟件顯示其具有MIR142結合位點(A),FISH顯示兩者共定位(B),PCR顯示MIR142在AIS病人中下調 C, OGD-R處理細胞后MIR142 下調(E,F);pull down顯示MIR142模擬五可拉下circHECTD1 (G),circHECTD1探針可拉下MIR142 (H).

4. circHECTD1-MIR142的靶基因驗證
作者進一步研究MIR142的靶基因。通過預測發現MIR142可靶向TIPARP(A),熒光素酶報告基因實驗驗證其相互作用(B); mRNA芯片(C,D) 和PCR、wb(E,F)顯示靶基因在模型小鼠中上調。免疫熒光顯示TIPARP與GFAP共定位(G);AS和A172細胞中MIR142可下調TIPARP表達(H,I),體內干擾circHECTD1后TIPARP表達下調(J).

5. 進一步驗證circHECTD1-MIR142-TIPARP促進星形膠質細胞活性
作者通過拯救實驗驗證這一ceRNA軸中的分子對星形膠質細胞標記物GEAP的表達的調控
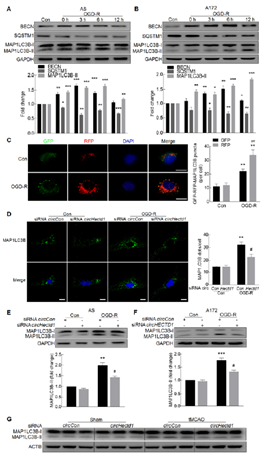
6. circHECTD1對自噬的調控
越來越多的證據表明自噬參與了星形膠質細胞的激活,并參與了腦卒中的發病機制,因此作者研究circHECTD1是否通過自噬激活星形膠質細胞。首先證明星形膠質細胞激活與自噬相關:檢測OGD-R刺激上調自噬相關蛋白的表達(A,B)和自噬流信號(C)。然后證明circHECTD1影響自噬:免疫熒光顯示circHECTD1干擾后抑制OGD-R誘導MAP1LC3B的表達(D),pcr和wb進一步驗證(E,F),體內證明circHECTD1干擾后MAP1LC3B表達降低(G).

7. circHECTD1-MIR142 axis通過TIPARP調控自噬進而激活星形膠質細胞
circHECTD1-MIR142-TIPARP對自噬的影響:干擾circHECTD1能夠改善anti-MIR142誘導的自噬(A),過表達circHECTD1能夠改善MIR142誘導的MAP1LC3B-II下調(B), Tiparp siRNA顯著抑制OGD-R引起的自噬(C)。進一步檢測自噬對星星價值細胞的影響:自噬抑制劑3-MA降低OGD-R引起的膠質細胞標志物GFAP和自噬標志物MAP1LC3B-II的表達(D,E),自噬激動劑rapamycin起想反作用(F,G)