多種癌細胞釋放的LIF和Gal3劫持神經信號
神經信號對腫瘤預后有顯著影響。然而,癌細胞如何主動調節神經系統以使其自身存活尚不完全清楚。在這項研究中,作者報告了一種重疊的大腦反應模式,包括下丘腦室旁核,在多種外周癌癥小鼠模型中。隨后,多組學篩選確定白血病抑制因子(LIF)和半乳糖凝集素-3 (Gal3)是這些癌細胞類型釋放的觸發大腦激活的關鍵細胞因子。重要的是,這兩種細胞因子的血漿水平在不同癌癥患者中均有升高。作者進一步證明,藥物或基因阻斷癌細胞來源的LIF或Gal3信號可以消除大腦反應并強烈抑制腫瘤生長。此外,周圍交感神經活動的消融同樣可以恢復抗腫瘤免疫。這些結果闡明了多種癌細胞劫持神經系統以促進腫瘤進展的一種新的共享機制。該文章于2024年3月發表在《Cell research》,IF:44.1。
技術路線:

技術路線圖
1. 大腦對多種外周腫瘤反應的重疊模式
作者試圖探索外周腫瘤與中樞神經系統通訊的機制。作為研究的切入點,作者使用了幾種小鼠同種異體移植模型,即LLC肺癌、RM1前列腺癌、MC38結腸癌和4T1乳腺癌。值得注意的是,這些同種異體移植模型通常被用于癌癥免疫學研究抗腫瘤免疫和MDSCs在免疫能力野生型小鼠中的作用。小鼠皮下植入每一種癌細胞系,然后對荷瘤小鼠的腦組織進行磷酸化核糖體蛋白S6 (p-S6)的免疫染色,p-S6是神經元激活的特異性標志物作者全面評估了從嗅球到腦干的腦區。令人驚訝的是,作者在所有的腫瘤條件下發現了一個共同的大腦反應模式,包括下丘腦室旁核(PVN),一個啟動傳出交感信號的大腦中樞區域(圖1a, b)。此外,視交叉上核(SCN)、左右前庭核(Ve-L/-R)、三叉神經左右中腦核(Me5-L/-R)、紅核(RN)、舌下核(12N)、以及三叉神經左右運動核(5N-L/-R)在這些同種異體移植物模型中被觸發(圖1a, b)。另一方面,在與內臟或代謝信號相關的大腦區域,如孤立束核(NTS)、左右臂旁核(PBN-L/-R)和弓形核(ARC),沒有檢測到神經活動(圖1c, d),這說明了癌癥誘導的大腦激活的特異性。
除了同種異體移植癌癥模型,作者還評估了MMTV-PyMT小鼠的大腦激活情況,這是一種標準的原位乳腺癌遺傳模型重要的是,該遺傳模型顯示出與上述同種異體移植模型相同的一組反應性和非反應性腦區(圖1a-d)。這些結果表明,盡管它們的起源和突變譜不同,但多種類型的外周癌癥可能誘導重疊的腦反應模式。
為了確定腫瘤的生理負擔是否可能是大腦對不同癌癥反應的共性的基礎,作者向野生型小鼠植入了一個由醫用級硅膠制成的假腫瘤。盡管這些假腫瘤有效地模仿了“真實”腫瘤的體積和重量,但它們未能在包括PVN、SCN、Ve-L/-R和Me5-L/-R在內的特征腦區引起任何神經活化。這一觀察結果在很大程度上排除了外周腫瘤的物理性質參與誘導腦激活的可能性。
2. 白血病抑制因子(LIF)和半乳糖凝集素-3 (Gal3)是引發大腦反應的癌細胞來源因子
作者考慮了多種癌癥類型可能釋放相同的因子來觸發大腦激活的重疊模式的可能性。為了驗證這一假設,作者通過RNA測序(RNA-seq)分析了LLC、RM1、MC38和4T1異體移植模型和MMTV-PyMT遺傳模型的腫瘤轉錄組(圖1e),并鑒定出約2000個候選基因在不同癌癥類型中表現出共同的表達模式。同時,通過蛋白質組學分析檢測LLC、RM1、MC38或4T1細胞培養基中的蛋白質(圖1e)。作者發現,114種蛋白質在這些癌細胞的分泌組中普遍存在,其中89種被列入RNA-seq分析鑒定的候選基因列表。其中,61個候選蛋白被過濾為真正的分泌因子,即具有信號肽,其中11個具有特定受體。作者進一步分析了這些受體在已發表的小鼠三叉神經節神經元(GSE213105)的單細胞RNA-seq (scRNA-seq)數據集中的表達,其軸突控制Me5-L/-R和5N-L/-R,這是多種癌癥類型激活的特征區域。通過多組學篩選,獲得了三個候選蛋白(LIF、色素上皮衍生因子和血栓反應蛋白-1),進行了深入的功能檢查(圖1f)。

圖1 多種外周腫瘤小鼠模型中腦反應的重疊模式
作者用三種候選蛋白中的每一種重組蛋白處理非荷瘤野生型小鼠,測試是否可以重現對外周腫瘤的相同腦反應模式(圖2a)。值得注意的是,單次腹腔注射1 μg小鼠LIF可以有效地激活特征腦區,即PVN, SCN, Ve-L/-R, Me5-L/-R, RN, 12N和5N-L/-R,持續長達24小時(圖2b,c)。同時,讓人聯想到在荷瘤小鼠中觀察到的情況,這種LIF治療沒有引起NTS或PBN-L/-R中可檢測到的神經活動(圖2d,e)。此外,在LLC、RM1、MC38或4T1細胞的所有同種異體移植模型中,以及荷瘤MMTV-PyMT小鼠中,血漿LIF蛋白水平顯著上調(圖2f)。此外,在前列腺癌、膀胱癌、輸尿管癌、非小細胞肺癌、結直腸癌和腎癌等多種癌癥患者中均檢測到血漿LIF水平升高(圖2g)。這些結果支持LIF是一種癌細胞衍生因子,可觸發大腦反應。
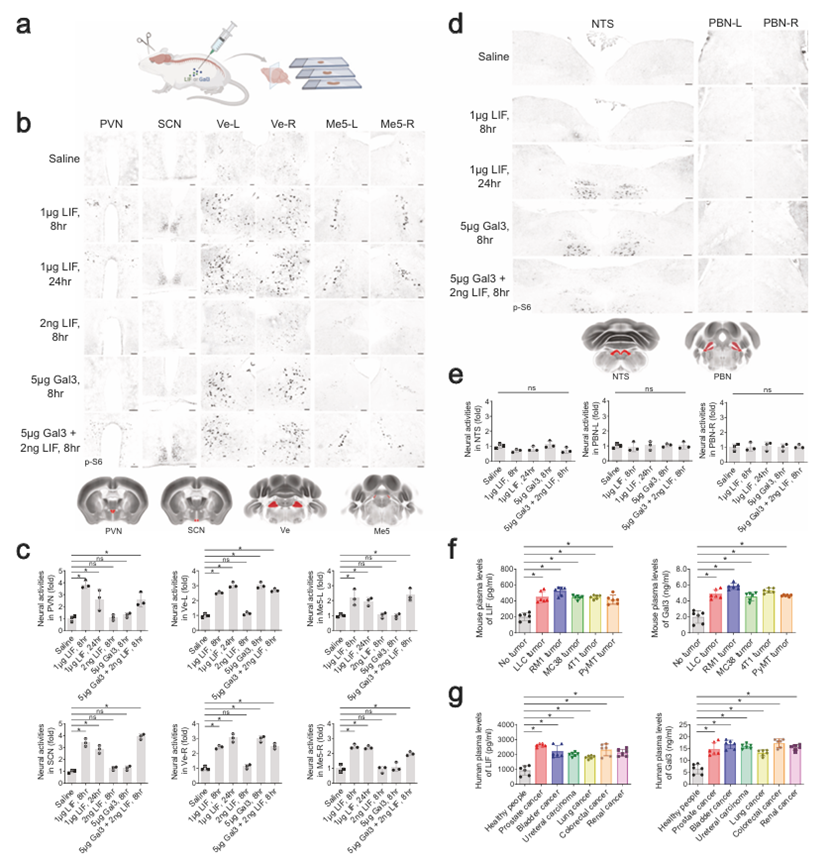
圖2 LIF和Gal3是癌細胞衍生的因子,它們協同激活特定的大腦區域
然而,作者注意到腹腔注射1μg重組LIF蛋白導致血漿水平達到~50 ng/mL,比荷瘤小鼠高100倍。另一方面,盡管單次注射2ng LIF可使其血漿水平與荷瘤條件下的水平相當,但這種低劑量不足以引起大腦激活(圖2b,c)。這一現象提出了一個具有挑戰性的問題,即可能存在其他癌細胞衍生因子在神經激活中與LIF協同作用。為此,作者繼續對剩余的60個候選分泌因子的市售重組蛋白進行了篩選,希望找到一個在低劑量LIF治療條件下可以誘導神經活動的重組蛋白。作者設法發現,雖然單獨腹腔注射5 μg半乳糖凝集素-3(Gal3)僅誘導非荷瘤小鼠Ve-L/-R區的神經活動,但它與2ng LIF協同作用,觸發所有特征腦區的反應(圖2b,c)。順便說一句,重組LIF和Gal3蛋白在血液中的清除速度都相對較快(LIF的t1/2 = 2.9 min,Gal3的t1/2 = 3.2 min)。值得注意的是,在LLC、RM1、MC38或4T1細胞的同種異體移植模型和MMTV-PyMT遺傳模型中,血漿Gal3水平顯著上調(圖2f)。此外,不同癌癥患者血漿中Gal3水平顯著升高(圖2g)。這些結果共同確定了LIF和Gal3是多種癌癥類型釋放的與大腦溝通的關鍵因子。
3. 阻斷大腦的LIF和Gal3信號可抑制腫瘤進展
接下來,作者探索了癌細胞來源的LIF和Gal3信號與大腦的疾病相關性。通過CRISPR/Cas9生成LIF或Gal3基因缺失的LLC、RM1、MC38或4T1細胞,然后在小鼠同種異體移植模型中進行測試(圖3a)。值得注意的是,這些細胞中的LIF敲除(KO)阻斷了特征腦區域(如PVN和Me5-L/-R)的癌癥誘導活性(圖3b,c)。有趣的是,LIF缺失的LLC、RM1、MC38或4T1細胞并沒有完全消除Ve-L/-R的神經活動(圖3b,c),這與上述觀察一致,即Gal3單獨可以刺激腦核(圖2b,c)。癌細胞中的Gal3 KO強烈地破壞了腫瘤小鼠所有特征腦區的神經活動(圖3b,c)。這些結果驗證了癌細胞來源的LIF和Gal3在介導多種類型外周腫瘤的腦反應中的協同作用。
在LLC、RM1、MC38或4T1細胞的小鼠同種異體移植模型中,LIF KO或Gal3 KO阻斷腦激活可延緩腫瘤生長(圖4a)。為了進一步支持LIF和Gal3信號的關鍵作用,作者每天用EC330(一種LIF的小分子抑制劑)治療攜帶“野生型”腫瘤的小鼠。這種藥理學方法抑制了大腦特征區域(如PVN、SCN和Me5-L/-R)的大腦反應。與此同時,與LIF - KO的結果一致,在使用EC330處理的荷瘤小鼠中,Ve-L/-R的神經活動持續存在。重要的是,在“野生型”LLC、RM1、MC38或4T1細胞的小鼠同種異體移植模型中,EC330治療延遲了腫瘤生長。同樣,當使用Gal3小分子抑制劑GB1107治療時,攜帶“野生型”腫瘤的小鼠在所有特征區域都沒有表現出大腦反應。此外,這種對Gal3信號的藥理學抑制導致了腫瘤生長的強烈抑制。這些結果闡明了癌細胞來源的LIF和Gal3信號在調節腫瘤進展中的作用。
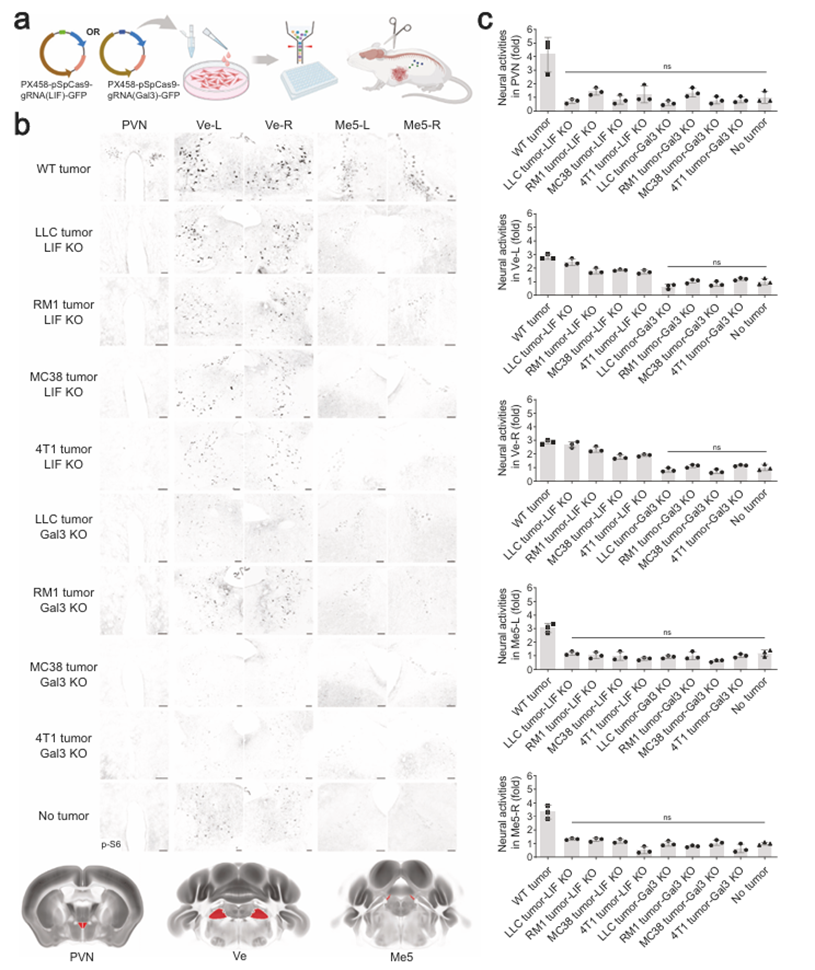
圖3 癌細胞來源的LIF和Gal3對大腦反應至關重要
4. 交感信號促進MDSC的產生,促進腫瘤進展
研究表明,MDSCs可進一步分類為多形核MDSCs (PMN-MDSCs)或單核MDSCs (M-MDSCs),它們具有抑制CD8+ T細胞介導的抗腫瘤免疫的作用。作者發現,在LIF KO或Gal3 KO細胞的小鼠同種異體移植模型的血液和腫瘤中,PMN-MDSCs和M-MDSCs的存在減少(圖4b)。因此,與親代“野生型”細胞相比,LIF KO或Gal3 KO細胞的同種異體移植腫瘤中CD8+ T細胞的募集增加(圖4c)。這些結果表明,阻斷癌細胞來源的LIF和Gal3信號傳導到大腦可以增強抗腫瘤免疫。

圖4 阻斷LIF或Gal3信號可抑制腫瘤進展
因此,作者試圖確定這種癌癥誘導的大腦反應所提供的神經免疫機制。骨髓間充質干細胞主要通過骨髓和脾臟等淋巴器官的骨髓生成。由于癌細胞來源的LIF和Gal3協同激活了PVN, PVN是控制輸出交感作用的中樞腦區,作者探索了特定淋巴器官的局部交感輸入是否可能調節MDSC的產生。作者利用Th-Cre;TrkAfl/fl小鼠模型,其中NGF高親和受體TrkA在交感神經元中缺失。作者之前使用先進成像技術的研究顯示Th-Cre; TrkAfl/fl小鼠骨髓和脾臟交感輸入完全消融。在小鼠同種異體移植模型中檢測Th-Cre、TrkAfl/fl(即交感神經消融)和對照Th-Cre、TrkA+/+窩鼠。作者比較了這些荷瘤小鼠的腦活動,揭示了交感神經消融與對照條件下特征區域的神經活動水平相似。此外,交感神經消融荷瘤小鼠的血漿LIF或Gal3水平沒有顯著變化。這些發現證實了癌癥引起的大腦反應會在交感神經信號的上游發生。然而,Th-Cre;TrkAfl/fl小鼠的腫瘤生長明顯受到抑制(圖5a),這與這些小鼠血液和腫瘤中MDSCs減少而CD8+ T細胞增加有關(圖5b-d)。作者進一步在Th-Cre、TrkAfl/fl和對照幼崽中檢測了LIF KO或Gal3 KO癌細胞。重要的是,在交感神經切除和對照條件下,LIF或Gal3 KO腫瘤的生長速率是相當的(圖5e,f),表明在這種情況下,LIF或Gal3基因缺失沒有加性效應。這些結果支持了LIF和Gal3可以通過交感信號促進MDSC生成以促進腫瘤進展的觀點。
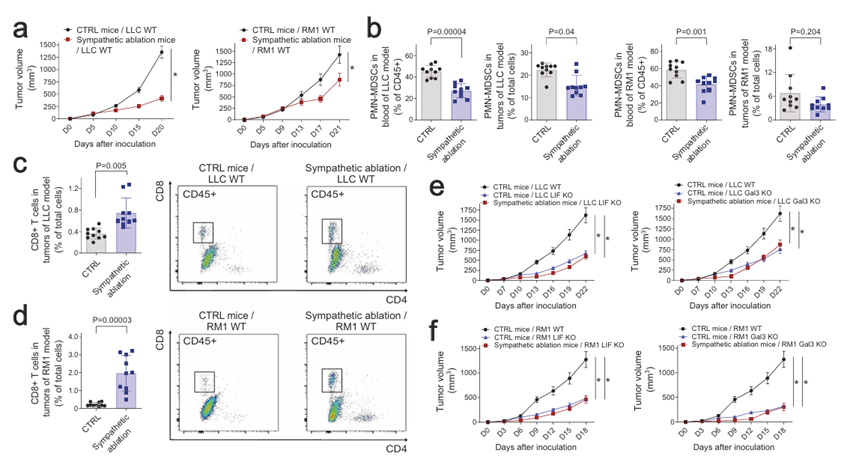
圖5 癌細胞來源的LIF和Gal3通過交感信號促進MDSC的產生
接下來,作者利用交感神經切除術的手術方法特異性地去除小鼠脾臟中的交感神經輸入(圖6a),然后將其用于異體移植物癌癥模型。與交感神經消融術觀察到的情況類似,脾交感神經切除術對血漿LIF或Gal3水平沒有顯著影響。另一方面,局部去除交感輸入足以減少腫瘤小鼠脾臟(圖6b)和血液循環(圖6c)中的PMN-MDSCs和M-MDSCs,這表明脾臟中的交感信號促進了MDSCs的產生。
最后,作者從小鼠同種異體移植模型的脾臟中篩選PMN-MDSCs和M-MDSCs進行體外培養。有趣的是,交感神經遞質去甲腎上腺素(NE)提高了MDSCs中免疫抑制基因(如iNOS2、Arg1和Il-10)的表達。這種神經免疫作用可被β2-腎上腺素受體拮抗劑完全消除(圖6d)。同時,作者發現荷瘤小鼠的血漿LIF或Gal3水平不受外源性NE處理的影響,證實癌細胞釋放LIF或Gal3不依賴交感信號。這些結果表明,交感信號可以直接促進MDSCs的免疫抑制功能。
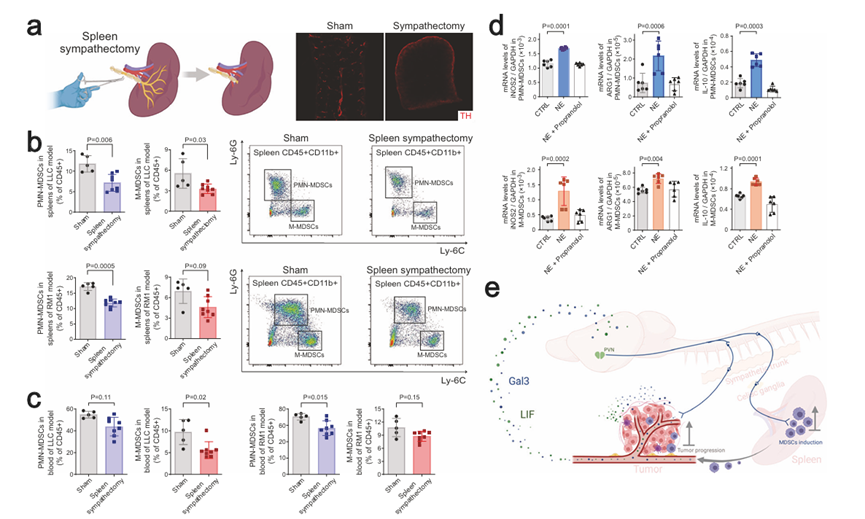
圖6 交感信號直接促進MDSCs的免疫抑制功能
結論:
總之,該研究闡明了多種癌癥劫持神經信號促進腫瘤進展的一種新的共享機制(圖6e),這對更好地理解癌癥神經科學的復雜性具有廣泛的意義。
實驗方法:蛋白質組學分析,ELISA,小鼠腦組織免疫染色,RNA-seq
參考文獻:
Xu, Q., Cao, Y., Kong, F. et al. Multiple cancer cell types release LIF and Gal3 to hijack neural signals. Cell Res (2024). https://doi.org/10.1038/s41422-024-00946-z






