熊果苷通過FTO/SLC7A11通路抑制鐵死亡減輕脂肪肝
非酒精性脂肪肝(NAFLD)是一種潛在的嚴重疾病,影響著全球30%的人口,對人類健康構成重大威脅。然而,迄今為止還沒有安全、有效和適當的治療方法。近年來,鐵死亡已成為一種重要的細胞死亡模式,并被發現在非酒精性脂肪肝的發展過程中起著關鍵的調節作用。在這項研究中,作者發現一種從熊果樹中提取的天然抗氧化劑——熊果苷(ARB),能在體內和體外抑制鐵突變的發生并改善高脂飲食誘導的非酒精性脂肪肝。通過反向對接,作者發現去甲基化酶脂肪量和肥胖相關蛋白(FTO)是ARB的潛在靶點。隨后的機理研究發現,ARB通過抑制FTO來控制SLC7A11基因甲基化。此外,作者還證明了SLC7A11可以緩解非酒精性脂肪肝在體內和體外的發展,FTO/SLC7A11軸是治療非酒精性脂肪肝的潛在治療靶點。具體而言,作者發現ARB可通過作用于FTO/SLC7A11通路抑制鐵死亡,從而緩解非酒精性脂肪肝。該研究為非酒精性脂肪肝的治療提供了一種新的方法和理論基礎。本文于2023年12月發表在《Redox Biology》,IF:11.4。
技術路線:
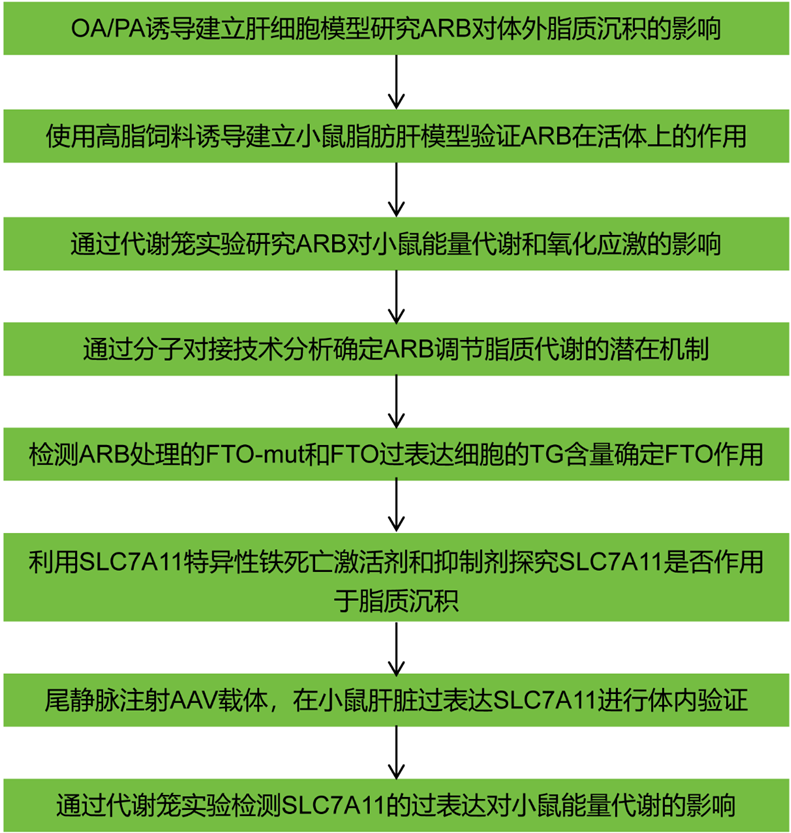
主要實驗結果:
1.ARB調節細胞內脂質沉積
ARB提取自熊果的葉子,其分子式如圖1A所示。在本研究中,作者通過油酸和棕櫚酸(OA/PA)處理HepG2細胞建立了脂質沉積的細胞模型。首先,作者使用CCK-8和劃痕實驗檢測ARB對細胞活力的影響。我們發現ARB在濃度高達100μM時對HepG2細胞活力沒有影響(圖1B),且ARB可以降低HepG2細胞內TG水平,在75μM時效果更明顯(圖1C)。類似地,ARB對3T3-L1細胞的細胞活力無影響,并降低了細胞內TG水平(圖1)基于這些結果,作者在后續實驗中使用了濃度為75μM的ARB。ARB可增加細胞外TG水平,并顯著降低細胞內和細胞外TC水平(圖1D-F)。油紅O染色顯示,與OA/PA處理的細胞相比,ARB處理OA/PA處理的HepG2細胞可顯著減少細胞內脂滴聚集(圖1G、H)。
接著,作者量化了HepG2細胞中與脂質代謝相關的基因的表達水平,發現ARB處理抑制了CD36和FANS等脂質合成基因的表達,但促進了CPT1和MTTP等參與脂質分解和脂質轉運基因的表達(圖1I)。這些發現共同表明,ARB可減少細胞內脂質積累而不影響細胞活力。
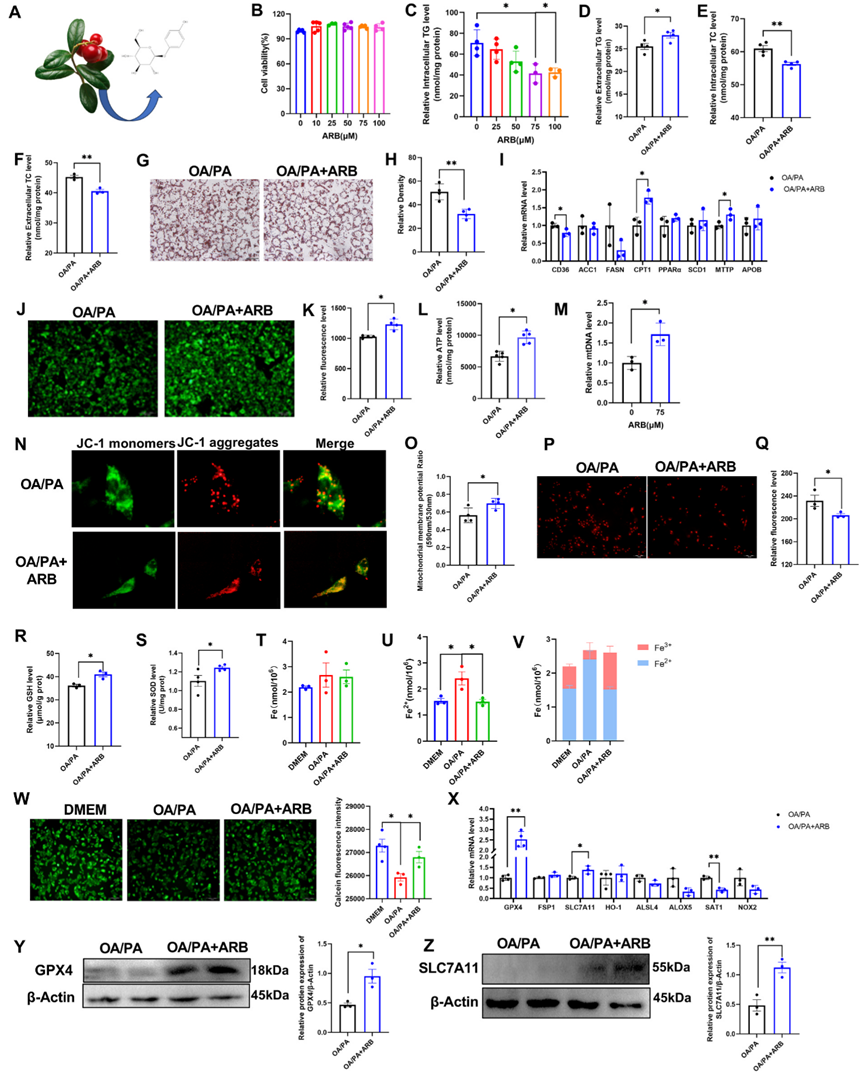
圖1:ARB調節細胞內脂質沉積和鐵死亡
2.ARB通過調節細胞能量代謝和氧化應激抑制鐵死亡
由于非酒精性脂肪肝的發生與代謝失調和氧化應激密切相關,作者接下來試圖確定ARB是否會影響能量代謝和氧化應激,發現ARB能明顯增加線粒體的數量,并提高OA/PA處理細胞中ATP的水平(圖1J-M)。此外,線粒體膜電位(MMP)檢測顯示,ARB處理OA/PA處理細胞后,MMP水平明顯增加(圖1N-O)。同時,ARB處理導致細胞內GSH、超氧化物歧化酶(SOD)和過氧化氫酶(CAT)水平升高,Tatol ROS、線粒體ROS和丙二醛(MDA)生成減少。
作者進一步研究了ARB對OA/PA處理的細胞內總鐵(Fe)和亞鐵離子(Fe2+)含量的影響,發現ARB處理可顯著降低細胞內Fe2+含量(圖1T-V)。此外,鈣黃綠素染色顯示,ARB處理OA/PA處理的HepG2細胞逆轉了單用OA/PA處理后觀察到的細胞內不穩定鐵池的增加(圖1W)。
作者發現,ARB處理可顯著上調GPX4和SLC7A11等鐵死亡抑制基因的表達,同時顯著下調鐵死亡促進基因SAT1的表達(圖1X)。此外,ARB還能顯著降低血紅素mRNA的表達水平。Western blot分析表明,ARB處理OA/PA處理細胞可明顯提高GPX4和SLC7A11蛋白表達水平(圖1Y-Z)。綜上所述,作者的研究結果表明,在非酒精性脂肪肝的OA/PA細胞模型中,ARB可抑制細胞鐵死亡。
3.ARB減少小鼠脂質沉積
為了確定ARB對小鼠脂質沉積的影響,高脂飼料(HFD)喂養的小鼠以1g/kg的劑量給予ARB。飼喂正常飲食的小鼠被認為是CON組。實驗過程的大綱如圖2A所示。
作者發現,HFD導致體重(圖2B、C)和脂肪比率(圖2E)顯著增加,瘦肉比率(圖2D)降低,而ARB治療HFD喂養的小鼠顯著減輕了這些影響。通過顯微CT測量,HFD+ARB組小鼠的脂肪沉積明顯少于HFD組小鼠(圖2F)。與HFD組相比,HFD+ARB組小鼠附睪和皮下脂肪以及肝組織的相對重量明顯減少(圖2G-K)。H&E和油紅O染色顯示,與HFD組相比,ARB減輕了肝臟的損傷,減少了肝臟中脂質的積累,并縮小了附睪脂肪的體積和面積(圖2L-M)。
與HFD小鼠相比,ARB治療HFD小鼠可降低肝臟TG和TC水平以及糞便TG含量(圖2N-O)。此外,ARB能顯著降低HFD引起的血清TG、TC、LDL-H和AST、ALT水平的升高以及HDL-H水平的降低(圖2P-Q)。這些結果表明,ARB可減輕HFD引起的脂質沉積和肝損傷。
為了進一步評估ARB治療對HFD小鼠糖代謝的影響,作者在ARB治療的第9周和第10周進行了GTT和ITT試驗。GTT結果顯示,與HFD小鼠相比,ARB能顯著降低葡萄糖注射后血糖水平的升高,并促進血糖水平恢復到正常水平(圖2R和S)。作者的ITT結果與GTT數據一致(圖2T-U)。研究結果表明,膳食中補充ARB可以改善HFD誘導的胰島素抵抗。

圖2:ARB可減少小鼠的脂質沉積
4.ARB調節小鼠的能量代謝和氧化應激以改善鐵死亡
ARB治療10周后,作者進行了代謝籠試驗,以測量小鼠的能量消耗和體力活動。作者發現,與HFD組相比,HFD+ARB組的二氧化碳產生量和氧氣消耗量明顯更高(圖3A-D)。同樣,HFD+ARB組小鼠的呼吸熵率(RER)和能量消耗也明顯高于HFD組(圖3E-H)。這些影響在黑暗環境中更為明顯(圖3A-H)。HFD+ARB組小鼠的體力活動水平明顯高于HFD組小鼠,而且這種效應與飼料攝入量無關。這些結果表明ARB可改善HFD引起的小鼠能量代謝紊亂。
作者進一步研究了ARB對小鼠氧化應激的影響,發現與HFD組相比,ARB可減少ROS和MDA的積累,增加GSH的含量(圖3I-K),這表明ARB可改善HFD誘導的氧化應激。作者還檢測了肝臟中鐵和Fe2+的含量,發現HFD導致肝臟中Fe2+含量顯著積累,而鐵含量沒有明顯變化。然而,在膳食中添加ARB可抑制HFD引起的Fe2+含量增加(圖3L-N),而血清中的鐵含量也呈現類似的趨勢(圖3O)。
最后,qRT-PCR顯示,與HFD小鼠相比,在HFD小鼠的膳食中添加ARB會導致抑制鐵死亡的基因(GPX4、SLC7A11)的表達顯著增加,而促進鐵死亡的基因(ACSL4、STA1)的表達減少(圖3P)。Western blot分析顯示ARB促進了GPX4和SLC7A11的表達(圖3Q-R)。這些研究結果表明,ARB可改善小鼠的氧化應激并減輕鐵死亡。
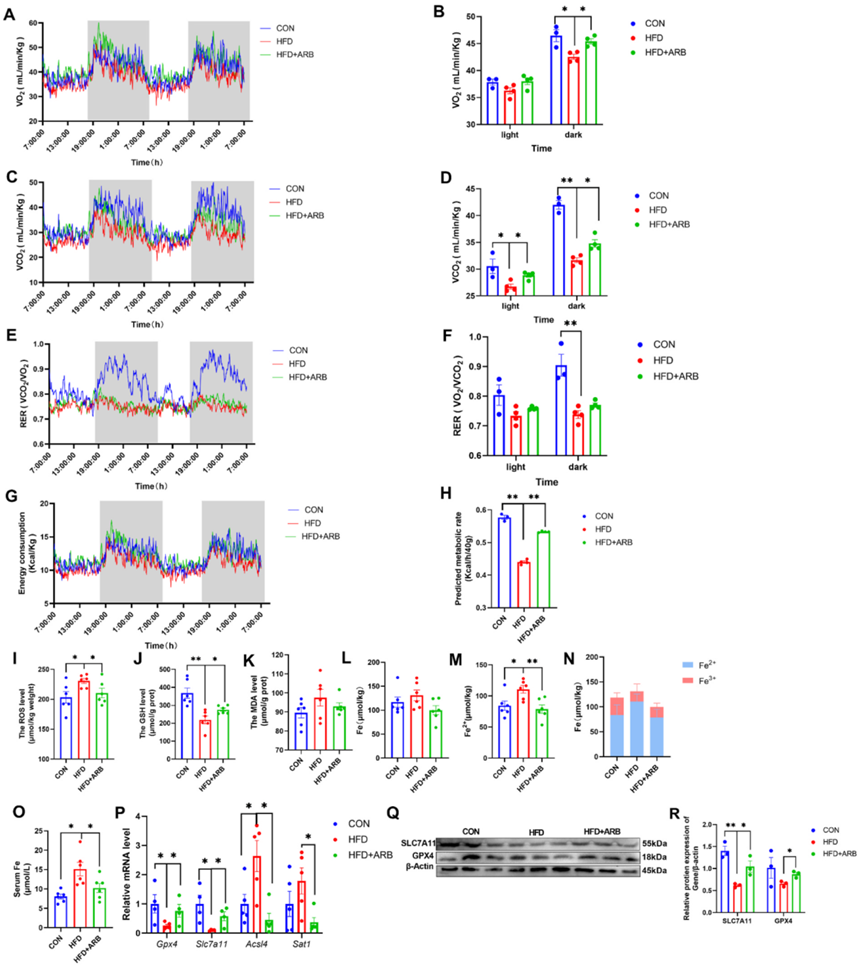
圖3:ARB通過調節小鼠能量代謝和氧化應激,改善鐵死亡
5.FTO是ARB的靶標
接下來,作者利用Discovery Studio進行反向對接分析,試圖確定ARB調節脂質代謝的潛在機制。在排除Fit值低于0.6的模型并對預測數據進行去重和生物校正后確定了410個潛在靶點。為了優化靶點的選擇,作者將從GeneCards和Swiss TargetPredicion數據庫中獲得的與非酒精性脂肪肝相關的靶點與410個已確定的靶點重疊,確定了16個可能與ARB對非酒精性脂肪肝的影響潛在相關的靶點(圖4A)。在確定的靶點中,前10位靶蛋白包括脂肪量和肥胖相關蛋白(FTO)、細胞周期蛋白依賴性激酶2(CDK2)和糖原合酶激酶-3β(GSK-3β)。作者對去甲基化酶FTO特別感興趣,因為之前已經證明FTO能有效調節肝臟脂質代謝。因此,作者假設FTO可能是ARB調節脂質代謝的潛在靶點。為了驗證這一點,作者對ARB和FTO進行了分子對接,發現ARB與FTO在Glu234、Tyr106和Arg96處形成了直接的氫鍵相互作用,并與Asp233、His231和His232形成了疏水相互作用(圖4B-E)。這些結果表明,FTO是ARB的靶標,可能介導ARB對脂質代謝的影響。
Western blot分析表明ARB對FTO蛋白表達水平沒有影響,而qRT-PCR分析表明ARB抑制了FTO表達細胞中FTO mRNA的表達。接下來,作者使用細胞熱轉移試驗(CETSA)和可分化結構搜索(DARTS)證實ARB與FTO結合(圖4F、G)。
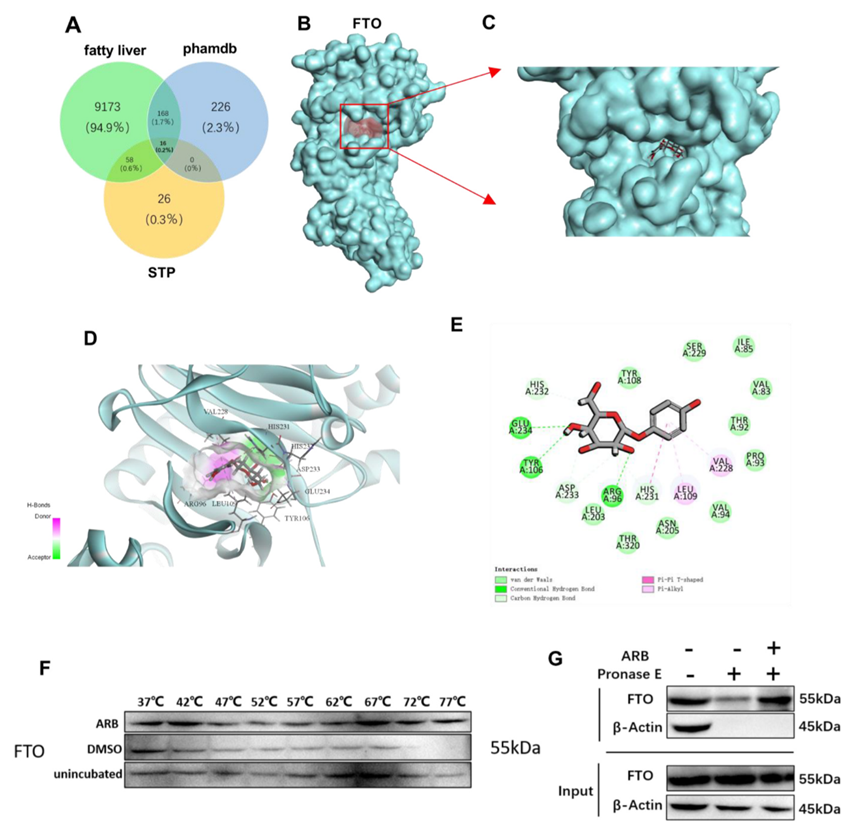
圖4:FTO是ARB的靶點
6.ARB通過FTO調節細胞內脂質代謝和鐵死亡
FTO會破壞細胞的脂質代謝和能量代謝,并影響氧化應激。作者發現ARB處理可降低FTO誘導的TG含量增加,但對過表達FTO-mut(去甲基化功能喪失)細胞中的TG水平沒有影響(圖5A)。與這些發現一致的是,油紅O染色顯示ARB處理減少了FTO過表達誘導的細胞內脂滴的異常積累,尤其是面積大于40μm2的脂滴(圖5B、C)。同樣,ARB處理可減少FTO誘導的TC水平的增加(圖5D)。這些結果表明,ARB可能通過調節FTO去甲基化酶的活性來影響脂質代謝物。
FTO過表達增加了ROS的積累,而ARB逆轉了這些效應(圖5E-FE)。此外,ARB處理過表達FTO的細胞可增加GSH、SOD和MDA水平,降低線粒體熒光(圖5G-H)。接下來作者評估了FTO過表達對細胞Fe和Fe2+含量的影響,發現ARB處理逆轉了FTO誘導的Fe2+含量增加(圖5I-K)。作者的鈣黃綠素染色數據與這些發現一致(圖5L-M)。總之,這些結果進一步證明了ARB對脂質代謝和鐵死亡的調節作用是通過FTO介導的。
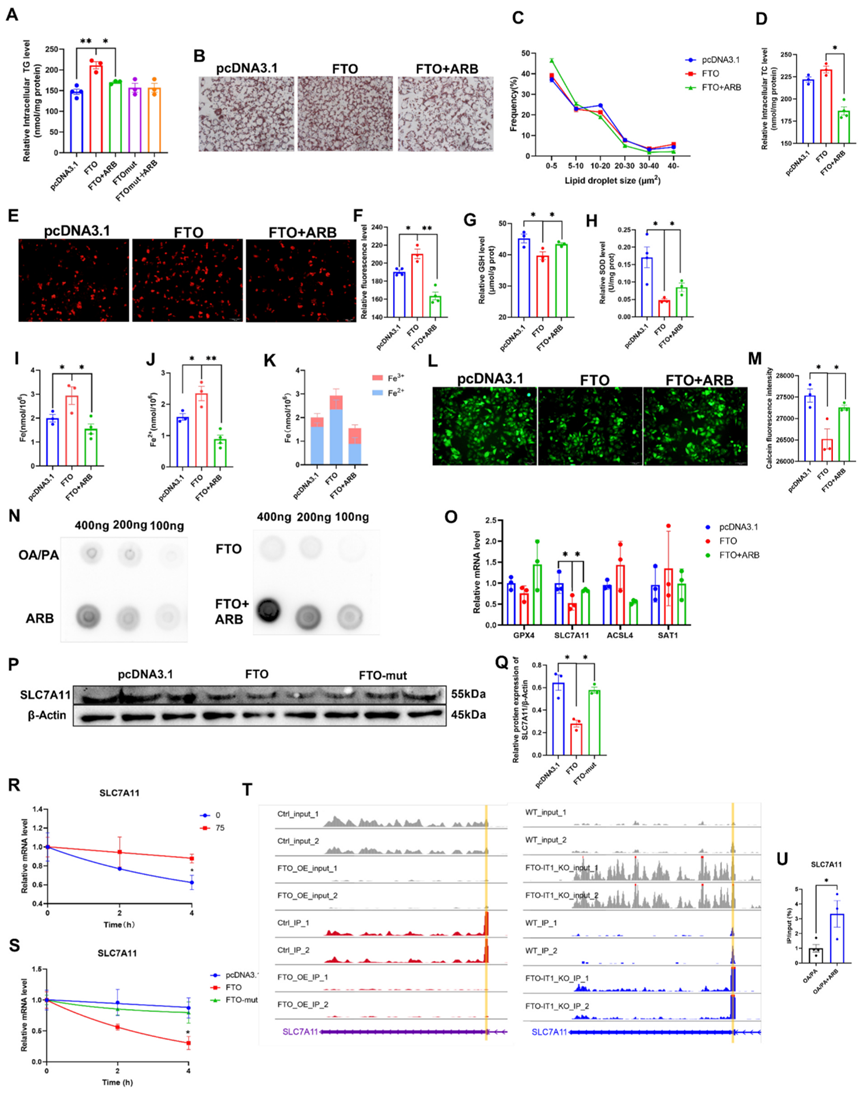
圖5:ARB可調節細胞內脂質代謝和鐵死亡,并通過抑制FTO促進SLC7A11的甲基化修飾。
7.ARB通過抑制FTO促進SLC7A11的m6A甲基化
接下來,作者使用斑點印跡試驗來確定ARB是否會影響FTO介導的m6A甲基化修飾。在ARB組中觀察到較高水平的m6A(圖5N)。qRT-PCR分析表明,ARB增加了FTO誘導的鐵死亡抑制基因(如GPX4和SLC7A11)的減少。相反,ARB會降低促進鐵死亡基因的表達,包括ACSL4和SAT1(圖5O)。由于SLC7A11表達的減少最為顯著,作者在隨后的實驗中重點研究了SLC7A11。過表達FTO導致SLC7A11蛋白表達水平下降,而過表達FTO突變體對SLC7A11的表達沒有影響(圖5P-Q)。接下來,作者檢測了SLC7A11的半衰期,發現ARB處理增加了SLC7A11的半衰期,從而促進了其穩定性(圖5R)。FTO的過表達縮短了SLC7A11的半衰期,而FTO突變則沒有影響。
為了評估FTO對SLC7A11 m6A甲基化的影響,作者使用MeRIP-seq分析和鑒定了SLC7A11的甲基化位點,發現敲除FTO會導致SLC7A11的3′-非翻譯區(3′-UTR)的甲基化增加,而過表達FTO會導致SLC7A11的3′-UTR區的m6A甲基化減少(圖5T)。此外,MeRIP-qPCR證實ARB處理促進了SLC7A113′-UTR區域的m6A甲基化(圖5U)。這些發現表明,ARB介導的FTO抑制促進了SLC7A113′-UTR區的m6A甲基化,從而促進了SLC7A11的表達。
8.ARB通過影響SLC7A11的表達來抑制鐵死亡
接下來,作者利用與SLC7A11相互作用的鐵死亡特異性激活劑Erastin來研究SLC7A11在脂質代謝和鐵死亡中的作用。研究發現,Erastin通過與Gln191形成直接的氫鍵相互作用來抑制SLC7A11的表達。用CCK-8試驗測定,發現ARB可減輕0.1-100μM Erastin處理細胞24小時誘導的細胞死亡(圖6A)。此外,ARB還降低了10μM Erastin處理細胞24小時后誘導的TG(圖6B)和Fe2+(圖6C-E)水平的升高。作者的鈣黃綠素染色數據與這些結果一致(圖6F、G)。為了進一步驗證研究結果,接下來作者研究了鐵死亡抑制劑Ferrostatin-1(Fer-1)對細胞活力和脂質代謝的影響。作者發現,1-100nM Fer-1處理細胞24小時可提高細胞活力,而ARB處理則無明顯影響(圖6H)。同樣,雖然與OA/PA處理的細胞相比,10nM Fer-1和Fer-1+ARB處理導致細胞外TG水平下降,但Fer-1和Fer-1+ARB處理之間沒有觀察到顯著差異(圖6I)。作者的鈣黃綠素染色數據也顯示了類似的趨勢(圖6J和K)。
作者用SLC7A11 siRNA(siSLC7A11)轉染HepG2細胞以敲除SLC7A11的表達,發現ARB逆轉了siSLC7A11誘導的細胞內TG水平的增加(圖6L)。此外,敲除SLC7A11導致ROS積累和GSH含量降低,而ARB處理可逆轉這兩種情況(圖6M-O)。ARB處理抑制了siSLC7A11誘導的Fe2+水平的增加(圖6P-R),而作者的鈣黃綠素染色數據也顯示了類似的效果。相反,過表達SLC7A11會導致細胞內TG水平下降(圖6U)、ROS積累和Fe2+水平下降以及GSH水平上升(圖6V-Z)。siSLC7A11和siSLC7A11+ARB處理組之間沒有觀察到明顯差異,表明ARB是通過SLC7A11發揮作用的。
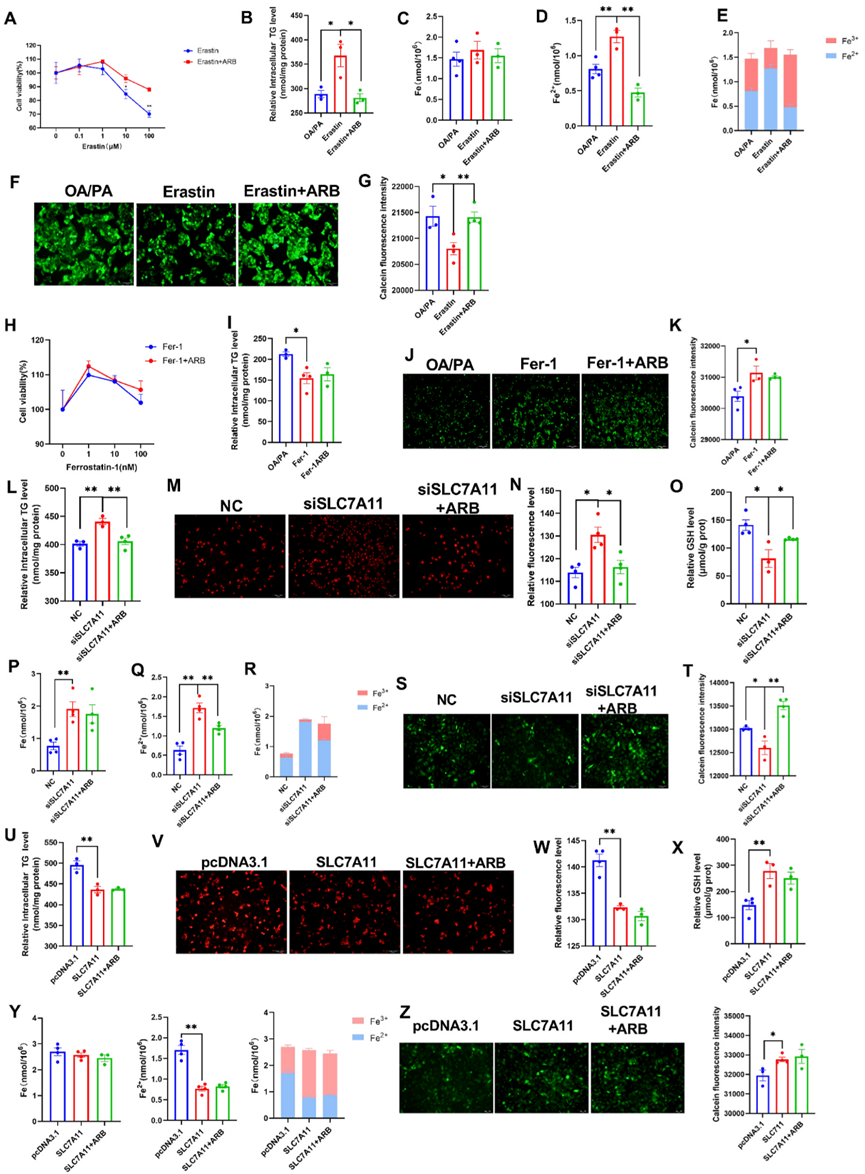
圖6.ARB影響SLC7A11以抑制鐵死亡。
9.AAV介導的SLC7A11肝過表達可減輕小鼠的脂肪肝
為了進一步確定SLC7A11對非酒精性脂肪肝的影響,作者通過尾靜脈注射將編碼SLC7A11的AAV載體注入小鼠肝臟。然后給小鼠喂食CON或HFD。注射對照AAV的小鼠也被分為CON組和HFD組。實驗過程如圖7A所示。10周后,小鼠被人道處死,并測量肝臟、心臟、脾臟、腎臟和附睪脂肪組織樣本中的SLC7A11蛋白表達水平。作者的數據表明,SLC7A11已經在肝臟中成功表達。Western blot分析進一步顯示,與高脂飲食小鼠相比,高脂飲食-SLC7A11小鼠附睪脂肪和腎臟中的SLC7A11蛋白表達水平顯著增加。
作者發現,與HFD組相比,HFD-SLC7A11組小鼠的體重和脂肪體積顯著降低,而瘦肉率顯著升高(圖7B-E)。CT掃描也顯示,與HFD小鼠相比,HFD-SLC7A11組的脂肪含量明顯減少(圖7F)。此外,HFD-SLC7A11組小鼠附睪脂肪、皮下脂肪和肝臟的重量也明顯降低(圖7G-K)。此外,與HFD小鼠相比,在HFD小鼠中過表達SLC7A11可減少附睪脂肪組織的脂肪含量和面積,并減輕肝臟的組織損傷和脂質沉積(圖7L-M)。
與高脂血癥組相比,HFD-SLC7A11小鼠肝臟和血清中的TG和TC水平明顯下降(圖7N-Q)。血清指標分析表明,HFD-SLC7A11組與HFD組相比,LDL-C、AST和ALT水平顯著降低,而HDL-C水平顯著升高。這些發現表明,過表達SLC7A11可減輕小鼠的非酒精性脂肪肝。
通過在治療的第6周和第7周進行GTT和ITT測試,研究了SLC7A11對小鼠糖代謝的影響。作者的GTT數據表明,過表達SLC7A11可改善高氟酸小鼠的葡萄糖耐量(圖7R、S)。同樣,作者的ITT數據顯示,過表達SLC7A11改善了高氟酸小鼠的胰島素抵抗(圖7T-U)。這些發現表明,SLC7A11在調節高纖維食物喂養小鼠的糖代謝和改善胰島素敏感性方面發揮著有益的作用。
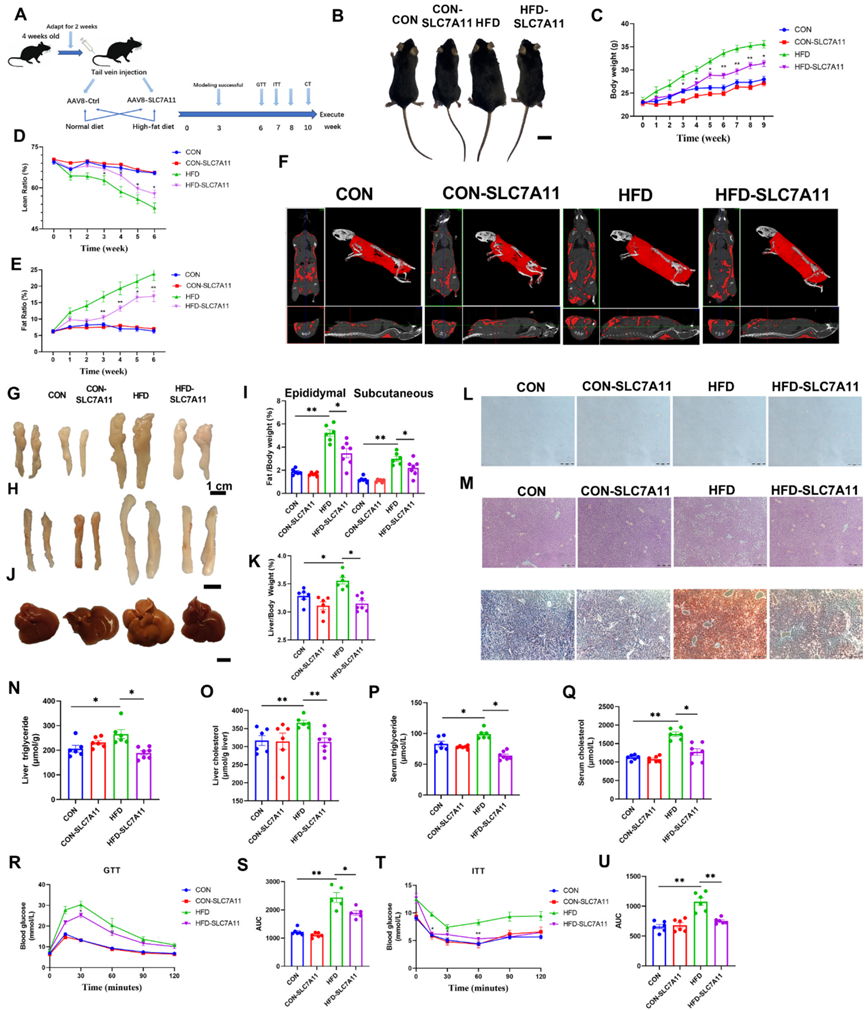
圖7:AAV介導的SLC7A11肝臟過表達可減輕小鼠脂肪肝。
10.AAV介導的SLC7A11肝過表達可改善能量代謝并減少氧化應激
在治療的第8周,使用代謝籠實驗檢測了SLC7A11的過表達對小鼠能量代謝的影響。過表達SLC7A11對CON小鼠的能量代謝沒有顯著影響,但對HFD小鼠的氧氣消耗和二氧化碳產生率有顯著改善(圖8A-D)。我們的RER和能量消耗數據與這些發現一致(圖8E-H)。此外,能量代謝的這些變化在黑暗條件下更為明顯(圖8A-H),并且與飼料攝入量和運動無關(圖S8E-F)。
在CON小鼠肝臟中未觀察到ROS和GSH水平的明顯變化。然而,與HFD小鼠相比,HFD-SLC7A11小鼠肝臟中的ROS水平顯著降低(圖8I),GSH水平顯著升高(圖8J)。與HFD小鼠相比,HFD-SLC7A11小鼠肝臟MDA水平也明顯下降(圖8K)。這些發現表明,過表達SLC7A11可改善高纖維食物喂養小鼠的能量代謝和氧化應激。HFD小鼠肝臟中的Fe2+含量明顯高于CON小鼠。然而,與HFD小鼠相比,過表達SLC7A11會導致HFD-SLC7A11小鼠體內的Fe2+含量顯著降低(圖8L-N)。血清中的鐵含量也出現了類似的趨勢(圖8O)。這些結果表明,在肝臟中過表達SLC7A11可改善鐵變態反應。

圖8:AAV介導的SLC7A11肝過表達可改善能量代謝并減少氧化應激
實驗方法:
Dot blot、MeRIP-qPCR、RIP-qPCR、Western blot、RNA m6A的定量檢測、分子對接技術、代謝籠實驗、質粒轉染
參考文獻:
Jiang T, Xiao Y, Zhou J, Luo Z, Yu L, Liao Q, Liu S, Qi X, Zhang H, Hou M, Miao W, Batsaikhan B, Damba T, Liang Y, Li Y, Zhou L. Arbutin alleviates fatty liver by inhibiting ferroptosis via FTO/SLC7A11 pathway. Redox Biol. 2023 Dec;68:102963. doi: 10.1016/j.redox.2023.102963. Epub 2023 Nov 16. Erratum in: Redox Biol. 2023 Dec 1;:102974. PMID: 37984229; PMCID: PMC10694775.






