METTL17通過調節結直腸癌中的線粒體翻譯來協調鐵死亡和腫瘤發生
鐵死亡是一種鐵依賴的脂質過氧化誘導的細胞調節性死亡,在癌癥治療中顯示出優良的前景。盡管線粒體在鐵死亡的調控中發揮重要作用,但其潛在機制仍不清楚。本研究揭示了線粒體蛋白METTL17通過表觀遺傳調控調控結直腸癌(CRC)細胞的線粒體功能。生物信息學分析證實METTL17的表達與癌細胞的鐵死亡抵抗呈正相關,并且在CRC中上調。METTL17的缺失使CRC細胞對鐵死亡敏感,損害細胞增殖,遷移,侵襲,異種移植腫瘤生長,以及AOM/DSS誘導的CRC腫瘤發生。此外,在鐵死亡應激過程中,METTL17的抑制會破壞線粒體功能和能量代謝,并增強細胞內和線粒體脂質過氧化和ROS水平。在機制上,抑制METTL17可顯著降低線粒體RNA甲基化,包括m4C、m5C、m3C、m7G和m6A,導致線粒體蛋白編碼基因的翻譯受損。此外,與METTL17相關的相互作用蛋白對線粒體基因表達至關重要,敲低它們可使CRC細胞對鐵死亡敏感并抑制細胞增殖。值得注意的是,聯合靶向METTL17和鐵死亡的治療方法有效地抑制了體內結直腸癌異種移植的生長。本研究揭示了METTL17介導的線粒體中細胞存活和鐵死亡的防御機制,突顯了METTL17是治療CRC的潛在靶點。本文于2024年2月發表在《Redox Biology》,IF:11.4。
技術路線:
主要實驗結果:
1.METTL17的表達與CRC細胞對鐵死亡的抵抗呈正相關,敲低METTL17可使CRC細胞對鐵死亡增敏
癌癥治療反應門戶(CTRP)提供了一個包含545種化合物處理的907個癌細胞系的基因表達和耐藥信息的綜合數據集。值得注意的是,對CTRP數據的分析表明,METTL17 mRNA表達與對GPX4抑制劑(包括ML162和RSL3這兩種鐵死亡的經典誘導劑)的耐藥性呈正相關(圖1A)。進一步對另外兩個數據庫,癌癥依賴圖(DepMap)和癌癥細胞系百科全書(CCLE)的綜合分析表明,在各種癌細胞株中METTL17的蛋白水平與ML162和RSL3 AUC藥物敏感性呈正相關(圖1B和C)。
為了確定METTL17是否調控CRC的鐵死亡,利用慢病毒介導的shRNA敲低METTL17構建穩定細胞株。與在CTRP、DepMap和CCLE數據集中觀察到的相關性一致,在SW620和RKO這兩個高水平表達METTL17的結直腸癌(CRC)細胞中敲低METTL17(圖2D),增加了對ML162或RSL3誘導的鐵死亡的敏感性,而細胞活力被鐵螯合劑去鐵胺(DFO)挽救(圖1D和E)。此外,碘化丙胺(PI)染色顯示,ML162或RSL3處理的METTL17缺陷細胞表現出更多的細胞死亡,而DFO能顯著逆轉(圖1F-H),表明敲低METTL17使CRC細胞對GPX4抑制敏感。
接下來,作者在METTL17敲低的SW620細胞中外源性表達METTL17,發現恢復METTL17表達部分挽救了ML162誘導的鐵死亡。然而,在Scramble細胞中過表達METTL17輕微促進了ML162誘導的鐵死亡。此外,METTL17敲低加速了Erastin(胱氨酸/谷氨酸反向轉運體系統Xc-的抑制劑)誘導的鐵死亡。在METTL17敲低的RKO細胞中,恢復METTL17的表達部分挽救了Erastin誘導的鐵死亡。總之,這些生物信息學和實驗結果證實了METTL17在CRC鐵死亡調節中的重要作用。
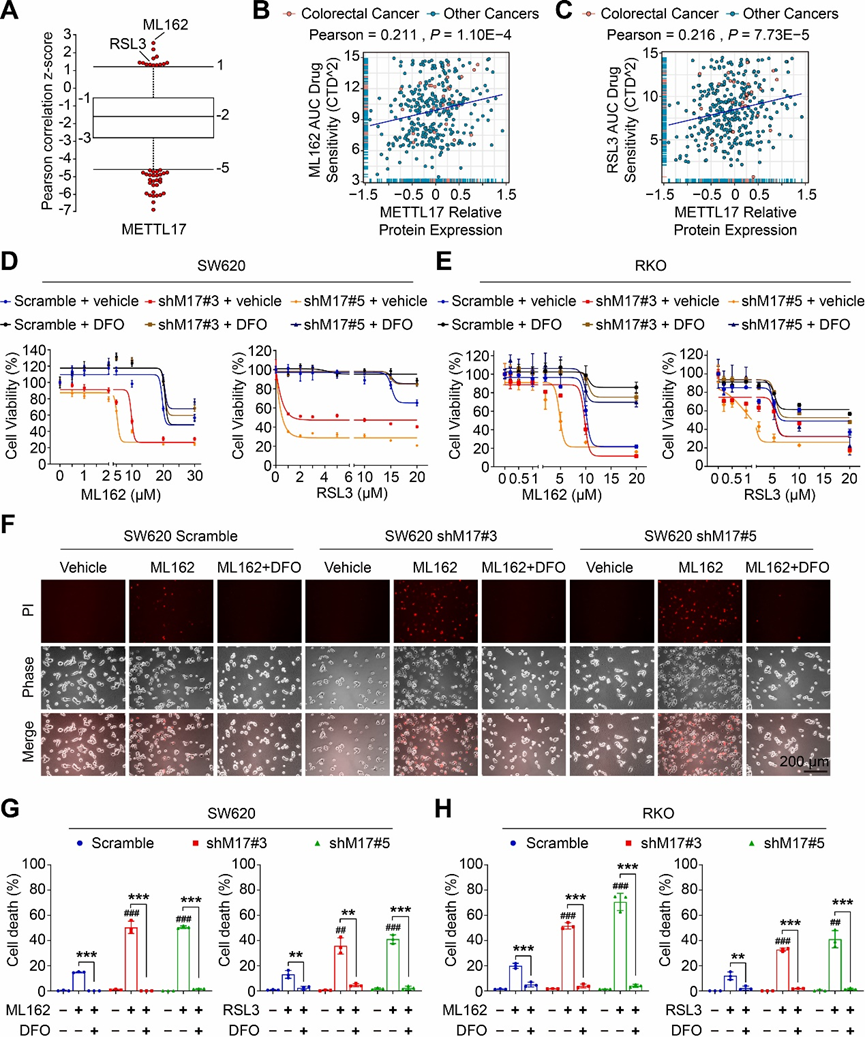
圖一:METTL17的表達與CRC細胞的鐵死亡抵抗呈正相關,敲低METTL17可增加CRC細胞對鐵死亡的敏感性。
2.2.METTL17在人結直腸癌中高表達,敲低METTL17可抑制結直腸癌細胞的增殖、遷移、侵襲和體外致癌特征
癌癥基因組圖譜(TCGA)分析發現,與正常結直腸組織相比,CRC組織中的METTL17 mRNA上調(圖2A)。相應的,METTL17蛋白在CRC組織中的表達高于其相鄰的正常組織(圖2B和C)。隨后研究人員評估了METTL17在CRC中的功能。首先,基于DepMap和CCLE數據庫,作者觀察到METTL17 mRNA表達水平在所有CRC細胞系中的分布不同,也表明了METTL17在CRC中的表達與其基因效應之間的相關性。其次,與正常結腸上皮細胞系相比,METTL17蛋白水平在CRC細胞系中顯著升高(圖2D)。在CRC細胞系中,RKO、SW620和DLD1具有較高的METTL17表達,因此選擇它們進行后續的表型實驗。
為了確定METTL17在CRC細胞進展中的作用,研究人員使用兩種不同的針對METTL17的短發夾RNA敲低了三個人CRC細胞系SW620、RKO和DLD1中的METTL17表達,并通過Western blot證實了敲低效率(圖2E)。結晶紫實驗顯示METTL17敲低CRC細胞中細胞增殖的顯著抑制(圖2F)。此外,細胞遷移和侵襲實驗表明,在RKO、SW620和DLD1細胞中,METTL17的下調顯著抑制了它們的跨膜遷移和通過基質包膜侵襲的能力(圖2G),表明METTL17敲低阻礙了CRC細胞的遷移和侵襲。細胞集落形成分析進一步表明,敲低METTL17能顯著抑制CRC細胞生長(圖2G)。此外,細胞周期分析表明,敲低METTL17導致G0/G1期延長和S期減少,表明在METTL17缺陷的CRC細胞中,G0/G1期的細胞周期停滯增加(圖2H)。
為了闡明METTL17調控CRC細胞存活的機制,研究人員對METTL17敲低和野生型CRC細胞進行了RNA-seq分析,然后進行了基因集富集分析(GSEA)。與觀察到的細胞周期停滯在G0/G1期的METTL17缺陷細胞相一致,GSEA顯示,與對照細胞相比,METTL17缺陷的CRC細胞在細胞周期階段轉換(圖2I)和DNA復制(圖2J)方面存在缺陷。此外,根據GSEA數據研究人員發現許多致癌特征基因集因METTL17缺陷而下調(圖2K)。受損的致癌基因包括ERBB2通路、LEF1通路、KRAS通路和MEK通路,其中,致癌基因的表達因METTL17基因敲除而下調。這些發現共同表明,敲低METTL17能顯著抑制CRC細胞的致癌活性。
此外,研究人員還發現恢復METTL17的表達部分逆轉了在METTL17敲低的SW620細胞中觀察到的受抑制的細胞增殖(圖2L)。綜上所述,這些結果強調了METTL17在人類CRC中過表達,并且敲低其表達可以抑制CRC細胞的增殖,遷移,侵襲,集落形成和細胞周期轉變,至少部分是通過破壞致癌通路來實現的。
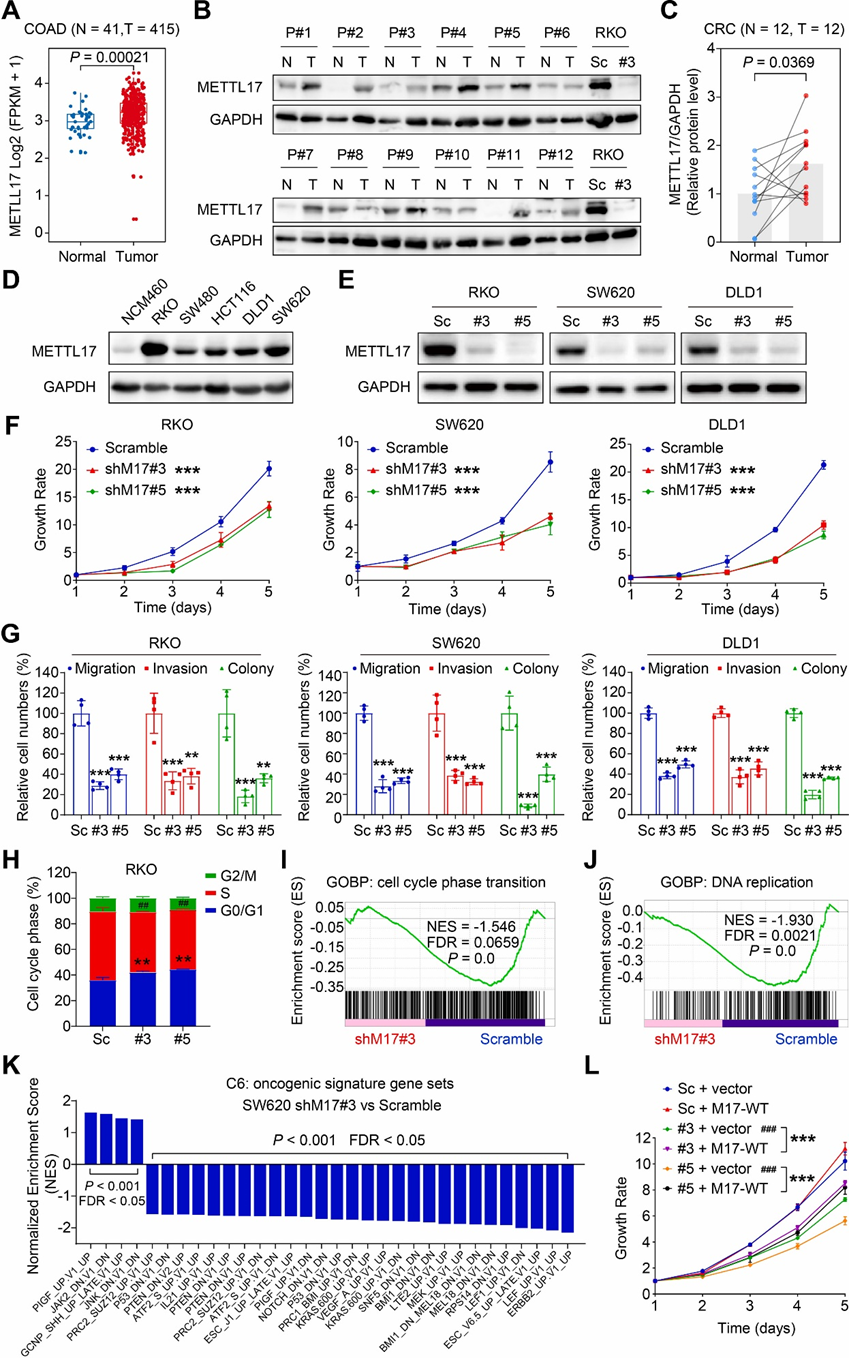
圖2:METTL17在CRC中高表達,體外敲低METTL17可抑制CRC細胞的增殖、遷移、侵襲和致癌特征。
3.METTL17缺陷抑制異種移植瘤的生長和AOM/DSS誘導的體內結直腸癌的發生
為了評估METTL17對體內CRC發生的影響,研究人員進行了異種移植腫瘤模型和AOM/DSS誘導的小鼠結腸炎相關的CRC模型。首先,將METTL17敲低的SW620細胞和對照SW620細胞分別注射到裸鼠皮下。結果顯示,METTL17敲低的腫瘤比對照腫瘤生長得慢得多,重量也小得多(圖3A、B、C)。Western blot和免疫染色分析表明,METTL17敲低的腫瘤顯示出β-Catenin的表達減少,而PCNA的蛋白水平和Ki-67陽性細胞的數量保持不變(圖3D、E、F)。這些結果表明,在異種移植腫瘤模型中,敲低METTL17通過非增殖依賴性途徑抑制腫瘤生長。
其次,研究人員通過AOM/DSS治療誘導了結腸炎相關的CRC。鑒于在METTL17敲除小鼠中觀察到的死亡率,實驗使用了METTL17雜合子(METTL17+/-),這些雜合子在結腸上皮中顯示出METTL17表達減少,而在結腸發育中沒有觀察到缺陷。有趣的是,研究人員發現METTL17+/-保護了小鼠,使其免受AOM/DSS誘導的CRC腫瘤發生,這可以通過腫瘤大小和腫瘤數量的減少得到證明(圖3G和H)。在METTL17+/-CRC樣本中,PCNA和β-Catenin的蛋白表達水平下調(圖3I和J)。接下來,研究人員通過對WT和METTL17+/-小鼠的結直腸腫瘤進行Ki-67和β-Catenin免疫染色,評估了細胞增殖率和惡性級別。結果表明,METTL17缺陷抑制了腫瘤進展,因為METTL17+/-小鼠表現出具有分化良好的腺管結構和β-Catenin彌漫性胞質分布的良性腺瘤,而WT小鼠表現出具有低分化癌和β-Catenin核定位的惡性腫瘤(圖3K)。這些結果表明,METTL17缺陷抑制異種移植腫瘤的生長和AOM/DSS誘導的體內結直腸癌進展。
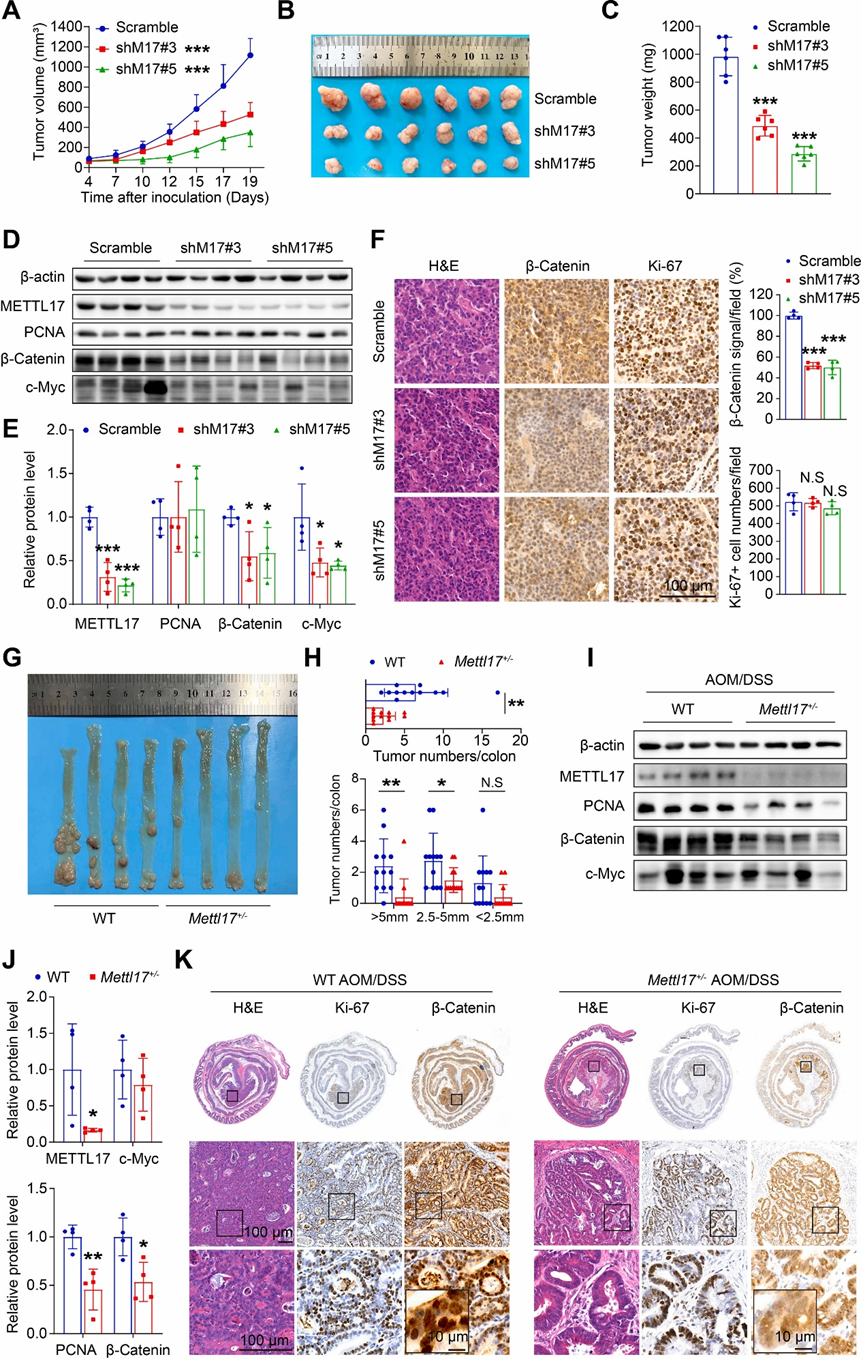
圖3.缺乏METTL17可減少異種移植腫瘤的生長和AOM/DSS誘導的體內CRC腫瘤發生。
4.敲低METTL17會破壞線粒體穩態,促進鐵死亡應激下的脂質過氧化和ROS生成
為了闡明METTL17影響鐵死亡敏感性和CRC發展的機制,作者研究了METTL17在癌細胞中的分布和功能。首先將RKO細胞分為線粒體和細胞質兩部分,通過Western blot檢測兩部分的內源性METTL17蛋白水平和細胞定位。研究結果表明METTL17主要在線粒體中表達(圖4A),這與之前的報道一致,即METTL17由核基因組編碼,是一種具有N端轉運肽的線粒體蛋白。其次,由于現有的METTL17抗體均不符合研究人員的免疫熒光質量標準,因此研究人員生成了一個C末端Flag標記的METTL17構建體,并在CRC細胞中過表達(圖4B)。在穩定表達3xHA-EGFP標記線粒體的RKO和SW620細胞系中外源性過表達METTL17-C-Flag后,通過熒光共聚焦顯微鏡觀察到METTL17-C-Flag在線粒體中的大量定位(圖4C)。因此,這些結果證實了METTL17的線粒體定位。
為了研究METTL17在線粒體中的功能,研究人員檢測了METTL17敲低細胞中能量代謝的變化。最初,研究人員測定了線粒體氧耗率(OCR),并觀察到METTL17敲低后OCR顯著受到抑制,表現為基礎呼吸、ATP生成、最大呼吸和備用容量減少,尤其是在shM17#5細胞中(圖4D)。GSEA分析一致表明,在METTL17缺陷細胞中,與氧化磷酸化相關的基因下調(圖4E),表明METTL17敲低導致線粒體功能障礙。隨后,研究人員評估了細胞外酸化率(ECAR),發現敲除METTL17的細胞糖酵解能力減弱,糖酵解儲備減少(圖4F)。此外,研究人員還發現敲低METTL17會顯著抑制癌細胞的葡萄糖攝取能力(圖4G),表明METTL17缺失細胞的葡萄糖供應受損。綜上所述,這些發現揭示了METTL17在維持線粒體穩態和糖酵解中的關鍵作用。
由于ROS和氧化脂質的積累是鐵死亡的決定因素,因此線粒體事件在這一受調節的細胞死亡過程中起著至關重要的作用。隨后,研究人員使用四種熒光探針分別通過流式細胞術和激光共聚焦顯微鏡評估活細胞中ROS和氧化脂質的細胞和線粒體水平。ML162處理3h后,SW620細胞脂質過氧化物含量增加,METTL17缺陷顯著增加鐵死亡脅迫下脂質過氧化物的形成。C11-BODIPY和MitoPerOx的紅色熒光轉變為綠色熒光(圖4H),表明METTL17敲低的癌細胞在鐵死亡應激過程中存在過度的細胞內和線粒體脂質過氧化。同時,如DCFH-DA和MitoSOX染色所示,在ML162處理后,METTL17敲低的癌細胞中,細胞內和線粒體ROS水平顯著升高(圖4I)。
此外,通過透射電子顯微鏡發現,METTL17敲低細胞中存在顯著的線粒體損傷,表現為ML162攻擊后線粒體收縮增加和嵴減少(圖4J和K)。研究人員接下來通過檢測關鍵鐵死亡標志物的蛋白水平,研究了METTL17調節鐵死亡的機制。令人驚訝的是,METTL17敲低顯著抑制了血紅素加氧酶1(HMOX1/HO-1)的表達,并顯著上調了ML162處理后NRF2的表達(圖4M)。然而,在mettl17敲低的細胞中,鐵死亡的關鍵調節因子,包括xCT、GPX4和ACSL4,在基礎和ML162處理條件下保持不變(圖4M)。此外,我們發現單獨敲低METTL17足以增加NADH水平(圖4L)。然而,在鐵死亡應激下,METTL17敲低加速了NADH的下降(圖4L),表明在鐵死亡期間,METTL17缺陷細胞中的抗氧化系統被破壞。此外,單獨敲低METTL17并不影響氧化還原穩態相關基因的表達。總之,這些結果表明,METTL17介導的線粒體穩態對維持CRC生長和抵御鐵死亡至關重要。
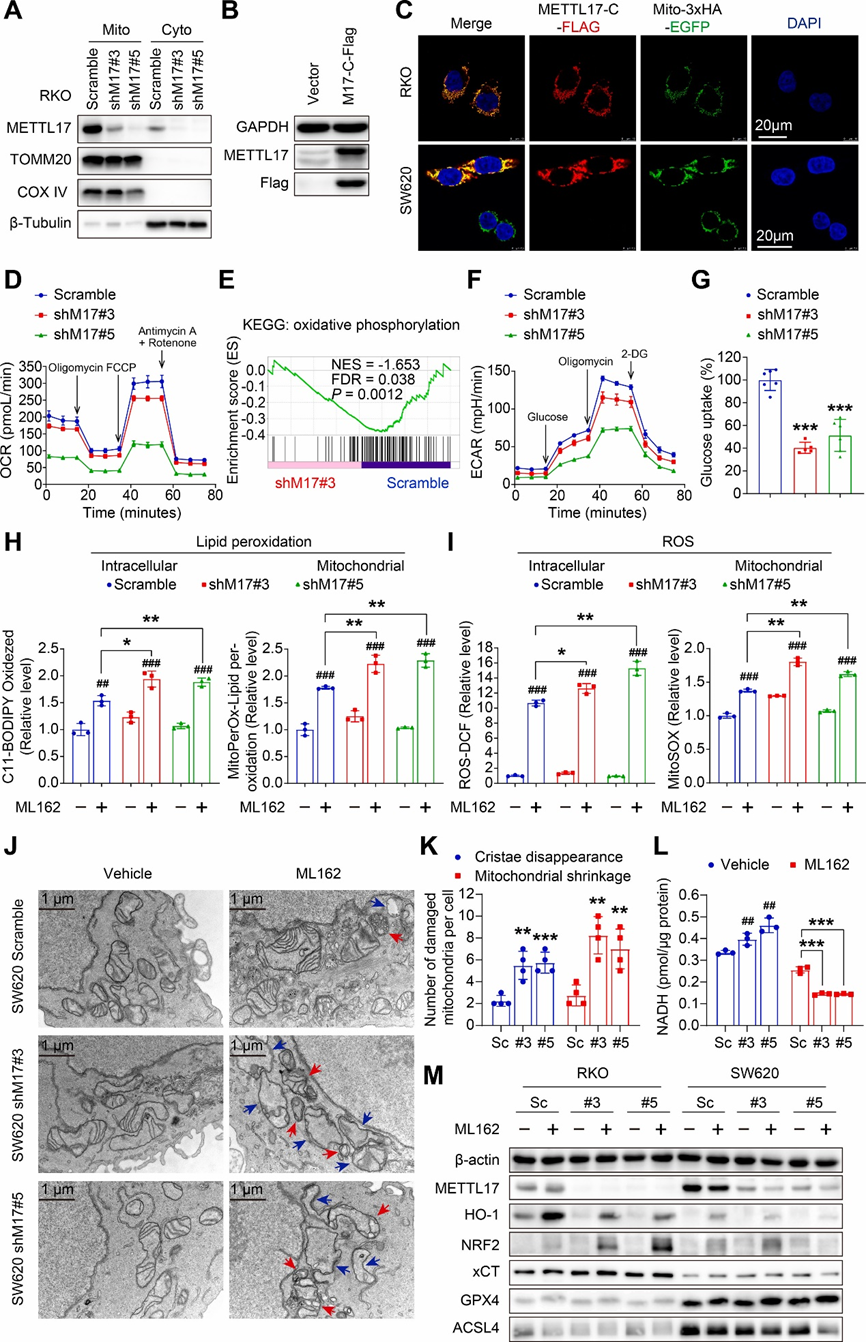
圖4.METTL17的缺失會導致線粒體功能嚴重失調,并促進鐵死亡線粒體脂質過氧化。
5.METTL17通過線粒體RNA甲基化的方式控制CRC的線粒體翻譯
METTL17被認為是mESCs中線粒體基因表達的調節因子。然而,目前尚不清楚METTL17是否是癌細胞中線粒體基因表達所必需的。首先,研究人員對DepMap數據庫中METTL17的前100個共依賴基因進行了全面分析,DepMap數據庫通過全基因組匯總的CRISPR-Cas9敲除篩選,對700多個癌癥細胞系的基因依賴性進行了評分,并對這些基因進行了基因本體(GO)分析。GO分析顯示METTL17共依賴基因編碼蛋白顯著富集于線粒體內膜和線粒體核糖體。這些蛋白在協調線粒體基因表達和翻譯中發揮不可或缺的作用,影響多種過程,如線粒體體生物發生、NADH、泛醌和醌活性(圖5A)。為了驗證METTL17參與線粒體基因調控,研究人員使用Western blot檢測了13個線粒體蛋白編碼基因的蛋白水平。結果表明,在CRC細胞中,METTL17敲低導致CRC細胞中線粒體蛋白的整體減少(圖5B和C),然而,mRNA水平沒有同時發生改變。這表明METTL17對于維持癌細胞中正常的線粒體基因表達是必需的。
雖然之前的研究表明,METTL17與12S mt-rRNA結合并介導mESCs中m4C840和m5C842甲基化,但其在其他甲基轉移酶活性,特別是在mt-tRNAs和mt-mRNAs中的潛在作用仍不清楚。為了填補這一知識缺口,研究人員對線粒體RNA進行了LC-MS/MS分析,以探索METTL17敲低的CRC細胞中甲基化模式的變化(圖5D)。研究結果顯示,與對照細胞相比,shM17#5中m4C水平顯著降低至約20%,而與METTL17相關的另一種RNA修飾m5C在METTL17敲低細胞中降低至約75%(圖5E)。有趣的是,m3C(先前與mt-tRNA中的METTL8相關的修飾)在METTL17敲低的細胞中下降到大約70%(圖5E),這表明METTL17可能是mt-tRNA中m3C的一個尚未確定的甲基化調節因子。此外,敲低METTL17也降低了m7G和m6A的水平(圖5E),表明METTL17可能是線粒體RNA甲基化的多功能調節因子。重要的是,敲低METTL17不影響其他線粒體甲基轉移酶的表達。綜上所述,表明METTL17通過調節CRC細胞中12S mt-rRNA中的m4C和m5C,mt-tRNA中的m3C和m7G,以及mt-mRNA中的m6A的甲基化來調控線粒體基因的表達。
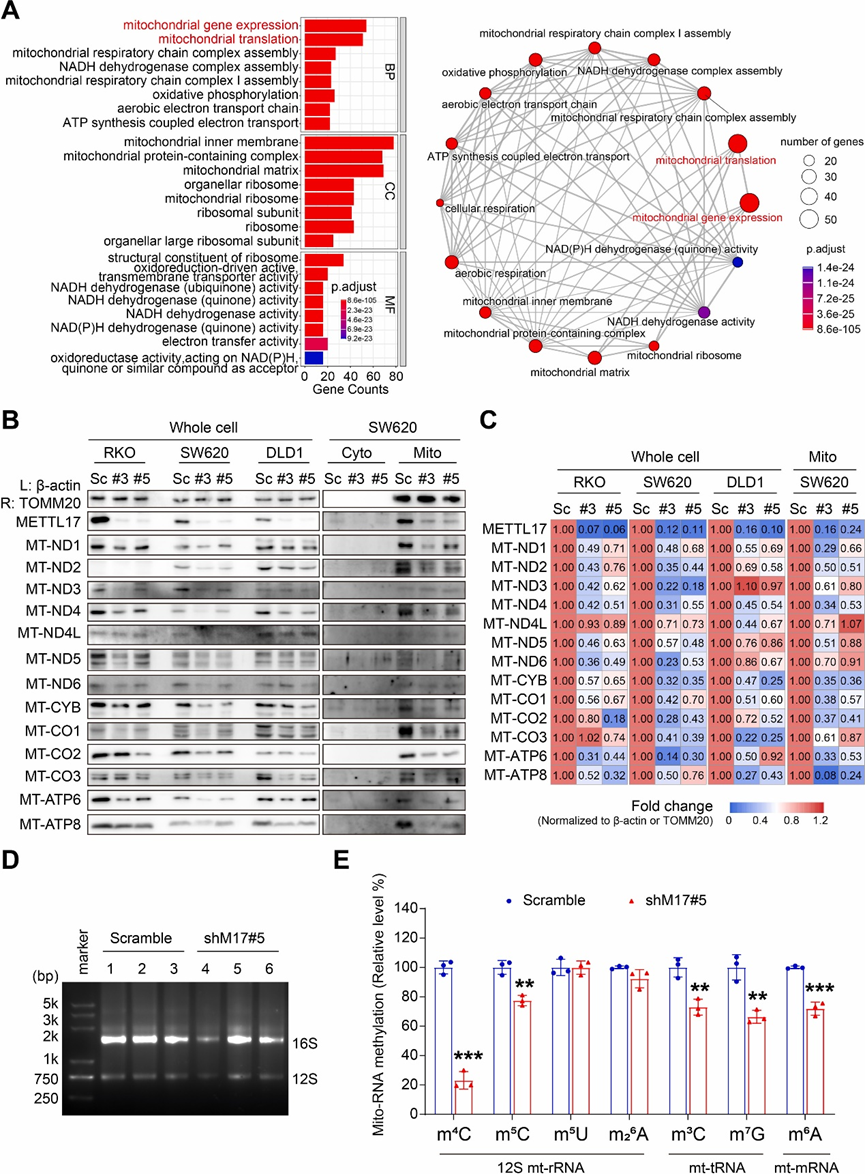
圖5:在CRC中,METTL17是線粒體RNA甲基化方式下全局線粒體翻譯所必需的。
6.與METTL17相互作用的蛋白調控線粒體基因表達和鐵死亡
多種蛋白有利于線粒體基因表達和蛋白翻譯。為了揭示METTL17的相互作用伙伴,在慢病毒過表達METTL17-Flag的RKO細胞中,分別用Flag免疫沉淀(IP)富集線粒體、細胞質和全細胞蛋白裂解物(圖6A)。通過質譜(MS)對富集的蛋白質進行鑒定,以覆蓋度大于50%和唯一肽段大于20為標準進行數據過濾。人類線粒體蛋白質組數據庫Human MitoCarta包含1136個同種人線粒體蛋白質,利用該數據庫生成的韋恩圖顯示了26個與METTL17具有高親和力的線粒體蛋白(圖6B)。GO富集分析表明,這些蛋白在線粒體基因表達和線粒體翻譯中發揮重要作用。值得注意的是,IP-Western blot分析顯示METTL17與MRPS9,MRPS22和MRPS35之間有很強的親和力,而與MRPL15和MRPL11之間的相互作用較弱(圖6C)。這表明METTL17與線粒體核糖體的小亞基(MSSU),而不是線粒體核糖體的大亞基(MLSU)之間存在特定的相互作用。除了MSSU,研究還發現METTL17和LRPPRC之間存在高度相互作用(圖6C),LRPPRC是一種線粒體蛋白,對線粒體mRNA的多聚腺苷酸化和翻譯協調至關重要。
為了探索METTL17相互作用蛋白是否也調節CRC細胞中的鐵死亡和細胞存活,研究人員在RKO細胞中使用慢病毒shRNA敲低LRPPRC、MRPS9、MRPS22和MRPS35。值得注意的是,與METTL17敲低實驗相似,敲低這些METTL17相互作用蛋白使癌細胞對ML162誘導的鐵死亡敏感,并抑制CRC中的細胞增殖(圖6D-G)。DepMap分析顯示,METTL17和LRPPRC、MRPS9、MRPS22和MRPS35之間的基因效應具有強相關性,突出了METTL17相關的細胞功能在癌細胞生存和鐵死亡防御中的重要性(圖6D-G)。CTRP和DepMap分析表明,LRPPRC、MRPS9、MRPS22和MRPS35的表達升高與對ML162和RSL3的耐藥性相關。此外,敲低METTL17并不影響這些相互作用蛋白的表達。值得注意的是,這些發現揭示了METTL17相互作用蛋白在控制癌細胞生存方面的高度相關性。
綜上所述,這些結果確定了METTL17及其相互作用蛋白共同調節線粒體基因的表達,從而有助于CRC細胞的鐵死亡防御和細胞存活。
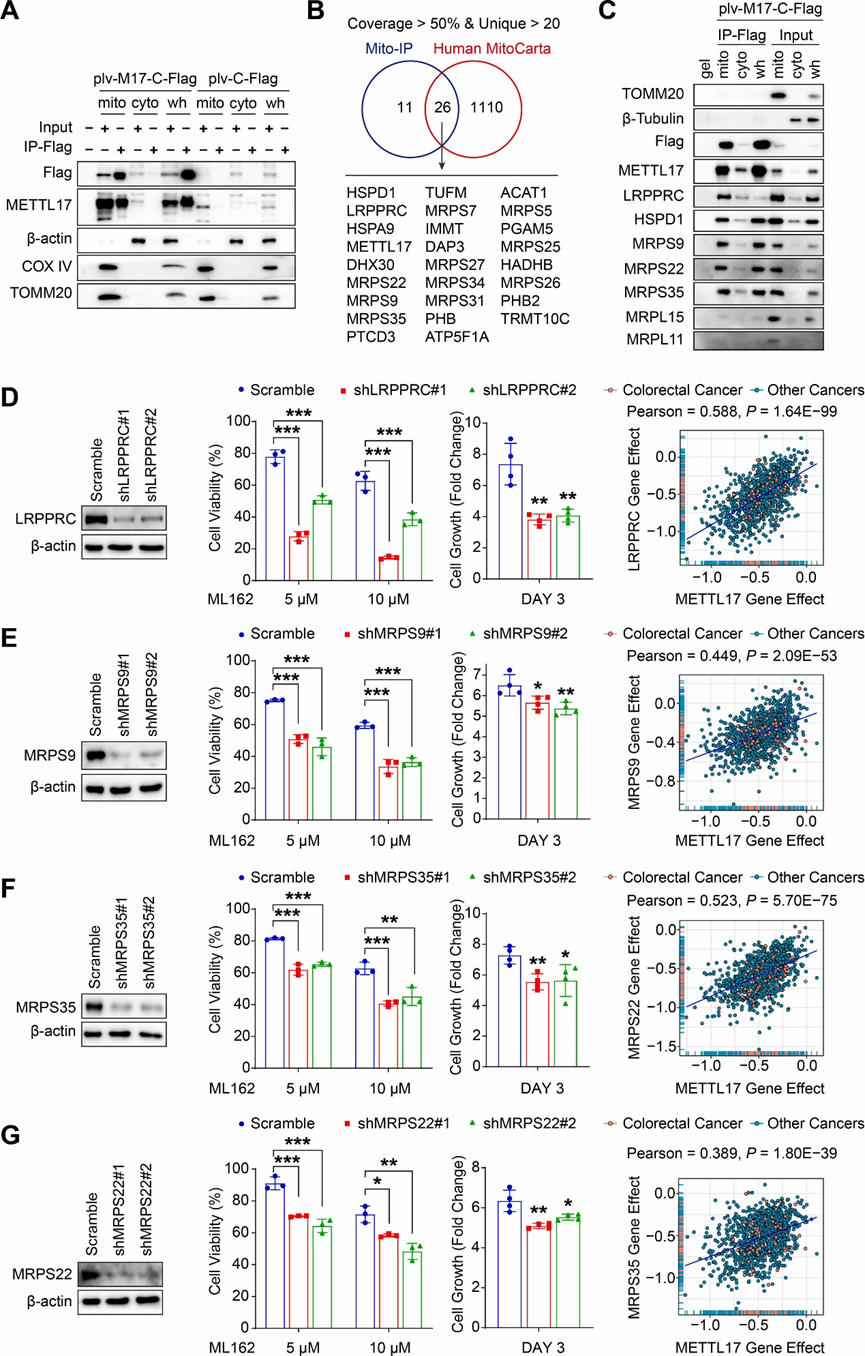
圖6:靶向METTL17相互作用蛋白使癌細胞對鐵死亡敏感
7.靶向METTL17和鐵死亡的聯合治療抑制CRC腫瘤的發生
由于單獨敲低METTL17在體內抑制了SW620異種移植瘤的生長,并且在體外使CRC細胞對GPX4抑制敏感,研究人員進一步研究了聯合METTL17抑制和鐵死亡誘導對CRC治療的治療潛力。首先,研究人員研究了敲低METLL17是否增加CRC細胞對鐵死亡誘導劑的敏感性。事實上,METTL17敲低使SW620異種移植瘤對ML162治療增敏,表現出對CRC治療的協同作用,這一點可以從腫瘤體積、大小和重量的減小中得到證明(圖7A和B)。重要的是,與利普司他丁-1(Lip-1,一種通過阻斷脂質過氧化而建立的鐵死亡抑制劑)聯合治療減弱了ML162治療下METTL17敲低腫瘤的生長抑制作用(圖7A和B)。ML162處理不影響這些腫瘤中的Ki-67染色,但與對照腫瘤相比,在METTL17敲低的腫瘤中,4-HNE染色(脂質過氧化的標志物)顯著增加(圖7C和D)。相反,在ML162處理的METTL17敲低的腫瘤中,給藥Lip-1減弱了脂質過氧化的增強(圖7C和D)。這些結果表明,同時抑制METTL17和鐵死亡誘導劑可通過增強鐵死亡在CRC治療中提供協同效應。
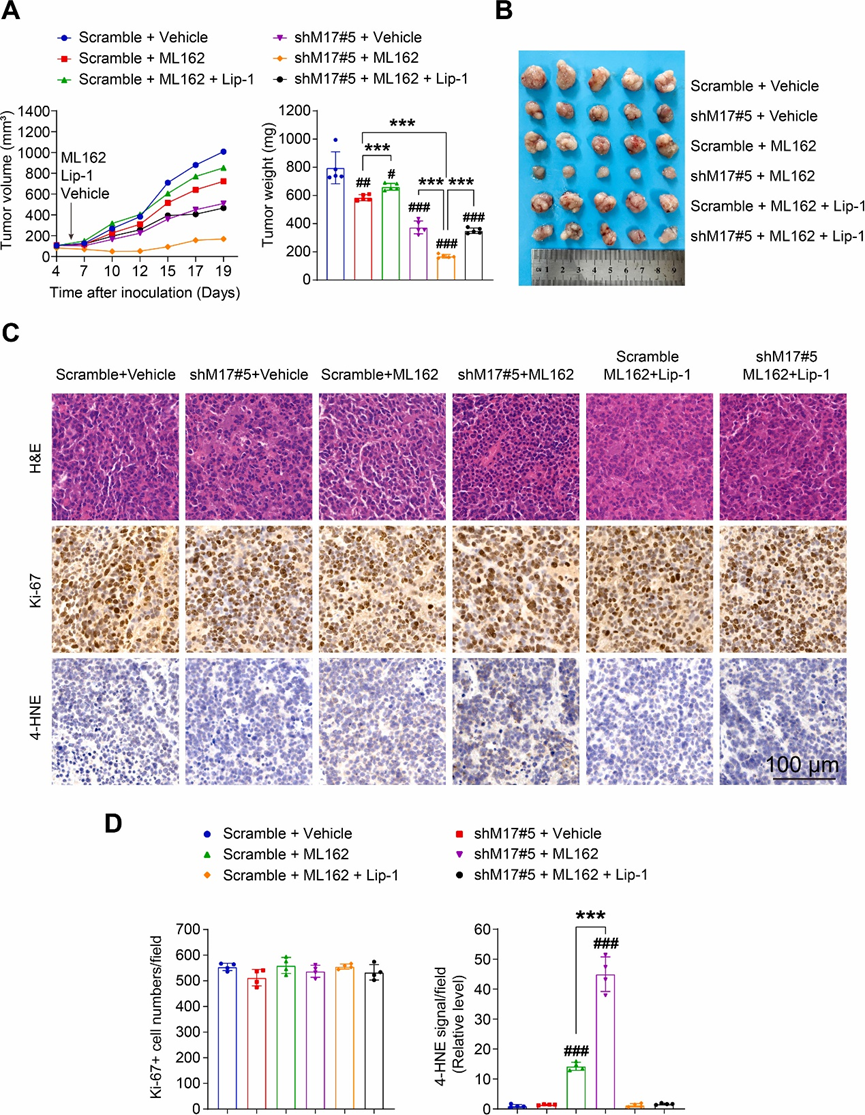
圖7:靶向METTL17和鐵死亡的聯合治療可抑制CRC腫瘤的發生
實驗方法:
抗體和蛋白免疫印跡、跨孔遷移和侵襲試驗、建立小鼠模型、異種移植腫瘤生長實驗、免疫組化分析、免疫熒光、RNA測序、線粒體RNA甲基化檢測、Seahorse能量代謝分析
參考文獻:
Li H, Yu K, Hu H, Zhang X, Zeng S, Li J, Dong X, Deng X, Zhang J, Zhang Y. METTL17 coordinates ferroptosis and tumorigenesis by regulating mitochondrial translation in colorectal cancer. Redox Biol. 2024 Feb 13;71:103087. doi: 10.1016/j.redox.2024.103087. Epub ahead of print. PMID: 38377789; PMCID: PMC10884776.






