通過(guò)體外轉(zhuǎn)錄的mRNA挽救p53功能阻礙高級(jí)別漿液性卵巢癌的生長(zhǎng)
高級(jí)別漿液性卵巢癌(HGSOC)是最致命的婦科惡性腫瘤。它與腫瘤間質(zhì)密切相互作用,生長(zhǎng)迅速,廣泛轉(zhuǎn)移,并表現(xiàn)出侵襲性的過(guò)程。卵巢癌(OC)細(xì)胞停留在腹膜腔內(nèi),僅播散到間皮襯里表面。目前的標(biāo)準(zhǔn)治療包括細(xì)胞減瘤手術(shù)和化療。然而,大約70%的患者在手術(shù)和鉑類化療后3年內(nèi)復(fù)發(fā),并死于疾病進(jìn)展。
腫瘤蛋白p53(TP53)基因是人類最常發(fā)生突變的腫瘤抑制基因,多數(shù)通過(guò)點(diǎn)突變,即氨基酸替換導(dǎo)致腫瘤蛋白p53與DNA的結(jié)合中斷。因此,p53通過(guò)對(duì)抗細(xì)胞應(yīng)激和DNA損傷來(lái)保護(hù)人類基因組。許多研究表明,腫瘤細(xì)胞含有功能失活的p53,其作用機(jī)制涉及DNA損傷,從而導(dǎo)致野生型(WT)p53的激活,因此腫瘤細(xì)胞對(duì)化療藥物具有耐藥性。癌癥基因組圖譜研究網(wǎng)絡(luò)揭示,高達(dá)96%的HGSOC病例具有失活或截短的TP53。此外,TP53突變似乎是腫瘤發(fā)生的早期事件,可能在OC的前體病變中,支持TP53突變作為這種惡性腫瘤的驅(qū)動(dòng)因素的重要性。目前已經(jīng)開(kāi)發(fā)了一些小分子來(lái)對(duì)抗p53功能的喪失,主要是通過(guò)穩(wěn)定p53的天然構(gòu)象,如PRIMA-1,它可以重新激活突變的p53,誘導(dǎo)癌細(xì)胞凋亡,目前正在臨床試驗(yàn)中。然而,不同的研究提供了與用于p53再激活的小分子相關(guān)的脫靶效應(yīng)的證據(jù)。因此,是否脫靶活動(dòng)或p53功能的恢復(fù)是治療反應(yīng)的起源目前正在研究中。該研究發(fā)表在《Cancer Communications》,IF:16.2。
技術(shù)路線:

主要研究結(jié)果:
1. HGSOC細(xì)胞中基于mRNA的p53再激活誘導(dǎo)細(xì)胞周期停滯和細(xì)胞死亡
作者的目的是通過(guò)用p53 mRNA轉(zhuǎn)染HGSOC細(xì)胞系和原代細(xì)胞來(lái)挽救不同臨床前模型中p53的功能。在OVCAR-8細(xì)胞中,低量的p53-mRNA(10-250 ng)強(qiáng)烈誘導(dǎo)p53蛋白表達(dá)(圖1A)。與對(duì)照組相比,在轉(zhuǎn)染后24小時(shí),在100~500 ng p53 mRNA時(shí),G1期細(xì)胞增加(圖1B),支持p53活性的再激活。在低劑量的p53 mRNA(≥0.1μg)下,細(xì)胞周期抑制因子p21,p16和p27的強(qiáng)烈誘導(dǎo)與關(guān)鍵調(diào)節(jié)因子(如PLK1,Aurora A,CDK1和Cyclin A/B)的下調(diào)相平行,使用基于載體的p53重表達(dá)證實(shí)了作者的結(jié)果(圖1C)。這些觀察結(jié)果與0.5μg劑量的細(xì)胞活力在48小時(shí)后顯著下降約2倍相關(guān)(圖1D),與未處理對(duì)照相比,伴隨著不同細(xì)胞死亡指標(biāo)的上升,如Puma,Noxa和Fas,裂解的PARP,裂解的Caspase-3(圖1C),以及Caspase 3/7活性的增加(圖1E)和膜聯(lián)蛋白染色(圖1F)。克隆形成能力的喪失是通過(guò)增加p53-mRNA的濃度來(lái)誘導(dǎo)的(圖1G)。作者還進(jìn)行了細(xì)胞毒性試驗(yàn),該試驗(yàn)證實(shí)了之前通過(guò)凋亡和集落形成試驗(yàn)觀察到的IVT P53 mRNA對(duì)卵巢癌細(xì)胞的影響(圖1H)。總之,作者的觀察表明,在不同的HGSOC細(xì)胞系中,通過(guò)轉(zhuǎn)染野生型p53 mRNA來(lái)挽救p53功能會(huì)誘導(dǎo)細(xì)胞死亡。
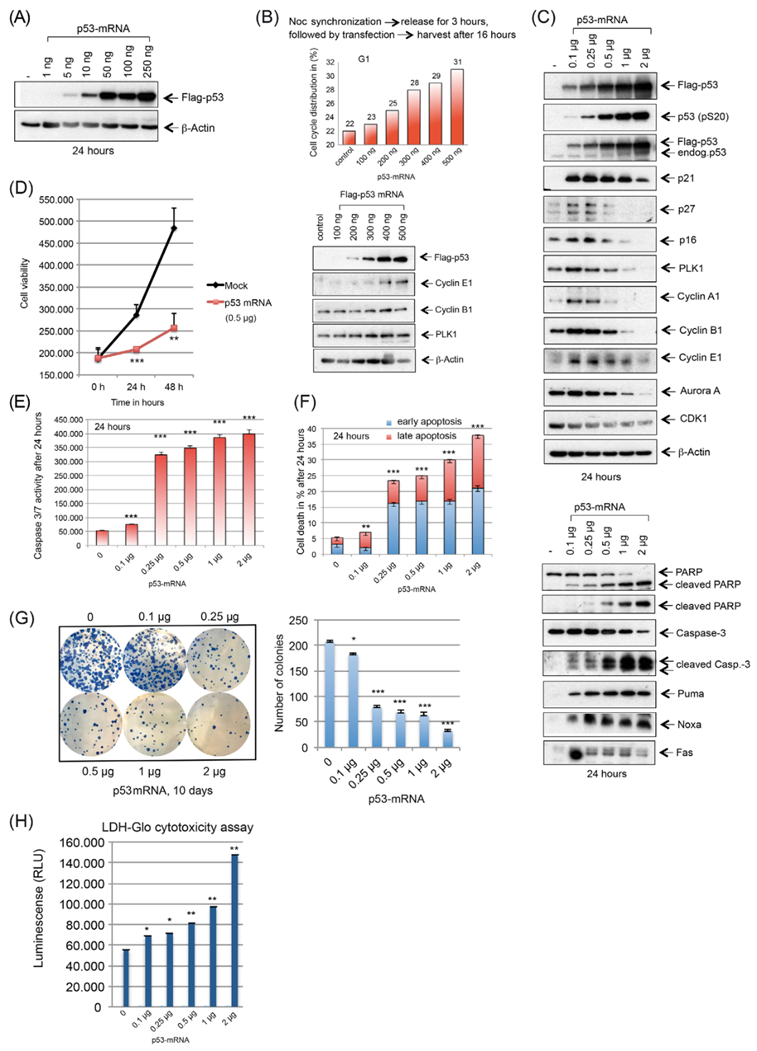
圖1 脂質(zhì)體轉(zhuǎn)染體外轉(zhuǎn)錄的WT p53 mRNA在HGSOC細(xì)胞系OVCAR-8中誘導(dǎo)細(xì)胞周期阻滯和凋亡
2. 在HGSOC細(xì)胞系OVCAR-8中,恢復(fù)p53可降低染色體不穩(wěn)定性
染色體不穩(wěn)定性是OC的基本特征,并且大多數(shù)人OC細(xì)胞表現(xiàn)出非整倍體。OVCAR-8細(xì)胞系是一種超二倍體細(xì)胞系,具有高度的數(shù)值復(fù)雜性和介于50-59的染色體模態(tài)數(shù)。因此,作者的目的是確定恢復(fù)野生型p53的功能是否可以將細(xì)胞中的染色體數(shù)量減少到接近二倍體的狀態(tài)。因此,每隔兩天用低劑量的p53-mRNA處理細(xì)胞,持續(xù)28天,并在孵育期結(jié)束時(shí)評(píng)估染色體的分布(圖2A-B)。當(dāng)野生型p53恢復(fù)后,平均染色體數(shù)目從53減少到47(圖2C-D)。
HGSOC亞型的特征是由多種因素導(dǎo)致的復(fù)制應(yīng)激增加,包括TP53的頻繁缺失。TP53功能的喪失通過(guò)損害DNA損傷反應(yīng)機(jī)制來(lái)促進(jìn)復(fù)制應(yīng)激,這可能部分解釋了在OVCAR-8細(xì)胞中觀察到的遺傳不穩(wěn)定性增加。為了量化p53功能恢復(fù)前后OVCAR-8細(xì)胞中復(fù)制應(yīng)激的程度,作者評(píng)估了Ser139-磷酸化H2AX焦點(diǎn)(γ-H2AX)作為復(fù)制應(yīng)激的可靠標(biāo)記,以及在7和14天后DNA雙鏈斷裂的存在。作者發(fā)現(xiàn),在OVCAR-8和p53 mRNA處理的OVCAR-8細(xì)胞中,γ-H2AX焦點(diǎn)的基線水平在處理14天后從平均8個(gè)焦點(diǎn)顯著下降到3個(gè)焦點(diǎn)(圖2E)。這一結(jié)果進(jìn)一步證明了p53在維持HGSOC細(xì)胞基因組完整性中發(fā)揮的關(guān)鍵作用,最有可能是通過(guò)對(duì)抗復(fù)制應(yīng)激。
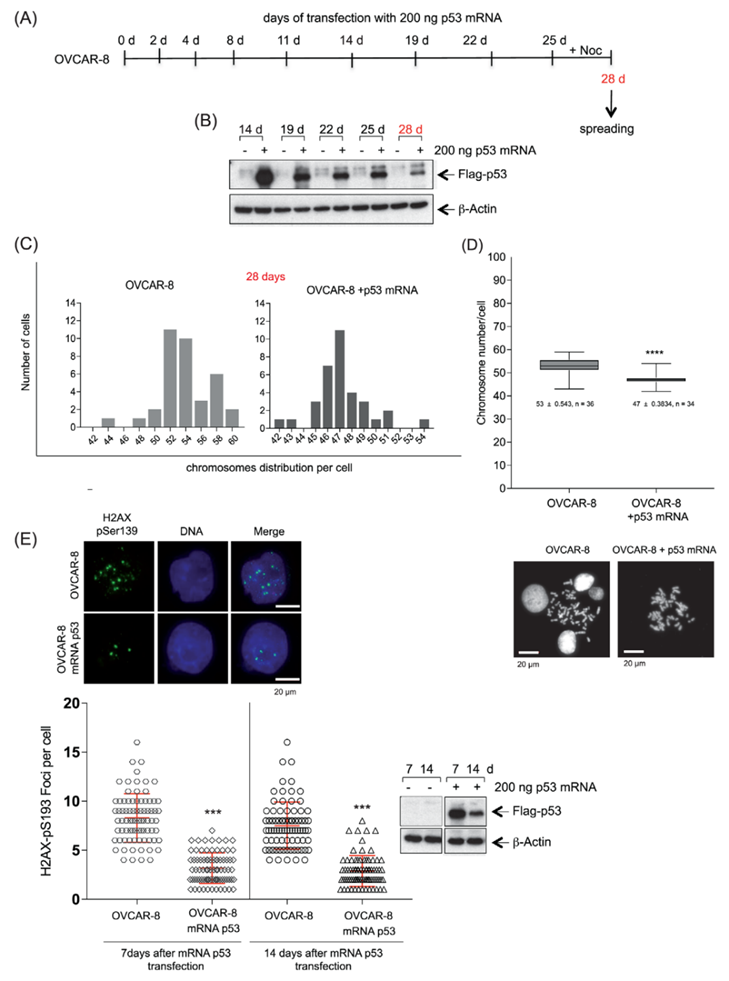
圖2 恢復(fù)p53功能可降低OVCAR-8細(xì)胞的染色體不穩(wěn)定性
3. 在原代HGSOC細(xì)胞中,基于mRNA的p53功能挽救誘導(dǎo)細(xì)胞周期停滯和細(xì)胞死亡
為了進(jìn)一步驗(yàn)證p53表達(dá)在臨床前的挽救作用,作者比較了p53 mRNA轉(zhuǎn)染在正常卵巢和HGSOC細(xì)胞中的作用。除角質(zhì)形成細(xì)胞外,所有原始樣本均檢測(cè)到p53的表達(dá)(圖3A)。對(duì)同一患者的HGSOC和相應(yīng)的正常卵巢組織進(jìn)行的第一次比較顯示,腫瘤細(xì)胞中p53的表達(dá)較高,盡管轉(zhuǎn)染的p53 mRNA的量相同(圖3A)。對(duì)其他患者來(lái)源組織的分析證實(shí),所有腫瘤樣本中的p53表達(dá)和caspase 3/7活性(圖3B)均顯著高于正常卵巢細(xì)胞中的相應(yīng)水平。
WB檢測(cè)揭示了抑制劑,p21,p16和p27的上調(diào)(圖3C)和凋亡(圖3D),在p53-mRNA-轉(zhuǎn)染的原代HGSOC細(xì)胞中,與它們的正常對(duì)應(yīng)細(xì)胞相比,凋亡更強(qiáng),與HGSOC克隆數(shù)量的更明顯減少相關(guān)(圖3E),這被LDH-Glo細(xì)胞毒性實(shí)驗(yàn)證實(shí)(圖3F)。對(duì)不同HGSOC患者來(lái)源的類器官的分析也表明,在3D細(xì)胞培養(yǎng)條件下,p53 mRNA處理后,體積顯著減小,caspase 3/7活性增加(圖3G)。綜上所述,雖然p53的表達(dá)降低了兩種原代細(xì)胞的活(正常細(xì)胞vs. HGSOC),但與正常細(xì)胞相比,在原代HGSOC細(xì)胞中的作用顯著更強(qiáng),這可能是由于p53在腫瘤細(xì)胞中的水平升高。
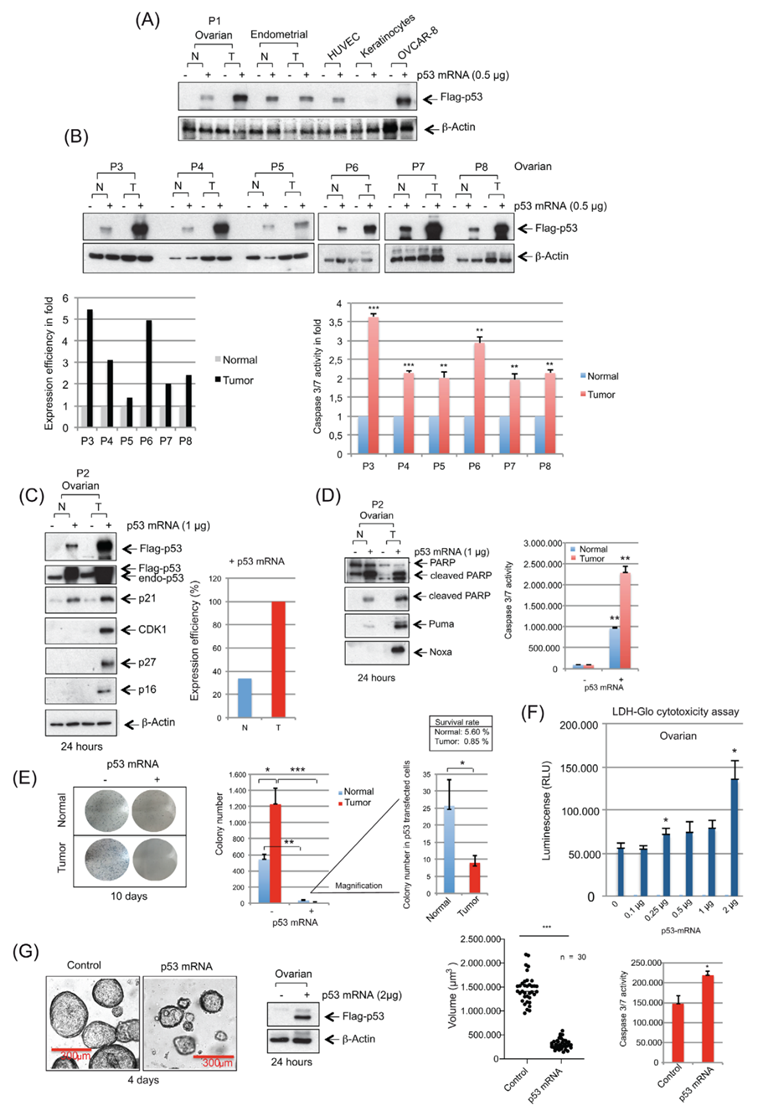
圖3 脂質(zhì)體轉(zhuǎn)染p53-mRNA導(dǎo)致p53在原代HGSOC細(xì)胞中的表達(dá)高于其正常對(duì)照。
4. 拯救野生型p53功能后OVCAR-8細(xì)胞的轉(zhuǎn)錄組改變
在HGSOC來(lái)源的細(xì)胞系和原代細(xì)胞中,作者觀察到細(xì)胞增殖活性降低,細(xì)胞死亡增加,這支持了mRNA轉(zhuǎn)染后p53重新表達(dá)后恢復(fù)p53功能的模型。為了加深作者對(duì)潛在生物學(xué)過(guò)程的理解,并以相對(duì)無(wú)偏倚的方式解決這方面的問(wèn)題,作者在三個(gè)獨(dú)立的實(shí)驗(yàn)中轉(zhuǎn)染1μg p53 mRNA或模擬對(duì)照(EGFP mRNA)。總共有25540個(gè)人類基因在轉(zhuǎn)染后24小時(shí)被RNA測(cè)序分析。考慮到組間差異,兩組均使用非配對(duì)T檢驗(yàn)進(jìn)行比較。轉(zhuǎn)錄組分析顯示,3061個(gè)轉(zhuǎn)錄本被上調(diào),1662個(gè)被下調(diào)(圖4A-B)。使用IPA軟件對(duì)這些重要基因進(jìn)行進(jìn)一步分析,以確定與p53 mRNA轉(zhuǎn)染相關(guān)的過(guò)度表達(dá)的經(jīng)典通路(圖4C)。
與p53作為腫瘤抑制因子參與誘導(dǎo)細(xì)胞周期停滯和凋亡的促凋亡功能相一致,作者的IPA揭示了p53 mRNA轉(zhuǎn)染后的幾個(gè)相關(guān)通路的過(guò)度表達(dá),如“p53信號(hào)”、“凋亡信號(hào)”和幾個(gè)“細(xì)胞周期”通路(圖4C)。為了證實(shí)這些發(fā)現(xiàn),作者研究了參與IPA“p53信號(hào)”通路的所有基因,作者意識(shí)到其中大多數(shù)(51/81,63%)在FDR q<0.05和絕對(duì)FC>1.5時(shí)存在差異表達(dá)(圖4D)。值得注意的是,p53信號(hào)通路的大多數(shù)已知下游靶點(diǎn)通過(guò)p53 mRNA轉(zhuǎn)染協(xié)同上調(diào)(圖4D)。作者對(duì)p53信號(hào)通路中選擇的蛋白(包括p21(CDKN1A)、MDM2、Puma(BBC3)、p73、FAS(CD95)和CDK1)進(jìn)行WB,進(jìn)一步驗(yàn)證了這些結(jié)果(圖4E)。它們?cè)?span>OVCAR-8細(xì)胞中的表達(dá)被p53-mRNA顯著上調(diào)或下調(diào),這與轉(zhuǎn)錄組學(xué)分析一致。
一些“細(xì)胞周期”途徑,包括“染色體復(fù)制的細(xì)胞周期控制”,“細(xì)胞周期:G2/M DNA損傷檢查點(diǎn)調(diào)節(jié)”,和“細(xì)胞周期蛋白和細(xì)胞周期調(diào)節(jié)”,以及“Polo樣激酶的有絲分裂作用”,它們顯示了整體下調(diào)(負(fù)z值)(圖4C)。值得注意的是,細(xì)胞衰老途徑也被上調(diào),并可能在誘導(dǎo)凋亡的同時(shí)促進(jìn)細(xì)胞死亡(圖4C)。
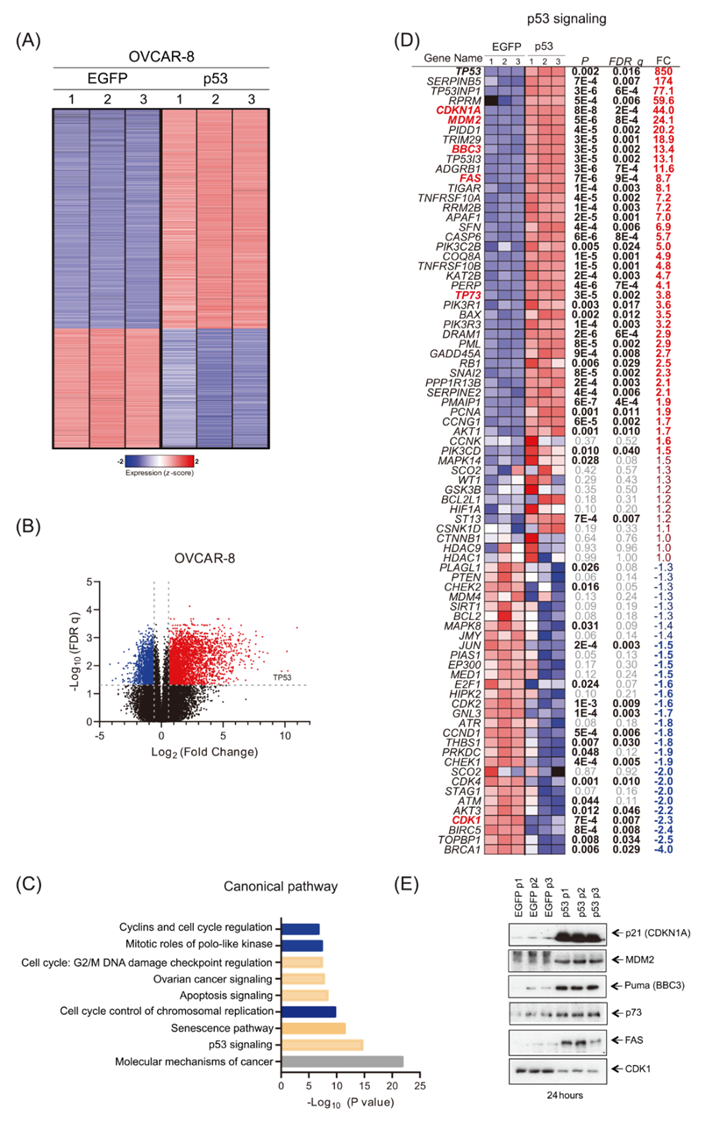
圖4 p53 mRNA轉(zhuǎn)染的OVCAR-8細(xì)胞與模擬轉(zhuǎn)染的OVCAR-8細(xì)胞相比,差異表達(dá)基因的鑒定
接下來(lái),作者對(duì)來(lái)自患者1的原代HGSOC細(xì)胞和OVCAR-8細(xì)胞進(jìn)行了轉(zhuǎn)錄組比較,OVCAR-8細(xì)胞和患者1的原代HGSOC細(xì)胞均轉(zhuǎn)染了p53-mRNA(圖5A)。主要樣本之間的高變異性導(dǎo)致多重檢驗(yàn)FDR校正后的低顯著性。因此,作者認(rèn)為原代HGSOC細(xì)胞的轉(zhuǎn)錄顯著性P<0.01和FC>1.5。共有156個(gè)轉(zhuǎn)錄本被上調(diào),115個(gè)被下調(diào)(圖5B-C)。來(lái)自原代HGSOC細(xì)胞的幾個(gè)基因是顯著的,并且與在OVCAR-8細(xì)胞中發(fā)現(xiàn)的通路相似(圖5D),支持兩個(gè)數(shù)據(jù)集的相關(guān)性。
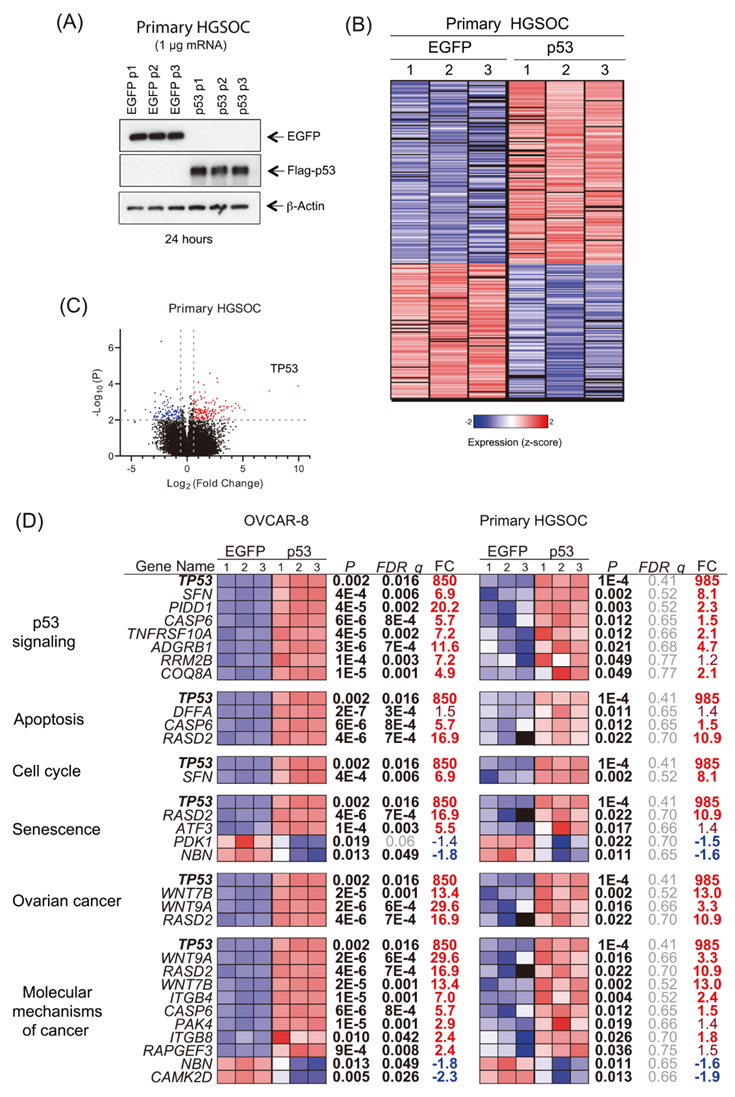
圖5 原代HGSOC細(xì)胞差異表達(dá)基因分析。
與p53在OC發(fā)育中的重要功能一致,作者的IPA顯示了“卵巢癌信號(hào)”通路中的多個(gè)轉(zhuǎn)錄改變。該通路中的許多基因(55/76,72%),包括Wnt/β-catenin信號(hào)通路,被顯著地解除調(diào)控(圖6A-B)。Wnt/β-catenin通路通過(guò)異常激活Wnt/β-catenin信號(hào)通路,導(dǎo)致catenin過(guò)度激活,從而促進(jìn)卵巢癌的化療耐藥、轉(zhuǎn)移和腫瘤干細(xì)胞的自我更新。p53 mRNA的處理導(dǎo)致AXIN1的表達(dá)上調(diào),AXIN1是β-catenin破壞復(fù)合物成分的腳手架蛋白,包括APC, CK1PP2A和GSK3β。此外,在frizzled受體、Wnt和TCF/LEF家族成員中觀察到異常(圖6A-B)。總之,在p53-mRNA處理的細(xì)胞中,這些轉(zhuǎn)錄改變導(dǎo)致β-catenin的適度減少(圖6B),并通過(guò)TCF/LEF報(bào)告基因?qū)嶒?yàn)降低Wnt信號(hào)的活性(圖6C)。
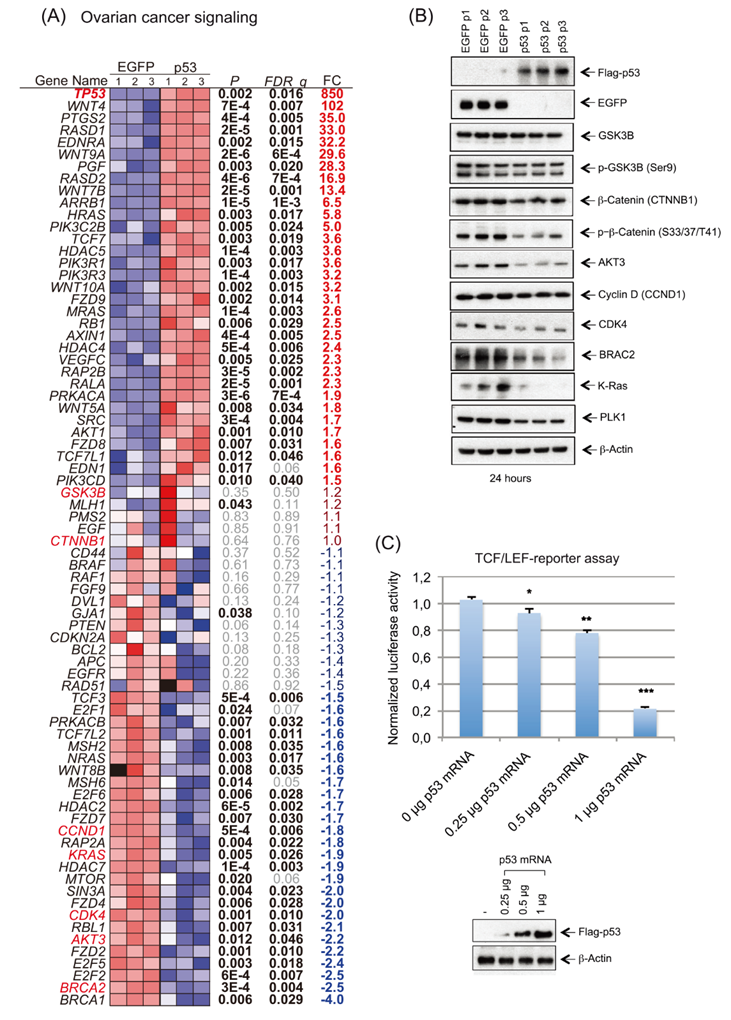
圖6 IVT p53 mRNA處理OVCAR-8細(xì)胞后,OC信號(hào)通路上調(diào)。
5. 在HGSOC異種移植模型中,p53 mRNA處理的OVCAR-8細(xì)胞的原位應(yīng)用導(dǎo)致了劑量依賴性的腫瘤生長(zhǎng)減少
在異種移植實(shí)驗(yàn)的前一天,OVCAR-8/Luc細(xì)胞被轉(zhuǎn)染mock-mRNA或p53-mRNA(100 ng或500 ng)(圖7A)。為了建立原位模型,將Matrigel/OVCAR-8/Luc細(xì)胞懸液注射到每只小鼠的右側(cè)卵巢。在為期10周的觀察期間,BLI以每周1倍的速度測(cè)定腫瘤體積,結(jié)果表明,100ng p53-mRNA處理的細(xì)胞產(chǎn)生的腫瘤生長(zhǎng)遲緩,以及500ng p53-mRNA處理的細(xì)胞增殖完全受阻(圖7B)。為驗(yàn)證熒光素酶在體內(nèi)的活性,研究結(jié)束后處死小鼠,由兩名獨(dú)立的獸醫(yī)組織學(xué)學(xué)家對(duì)所有器官進(jìn)行解剖/組織學(xué)檢查。基于體積測(cè)定(圖7C)和BLI測(cè)量(圖7D)對(duì)切除的卵巢的檢查證實(shí)了通過(guò)支持In vivo BLI測(cè)量的p53 mRNA治療對(duì)卵巢腫瘤的劑量依賴性大小減少(圖7B)。組織學(xué)檢查顯示巨大的腫瘤腫塊和深刻的形態(tài)學(xué)改變,這是由于在注射了模擬處理的OVCAR-8/Luc細(xì)胞的右側(cè)卵巢中巨大的癌組織。在100ng p53-mRNA處理組中,右側(cè)卵巢顯示出低到中等數(shù)量的腫瘤(圖7E,d-e)或正常組織學(xué)。500ng p53-mRNA處理組的右側(cè)卵巢和所有其他器官顯示正常組織學(xué)(圖7E,g-h)。在所有處理組(mock,100ng和500ng p53-mRNA)中,未接受OVCAR-8/Luc細(xì)胞的左側(cè)卵巢顯示出正常的組織學(xué),具有卵泡和黃體結(jié)構(gòu),以及基質(zhì)組織(圖7E,c-f-i)。在注射了mock-treated細(xì)胞的小鼠中,在腸道中檢測(cè)到轉(zhuǎn)移;100-ng組的轉(zhuǎn)移活性較低,在500-ng組中沒(méi)有轉(zhuǎn)移活性(圖7D-F)。總之,這些動(dòng)物數(shù)據(jù)揭示了在原位條件下,p53 mRNA處理的OVCAR-8/Luc細(xì)胞的劑量依賴性生長(zhǎng)遲緩和播散受阻。
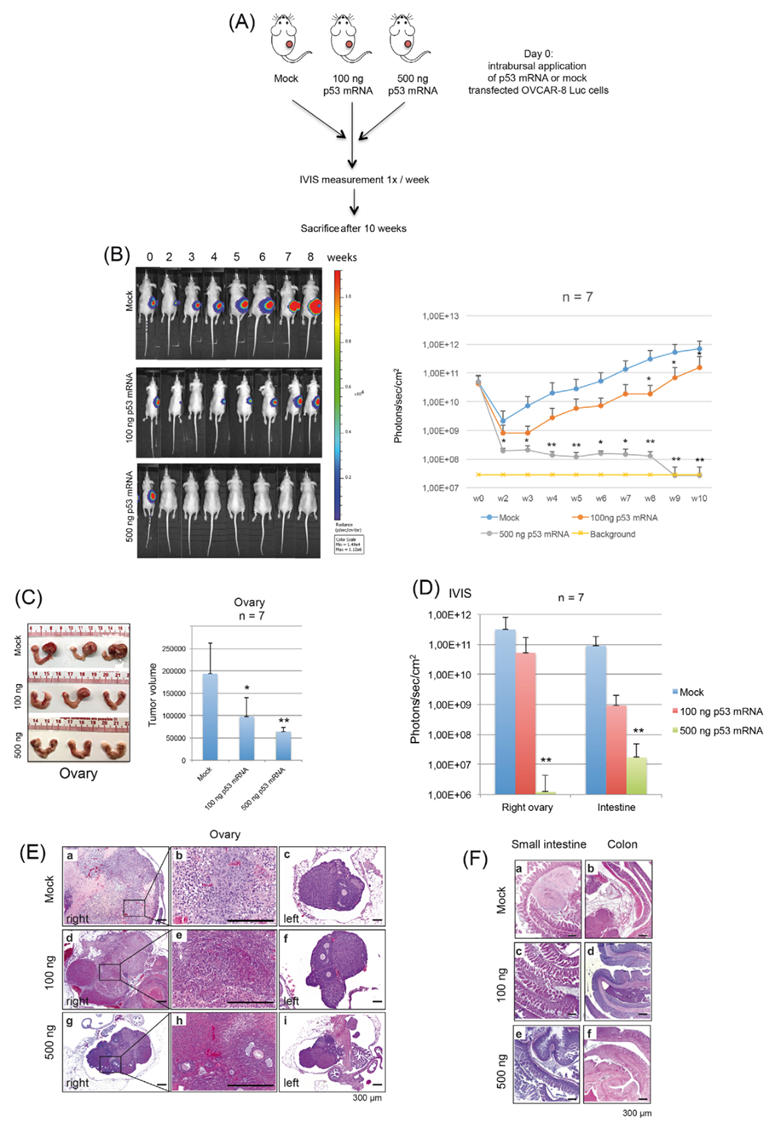
圖7 在原位小鼠模型中,應(yīng)用脂質(zhì)體p53-mRNA到OVCAR-8細(xì)胞可防止鞘內(nèi)生長(zhǎng)和播散。
6. 腹腔內(nèi)應(yīng)用OVCAR-8細(xì)胞,隨后腹腔內(nèi)治療p53-mRNA抑制腫瘤細(xì)胞的播散
為了進(jìn)一步驗(yàn)證p53-mRNA在轉(zhuǎn)移性HGSOC中的臨床相關(guān)性,作者測(cè)試了腹膜內(nèi)散在的腫瘤細(xì)胞是否可以被脂質(zhì)體p53-mRNA所接近。治療OC的藥物腹腔給藥被證明比全身給藥更有效,美國(guó)國(guó)立癌癥研究所推薦腹腔給藥。沿著這些路線,作者腹腔注射2×106 OVCAR-8/Luc細(xì)胞,并在4-6小時(shí)后通過(guò)腹腔途徑給予p53-mRNA。小鼠每周2次腹腔注射p53-mRNA(0.16mg/kg)或?qū)φ战M,共治療3周。盡管對(duì)照組的OVCAR-8/Luc細(xì)胞呈指數(shù)增長(zhǎng),但脂質(zhì)體p53-mRNA腹腔內(nèi)處理完全阻斷了腫瘤細(xì)胞的生長(zhǎng)(圖8A)。在整個(gè)觀察期間,兩組小鼠體重發(fā)育正常(圖8B)。
在接受腹腔OVCAR-8/Luc細(xì)胞和腹腔模擬治療的對(duì)照小鼠中,大體解剖分析顯示腹膜表面有腫瘤塊(圖8C-D)。大多數(shù)轉(zhuǎn)移灶與臟器附著較弱。在大網(wǎng)膜、卵巢脂肪墊和腸系膜等脂肪組織中也檢測(cè)到大腫瘤(圖8C-D)。特別是,附著在小腸和大腸的較大腫瘤塊會(huì)導(dǎo)致腸道結(jié)構(gòu)之間的粘連,這意味著腸道狹窄。大網(wǎng)膜和腸道的IVIS測(cè)量顯示了最顯著的信號(hào),與組織學(xué)結(jié)果相關(guān)(圖8D-E)。在p53-mRNA處理的小鼠中,大體解剖和組織學(xué)分析沒(méi)有發(fā)現(xiàn)腹腔內(nèi)的腫瘤團(tuán)塊,所有的器官在肉眼檢查中顯示正常。IVIS測(cè)量和組織學(xué)檢查沒(méi)有提供腫瘤細(xì)胞播散的證據(jù)(圖8D-E)。
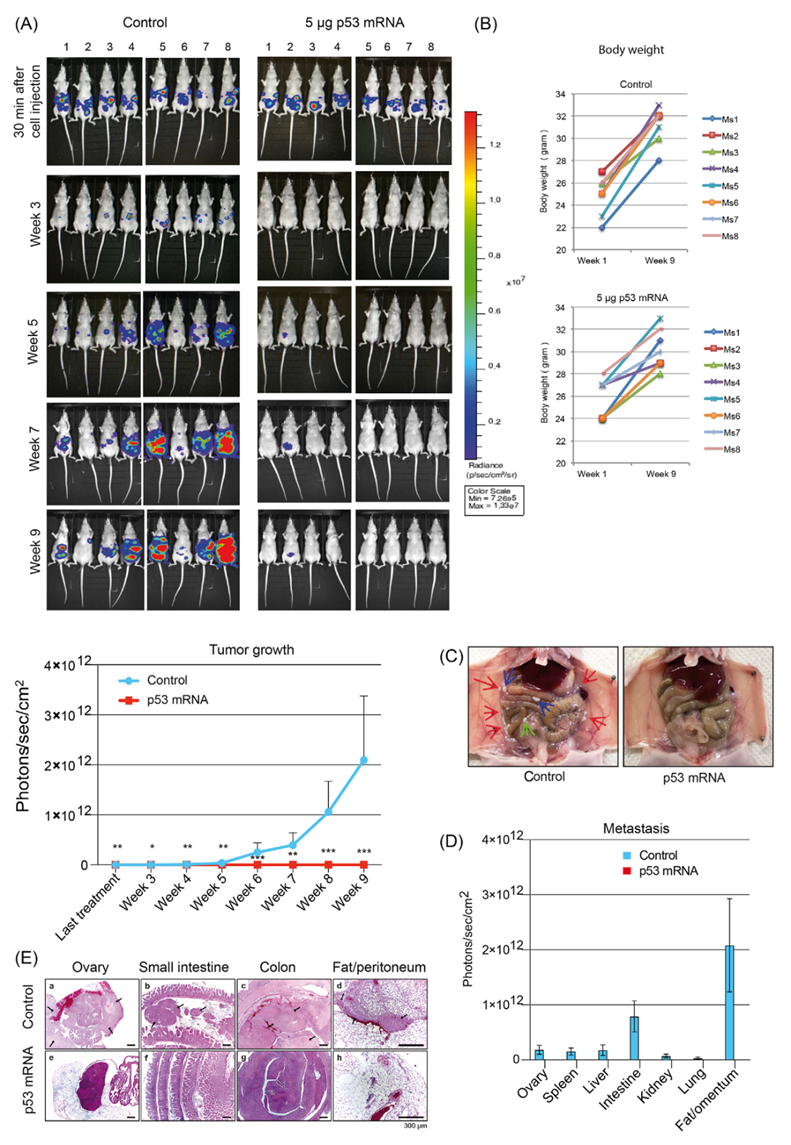
圖8 腹腔內(nèi)注射OVCAR-8細(xì)胞后腹腔內(nèi)治療小鼠脂質(zhì)體p53-mRNA防止腫瘤形成和異種移植小鼠模型的器官播散。
結(jié)論:
該研究證明了IVT mRNA激活HGSOC中TP53腫瘤抑制基因的有效性。脂質(zhì)體IVT mRNA可有效、持續(xù)地表達(dá)WT p53,并精確挽救p53功能;從而抑制HGSOC細(xì)胞增殖,降低染色體不穩(wěn)定性,觸發(fā)細(xì)胞死亡。在不同的小鼠模型中,p53-mRNA治療導(dǎo)致了劑量依賴性的腫瘤生長(zhǎng)和腹膜腔內(nèi)播散的減少。這些發(fā)現(xiàn)表明,基于IVT-mRNA的方法有希望在癌細(xì)胞中重新激活p53,并可能為HGSOC提供一個(gè)有價(jià)值的治療選擇。
實(shí)驗(yàn)結(jié)果:
細(xì)胞培養(yǎng)和轉(zhuǎn)染,集落形成試驗(yàn),類器官,免疫印跡,細(xì)胞周期、細(xì)胞活力和增殖分析,熒光素酶檢測(cè),乳酸脫氫酶細(xì)胞毒性測(cè)定,RNA測(cè)序,TCF/LEF報(bào)告基因檢測(cè),小鼠實(shí)驗(yàn),活體成像系統(tǒng),組織學(xué)檢查
參考文獻(xiàn):
Raab M, Kostova I, Pe?a-Llopis S, Fietz D, Kressin M, Aberoumandi SM, et al. Rescue of p53 functions by in vitro-transcribed mRNA impedes the growth of high-grade serous ovarian cancer. Cancer Commun (Lond). 2024 Jan;44(1):101-126. doi: 10.1002/cac2.12511.






