METTL1 通過前列腺癌中 tRNA 衍生的片段生物發(fā)生促進腫瘤發(fā)生
前列腺癌(Prostate cancer, PCa)是全球第二大最常診斷的癌癥,也是男性癌癥相關死亡的第二大原因[1]。常規(guī)療法針對疾病的雄激素相關信號通路。然而,高達30%的患者最終對治療和轉移產生耐藥性,其治療選擇有限。隨著最近大規(guī)模腫瘤樣本平行測序的出現,分子分析工作揭示了高度多樣化的基因組、表觀基因組和轉錄組學景觀,凸顯了識別具有治療潛力的替代改變和靶向分子通路的必要性。RNA 修飾在轉移 RNA (tRNA) 中普遍存在。目前,越來越多的證據表明,tRNA及其修飾酶的失調也與腫瘤發(fā)生有關。N7-甲基鳥苷(M7G)是真核生物中最普遍的tRNA修飾之一,存在于幾種tRNA物種的可變環(huán)區(qū)。在人類中,m7G由甲基轉移酶1(Methyltransferase1,METTL1)和WDR4形成的復合物催化。 從功能上講,m7G修飾的tRNA選擇性地調節(jié)特定轉錄本的翻譯。 在病理水平上,METTL1表達增加與幾種癌癥類型的腫瘤侵襲性有關。這些觀察結果表明了tRNA修飾在癌癥發(fā)展中的關鍵功能,并表明靶向癌癥中異常的轉錄后修飾可能有望成為有效的治療靶點。該文章于2023年7月發(fā)表在《Molecular Cancer》,IF:37.3
技術路線: 
研究結果:
1.METTL1 在人和PCa小鼠 中升高
為了研究RNA修飾在PCa腫瘤發(fā)生中的潛在作用,我們采用了一種確保選擇與PCa腫瘤發(fā)生相關的RNA修飾的方法。我們在五項PCa研究的數據集中鑒定132組帶注釋的RNAmodifying proteins (RMPs)的表達變化(圖1A)。此外,我們使用基因工程PCa小鼠模型將分析擴展到小鼠PCa(圖1A)。我們發(fā)現原發(fā)性和轉移性PCa中表達差異最大的基因是METTL1(圖1B;)。從原發(fā)性到轉移性人類腫瘤,METTL1表達持續(xù)增加(圖1C),分析發(fā)現METTL1高表達的預后較差(圖1D)。我們還發(fā)現m7g RNA甲基轉移酶復合物的調控亞基WDR4的表達升高(圖1C)[30,31],在其他癌癥中也過表達,然而,我們沒有發(fā)現WDR4過表達是不良預后的危險因素(圖1D)。病人樣本證實了METTL1和WDR4蛋白表達的增加(圖1E)。基于前列腺癌腫瘤的激素依賴性,我們進行了METTL1、WDR4和AR的表達分析,但METTL1、WDR4與AR的表達沒有明顯的相關性(圖1E)。為了證實METTL1和WDR4的表達是否與晚期腫瘤狀態(tài)相關,我們通過S6K的磷酸化狀態(tài)來測量PI3K通路的活性,在大約70%的晚期PCa患者中,S6K的磷酸化狀態(tài)發(fā)生了改變。我們發(fā)現METTL1和WDR4表達與PI3K通路激活增強呈正相關(圖1E),表明METTL1和WDR4表達在晚期PCa腫瘤中升高
綜上所述,我們的結果表明,METTL1是PCa中改變的主要表觀轉錄組調節(jié)因子,其過表達與不良預后相關。
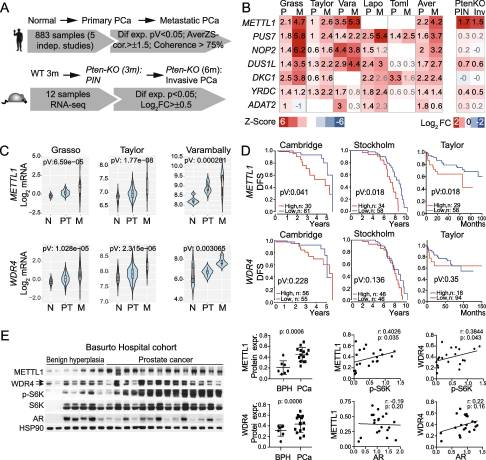
圖1. METTL1 在人和PCa小鼠 中升高
2.METTL1 表達受 AKT-mTOR 下游信號通路調控
接下來,我們試圖闡明前列腺癌中METTL1表達上調的機制。由于雄激素受體(AR)活性的增加是PCa的主要驅動因素之一,我們分析了通過受體和下游靶基因(如KLK3)的表達來測量的AR表達或活性的增加是否與PCa中METTL1的表達相關。在Grasso數據集中,我們觀察到METTL1與AR和KLK3之間幾乎存在顯著的直接相關性。在Taylor數據集中,我們發(fā)現了METTL1和AR之間的直接相關性,支持了這兩個因素之間潛在關系的概念。然而,在KLK3的情況下,我們沒有觀察到顯著的相關性。我們使用TGCA數據集的分析揭示了METTL1和KLK3之間的直接相關性。然而,有趣的是,在這個特定的數據集中,我們沒有發(fā)現METTL1和AR之間的顯著相關性。由于我們發(fā)現與良性前列腺增生標本相比,前列腺癌標本中METTL1蛋白表達與磷酸化- s6k呈正相關(圖1E),我們接下來分析了METTL1表達是否與PTEN表達相關,PTEN是PI3K/AKT/mTOR通路的負調節(jié)因子,在大約70%的晚期前列腺癌患者中缺失[47]。分析的所有數據集均顯示METTL1與PTEN表達呈顯著負相關(圖2A),表明PI3K-mTOR軸調控了PCa中METTL1的表達。使用PI3K (BKM-120抑制劑)、AKT (MK2206)、mTORC1(雷帕霉素)和mTORC1/2 (Torin)的小分子抑制劑進一步解剖PI3K - mTORC1/2通路發(fā)現,AKT抑制降低了METTL1 mRNA的水平,mTOR抑制劑持續(xù)降低了METTL1 mRNA和蛋白的表達(圖2B-C),表明METTL1的表達是通過mTOR信號傳導調節(jié)的。接下來,我們研究了METTL1表達水平是否有助于確定pten缺失相關的患者生存率下降,這是具有臨床意義的,并在臨床局限性腫瘤患者中區(qū)分惰性和侵襲性疾病。有趣的是,我們發(fā)現高METTL1表達突出了pten -低患者預后不良的子集(圖2D)。為了確定前列腺癌中METTL1的上調是否是PTEN表達低或缺失的直接后果,我們分析了野生型(WT)小鼠和Probasine-Cre x Ptenflox/flox小鼠(以下簡稱PTEN - ko)前列腺組織中METTL1 mRNA和蛋白水平,這些小鼠在前列腺上皮中有條件地缺失PTEN。這些小鼠在12周后發(fā)生高級別癌前病變,在5個月大后發(fā)展為浸潤性腺癌。我們觀察到Pten缺失后Mettl1的表達逐漸增加(圖2E-G)。有趣的是,來自小鼠前列腺的trna腫瘤組織和尿液中提取的tRNA中m7g的沉積明顯增加(圖2H-K)。免疫組織化學分析進一步顯示,Mettl1在小鼠PCa中的表達更高,在最常見的上皮細胞類型管腔細胞中也有高表達,被普遍認為是人類前列腺癌的首選起源細胞(圖2L)。綜上所述,這些數據表明METTL1是mTORC1通路的下游效應物,其激活可誘導METTL1在PCa中的表達增加。
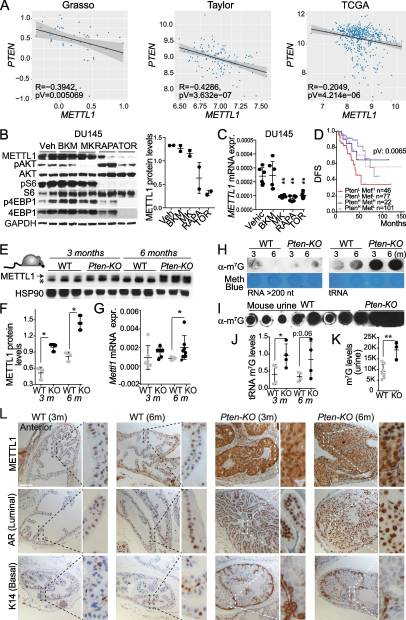
圖2. METTL1 表達受 AKT-mTOR 下游信號通路調控
3.METTL1 介導tRNA甲基化
為了了解METTL1在PCa腫瘤發(fā)生中的作用,我們通過結合兩種轉錄組范圍的方法確定了METTL1 RNA底物。為了鑒定PCa細胞中mettl1特異性RNA靶點,我們使用了光活化核糖核苷增強交聯免疫沉淀(PAR-CLIP),這是一種嚴格的技術,將光反應性核糖核苷類似物納入新生RNA中,通過紫外線交聯誘導蛋白質和RNA之間的共價鍵,然后進行下一代測序。以空載體感染多西環(huán)素誘導的細胞為對照。我們發(fā)現,與對照樣本結合的RNA相比,t與對照樣品相比,我們沒有觀察到HA-METTL1樣品上結合的其他RNA物種的富集(圖3A)。接下來,為了精確定位trna中的m7g,我們使用CRISPR/Cas9敲除PCa細胞系PC3中的METTL1(圖3B)。使用抗m7g抗體的North-dot blot分析和質譜分析證實了METTL1 KO細胞trna中m7g的缺失(圖3B-C)。高通量測序數據的分析證實了先前報道的鳥苷46可變環(huán)的強大甲基化(圖3D)。我們鑒定出大約50%的同型受體為METTL1底物(圖3E, G)。綜上所述,我們的分析證實了METTL1優(yōu)先甲基化PCa細胞中可變環(huán)上的trna。
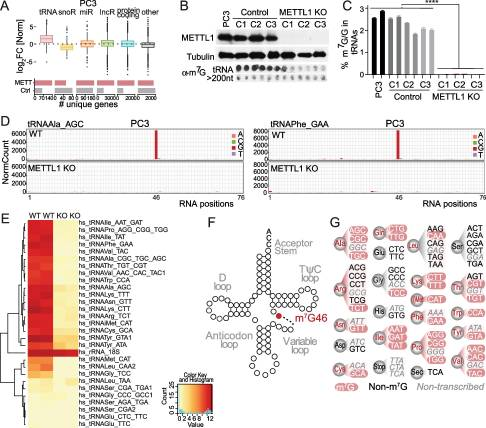
圖3. METTL1 介導tRNA甲基化
4.METTL1介導的甲基化可保護tRNA免于裂解成小的非編碼RNA
在酵母和人類中,當m7g甲基化降低時,trna的穩(wěn)定性會降低。為了確定METTL1缺失可能會擾亂PCa細胞中單個METTL1靶向trna的水平,我們對從PC3 WT和METTL1 KO細胞中分離的trna進行了高通量測序。與之前的研究結果相反,我們沒有發(fā)現證據表明mettl1特異性甲基化的缺失會降低特異性成熟tRNA同受體的豐度(圖4A)。最近的報道表明,tRNA修飾保護或誘導tRNA切割成抑制性小ncrna。我們分析了來自PC3 WT和METTL1 KO細胞的小RNA測序數據,以尋找tRNA片段(trf)的主要類別的差異,包括5 ' /3 '衍生的trf (5 ' trf和3 ' trf)、5 ' tRNA一半和內部trf (int-tRF)。有趣的是,我們在PC3 METTL1 KO細胞中檢測到一致的5’trna片段富集(圖4B)。然而,與WT細胞相比,大多數METTL1 KO細胞的富集程度適度增加(圖4C)。我們的分析顯示,與WT細胞相比,在所有5'tRNA片段中,一個特定的類別,即5 '末端低鳥嘌呤tRNA片段(5'TOGs),在KO細胞中顯著過度代表(log2 FC>2, p值<0.05)(圖4B和C)。5 ' togs長約20或30個核苷酸,主要來源于mettl1靶tRNA Cys(產生含有5 ' togs的5個末端鳥嘌呤(5G))和Ala(產生含有5 ' togs的4G)的裂解(圖4D和E)。Northern blotting證實,與WT細胞相比,PC3 METTL1 KO細胞的兩個獨立克隆中cys衍生的5 ' trf的積累較弱,但明顯較高(圖4F)。在PC3、DU145和22Rv1細胞中,METTL1下調時觀察到5'tRFs,表明5'tRFs的形成與PTEN、p53和AR狀態(tài)無關(圖4F)。證據表明,一小部分tRNA切割成tRNA衍生的ncrna是對應激的保守反應,tRNA修飾保護它們免受應激誘導的切割。在應激反應中,tRNA切割在METTL1 KO細胞中比在WT細胞中更為突出,早在氧化應激暴露2小時達到峰值,在應激刺激8小時后下降,可能是因為無法解決應激導致細胞死亡增加(圖4G, H)。總之,我們的數據表明,mettl1介導的甲基化是一種保守的機制,它調節(jié)了PCa細胞在應激反應中源自5’trna片段的一類新型小ncrna的生物發(fā)生,而不管它們的遺傳狀態(tài)如何。
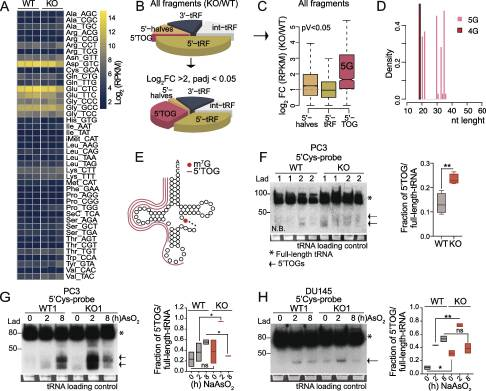
圖4. METTL1介導的甲基化可保護tRNA免于裂解成小的非編碼RNA
5.METTL1 的缺失通過 tRNA 片段生物發(fā)生抑制翻譯起始
由于已知5'TOGs抑制全局翻譯,我們接下來研究了5'TOGs的積累是否導致了PC3 mettl1缺失細胞的翻譯改變。我們證實,與WT細胞相比,METTL1 KO細胞中通過o -丙基嘌呤霉素(OP-puro)摻入測量的蛋白質翻譯減少(圖5A)。蛋白質合成速率的變化與翻譯起始復合物組分的表達變化或eIF2α的磷酸化狀態(tài)無關。細胞應激反應中5’trna片段的產生在應激反應機制中起關鍵作用。這一過程有助于抑制整體蛋白質合成,使細胞能夠恢復并在應激條件下存活[66]。為了確定METTL1的去除是否會影響應激反應,我們測量了氧化應激誘導后的蛋白質合成速率。我們的分析表明,與WT細胞相比,METTL1缺陷細胞的蛋白質合成回收率降低,這表明METTL1 KO細胞對應激更敏感(Supplementary Fig. S5B)。這一發(fā)現表明m7g的缺失顯著抑制了蛋白合成,并且這一過程與eIF2α磷酸化狀態(tài)無關。接下來,我們試圖確定METTL1 KO細胞獨特的翻譯抑制及其對5'TOGs的依賴的分子基礎。先前的證據表明,5'TOGs通過取代mrna帽上的翻譯起始復合物eIF4A/G/E和調控因子YB1和PABP1的組分而損害翻譯起始。為了確定翻譯起始因子是否從PC3 METTL1 KO細胞中7-甲基-鳥苷化(m7g)覆蓋的mrna中轉移,我們分析了翻譯起始因子對m7g -帽包被的sepharose beads的親和力。我們發(fā)現,與WT細胞相比,METTL1 KO細胞中eIF4G和PABP1的m7 g -cap親和力顯著降低(圖5B)。這表明,5'TOGs積累的增加破壞了翻譯起始復合物某些因子的組裝和結合的穩(wěn)定性,導致METTL1 KO細胞中的翻譯受到抑制。我們進一步評估了在WT細胞中表達的合成5'TOG是否能夠結合翻譯起始因子和調節(jié)因子,以及它們對這些因子的親和力是否可以通過合成的逆補體5'TOG rna(或抗tog)來阻斷。為此,我們用5 '生物素化的5'TOG rna(包含PC3 METTL1 KO細胞中最豐富的5'TOG序列)轉染PC3 WT細胞,并添加或不添加抗tog。在去除5 '生物素化-5 ' togs后,我們發(fā)現在抗togs存在下,PABP1和YB1對5'TOG的親和力顯著降低(圖5C)。接下來,我們研究了人工合成的5'TOGs是否可以在WT細胞中表型化翻譯起始復合物的位移,以及抗tog rna是否可以在METTL1 KO細胞中挽救這種觀察到的效應。我們發(fā)現,在轉染5'TOGS的WT細胞中,PAPB1與m7 g -cap的結合被取代,但在轉染抗tog rna的METTL1 KO細胞中,PAPB1與m7 g -cap的親和力顯著增加(圖5D)。總的來說,這表明5'TOGs的形成通過取代PAPB1來抑制蛋白質翻譯。有趣的是,PAPB1先前已被證明對其他細胞類型中的5'TOGs具有很強的親和力。因此,我們的研究結果證實,METTL1 KO細胞中表達的5'TOGs可以取代mRNA帽上的翻譯調節(jié)因子,并為METTL1介導的翻譯抑制的分子基礎提供了關鍵見解。
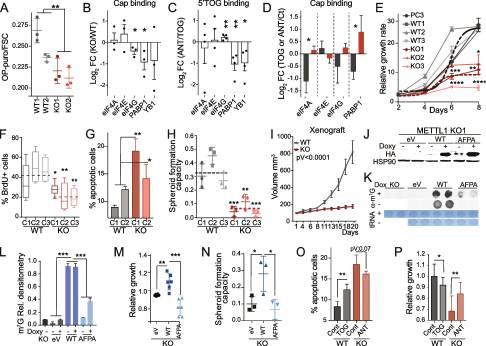
圖5. METTL1 的缺失通過 tRNA 片段生物發(fā)生抑制翻譯起始
5.METTL1下調可抑制前列腺腫瘤在體內和體外的生長
鑒于METTL1 KO細胞合成的蛋白質較少,我們假設METTL1抑制可以降低細胞和腫瘤的生長。事實上,我們觀察到METTL1的敲低會損害PC3、DU145和22Rv1細胞的生長(圖5E)。METTL1下調還會減少細胞分裂,誘導細胞周期阻滯,增加細胞凋亡,損害球體形成能力,并顯著降低腫瘤異種移植物的生長和增殖(圖5f - I)。因此,我們的數據表明,下調METTL1可以有效地抑制腫瘤生長,有力地支持METTL1在調節(jié)PCa進展中起關鍵作用。接下來,我們研究了METTL1甲基化酶活性是否足以促進細胞生長。我們在PC3 METTL1 KO細胞中重新表達了野生型METTL1 (WT)和催化死亡突變體(AFPA)(圖5J-L)。與用空載體(eV)轉導的KO細胞相比,重新表達WT METTL1的KO細胞的增殖和球體形成能力增強。相比之下,無催化活性突變體的表達未能促進METTL1 KO細胞生長和球體形成能力(圖5M-N)。由于METTL1的催化活性得到了與調控亞基WDR4形成復合物的支持,并且WDR4在PCa中過表達(圖1C, E),綜上所述,這些結果表明METTL1以酶活性依賴的方式促進PCa細胞的生長,但不依賴于WDR4。為了進一步確定5'TOG是否足以誘導生長停滯和凋亡,我們用5'TOG轉染PC3 WT細胞,用抗tog轉染METTL1 KO細胞,并測量細胞凋亡和增殖。我們檢測到WT細胞轉染5’tog rna后,凋亡顯著增加,增殖顯著減少,而METTL1 KO細胞轉染antiTOGs后,凋亡雖不顯著減少,但增殖顯著增加(圖5O,P)。總之,我們的數據表明,METTL1失活和5'TOGs是誘導生長停滯所必需的,重新表達催化活性版本的METTL1和抗togs可以部分修復METTL1 KO細胞中觀察到的缺陷。
6.METTL1 缺失激活 IFN 信號通路
鑒于翻譯受到METTL1抑制的影響,我們探討了METTL1缺失對翻譯體即刻變化的影響。為此,我們利用OP-puro特性來標記新生蛋白,隨后將其偶聯到生物素包被的微球上,然后進行微球上的消化和LC-MS /MS(圖6A)。基因本體(GO)術語富集分析發(fā)現,與細胞分裂和有絲分裂相關的基因翻譯減少,證實了觀察到的METTL1 KO細胞增殖缺陷(圖6)。出乎意料的是,我們還發(fā)現METTL1 KO細胞中與應激反應相關的轉錄本翻譯增加,包括I型和II型干擾素(IFN)信號通路、免疫效應過程和分解代謝過程(圖6B)。翻譯的差異反映在PC3 METTL1 KO細胞的整體蛋白質組組成中,但與RNA表達水平無關,這表明轉錄后或翻譯調控是導致METTL1 KO細胞中不相關的RNA -蛋白表達水平的原因(圖6C)。為了進一步測試METTL1 KO細胞中某些轉錄本的翻譯效率是否存在差異,我們進行了多體分析。這種方法使我們能夠確認METTL1 KO細胞中活性多體的形成減少,同時整體蛋白合成減少(圖6D)。對METTL1 KO細胞多體部分mRNA富集的分析顯示,與干擾素信號相關的特定轉錄物的翻譯增加,如干擾素調節(jié)因子9 (IRF9)和干擾素刺激基因15 (ISG15)(圖6D)。作為翻譯變化特異性的對照,我們沒有發(fā)現在METTL1 KO細胞的多體部分中富集GAPDH、Catenin β、KIF20A或STAT1等轉錄本(圖6D)。綜上所述,我們的研究結果表明,mettl1介導的tRNA甲基化引導著一個獨特的翻譯程序。由于5'TOGs可以重新編程翻譯機制,以支持癌細胞所需的翻譯程序,我們接下來研究了METTL1 KO細胞中的翻譯變化是否由5'TOGs的生物發(fā)生增加介導。為此,我們用5'TOG和抗tog rna轉導PC3 WT和METTL1 KO細胞,并評估蛋白質表達的變化。我們發(fā)現,WT細胞中轉染5'TOGs增加了IRF9和ISG15蛋白的表達,而在METTL1 KO細胞中轉染抗tog rna輕微但顯著地降低了這兩種蛋白的表達(圖6E)。我們還觀察到METTL1 KO細胞和異種移植物中STAT1的蛋白表達和磷酸化增加(圖6E),但其表達的增加與翻譯的增加無關(圖6D),而是轉錄依賴的,這表明STAT1表達的增加是由METTL1 KO細胞中IFN信號通路的激活誘導的。事實上,其他干擾素刺激基因(ISGs)的轉錄也在METTL1敲除細胞中被轉錄激活。綜上所述,我們的數據表明,mettl1介導的tRNA甲基化和tRNA片段生物發(fā)生誘導了激活IFN信號通路的翻譯程序。為了證實METTL1的高表達與人類PCa樣本中IFN通路活性的降低相關。
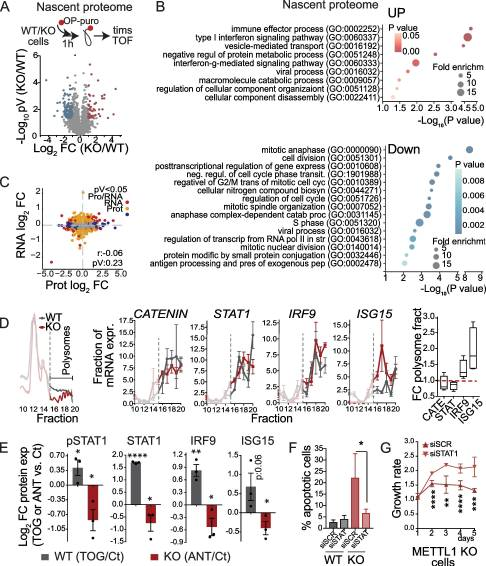
圖6.METTL1 缺失激活 IFN 信號通路
7.PCa 中 METTL1 表達低與促炎免疫細胞極化增加相關
最近,表觀遺傳靶向治療已被證明可以在幾種癌癥類型中觸發(fā)IFN抗病毒反應,包括PCa,引發(fā)先天免疫反應并導致許多細胞因子的產生[74-77]。為了闡明METTL1抑制是否可以通過激活IFN信號通路引發(fā)先天免疫反應,我們研究了METTL1下調是否會改變PCa細胞中細胞因子的表達和分泌。總體而言,在METTL1 KO細胞中,細胞因子組成分析顯示,參與促炎活性的細胞因子分泌增加,并使巨噬細胞極化為m1樣內型[78],包括粒細胞-巨噬細胞集落刺激因子(GM-CSF)和腫瘤壞死因子α (TNF-α)(圖7A)。METTL1的去除也誘導了抗炎細胞因子的下調,包括巨噬細胞或集落刺激因子(M-CSF)、IL10和IL13(圖7A),可使巨噬細胞極化為m2樣內型。這些數據表明,腫瘤細胞中METTL1的抑制可以使腫瘤微環(huán)境(TME)中的免疫細胞向細胞毒性殺瘤內型分化。我們用PC3 WT或METTL1 KO細胞的條件培養(yǎng)基(cm)培養(yǎng)人單核細胞系THP1,并研究了m1樣和m2樣巨噬細胞內源性標記物的表達(圖7B)。此外,PC3 METTL1 KO細胞cm存在下培養(yǎng)的外周血巨噬細胞對CD3+T細胞的增殖和遷移具有更高的誘導作用(圖7C, D)。總之,我們的數據表明,METTL1在癌細胞中的抑制可能會刺激TME的細胞毒性和抗腫瘤炎癥反應。為了在體內驗證我們的發(fā)現,我們使用免疫組織化學分析評估了人類前列腺腫瘤的腫瘤內免疫細胞組成。分析表明,在PCa石蠟樣品中,m2樣巨噬細胞浸潤與METTL1表達之間存在顯著的直接相關,但m1樣巨噬細胞浸潤呈相反趨勢。同樣,CD8+T細胞浸潤與METTL1表達呈負相關(圖7E)。Pten-KO小鼠前列腺上皮中Mettl1雜合缺失(Pten-KO/Mettl1+/-)和Mettl1條件缺失(Pten-KO/ mett1flox /flox)導致腹側和前葉腫瘤體積顯著減少,Pten-KO/Mettl1+/+小鼠的腫瘤體積始終較大(圖7F)。基于這些觀察結果和mettl1缺陷細胞引發(fā)細胞毒性免疫反應的能力,其特征是誘導m1樣巨噬細胞極化,以及體外CD8+T細胞的增殖和遷移增強(圖7AD)。為了闡明Mettl1抑制對免疫腫瘤組成重編程的影響,我們分析了免疫調節(jié)分子,包括細胞因子和趨化因子,作為腫瘤中存在的免疫細胞的替代標記物。我們的研究結果揭示了細胞因子組成的顯著變化,其特征是促腫瘤細胞因子的分泌減少。此外,我們觀察到在Pten-KO/ mettt1fl /fl腫瘤中,已知與免疫檢查點阻斷(ICB)治療有利應答相關的細胞因子分泌增加(圖7H)。這些發(fā)現表明,抑制Mettl1可能有助于改善ICB治療結果的免疫微環(huán)境,突出了靶向Mettl1作為增強抗腫瘤免疫反應的治療策略的潛力。為了確定mett1缺陷腫瘤的腫瘤內細胞因子組成是否可以增強ICB治療的療效,我們用抗pd1和抗ctl4a抗體治療小鼠。與未治療的小鼠相比,Pten-KO/Mettl1+/+小鼠在ICB治療后未顯示腫瘤體積減少,而Pten-KO/ mett1flox /flox小鼠在ICB治療后腫瘤體積顯著減少(圖7I)。我們還研究了METTL1表達水平是否可以預測患者ICB治療的療效。使用ROC繪圖儀平臺,我們分析了抗pd1治療的幾種腫瘤類型中METTL1的表達水平。我們發(fā)現,在乳腺癌、結直腸癌、卵巢癌和膠質母細胞瘤患者中,對ICB治療有反應的METTL1表達低于無反應的METTL1表達,這表明高METTL1表達預示著對ICB治療的不良反應(圖7J)。總之,我們的研究結果表明,METTL1的表達水平可以決定腫瘤內細胞毒性免疫浸潤和ICB治療的成功。
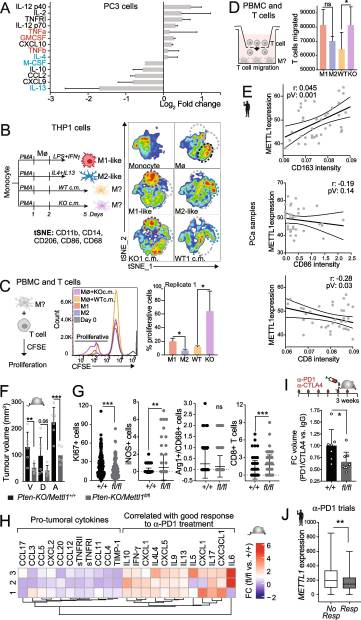
圖7.PCa 中 METTL1 表達低與促炎免疫細胞極化增加相關
結論:
本研究表明,我們發(fā)現轉移RNA N7 -甲基鳥苷(m7g)轉移酶METTL1在原發(fā)性和晚期前列腺腫瘤中高度表達。從機制上講,我們發(fā)現METTL1缺失導致m7 G tRNA甲基化缺失,并促進了一類來自5'tRNA片段的新型小非編碼rna的生物發(fā)生。5 ' trna衍生的小rna引導翻譯控制,有利于腫瘤生長抑制、干擾素途徑和免疫效應器的關鍵調節(jié)因子的合成。在前列腺癌臨床前模型中,Mettl1的敲低增加了促炎免疫細胞在腫瘤內的浸潤,增強了對免疫治療的反應。總的來說,我們的研究結果揭示了mettl1導向的m7g tRNA甲基化在癌細胞翻譯控制和腫瘤生物學中的治療作用。
實驗方法:
細胞培養(yǎng)、穩(wěn)轉細胞系建立、WB、RT-qPCR、免疫組化、免疫熒光、mRNA-seq、PAR-CLIP、PAR-CLIP analysis、AlkAniline-seq、tRNA-seq、tRNA-seq analysis、Northern blotting、帽結合試驗。
參考文獻:
METTL1 promotes tumorigenesis through tRNA-derived fragment biogenesis in prostate cancer. Mol Cancer. 2023;22(1):119. Published 2023 Jul 29.






