解碼人類脊髓發(fā)育過程中轉(zhuǎn)錄因子的時空調(diào)控
脊髓是中樞神經(jīng)系統(tǒng)的重要組成部分,促進感覺處理和運動表現(xiàn)。盡管它很重要,但人類脊髓發(fā)育的時空密碼仍然難以捉摸。在這項研究中,作者引入了一種基于圖像的單細胞轉(zhuǎn)錄因子(TF)表達解碼空間轉(zhuǎn)錄組方法(TF-seqFISH)來研究TF在人類脊髓發(fā)育過程中的空間表達和調(diào)控。通過結(jié)合TF-seqFISH的空間轉(zhuǎn)錄組學數(shù)據(jù)和單細胞RNA測序數(shù)據(jù),作者揭示了以組合TF為特征的神經(jīng)祖細胞沿背腹側(cè)軸的空間分布,以及沿中外側(cè)軸控制神經(jīng)元產(chǎn)生、遷移和分化的分子和空間特征。值得注意的是,作者觀察到一個三明治狀的興奮性和抑制性中間神經(jīng)元短暫出現(xiàn)在發(fā)育中的人脊髓背角。此外,作者整合了10x Visium的數(shù)據(jù),確定了背角神經(jīng)發(fā)生的早期和晚期波,揭示了脊髓背角的形成。作者的研究還揭示了運動神經(jīng)元(MN)多樣化的空間差異和分子線索,以及MNs和小膠質(zhì)細胞中肌萎縮側(cè)索硬化癥(ALS)風險基因的富集。有趣的是,作者在發(fā)育中的人類脊髓中檢測到疾病相關(guān)的小膠質(zhì)細胞(DAM)樣小膠質(zhì)細胞群,這些小膠質(zhì)細胞被預測易受ALS的影響,并參與TYROBP因果網(wǎng)絡和對未折疊蛋白的反應。這些發(fā)現(xiàn)為人類脊髓的發(fā)育提供了時空轉(zhuǎn)錄組學資源,并為脊髓損傷修復和ALS治療提供了潛在的策略。該文章于2024年1月發(fā)表在《Cell research》,IF:44.1。
技術(shù)路線:

主要研究結(jié)果:
1. 發(fā)育中的人類脊髓的時空轉(zhuǎn)錄組圖譜
作者在這里提出了一個全面的時空細胞圖譜的發(fā)展中的人類脊髓,基于兩個來源的轉(zhuǎn)錄組數(shù)據(jù)在單細胞分辨率。第一個數(shù)據(jù)集是通過對發(fā)育中的人類脊髓的單個細胞進行scRNA-seq獲得的,涵蓋了妊娠早期至晚期早期(GW7-27),得到了217,636個單細胞的轉(zhuǎn)錄譜。第二個數(shù)據(jù)集由兩組空間分解的轉(zhuǎn)錄組數(shù)據(jù)組成,分別使用10x Visium和單細胞轉(zhuǎn)錄組學方法獲得,該方法量化了1085個TF的表達水平(TF-seqFISH)(圖1a)。為了創(chuàng)建更全面的細胞景觀,作者將scRNA-seq數(shù)據(jù)與先前研究的數(shù)據(jù)整合在一起,產(chǎn)生了橫跨GW7至GW25的912,514個單細胞的轉(zhuǎn)錄普查(圖1b)。作者的分析顯示,在細胞分裂周期中存在三種細胞類型,分別標記為細胞周期-1、-2和-3,以及神經(jīng)祖細胞(NPC)和In-INs、Ex-INs和MNs的神經(jīng)元類型(圖1b)。此外,作者在少突膠質(zhì)細胞譜系中檢測到不同的細胞類型,包括少突膠質(zhì)細胞祖細胞(OPCs)、定向少突膠質(zhì)細胞祖細胞(COPs)、髓鞘形成少突膠質(zhì)細胞(MFOLs)和成熟少突膠質(zhì)細胞(MOLs)(圖1b)。在UMAP包埋中,作者還發(fā)現(xiàn)了星形膠質(zhì)細胞和星形膠質(zhì)細胞祖細胞(APCs),以及一組位于星形膠質(zhì)細胞和少突膠質(zhì)細胞譜系之間的膠質(zhì)祖細胞(GPCs)(圖1b)。此外,作者還發(fā)現(xiàn)了小膠質(zhì)細胞、內(nèi)皮細胞、周細胞、神經(jīng)嵴細胞、中胚層細胞和室管膜細胞(圖1b)。
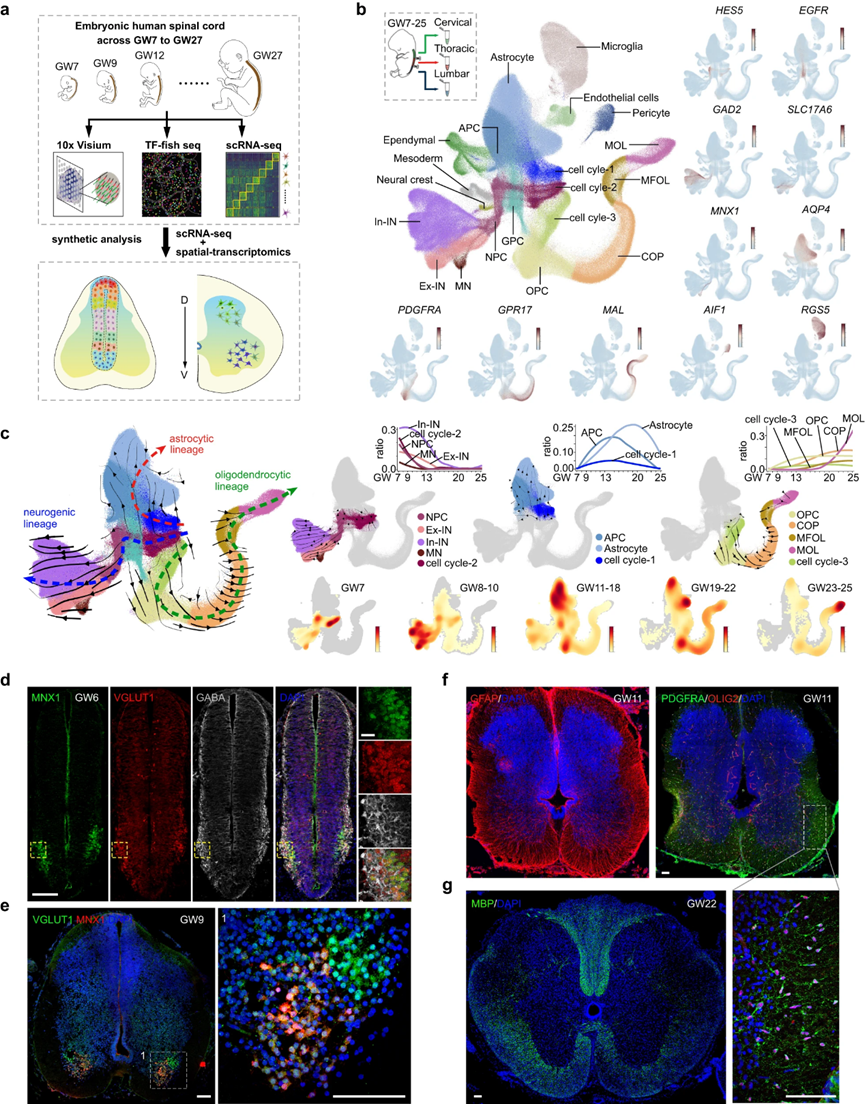
圖1 人類脊髓發(fā)育過程中轉(zhuǎn)錄組變化的全面時空視圖
接下來,作者采用RNA速度分析來推斷導致神經(jīng)元、星形膠質(zhì)細胞和少突膠質(zhì)細胞分化的譜系(圖1c)。有趣的是,分化軌跡顯示,細胞分裂(細胞周期-1/2/3)中的三個細胞組分別涉及星形細胞,神經(jīng)元和少突膠質(zhì)細胞譜系,具有明顯的差異表達基因(DEGs)(圖1)。這些發(fā)現(xiàn)表明,指導神經(jīng)源性、星形膠質(zhì)細胞或少突膠質(zhì)細胞命運的遺傳線索出現(xiàn)得很早,甚至在分裂細胞中也是如此。為了闡明發(fā)育中的人類脊髓中神經(jīng)發(fā)生和膠質(zhì)發(fā)生事件的時間,作者分析了GWs中涉及神經(jīng)元、星形膠質(zhì)細胞和少突膠質(zhì)細胞譜系的細胞比例動力學(圖1c)。作者的結(jié)果表明,發(fā)育中的人類脊髓的神經(jīng)發(fā)生很早就開始了,因為神經(jīng)源性分裂細胞(細胞周期-2)和NPC在GW7(作者的數(shù)據(jù)集中包含的最早階段)的比例很高(圖1c)。因此,豐富的神經(jīng)元子代,包括MNs, Ex-INs和In-INs,根據(jù)其神經(jīng)遞質(zhì)性質(zhì)分類,早在GW7就可以檢測到(圖1c)。
相比之下,膠質(zhì)源性事件則更具有滯后性。在星形細胞譜系中,星形細胞分裂細胞和APC在GW10左右可檢測到,并在GW15達到峰值,而星形細胞在GW10左右逐漸增加,并在GW20達到峰值(圖1c)。在少突膠質(zhì)細胞譜系中,低分化狀態(tài)的細胞類型,如少突膠質(zhì)分裂細胞(細胞周期-3),OPCs和COPs,在GW10左右出現(xiàn),此后逐漸增加(圖1c)。分化良好的MFOLs和MOLs產(chǎn)生于GW18,并在GW20后顯著增加(圖1c)。免疫熒光染色進一步支持了發(fā)育中的人脊髓神經(jīng)發(fā)生和膠質(zhì)發(fā)生事件的這些時間規(guī)律,其中MNX1+ MNs, VGLUT1+ Ex-INs和GABA+ In-INs早在GW6就可以檢測到,特別是在腹角,這表明人脊髓的神經(jīng)發(fā)生可能比GW6更早發(fā)生(圖1d)。此外,作者還探測了GW9時MNX1+細胞和VGLUT1+細胞的空間組織特征(圖1e)。此外,作者對胚胎人脊髓膠質(zhì)細胞分化相關(guān)基因進行了免疫染色。雖然在GW8時缺失,但在GW11時可以檢測到豐富的GFAP+星形細胞和PDGFRA+OLIG2+ OPCs(圖1f)。此外,在GW22時,脊髓白質(zhì)中檢測到MBP+少突膠質(zhì)細胞(圖1g)。綜上所述,作者的研究結(jié)果表明,在GW6前后,人類脊髓神經(jīng)發(fā)生的早期開始,而在GW10前后,神經(jīng)膠質(zhì)發(fā)生的遲滯性發(fā)生。
2. 利用TF-seqFISH揭示神經(jīng)祖細胞的空間組織
為了研究人胚胎脊髓神經(jīng)發(fā)生的分子特征和空間組織原理,作者對提取的神經(jīng)細胞和神經(jīng)元進行了scRNA-seq分析。通過實施無監(jiān)督聚類、RNA速度分析和隨后使用UMAP的可視化,作者確定了具有獨特分子特征的不同神經(jīng)元譜系(圖2a)。發(fā)現(xiàn)每個譜系中的NPC具有較低的偽時間值,并充當起始細胞(圖2a)。作者根據(jù)認可的TF標記物的特征表達對這些譜系進行了注釋,定義了不同的NPC池dp1、dp2、dp3-6、p0、p0/1、pMN和p2/3,以及相應的神經(jīng)元類型dI1、dI2、dI3、dI4、dI5、dI6、V0、V1、MN、V2和V3(圖2a-c)。例如,dp1(例如MSX1, MSX2)和dI1(例如LHX2, LHX9和BARHL1)的小鼠TF標記物被發(fā)現(xiàn)在譜系1的人類NPC和神經(jīng)元中特異性富集,因此作者將其分別定義為dp1和dI1(圖2a-c)。作者在發(fā)育中的人類脊髓中鑒定了六種神經(jīng)元譜系,每一種都具有獨特的細胞組成。譜系1由dp1和dI1組成;譜系2描述了從dp2向dI2的分化;譜系3包括不同類型的dp3-6和dI3、dI4、dI5、dI6;譜系4顯示p0-1向V1和V0分化;譜系5演示了pMN到MN的規(guī)范;和譜系6表明p2-3向V2和V3分化(圖2a)。值得注意的是,由于分子特征的相似性,在小鼠中很容易區(qū)分的某些細胞類型在人胎兒脊髓中很難識別,例如dp3-6、p0-1和p2-3(圖2a-c)。此外,作者觀察到具有相同神經(jīng)遞質(zhì)性質(zhì)的神經(jīng)元一致聚集在一起,在UMAP中,谷氨酸能dI3和dI5神經(jīng)元緊密聚集在一起,GABA能dI4和dI6也是如此(圖2a)。此外,作者在已知的遺傳標記之外發(fā)現(xiàn)了新的基因表達模式。例如,作者發(fā)現(xiàn)在dI1中特異性表達CRABP1、LHX2和BARHL2,在dI5中特異性表達EBF1、EBF3和AJAP1,在dI6中特異性表達THSZ2、SST和CHL1,在MNs中特異性表達SLIT3、ISL1和ISL2(圖2c)。對CRABP1和經(jīng)典dI1標記物LHX2進行免疫染色,對SLIT3和MN特異性CHAT進行免疫染色。
在發(fā)育過程中,TF在調(diào)節(jié)神經(jīng)祖結(jié)構(gòu)域、細胞規(guī)格和腦區(qū)域的模式方面是必不可少的。在這項研究中,作者引入了一種基于圖像的單細胞TF-seqFISH技術(shù),在空間背景下檢測1085個TF在發(fā)育中的人脊髓中的表達譜。作者的重點是解讀心室區(qū)(VZ)駐留NPC內(nèi)TF的空間分布。因此,作者進行了全面的分析,以確定適合進行TF-seqFISH的脊髓組織。作者首先對SOX2和NEUN進行免疫染色,以標記發(fā)育中不同階段的人類脊髓中的NPC。結(jié)果表明,SOX2+ NPCs在GW8位點明顯富集,聚集在增厚的VZ區(qū)在作者的研究中,NPC沿背腹軸的空間分布(dp1→dp2→dp3-6→p0/1→pMN→p2/3)與在發(fā)育中的小鼠和小雞脊髓中的報道相似 (圖2e)。
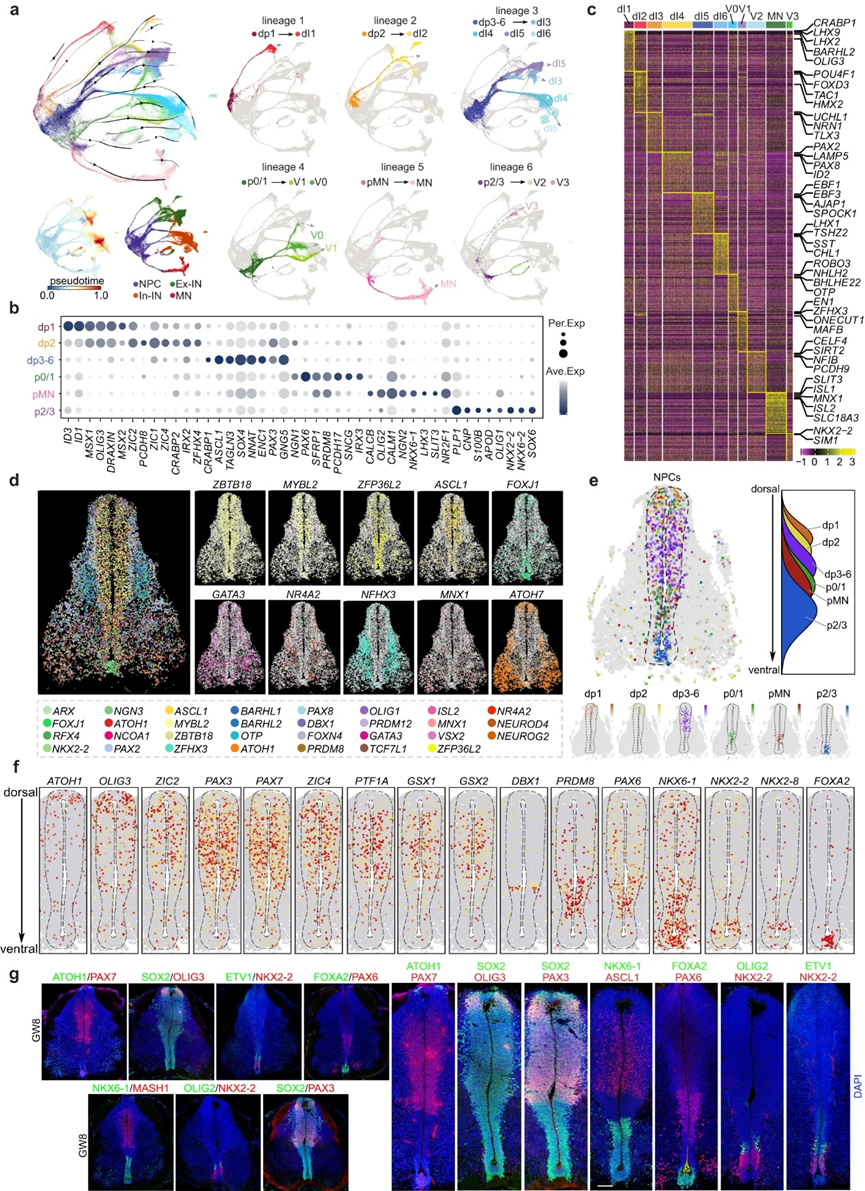
圖2 發(fā)育中的人脊髓神經(jīng)祖細胞的分子和空間特征
此外,作者還研究了人類祖細胞細分的TF結(jié)構(gòu)的空間組織模式。作者的研究結(jié)果顯示,在VZ區(qū)域,對確定祖細胞身份至關(guān)重要的TF在空間上表達受限(圖2f)。其中,dp1特異性的ATOH1主要富集于背側(cè)大部分細胞,而dp3-6富集的PAX3、PAX7、GSX1、GSX2廣泛分布于中上部分(圖2f)。此外,作者觀察到腹側(cè)受限的tf如PRDM8、NKX6-1、NKX2-2、NKX2-8和FOXA2的表達(圖2f)。免疫染色證實了這些發(fā)現(xiàn)(圖2g)。雖然作者的研究揭示了脊髓NPC在物種進化過程中空間基因表達的顯著保守性,但作者也發(fā)現(xiàn)了人類脊髓發(fā)育的獨特特征。例如,PTF1A廣泛分布于人脊髓,其模式與dp3-6特異性GSX1、GSX2、PAX3和PAX7相似(圖2f),不同于其對小鼠脊髓dp4神經(jīng)元的限制這種差異可能解釋了dp3-6祖細胞在人類脊髓中的不可區(qū)分性。
綜上所述,作者的研究不僅基于scRNA-seq分析鑒定了轉(zhuǎn)錄多樣性的NPC,而且闡明了NPC和TF在發(fā)育中的人脊髓表達的空間組織模式。作者的研究結(jié)果表明,盡管NPCs的空間轉(zhuǎn)錄組在物種進化中很大程度上是保守的,但人類胎兒脊髓的發(fā)育遵循著微妙的不同的遺傳調(diào)控規(guī)則。
3. 利用TF-seqFISH揭示神經(jīng)元分化和沿中-外側(cè)軸遷移的空間動力學
在描述了NPC的空間轉(zhuǎn)錄組之后,作者試圖闡明在發(fā)育中的人類脊髓中控制神經(jīng)元組織的規(guī)則。為此,作者基于TF-seqFISH數(shù)據(jù)集中1085個TF的表達,采用無監(jiān)督分類方法,鑒定出18個不同的分子簇(圖3a,b)。通過基于相關(guān)性的分析,這些集群進一步劃分為5個空間離散域(區(qū)域1-5)(圖3a)。具體來說,集群2、7、9、11、12、16和18與區(qū)域1相關(guān);第4組和第13組分配給區(qū)域2;聚類10與區(qū)域3相關(guān);集群14和集群5位于區(qū)域4;集群1、3、6、8和17被分組在區(qū)域5(圖3a)。根據(jù)發(fā)育中的人脊髓圖譜,22區(qū)1位于中間,主要由分裂的祖細胞組成。區(qū)域2,一個與增殖區(qū)相鄰的中間區(qū)(IZ),被指定為暫居區(qū),包含預遷移神經(jīng)元。背側(cè)定位的地幔區(qū)3區(qū)由背角神經(jīng)元遷移和定居組成。第4區(qū)是間地幔區(qū)(MZ),包含中間神經(jīng)元和向腹角方向遷移的神經(jīng)元。最后,腹角特異區(qū)5主要由固定的腹角神經(jīng)元組成(圖3a)。這些TF分類的空間區(qū)域為描繪神經(jīng)解剖結(jié)構(gòu)提供了有價值的分子基礎。
然后,作者結(jié)合TF-seqFISH和scRNA-seq數(shù)據(jù),計算了轉(zhuǎn)錄組全基因的表達譜。利用這些數(shù)據(jù),作者還推導出了非TF基因的空間表達模式,為解碼發(fā)育中的人類胎兒脊髓的細胞和分子組織原理提供了全面的資源。利用這個數(shù)據(jù)集,作者旨在解開人類脊髓中神經(jīng)元遷移和分化的謎團。在背角,區(qū)域1、2和3高度層積(圖3a)。DEGs和基因本體(GO)分析顯示,1區(qū)的VZ細胞參與細胞分裂、維持神經(jīng)干細胞群體和調(diào)節(jié)神經(jīng)發(fā)生(圖3c)。相反,側(cè)定位區(qū)域2 (IZ)和3 (MZ)中的細胞與神經(jīng)元分化、遷移、投射發(fā)育和脊髓背側(cè)發(fā)育有關(guān)(圖3c)。
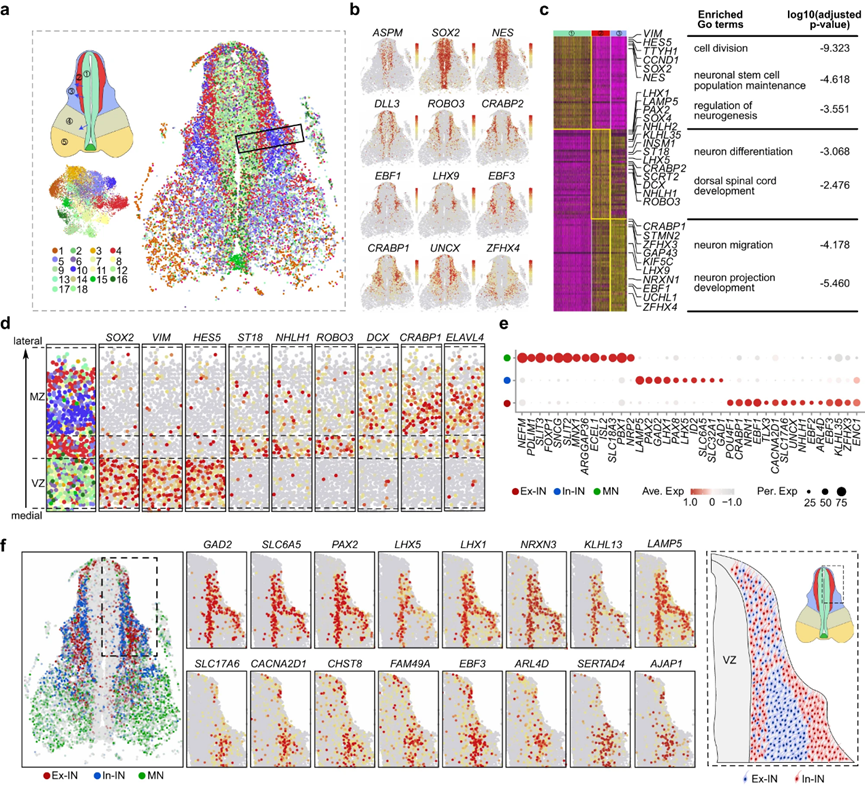
圖3 發(fā)育中的人脊髓中外側(cè)組織模式的空間分辨特征
從增殖祖細胞到有絲分裂后神經(jīng)元的轉(zhuǎn)變受到不同分子的嚴格調(diào)控。例如,作者發(fā)現(xiàn)SOX2、VIM和HES5在VZ區(qū)(1區(qū))富集,而ST18、NHLH1、ROBO3和INSM1在空間上僅限于IZ區(qū)(2區(qū))。相比之下,DCX、CRABP1和ELAVL4的表達僅限于更偏側(cè)的MZ區(qū)(3區(qū))(圖3c,d)。在區(qū)域2細胞中富集的基因中,NHLH1和INSM1在晚期神經(jīng)元祖細胞和新生神經(jīng)元中短暫表達,進一步表明了尚未完全分化并到達最終位置的區(qū)域2細胞的新生身份。因此,通過探測區(qū)域2的特異性基因表達,作者在發(fā)育中的人脊髓的IZ中發(fā)現(xiàn)了一組有絲分裂后神經(jīng)元的早期標記,包括NHLH1、INSM1、ST18、ROBO3、KLHL35等。此外,作者在側(cè)MZ(3區(qū))較晚、更成熟的有絲分裂后細胞中發(fā)現(xiàn)了表達的基因,如CRABP1、STMN2、DCX和ZFHX3(圖3c、d)。然而,腹側(cè)增殖性VZ區(qū)比其背側(cè)對應區(qū)薄得多,可能是由于腹側(cè)區(qū)域更早的神經(jīng)發(fā)生(圖3a)。
總的來說,作者的TF-seqFISH數(shù)據(jù)集為理解發(fā)育中的人類脊髓神經(jīng)解剖劃分的細胞和分子基礎提供了寶貴的資源。此外,作者的數(shù)據(jù)集提供了對神經(jīng)元生成、遷移和分化背后的空間和分子程序的詳細理解。
4. 發(fā)育中的人脊髓的脊髓背角發(fā)育
脊髓神經(jīng)元可以根據(jù)其神經(jīng)遞質(zhì)特性進一步分類,它們在神經(jīng)元功能和電路連接中起著至關(guān)重要的作用。脊髓中有三種主要類型的神經(jīng)遞質(zhì)定義的神經(jīng)元:谷氨酸能Ex-INs、GABA能/甘氨酸能In-INs和乙酰膽堿能MNs。通過對scRNA-seq數(shù)據(jù)集的DEG分析,作者確定了區(qū)分這些神經(jīng)元類型的特征分子譜,如MNs中的NEFM、SLIT2、SNCG、ECEL1和NRP2, In-INs中的LAMP5、PAX2、PAX8和ID2, Ex-IN中的TLX3、NRN1、EBF3、CACNA2D1和CRABP1(圖3e)。為了進一步研究這三種神經(jīng)元類型的空間分布,作者將TF-seqFISH細胞映射到轉(zhuǎn)錄組分類中,并分配了最匹配的神經(jīng)元身份。結(jié)果表明,MNs主要分布在腹角,而Ex-IN和In-INs主要分布在背角和中間部分(圖3f)。有趣的是,在GW8時,Ex-INs被夾在背角的兩個空間分叉的In-INs群之間(圖3f)。值得注意的是,位于VZ附近的In-INs與一些Ex-INs呈現(xiàn)混合模式(圖3f)。Ex-INs和In-INs富集基因的空間表達譜也揭示了這種獨特的組織模式,這種組織模式在整個脊髓中保持一致(圖3f)。在成人脊髓中,背角神經(jīng)元被組織成不同的層,接受特定的感覺輸入人類胎兒脊髓背角中Ex-INs和In-INs的三明治狀組織可能是形成適當?shù)幕芈愤B接以感知環(huán)境和內(nèi)部信號的中間狀態(tài)。
接下來,作者的目標是揭示在廣泛的時間范圍內(nèi)背角發(fā)育的分子和細胞事件。為此,作者對不同胎齡(GW8、GW9、GW13、GW27)的人脊髓組織發(fā)育進行了10× Visium實驗,豐富了空間轉(zhuǎn)錄組數(shù)據(jù)資源。利用無監(jiān)督聚類,作者根據(jù)分子特征和空間位置對13個具有分子特征的斑點簇進行了分類,包括腹側(cè)灰色細胞、背側(cè)灰色細胞、中間灰色細胞、外側(cè)皮質(zhì)脊髓束、分裂細胞、室管膜、中胚層、背根神經(jīng)節(jié)(DRG)細胞(僅從GW8和GW9的組織中捕獲)、背側(cè)和腹側(cè)膠質(zhì)細胞以及兩組MNs(圖4a,b)。作者發(fā)現(xiàn)GW8樣本中沒有一組斑點,主要由群集12和群集13組成(用紅色圓圈勾畫)(圖4c),當空間可視化時,這組斑點位于背角的表面(圖4d)。在GW9、GW13和GW27處,除了一些具有Cluster 8身份的黃色斑點外,作者還可以在背角處檢測到Cluster 12和Cluster 13的斑點(圖4d)。然而,在GW8時,背角僅能檢測到Cluster 8的斑點,而Cluster 12和13的斑點則完全缺失(圖4c,d)。作者的結(jié)果表明,在GW8時或之前出現(xiàn)了早生神經(jīng)元(Cluster 8),在GW8后出現(xiàn)了晚生神經(jīng)元(Cluster 12和13)。GW9時晚生神經(jīng)元的出現(xiàn)與發(fā)育中的人類脊髓背角的擴張相吻合,表明它們在背角構(gòu)建中的重要性(圖4d)。
此外,作者還進行了DEG分析,以探測背角中早生和晚生神經(jīng)元的分子特征。作者發(fā)現(xiàn),簇8中早生的神經(jīng)元對CRABP1、RBP1、ROBO3、MEIS2和OTP具有特異性,而簇12和13中晚生的神經(jīng)元則表現(xiàn)出獨特的分子特異性(圖4e)。集群12具有ENC1、SST、EBF3、GRIA2和PCDH8的特征,而集群13具有MAF、MAFA、CCK和RORB的特征(圖4e)。通過分析其在所有不同簇中的表達,也確定了CRABP1在簇8中的特異性富。CRABP1和DRGX的空間表達譜進一步說明了背角的模塊化結(jié)構(gòu),它們分別代表了早期和晚期的神經(jīng)元(圖4f, g)。值得注意的是,DRGX在GW8時特異性地在DRG細胞中表達豐富,而在脊髓中沒有表達(圖4f)。通過整合scRNA-seq和10x Visium數(shù)據(jù)集,作者還鑒定了集群8、12和13的神經(jīng)元身份。Cluster 8中早出生的神經(jīng)元主要定位于dI1、dI2、dI3和dI4神經(jīng)元類型,而Cluster 12和13中晚出生的神經(jīng)元主要定位于dI5和dI6神經(jīng)元類型(圖4h)。此外,作者對GW8和GW9的scRNA-seq數(shù)據(jù)集的分析顯示,大多數(shù)dI5和dI6神經(jīng)元起源于GW9,這表明這些神經(jīng)元具有晚出生的身份。有趣的是,與圖1c-g所描述的觀察結(jié)果一致,作者的研究還揭示了背側(cè)和腹側(cè)膠質(zhì)細胞的緩慢出現(xiàn)(圖4c)。
因此,通過采用空間視角,作者對支撐人類脊髓背角發(fā)育的細胞和分子機制進行了全面的研究(圖4i)。在胚胎初期,作者在背角中發(fā)現(xiàn)了典型的背腹層狀神經(jīng)元結(jié)構(gòu),這為體感覺回路的構(gòu)成奠定了基礎。利用空間轉(zhuǎn)錄組學數(shù)據(jù)集,作者不僅確定了發(fā)育中的人類脊髓背角的早期神經(jīng)源性事件,而且還確定了延遲的事件,并將GW8時代歸因于背角個體發(fā)育的關(guān)鍵時間間隔。
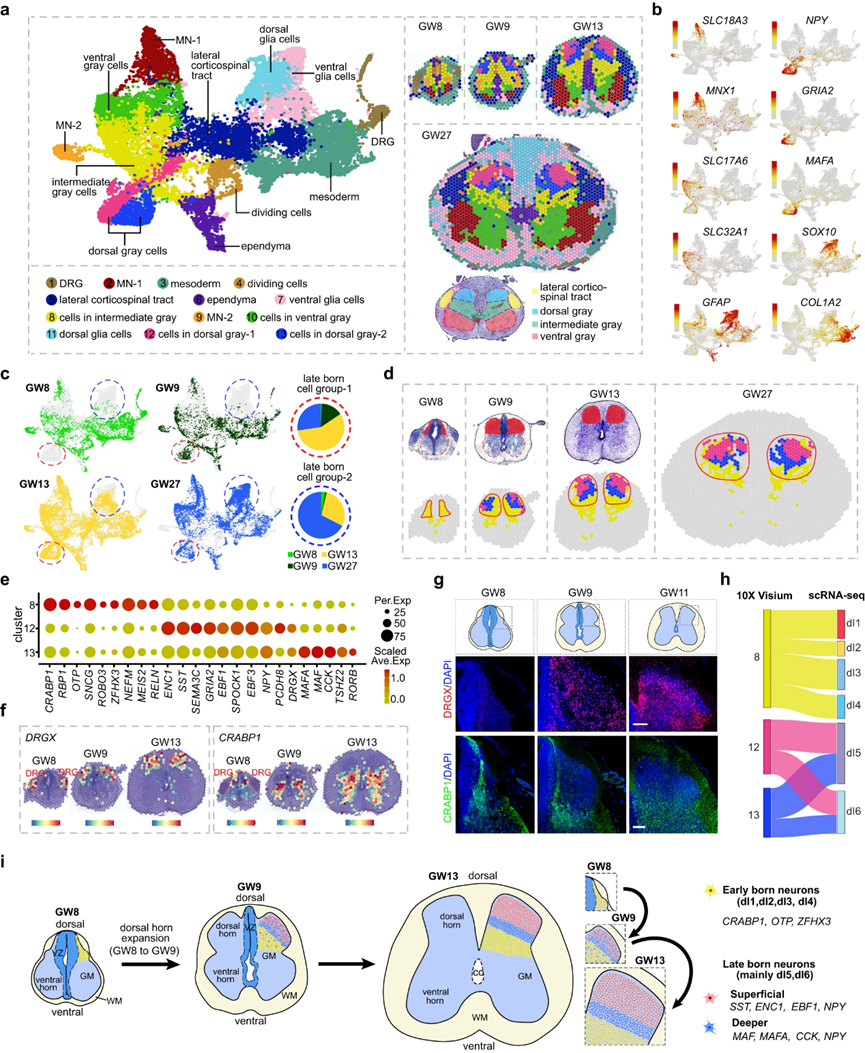
圖4 探索人類脊髓背角發(fā)育的空間、細胞和分子基礎
5. 人類脊髓發(fā)育過程中MNs的分子和空間多樣性
脊髓運動神經(jīng)元在形態(tài)、連通性和功能特征上表現(xiàn)出多樣性。MN多樣性的一個值得注意的方面是它們分為不同的柱狀群,每個柱狀群在脊髓內(nèi)占據(jù)特定的背側(cè)位置,并支配獨特的外周靶組織陣列。MN柱狀群主要有四大類:LMC(外側(cè)運動柱),可進一步分為外側(cè)(LMCl)和內(nèi)側(cè)(LMCm)子柱;節(jié)前運動柱(PGC);軸下運動柱(HMC)和正中運動柱(MMC)(圖5a)。
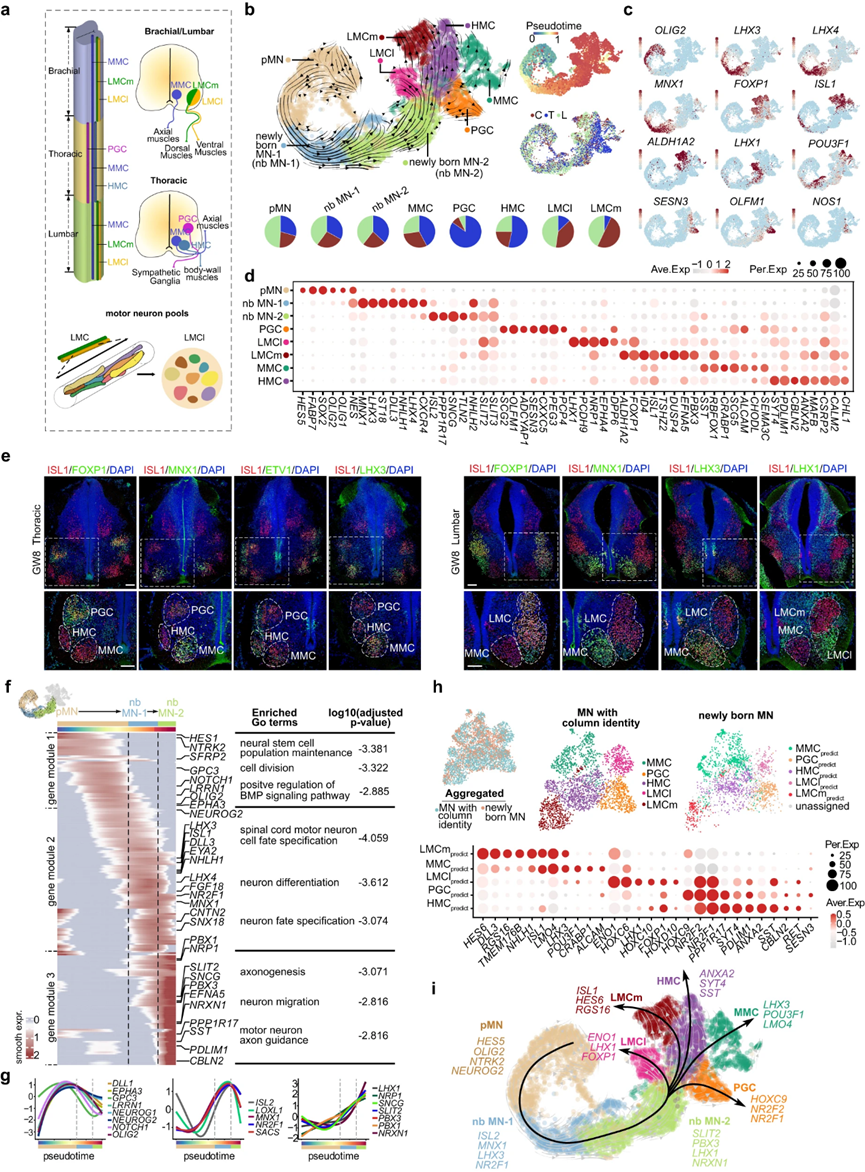
圖5 MN的分子程序占早期規(guī)范的多樣性
在闡明了控制背角神經(jīng)元回路形成的復雜細胞和分子原理之后,作者將努力揭示驅(qū)動MN多樣化的因素,這是對感知到的外周信號做出反應的唯一手段。為了實現(xiàn)這一目標,作者深入研究了包含MN及其祖細胞的scRNA-seq數(shù)據(jù)集,根據(jù)無監(jiān)督聚類和顯著的基因表達模式,將其進一步分類為MN的祖細胞(pMNs)、新生MN (nb MN-1和nb MN-2)和具有不同列身份的MN (LMCm、LMCl、MMC、PGC和HMC)(圖5b-d)。利用RNA速度推斷發(fā)育軌跡,揭示了MNs從pMN到新生MN到具有不同柱身份的MN的分化(圖5b)。還確定了每種細胞類型的節(jié)段偏好,即頸、胸和腰椎來源(圖5b)。有趣的是,作者的分析揭示了MNs在GW7-8的早期柱狀特性,這是作者研究中最早的時間點(圖5b-d)。此外,作者使用免疫染色驗證了柱狀身份的早期規(guī)范,以及它們的片段偏好(圖5e)。作者的研究還發(fā)現(xiàn)了新的柱特異性基因表達模式,為作者對柱特異性MNs的理解增加了一個新的維度。例如,作者發(fā)現(xiàn)TAC1、NRP1和NTRK2在LMC中富集,TSHZ2、DUSP4和ID4在LMCm中富集,PCDH9、DPP6和OPRK1在LMCl中富集,CXXC5、PEG3和CELF4在PGCs中上調(diào)(圖5d)。
不同的TF表達譜與針對不同目標肌肉群的MN池有關(guān)作者在LMC神經(jīng)元中鑒定出具有獨特轉(zhuǎn)錄組特征的亞群。這些亞組被稱為假定的運動神經(jīng)元池,通過評估池特異性基因的獨特表達來識別,如NKX6-1、NKX6-2、ETV1和ETV4。此外,作者還揭示了內(nèi)臟MNs(主要是胸椎衍生的交感PGCs)和軀體MNs(包括LMCm、LMCl、MMC和HMC)之間的轉(zhuǎn)錄差異,并通過GW13時頸椎和胸椎切片的空間轉(zhuǎn)錄組驗證了這一點。因此,作者的分析揭示了推測的MN柱和MN池的早期轉(zhuǎn)錄規(guī)范。在發(fā)育過程中對軸突軌跡和神經(jīng)-肌肉連接至關(guān)重要。然而,在作者的數(shù)據(jù)集中,體細胞MNs并沒有表現(xiàn)出明確的α和γ亞型的亞聚類這一觀察結(jié)果可能歸因于作者數(shù)據(jù)集的特征,因為它主要包括來自早期胚胎階段的MNs。
為了研究驅(qū)動MN分化的分子程序,作者首先分析了頸椎、胸椎和腰椎節(jié)段之間的DEG,特別是頭尾側(cè)HOX的表達,這被認為是指導不同節(jié)段的MN柱和池身份。接下來,利用發(fā)育軌跡推斷,作者揭示了pMN分化背后的分子級聯(lián),pMN分化分為三個不同的基因模塊,分別富集于pMN、nbMN-1和nbMN-2(圖5f)。功能推斷顯示,包含DLL1、EPHA3、OLIG2、NEUROG1、NEUROG2和GPC3等基因的基因模塊1參與神經(jīng)干細胞群體的維持和分裂。基因模塊2由LHX3、ISL1、MNX1、NR2F1、CNTN2等基因組成,參與調(diào)控脊髓MN細胞命運,促進神經(jīng)元分化。最后,基因模塊3由SLIT2、LHX1、PBX1、PBX3和NRXN1等基因組成,與細胞增生、MN軸突引導和神經(jīng)元遷移有關(guān)(圖5f、g)。作者的TF-seqFISH數(shù)據(jù)顯示了這些pMN、新生MN-1和新生MN-2富集基因沿中外側(cè)軸的空間分布。此外,通過將新生MNs與不同列中的MNs進行配對整合,作者確定了新生MNs具有假定的MMC、PGC、HMC、LMCl和LMCm命運,從而揭示了新生MNs中列特異性轉(zhuǎn)錄規(guī)范(圖5h)。新生MNs的無監(jiān)督子簇與列特異性轉(zhuǎn)錄特征之間的強大相似性進一步支持了這一點。
總的來說,作者的研究揭示了MNs在組織(MN柱和池)和功能(體細胞MNs和內(nèi)臟MNs)背景下的早期轉(zhuǎn)錄組特征。此外,作者的研究結(jié)果通過揭示控制MN多樣化的轉(zhuǎn)錄程序,為將干細胞編程為特定MN亞型提供了路線圖(圖5i)。
6. 人類脊髓發(fā)育過程中的星形細胞發(fā)生
對人類脊髓星形膠質(zhì)細胞異質(zhì)性的調(diào)控機制的認識仍然有限。為了解決這個問題,作者將細胞周期1細胞與指示星形細胞命運的分子線索結(jié)合起來,以及星形膠質(zhì)細胞和APC。采用無監(jiān)督聚類,作者確定了兩組不同的APC, APC-1和APC-2,以及五個星形膠質(zhì)細胞亞簇(圖6a)。然后,根據(jù)原生質(zhì)星形膠質(zhì)細胞(PA)和纖維狀星形膠質(zhì)細胞(FA)的標記基因SLC1A2和GFAP的表達,作者將5種不同的星形膠質(zhì)細胞類型分別標注為FA1-2和PA1-3(圖6a)。為了進一步研究FA和PA在發(fā)育過程中是如何分化的,作者利用RNA速度分析在轉(zhuǎn)錄組水平上推斷了人類脊髓星形膠質(zhì)細胞的分化軌跡。作者觀察到細胞周期-1作為起始細胞分化為APC-1和APC-2,然后分別產(chǎn)生FA和PA(圖6a)。這與APCs和星形膠質(zhì)細胞成對整合的結(jié)果一致,如Sankey圖所示(圖6b)。這些發(fā)現(xiàn)表明FA和PA起源于不同的祖細胞群,這使作者研究了APC-1和APC-2中活性差異的遺傳程序(圖6c)。作者的分析揭示了NTRK2、GFAP、ZFP36L1和IGFBP5在APC-1中的特異性表達,以及GLUL、MT3、APOE和SLC6A11在APC-2中的獨特表達,為指導不同類型星形膠質(zhì)細胞分化的分子密碼提供了重要的見解(圖6c, d)。此外,作者發(fā)現(xiàn)了定義FA和PA的新基因,如CRYAB、SAT1和ID3在FA中的特異性表達,以及MT3、ALDOC、CST3和ATP1B1在PA中的特異性表達,這通過空間轉(zhuǎn)錄組數(shù)據(jù)集和免疫染色結(jié)果進行了驗證(圖6e, f)。綜上所述,作者的研究結(jié)果表明,人類脊髓中的FA和PA來自具有不同基因表達譜的不同細胞系。
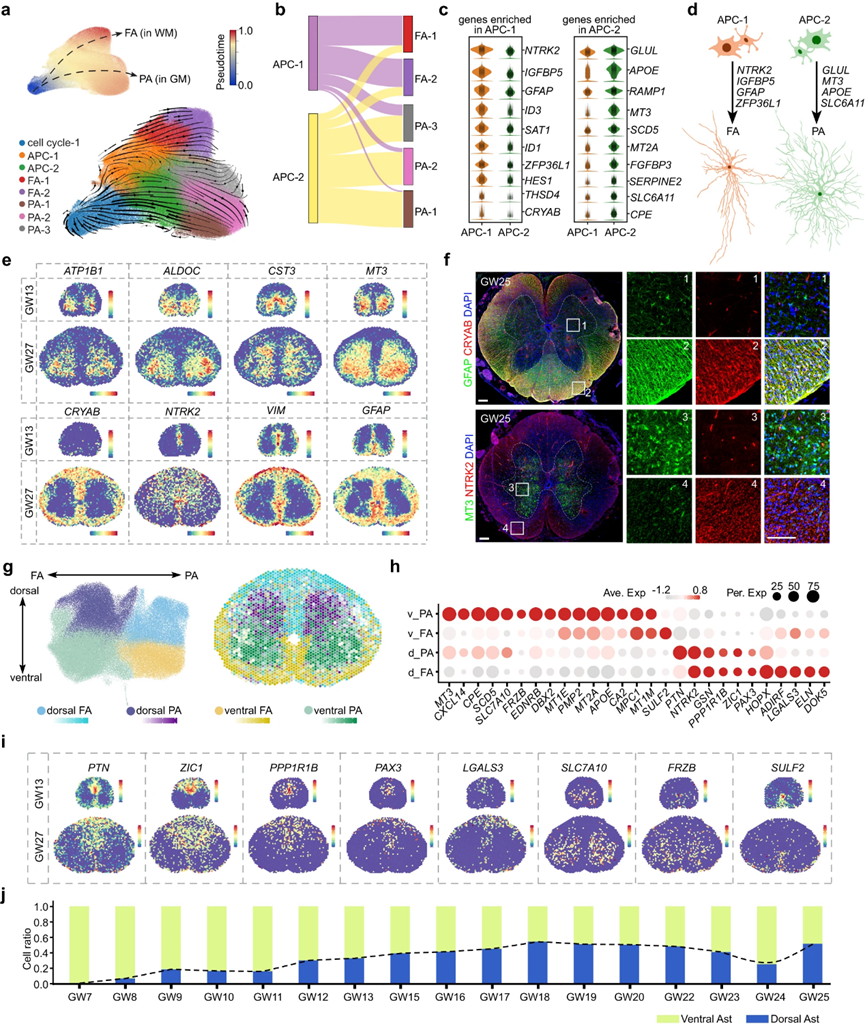
圖6 發(fā)育中的人脊髓中星形膠質(zhì)細胞的空間異質(zhì)性
為了探索人類胎兒脊髓中星形膠質(zhì)細胞的空間特征,作者對星形膠質(zhì)細胞進行了無監(jiān)督聚類,并鑒定出具有獨特轉(zhuǎn)錄組譜的四種不同組:背側(cè)FA、背側(cè)PA、腹側(cè)FA和腹側(cè)PA(圖6g,h)。使用GW27的10× Visium數(shù)據(jù),作者在空間上可視化了這些轉(zhuǎn)錄不同的星形膠質(zhì)細胞亞型(圖6g)。有趣的是,作者發(fā)現(xiàn)一些參與指定神經(jīng)元空間命運的基因,如PAX3和ZIC1,也在星形膠質(zhì)細胞中表達,這表明神經(jīng)元和星形膠質(zhì)細胞的空間規(guī)范可能在一定程度上共享共同的轉(zhuǎn)錄編碼(圖6h,i,2f)。此外,作者分析了不同發(fā)育階段背側(cè)和腹側(cè)星形膠質(zhì)細胞的比例,并觀察到腹側(cè)星形膠質(zhì)細胞在早期胚胎階段首次被檢測到。隨后,背部星形膠質(zhì)細胞的比例增加,并在大約GW16時與腹側(cè)星形膠質(zhì)細胞大致相等(圖6j)。這些發(fā)現(xiàn)為人類胎兒脊髓中星形膠質(zhì)細胞發(fā)育的空間動力學提供了重要的見解,并提出了星形膠質(zhì)細胞發(fā)育與神經(jīng)元之間的潛在聯(lián)系。
7. 揭示ALS細胞類型易感性的分子基礎
肌萎縮側(cè)索硬化癥(ALS)是一種毀滅性的神經(jīng)退行性疾病,其特征是逐漸喪失MNs,導致肌肉無力、萎縮、癱瘓,最終導致呼吸衰竭和死亡盡管付出了巨大的努力,ALS發(fā)病機制的潛在分子機制仍然不完全清楚。為了解決這個問題,作者對發(fā)育中的人類脊髓的scRNA-seq數(shù)據(jù)集與GWAS數(shù)據(jù)集進行了綜合分析,其中包括29,612名ALS患者和122,656名對照作者應用單細胞疾病相關(guān)評分(scDRS)來評估scRNA-seq數(shù)據(jù)中單個細胞的多基因疾病富集情況。作者的分析顯示,小膠質(zhì)細胞、內(nèi)皮細胞、MNs和周細胞是GWAS鑒定的ALS風險位點最脆弱的細胞類型(圖7a)。通過將ALS基因列表與這四種細胞類型中的DEGs交叉,作者確定了在這四種易感細胞類型中特異性富集的ALS風險基因:MNs(157個基因)、小膠質(zhì)細胞(70個基因)、內(nèi)皮細胞(92個基因)和周細胞(29個基因)。鑒于MN功能障礙和死亡是ALS的主要標志,作者首先關(guān)注了MN中富集的ALS風險基因(圖7b)。在這些MN富集的ALS風險基因中,MAPT、OPTN、NRXN3、UNC13A、KIF5A等基因在ALS中的作用已經(jīng)在前人的研究中得到了探討,為作者的分析提供了證據(jù)支持。作者的氧化石墨烯富集分析表明,在MNs中富集的風險基因主要參與細胞投射組織、化學突觸傳遞、跨突觸信號傳導和突觸信號傳導的調(diào)節(jié)等過程(圖7b,c)。
除了MNs外,作者的研究還深入了解了非神經(jīng)元細胞,特別是小膠質(zhì)細胞在ALS發(fā)病機制中的作用,這與該疾病的非細胞自主病理一致(圖7a)。作為中樞神經(jīng)系統(tǒng)的主要常駐免疫細胞,小膠質(zhì)細胞表現(xiàn)出免疫特性,根據(jù)不同的情況,它既可以是神經(jīng)保護細胞,也可以是神經(jīng)毒性細胞。雖然越來越多的證據(jù)表明小膠質(zhì)細胞在ALS中起作用,但它們對病理的確切貢獻尚不清楚。為了更好地了解發(fā)育中的人類脊髓中的小膠質(zhì)細胞景觀,作者用獨特的分子特征表征了異質(zhì)小膠質(zhì)細胞類型。其中包括表達MKI67的增生性小膠質(zhì)細胞,表達表達穩(wěn)態(tài)基因的小膠質(zhì)細胞,如CX3CR1、TMEM119和CSF1R,以及具有APOE、SPP1和DDIT4等遺傳特征的潛在活性狀態(tài)的小膠質(zhì)細胞(圖7d-f)。此外,作者確定了表達少突膠質(zhì)細胞標記物MBP的小膠質(zhì)細胞(圖7e),這在其他研究中也被記錄在小鼠腦白質(zhì)發(fā)育以及小鼠脊髓中。IBA1和MBP的免疫染色進一步證明了MBP+小膠質(zhì)細胞存在于發(fā)育中的人脊髓中,并優(yōu)先分布在白質(zhì)中(圖7f)。除了不同的小膠質(zhì)細胞類型,作者還鑒定了四個表達髓細胞標記物的髓細胞簇,如LYZ、LYVE1、S100A4和S100A9。作者的目的是研究哪些小膠質(zhì)細胞亞型優(yōu)先參與ALS病理。ScDRS分析顯示MG-2、MG-4、MG-5、MG-6和My-4與GWAS風險位點顯著相關(guān),表明它們優(yōu)先參與ALS病理(圖7g)。
先前的研究已經(jīng)確定了一種具有獨特轉(zhuǎn)錄特征的小膠質(zhì)細胞亞群,稱為DAM,用于神經(jīng)退行性疾病,如ALS和阿爾茨海默病。大壩的特點是下調(diào)穩(wěn)態(tài)基因特征和上調(diào)參與吞噬、脂質(zhì)代謝和溶酶體途徑的基因。因此,通過評估DAM基因評分,作者想知道在發(fā)育中的人類脊髓中發(fā)現(xiàn)的易感小膠質(zhì)細胞群(MG-2、MG-4、MG-5和MG-6)是否與DAM具有一些轉(zhuǎn)錄組學特征。作者的研究結(jié)果顯示,MG-2、MG-4、MG-5和MG-6的評分明顯更高,這表明成人大腦中的DAM與胚胎人類脊髓中的DAM樣小膠質(zhì)細胞之間的轉(zhuǎn)錄相似性(圖7h)。作者的免疫染色結(jié)果證實了DAM樣小膠質(zhì)細胞在發(fā)育中的人類脊髓中的存在,其中小膠質(zhì)標記物IBA1與DAM特異性標記物如APOE(圖7f)、DDIT4和SPP1共定位。這些結(jié)果也強調(diào)了DAM樣小膠質(zhì)細胞在發(fā)育中的人類脊髓白質(zhì)中的空間偏好。然后,對scRNA-seq數(shù)據(jù)集的進一步分析表明,DAM樣小膠質(zhì)細胞的出現(xiàn)發(fā)生在GW16至GW25的發(fā)育階段。先前的研究也報道了健康個體發(fā)育中的大腦中存在DAM樣小膠質(zhì)細胞,這與作者的研究結(jié)果一致。
通過DEG深入研究四個DAM樣小膠質(zhì)細胞群的遺傳特征(圖7i)和GO分析顯示,它們參與小膠質(zhì)細胞中TYROBP因果網(wǎng)絡等活動,對未折疊蛋白作出反應,積極調(diào)節(jié)細胞死亡,對有毒物質(zhì)作出反應,對軸突損傷作出反應,參與神經(jīng)元凋亡過程,激活T細胞(圖7j,k)。這些發(fā)現(xiàn)揭示了小膠質(zhì)細胞在ALS發(fā)病機制中的作用。綜上所述,作者的研究在胚胎發(fā)育的人類脊髓中發(fā)現(xiàn)了四種轉(zhuǎn)錄異質(zhì)性的DAM樣小膠質(zhì)細胞,為ALS發(fā)病機制背后的小膠質(zhì)細胞譜提供了有價值的見解。
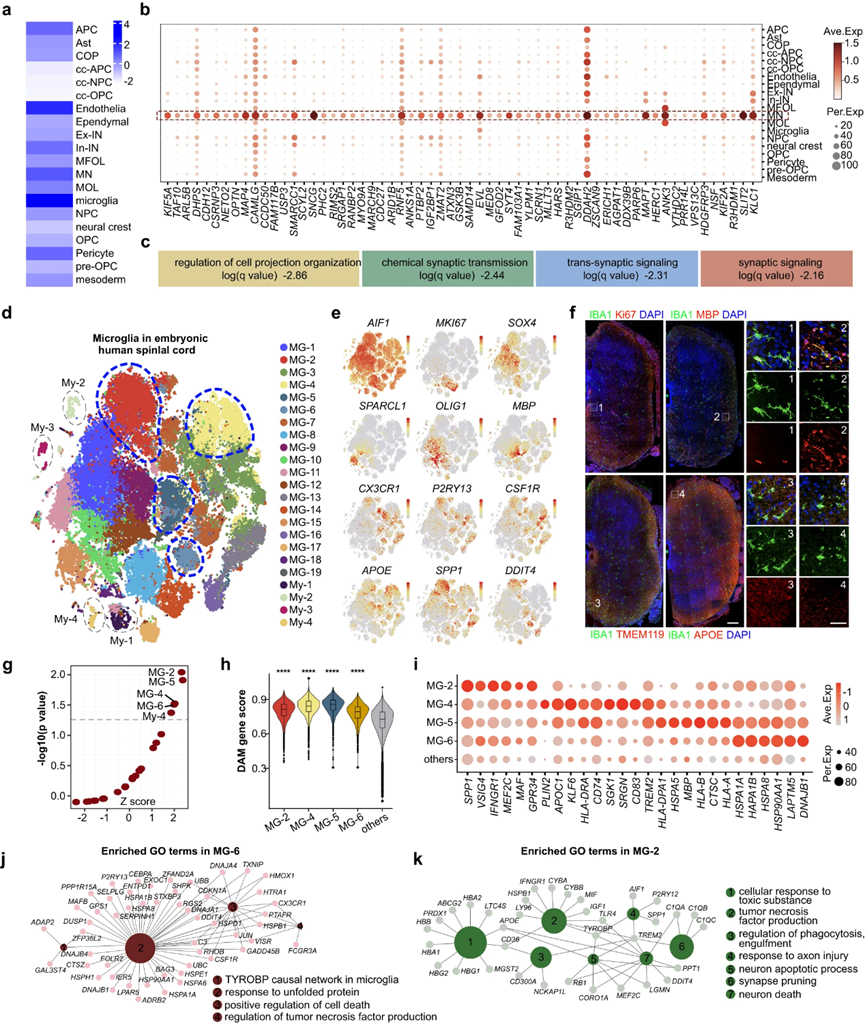
圖7 聯(lián)合GWAS分析揭示了ALS發(fā)病機制的細胞類型特異性特征
以往的研究已經(jīng)確定,血腦屏障和血脊髓屏障的破壞是ALS的關(guān)鍵因素,并將ALS歸類為神經(jīng)血管疾病。作者的研究還發(fā)現(xiàn)內(nèi)皮細胞和周細胞是與ALS遺傳風險位點相關(guān)的主要細胞類型(圖7a)。在內(nèi)皮細胞和周細胞中特異性表達的風險基因通過將注釋的風險基因與其DEG相交來鑒定。氧化石墨烯分析顯示,內(nèi)皮富集的風險基因與血管生成、止血和細胞連接組織等過程有關(guān),而周細胞富集的風險基因與脈管系統(tǒng)發(fā)育等過程有關(guān)。因此,作者關(guān)于內(nèi)皮細胞和周細胞參與ALS以及這些細胞類型中相關(guān)風險基因表達偏好的研究結(jié)果可能為ALS的神經(jīng)血管病因提供見解。
結(jié)論:
綜上所述,作者的研究結(jié)果揭示了ALS可能的細胞機制和特定細胞類型的風險基因表達偏好,這對作者對疾病發(fā)病機制的理解有深刻的見解,并可以為精確治療的發(fā)展提供信息。
實驗方法:
10× Visium空間轉(zhuǎn)錄組學,TF-seqFISH,免疫熒光,scRNA-seq和10x Visium數(shù)據(jù)的比對和準備,scRNA-seq數(shù)據(jù)分析,發(fā)育中的人類脊髓的發(fā)育軌跡推斷,探索人類皮層發(fā)育過程中神經(jīng)源性和膠質(zhì)源性事件中的細胞類型比例動態(tài),神經(jīng)元譜系測定,MN發(fā)展分析,基因表達隨MN分化的變化,星形膠質(zhì)細胞發(fā)育和譜系軌跡推斷。確定星形膠質(zhì)細胞的空間特性,聚類間DEG的鑒定,與GWAS聯(lián)合分析。
參考文獻:
Shi Y, Huang L, Dong H, Yang M, Ding W, Zhou X, Lu T, Liu Z, Zhou X, Wang M, Zeng B, Sun Y, Zhong S, Wang B, Wang W, Yin C, Wang X, Wu Q. Decoding the spatiotemporal regulation of transcription factors during human spinal cord development. Cell Res. 2024 Jan 5. doi: 10.1038/s41422-023-00897-x. Epub ahead of print. PMID: 38177242.






